Компьютерная технология изготовления медицинских имплантатов методом послойного лазерного спекания
Автор: Тверской Михаил Михайлович, Петрова Лина Николаевна, Аладин Александр Сергеевич, Сулацкая Елена Юрьевна, Жаринова Анна Сергеевна
Статья в выпуске: 23 (282), 2012 года.
Бесплатный доступ
Описывается технология автоматизированного проектирования сложнопрофильных имплантатов с использованием индивидуальных топографо-анатомических данных пациента и дальнейшее изготовление имплантатов из титаносодержащих порошков методом селективного лазерного спекания при компьютерном управлении процессом.
Имплантат, компьютерная томография, виртуальная модель, прототипирование, sls-технология, селективное лазерное спекание, реконструктивно-восстановительная хирургия
Короткий адрес: https://sciup.org/147154808
IDR: 147154808 | УДК: 004.94+617-089.844
Текст научной статьи Компьютерная технология изготовления медицинских имплантатов методом послойного лазерного спекания
Введение1
Имплантология как отрасль медицины в современных условиях развивается ускоренными темпами благодаря ее возможностям полного восстановления нарушенных либо утраченных функций органов и систем организма. Это достигается за счет применения имплантатов – медикотехнических изделий из небиологического материала, контактирующих с биологической средой в течение продолжительного времени. Наиболее широко используются костные имплантаты для замены утраченных или исправления поврежденных костных структур организма [1].2
Выпускаемые в настоящее время и используемые в медицине имплантационные системы являются унифицированными [2], т. е. выпускаются имплантаты разных размеров, но одинаковой формы. Это накладывает серьезные ограничения на
применение имплантации в сложных случаях. Например, в челюстно-лицевой и нейрохирургии применяются титановые имплантаты в виде перфорированных пластин, которые подгоняются по месту во время операции, что увеличивает время операции (нахождения пациента под общим наркозом), приводит к деформации крепежных отверстий, а главное – к возникновению зон концентрации напряжений, снижающих прочность имплантата.
Выходом из положения может стать применение индивидуализированных сложнопрофильных имплантатов, спроектированных и изготовленных с использованием современных технологий: быстрого прототипирования [3] и 3D-стереолитографии [4, 5].
-
1. Используемые материалы и технологии изготовления имплантатов
В настоящее время для получения имплантатов используются две группы материалов: полимеры (полиэтилен, полипропилен и др.) и металлы.
До недавнего времени в имплантологии применяли нержавеющую сталь и сплав хрома с кобальтом. Но сегодня от использования этих материалов практически отказались ввиду того, что они не имеют должной устойчивости при непосредственном контакте с биологическими средами. Наиболее приемлемыми являются биоинертные материалы – титан, золото, цирконий. Они обеспечивают лучшее и более быстрое приживление искусственной конструкции, имеют ряд преимуществ в технологии изготовления.
В настоящее время самым популярным и востребованным материалом для имплантатов является «чистый» титан и его сплавы. Они не являются химически инертными материалами, поэтому их поверхность быстро покрывается оксидной пленкой, которая и обеспечивает им высокую антикоррозийную устойчивость. Благодаря большой прочности и высокой устойчивости к коррозии титан и его сплавы практически не имеют конкурентов в имплантологии, так как не изменяют своих свойств под влиянием агрессивных биологических сред организма и сами не оказывает токсического воздействия на живые ткани.
Существует несколько способов изготовления имплантатов: фрезерование, обработка давлением, литье и методы порошковой металлургии.
Современная технология производства имплантатов с помощью фрезерования на станках с числовым программным управлением (ЧПУ) обеспечивает высокую точность изготовления (отклонение размеров – 15–20 мкм в сравнении с 50– 70 мкм при литье), высокий уровень автоматизации труда, большую производительность, применение широкого спектра обрабатываемых материалов и компактность оборудования. Однако при изготовления имплантатов способом фрезерования возникают следующие проблемы:
-
• сложность получения тонкостенных нежестких изделий;
-
• невозможность получения порист о й структуры имплантата, что является важным требованием для остеоинтеграции с жи в ой тканью [6].
Лазерное спекание порошковых м а териалов осн о вано на активно разрабатываемом методе SLS (selective laser sintering) – селективного лазерного спекания [3], когда смесь материалов с различными температурами плавления подвергают тепловой обработке. По SLS-технологии изделие создается из порошковых материалов за счет эффекта спекания при помощи энергии лазерного луча, который является источником тепла. В качестве материалов используются полиамид, полистирол, песок и порошки некоторых металлов.
Лазерное спекание по р ошков пре д ставляет собой многократно повторяющийся процесс, включающий несколько стадий (рис. 1):
-
• нанесение порошкового слоя и выравнивание его роликом;
-
• программно-управляемая лазерная обработка (сканирование) порошко в ого слоя с полным проплавлением легкоплавко й компоненты порошковой смеси по заданному контуру;
-
• чистка полученного сл о я;
-
• сдвиг столика с образцом вниз на величину толщины одного слоя;
-
• повторение всего процесса, то есть нанесение следующего порошкового слоя, лазерное сканирование и т. д.
-
2. Технология изготовления имплантатов методом послойного лазерного спекания
В 2010–2011 гг. сотруд н иками Юж н о-Уральско г о государственного университета и Челябинско г о окружного клинического онколо г ического диспансера была разработана технология изготовления титановых имплантатов с использованием метода селективного лазерн о го спекания, которая
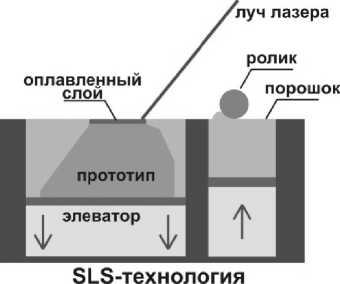
Рис. 1. Принципиальная схема технологии SLS
Гибкость технологии достигается благодаря непосредственному компьютерному управлению процессом. В отличие от традиционных методов изготовления деталей не требуется их последующая механическая обработка. Металлические изделия, изготовленные методом SLS, имеют благо- приятную пористую структуру.
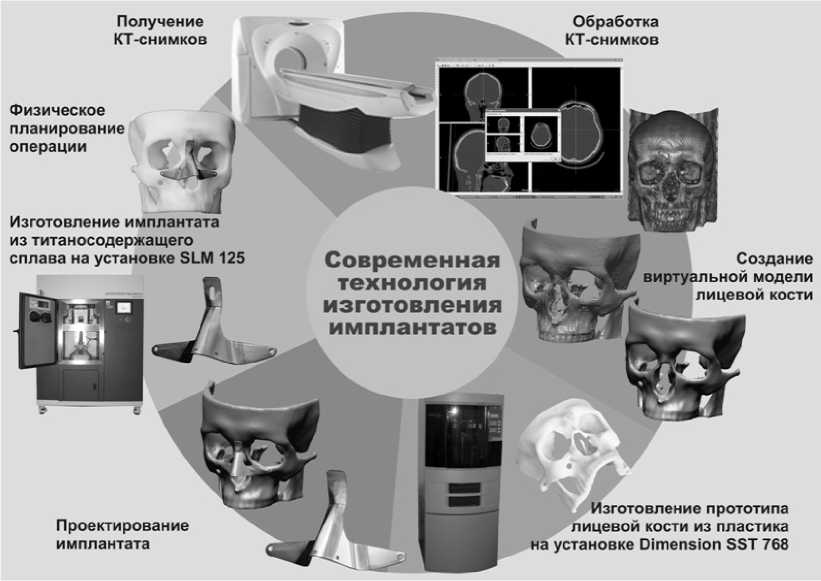
Рис. 2. Схема изготовления имплантата
в дальнейшем может быть использована в челюстно-лицевой и реконструктивно-восстановительной хирургии злокачественных новообразований головы и шеи.
На рис. 2 приведены основные этапы изготовления имплантата носа пациента:
-
• создание виртуальной модели лицевой кости пациента по данным компьютерной томографии (КТ);
-
• изготовление пластикового прототипа лицевой кости – необязательный этап;
-
• проектирование виртуальной модели имплантата с параметрами, соответствующими индивидуальной анатомии пациента;
-
• изготовление титанового имплантата сложной геометрической формы способом селективного лазерного спекания.
Основой для построения 3D-модели лицевой кости пациента являются снимки тканей пациента, выполненные в лечебном учреждении с использованием томографа. В ходе компьютерной томографии осуществляется послойное сканирование тела человека рентгеновскими лучами с целью выявления участков различной плотности. Для количественной оценки плотности исследуемых этим методом структур используется шкала ослабления рентгеновского излучения, получившая название шкалы Хаунсфилда. Диапазон единиц шкалы (денситометрических показателей, англ. Hounsfield units), соответствующих степени ослабления рентгеновского излучения анатомическими структурами организма, составляет от –1024 до +3071, т. е. 4096 чисел ослабления. Средний пока- 66
за т ель в шкале Хаунсфилда (0 HU) со о тветствует плотности воды, отрицате л ьные величины шкалы соответствуют воздуху и жировой тка н и, положительные – мягким тканям, костной ткани и более плотным веществам, например металлам (см. таблицу).
|
Вещество |
Воздух |
Жир |
Вода |
|
HU |
-1000 |
-120 |
0 |
|
Вещество |
Мягкие ткани |
Кости |
|
|
HU |
+40 |
+400 и вы ш е |
В связи с тем, что о б ычный компьютерный монитор способен отображать до 256 оттенков се р ого цвета, для визуального отображения результатов томографии осуществляется программный перерасчет серого градиента в зависимости от интересуемого интервала шкалы. Ч е рно-белый спектр изображения можно применять как в шир о ком интервале денситометрических показателей (визуализируются структуры всех плотностей, о д нако невозможно разли ч ить структуры, близкие по плотности), так и в более узком интервале с за д анным уровнем его центра и ширины («легочное окно», «мягкотканное окно» и т. д.; в этом случае теряется информация о структ у рах, плотность которых выходит за пределы ди а пазона, однако хорошо различимы структуры, близкие по плотности).
На рис. 3 представле н ы результаты компьютерной томографии (КТ-снимки) головы человека; на снимках кости выглядят белыми, воздух – черный, мягкие ткани имеют различные оттенки серо-
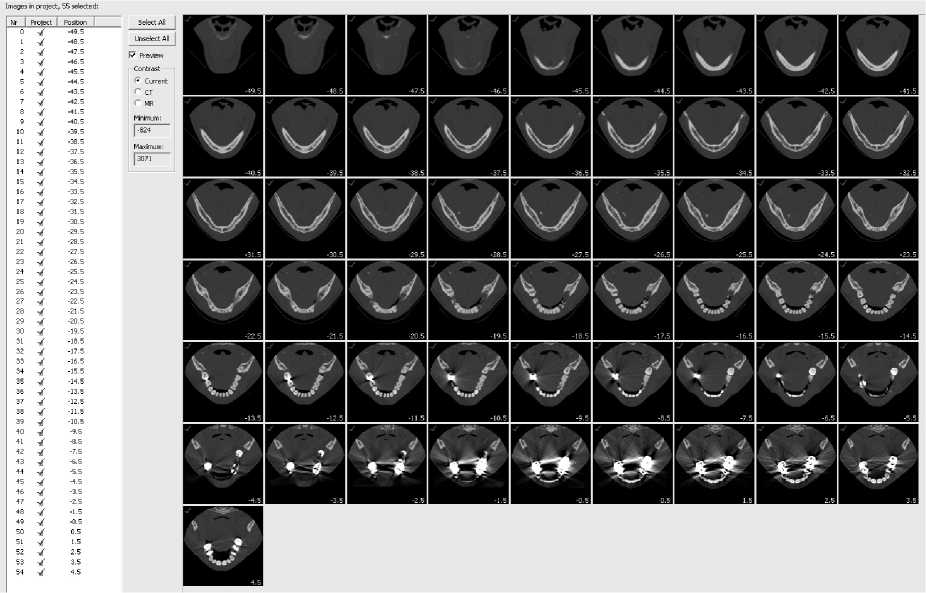
Рис. 3. КТ-снимки черепа пациента
го. Количество снимков определяется выбранным при проведении томографии шагом сканирования. Современные томографы позволяют получать снимки с шагом менее 1 мм, поэтому для построения качественной 3D-модели желательно осуществлять сканирование с наименьшим шагом.
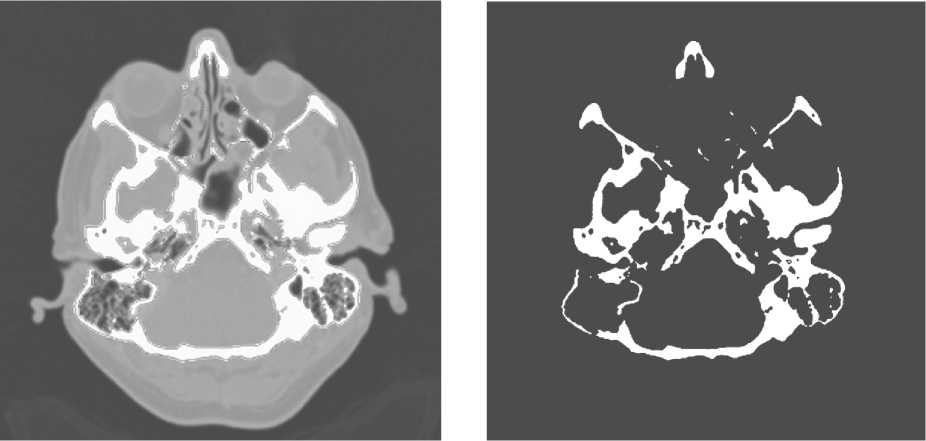
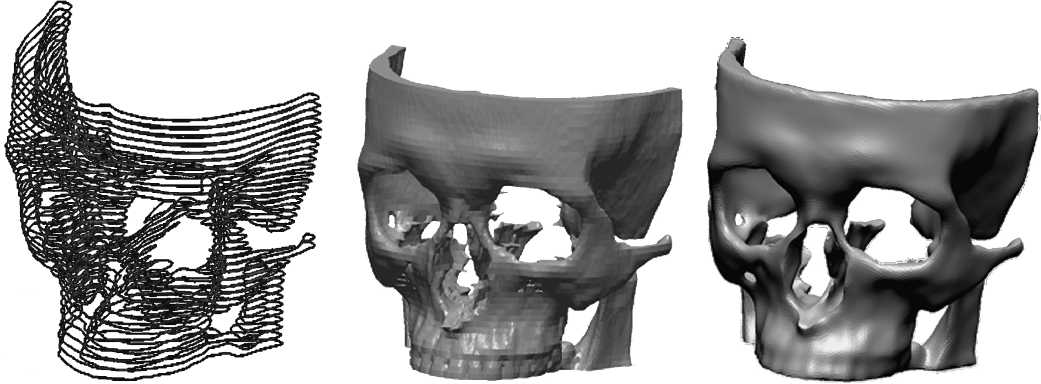
Для получения виртуальной трехмерной модели лицевой кости пациента необходимо на каждом КТ-снимке (рис. 4, а) выделить костные ткани пациента, подобрав интервал отображения денси-тометрических показателей (рис. 4, б). Для выделенных областей формируют контуры.
После этого контуры, относящиеся к разным снимкам, «склеивают» между собой с учетом заданной при томографии толщины слоя сканирования (рис. 5, а). С использованием интерполяционных алгоритмов производит с я формирование поверхностей чернового варианта модели (рис. 5, б).
а)
б)
Рис. 4. Выделение костных тканей на КТ-снимках
а) б) в)
Рис. 5. Создание виртуальной модели лицевой кости: а – «склеивание» контуров; б – создание поверхностей черновой модели; в – «очищенная» виртуальная модель
Полученная модель сохраняется в STL-формате. Однако она еще не может считаться законченной, так как в ней, скорее всего, будут присутствовать различные артефакты, вызванные дефектами сканирования и выделения костных тканей, а также шумами от металлических пломб и брекет-систем.
Доработка виртуальной модели включает следующие процедуры:
-
• локализацию интересующей области;
-
• удаление артефактов;
-
• улучшение качества поверхностей;
-
• нахождение и заливку поверхностной не-сплошности STL-модели;
-
• оптимизацию полигональной сетки.
После выполнение всех этих процедур «очищенная» виртуальная модель лицевой кости пациента приобретает вид, представленный на рис. 5, в, что позволяет перейти к следующему этапу – собственно проектированию имплантата.
Наиболее просто задача получения 3D-модели имплантата решается с использованием КТ-снимков, которые были сделаны еще до травмы или болезни. Если такие снимки отсутствуют, то проектирование имплантата утраченных тканей можно осуществлять на основе имеющихся у пациента симметричных аналогов (например, восстановление орбиты левого глаза по правому). Такой способ проектирования имплантата будет основан на зеркально-отображенной геометрии костных тканей пациента и сводит к минимуму использование при проектировании дополнительной информации, например, о типовом строении лицевых костей.
Если симметричного аналога нет (например, при восстановлении носа), то процесс проектирования существенно усложняется, так как в этом случае придется создавать имплантат исходя из анализа геометрии имеющихся у пациента костных тканей. На полученной виртуальной модели лицевой кости выделяются поверхности, с кото- рыми будет соприкасаться имплантат. На их основе формируются базовые элементы имплантата – так называемая опорная геометрия (рис. 6). Опорная геометрия передается в CAD-систему для дальнейшего проектирования.
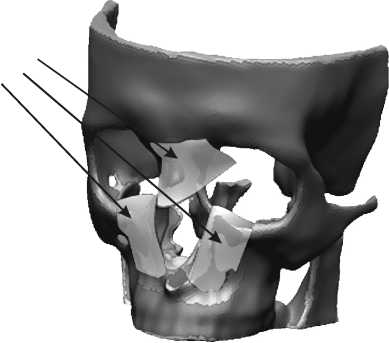
Рис. 6. Формирование элементов опорной геометрии
Элементы опорной геометрии
Проектирование имплантата осуществляется с использованием фотографий пациента д о болезни, эстетических канонов и другой информации, полученной от пациента или оперирующего хирурга. В ходе проектирования имплантату придается толщина, обеспечивающая достаточную прочность при минимальной массе изделия. При в и ртуальном планировании операции модель имплантата сов м ещается с моделью лицевой кости и намечаются к р епежные отверстия (рис. 7).
Подготовленная 3D-модель имп л антата используется при его изготовлении на установке селективного лазерного спекания DM-12 5 .
В сложных клинических случаях м о жет потребоваться изготовление прототипа лицевой кости для проведения физическо г о планиров а ния операции. Прототип изготавливается из ABS- п ластика на установке быстрого прототипирования по технологии FDM (Fused Deposition Modeling). Технология
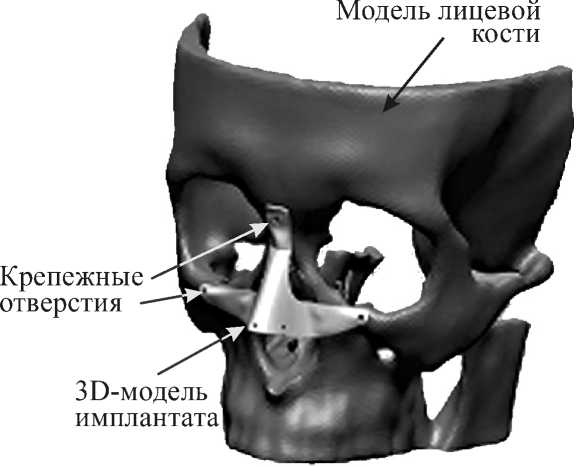
Рис. 7. Виртуальная модель лицевой кости пациента с имплантатом
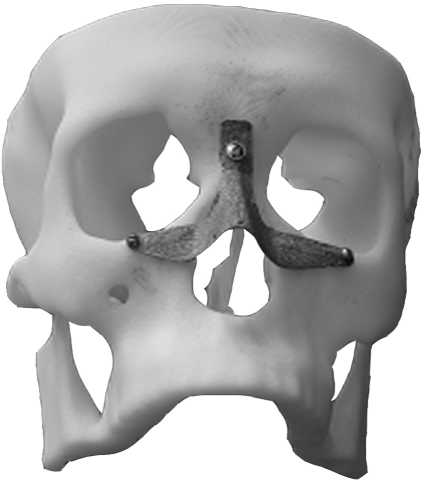
Рис. 8. Прототип лицевой кости пациента с имплантатом
заключается в послойной укладке разогретой полимерной нити в соответствии с геометрией модели изделия, разработанной в CAD-системе. При физическом планировании операции осуществляется совмещение прототипа лицевой кости и изготовленного имплантата (рис. 8).
Заключение
Внедрение описанной выше технологии получения титановых имплантатов методом селективного лазерного спекания в сочетании с современными подходами к проектированию позволит решить проблемы замещения утраченных костнохрящевых тканей пациента, которые ввиду сложности геометрии имплантата ранее не могли быть изготовлены.
Список литературы Компьютерная технология изготовления медицинских имплантатов методом послойного лазерного спекания
- Реконструктивные операции при опухолях головы и шеи/под ред. проф. Е.Г. Матякина. -М.: Изд-во «Вердана», 2009. -224 с.
- www.conmet.ru
- Зленко, М. Технология быстрого прототипирования -послойный синтез физической копии на основе 3D-СAD-модели/М. Зленко//CAD/CAM/CAE Observer. -2003. -№ 2 (11). -С. 2-9.
- www.laser.ru/science/scien21_01.html
- Компьютерное биомоделирование и лазерная стереолитография/А.В. Евсеев, С.В. Камаев, Е.В. Коцюба и др.//Современные лазерноинформационные и лазерные технологии: сб. тр. ИПЛИТ РАН. -М.: Интерконтакт Наука, 2005. -С. 119-130.
- Закономерности взаимодействия пористых имплантатов из никелида титана с биологическими тканями/А.Н. Вусик, В.Н. Ходоренко, Г.Ц. Дамбаев, И.В. Суходоло//Биосовместимые материалы и имплантаты с памятью формы. -Northampton; Томск: STT, 2001. -С. 171-175.


