Компьютерно-томографическая пневмогастрография в определении типов рака желудка по классификации Lauren
Автор: Амелина Инна Д., Нестеров Денис В., Шевкунов Лев Н., Карачун Алексей М., Артемьева Анна С., Багненко Сергей С., Трофимов Станислав Л.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.11, 2021 года.
Бесплатный доступ
Цель. Оценить возможности компьютерно-томографической пневмогастрографии в определении типов рака желудка по классификации Lauren на этапе клинического стадирования. Материалы и методы. Данное одноцентровое ретроспективное исследование включает 202 больных раком желудка, получавших лечение в Национальном Медицинском Исследовательском Центре онкологии имени Н.Н. Петрова с 2015 по 2018 гг. Все пациенты были прооперированы в объеме субтотальной резекции желудка или гастрэктомии. Всем пациентам на этапе клинического стадирования была проведена компьютерно-томографическая пневмогастрография. Пациентам, которым проводилась неоадъювантная химиотерапия, КТ выполнялась двукратно: перед химиотерапией и после, непосредственно перед операцией. Изучались количественные и качественные биомаркеры визуализации, проводилось измерение денситометрических показателей плотности опухоли желудка в артериальную, портальную и отсроченную фазы сканирования в пяти разных точках. Для пациентов, получавших НАПХТ, все показатели плотности фиксировались двукратно - до начала терапевтического лечения и после, непосредственно перед операцией. Результаты. Распределение типов рака желудка по классификации Lauren было следующим: у 59 (29,2%) был определен кишечный тип, 69 (34,2%) - диффузный, 16 (7,9%) - смешанный, 58 (28,7%) - неопределенный тип. На основе визуальных характеристик сучетом особенностей роста опухоли выделены 3 основных КТ-ПГГ типа РЖ: 1 - бугристый (68,3%), 2 - интрамуральный (57,3%) и 3 - смешанный (77,4%). КТ-ПГГ тип опухоли связан с типом по Lauren (х2=185,19, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак желудка, классификация рака желудка по lauren, диффузный рак желудка, биомаркеры визуализации, денситометрические показатели плотности, компьютерная томография, компьютерно-томографическая пневмогастрография
Короткий адрес: https://sciup.org/140290740
IDR: 140290740 | DOI: 10.18027/2224-5057-2021-11-2-13-26
Текст научной статьи Компьютерно-томографическая пневмогастрография в определении типов рака желудка по классификации Lauren
(совместного проекта Всемирной организации здравоохранения и Международного агентства исследований рака) в 2018 РЖ занимает пятое место в структуре онкологической заболеваемости и третье место в структуре смертности от онкологических заболеваний в мире [1].
Прогноз у больных РЖ зависит от многих факторов: стадии опухолевого процесса, гистологического фенотипа, молекулярного профиля, радикальности оперативного вмешательства и т. д. Финским патологоанатомом P.A. Lauren в1965году была предложена гистологическая классификация РЖ, учитывающая различные клинические и молекулярные характеристики, включая гистогенез, дифференцировку клеток, эпидемиологию, этиологию, канцерогенез, биологическое поведение, прогноз, с разделением на следующие типы: кишечный, диффузный, смешанный и недифференцированный [2]. Классификация по Lauren — одна из эффективных систем оценки РЖ, отражающих гистопатологические особенности опухоли, она является важным прогностическим маркером и одним из основных факторов, способных повлиять на лечебную тактику, в том числе хирургическую [3–6]. Изучение характерных особенностей типов РЖ по классификации Lauren с помощью методов лучевой диагностики является перспективным прогностическим маркером.
МАТЕРИАЛЫ И МЕТОДЫ
Всем пациентам на этапе клинического стадирования была проведена компьютерно-томографическая пневмо-гастрография (КТ-пневмогастрография, КТ-ПГГ). Пациентам, которым проводилась неоадъювантная химиотерапия (НАПХТ), КТ-ПГГ выполнялась двукратно: перед химиотерапией и после, непосредственно перед операцией. Клиническая характеристика пациентов представлена в табл. 2.
Таблица 1. Сопоставление классификаций РЖ по Lauren (1965) и ВОЗ (WHO, 2019)
|
Классификация РЖ по Lauren (1965) |
ВОЗ классификация РЖ (WHO, 2019) |
|
Кишечный |
Папиллярная аденокарцинома Тубулярная, высокодифференцированная Тубулярная, умеренно-дифференцированная |
|
Неопределенный |
Тубулярная, низкодифференцированная |
|
Диффузный |
Рак из плохо сцепленных клеток, перстневидноклеточный |
|
Кишечный / неопределенный / диффузный |
Муцинозная аденокарцинома |
|
Смешанный |
Смешанная аденокарцинома |
|
Недифференцированный |
Аденосквамозная карцинома, Плоскоклеточная карцинома, Недифференцированная карцинома, Карцинома с лимфоидной стромой, Гепатоидная карцинома, Микропапиллярная аденокарцинома и др. гистологические подтипы |
Протокол КТ-пневмогастрографии
Таблица 2. Клиническая характеристика пациентов
|
Пол, n (%) |
Мужчины–120 (59,41) |
||
|
Женщины–82 (40,59) |
|||
|
Возраст |
От 30 до 86 лет (средний возраст — 58,9) |
||
|
НАПХТ «+» |
151 (74,75) |
||
|
НАПХТ «-» |
51 (25,25) |
||
|
Локализация опухоли, n (%) |
|||
|
1 отдел (1/3) |
52 (25,74) |
Верхняя треть |
20 (9,9) |
|
Средняя треть |
13 (6,44) |
||
|
Нижняя треть |
19 (9,41) |
||
|
Два смежных отдела (2/3) |
94 (46,53) |
||
|
Три отдела (3/3) |
56 (27,72) |
||
|
1 стенка |
20 (9,9) |
Малая кривизна |
11 (5,45) |
|
Большая кривизна |
2 (0,99) |
||
|
Передняя стенка |
4 (1,98) |
||
|
Задняя стенка |
3 (1,49) |
||
|
2 смежные стенки |
59 (29,21) |
||
|
3 смежные стенки |
46 (22,77) |
||
|
Циркулярное распространение |
77 (38,12) |
||
|
Тип опухоли по классификации Borrmann, n (%) |
|||
|
Полиповидный |
16 (7,92) |
||
|
Язвенный |
11 (5,45) |
||
|
Язвенно-инфильтративный |
124 (61,39) |
||
|
Инфильтративный |
51 (25,25) |
||
Таблица 3. Сопоставление результатов гистологического типа опухоли по биопсии и макропрепарата*
|
Гистология биопсия |
Гистология макропрепарата |
||||||||
|
и |
и |
3 |
S |
и и ОС и |
и и |
и и и и ОС и |
Z |
Z |
|
|
0 |
0 |
0 |
1 |
2 |
0 |
0 |
0 |
0 |
0 |
|
Ca is |
2 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
|
G1 |
0 |
8 |
9 |
1 |
0 |
0 |
0 |
0 |
0 |
|
G2 |
0 |
4 |
18 |
9 |
1 |
1 |
0 |
7 |
3 |
|
G3 |
0 |
3 |
5 |
38 |
3 |
10 |
2 |
4 |
0 |
|
SRCC |
0 |
1 |
0 |
3 |
14 |
10 |
11 |
3 |
1 |
|
PCC |
0 |
0 |
0 |
3 |
0 |
4 |
0 |
0 |
0 |
|
SRCC+PCC |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
|
Mixed |
0 |
0 |
2 |
2 |
6 |
3 |
2 |
2 |
0 |
* Ca is— рак in situ, G1 — высокодифференцированная аденокарцинома,
G2 — умереннодифференцированная аденокарцинома,
G3 — низкодифференцированная аденокарцинома, SRCC — перстневидноклеточная карцинома, PCC— рак из плохосцепленных клеток, Mixed Ас— смешанная аденокарцинома, Mucinous — муцинозная карцинома.
Таблица 4. Сопоставление результатов патоморфологического заключения по гистологическому типу опухоли без НАПХТ и после НАПХТ (%)
|
Совпадение |
без НАПХТ, % |
после НАПХТ, % |
|
Совпадает |
57,7 |
44,3 |
|
Не совпадает |
42,3 |
55,7 |
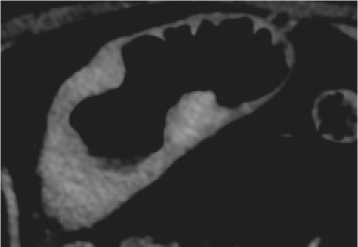
При смешанном КТ-ПГГ типе определяется как внутристеночная опухолевая инфильтрация с нечеткими контурами, так и бугристый внутрипросветный опухолевый компонент (рис. 3).
Статистический анализ
Анализ КТ-характеристик проводился с помощью специализированного для статистической обработки данных языка программирования R с применением программных модулей для вычислительной и графической обработки данных — стандартных библиотек и библиотек random Forest [8], caret [9], pROC [10], ggplot2 [11], party [12], dplyr [13] и tidyr [14]. Сравнение средних значений количественных показателей проводилось с помощью дисперсионного анализа с последующим попарным сравнением тестом
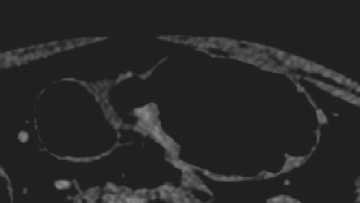
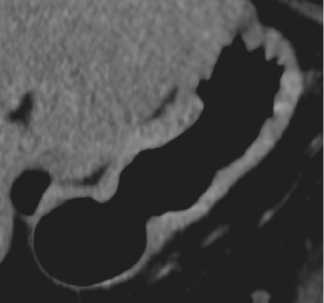
Рисунок 1. Бугристый КТ-ПГГ тип РЖ.
b
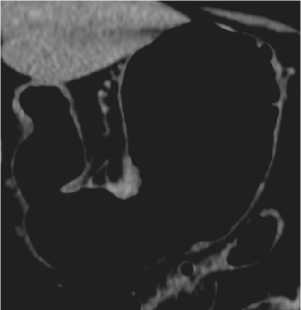
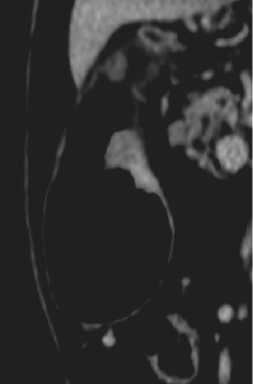
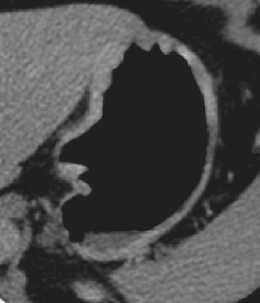
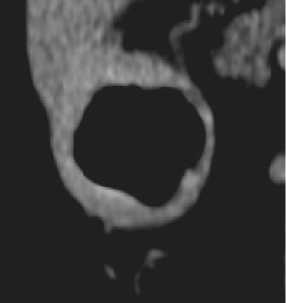
Рисунок 2. Интрамуральный КТ-ПГГ тип РЖ.
a
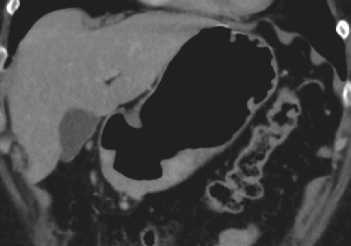
Рисунок 3. Смешанный КТ-ПГГ тип РЖ.
c
Тьюки. Таблицы сопряженности и последующие попарные сравнения в них проводились с помощью теста χ2 [42]. Статистически значимыми различия признавались при р <0,05. При множественных по парных сравнениях уровень р был скорректирован поправкой Холма. При анализе диагностической эффективности методов исследования проводился ROC-анализ (Receiver Operator Characteristic — операционная характеристика приемника).
Результаты
По результатам патоморфологического заключения распределение типов по классификации Lauren было следующим образом: у 59 (29,2%) был определен кишечный
Таблица 5. Распределение пациентов по гистологическому типу и типу по классификации Lauren
|
Гистологический тип* |
Тип опухоли по классификации Lauren |
|||
|
Кишечный |
Диффузный |
Смешанный |
Неопре-деленный |
|
|
G1 |
16 |
0 |
0 |
0 |
|
G2 |
38 |
0 |
0 |
0 |
|
G3 |
0 |
0 |
0 |
58 |
|
Mucinous |
3 |
1 |
0 |
0 |
|
SRCC |
0 |
25 |
0 |
0 |
|
PCC |
0 |
28 |
0 |
0 |
|
SRCC+PCC |
0 |
15 |
0 |
0 |
|
Mixed Ас |
0 |
0 |
16 |
0 |
|
Ca is |
2 |
0 |
0 |
0 |
* Ca is— рак in situ, G1 — высокодифференцированная аденокарцинома, G2 — умереннодифференцированная аденокарцинома, G3 — низкодифференцированная аденокарцинома, SRCC — перстневидноклеточная карцинома, PCC— рак из плохосцепленных клеток, Mixed Ас — смешанная аденокарцинома, Mucinous — муцинозная карцинома.
По визуальным КТ-характеристикам распределение следующее: 68 (34%) пациентов были отнесены в группу 1 — бугристый тип, 57 (28%) в группу 2 — интрамуральный тип, 77 (38%) в группу 3 — смешанный тип (табл. 6).
тип, 69 (34,2%) — диффузный, 16 (7,9%) — смешанный, 58 (28,7%) — неопределенный тип (табл. 5).
При сопоставлении типов РЖ по КТ-ПГГ в зависимости от формы опухоли с типами по классификации Lauren в соответствии с патоморфологическими данными, мы отметили, что опухоли кишечного типа по Lauren имеют преимущественно бугристую форму (83,1%) и реже — смешанную форму (16,9%). При диффузном типе по Lauren не встречается бугристая форма, и опухоли данного типа представлены интрамуральной (75,4%) и смешанной (24,6%) КТ-формой. Опухоли смешанного типа по Lauren в 93,8% имеют смешанную форму по КТ. При опухолях неопределенного типа по Lauren наблюдается различная форма по КТ: бугристая — в 32,8%, интрамуральная — в 6,9%, смешанная — в 60,3% (табл. 7).
Из табл. 7 следует, что КТ-ПГГ тип опухоли связан с типом по Lauren (χ2=185,19, p < 0,001). Таким образом, при бугристом КТ-ПГГ типе возможно предположить, что опухоль имеет кишечный или неопределенный тип по Lauren; чувствительность такого подхода составляет 0,58 (95% ДИ: 0,49–0,67), а специфичность 0,1 (95% ДИ: 0,96–
Таблица 6. Распределение типов РЖ по КТ-ПГГ в соответствии формы опухоли
|
КТ-ПГГ тип |
n = 202 (100%) |
|
1 — Бугристый |
68 (34%) |
|
2 — Интрамуральный |
57 (28%) |
|
3 — Смешанный |
77 (38%) |
Таблица 7. Соответствие типов РЖ по классификации Lauren с типами по КТ-ПГГ
|
КТ-ПГГ тип |
Тип по Lauren, n (%) |
|||
|
Кишечный |
Диффузный |
Смешанный |
Неопределенный |
|
|
1-КТ-ПГГ тип |
49 (83,1%)* |
0 (0%)* |
0 (0%)* |
19 (32,8%) |
|
2-КТ-ПГГ тип |
0 (0%)* |
52 (75,4%)* |
1 (6,2%) |
4 (6,9%)* |
|
3-КТ-ПГГ тип |
10 (16,9%)* |
17 (24,6%) |
15 (93,8%)* |
35 (60,3%)* |
* Выявлены статистически значимые различия в распределении значений в ячейке при post-hoc сравнении.
Таблица 8. Оценка диагностической эффективности типа РЖ по КТ-ПГГ в зависимости от формы опухоли при определении типа по Lauren
|
Тип РЖ по КТ-ПГГ |
Тип РЖ по Lauren |
|
|
Кишечный/ неопределенный |
Диффузный/ смешанный |
|
|
Бугристый |
68 (202) |
0 (202) |
|
Интрамуральный/ смешанный |
49 (202) |
85 (202) |
|
Диффузный |
Кишечный/ смешанный/ неопределенный |
|
|
Интрамуральный |
52 (202) |
5 (202) |
|
Бугристый/ смешанный |
17 (202) |
128 (202) |
|
Смешанный |
Кишечный/ диффузный/ неопределённый |
|
|
Смешанный |
15 (202) |
62 (202) |
|
Бугристый/ интрамуральный |
1 (202) |
124 (202) |
0,1). При интрамуральном КТ-ПГГ типе наиболее вероятен диффузный тип опухоли по Lauren; чувствительность при этом составляет 0,75 (95% ДИ: 0,64–0,85), а специфичность 0,96 (95% ДИ: 0,91–0,99). При смешанном КТ-ПГГ типе определение её типа по Lauren затруднено. В определении смешанного типа опухоли по Lauren чувствительность и специфичность смешанного КТ-ПГГ типа опухоли составляет 0,94 (95% ДИ: 0,70%–0,1) и 0,67 (95% ДИ: 0,59–0,73) соответственно (табл. 8) [41].
В артериальную фазу сканирования статистически значимые различия КТ плотности были получены только между опухолями кишечного и диффузного типов по Lauren — 71,04±22,56 HU и59,59±13,96 HU соответственно (p <0,001). В портальную фазу сканирования статистически значимых различий КТ плотности опухоли не было получено (р =0,12). Были выявлены статистически значимые различия плотности в отсроченную фазу сканирования: между кишечным и диффузным типами по Lauren — 76,96 ± 16,93 HU и 96,47 ± 18,79 HU соответственно (p <0,001), кишечным и смешанным типами по Lauren — 76,96 ± 16,93 HU и 90,79 ± 20,86 HU соответственно (p =0,03), диффузным и неопределенным типами по Lauren — 96,47 ± 18,79 HU и 79,69 ± 16,86 HU соответственно (p <0,001) (рис. 4).
По результатам ROC анализа плотность опухоли в артериальную фазу не имеет дифференциально диагностической ценности. Площади под ROC кривыми составили для кишечного типа по Lauren 0,59 (95% ДИ: 0,5–0,68), для диффузного типа по Lauren 0,62 (95% ДИ: 0,55–0,7), для смешанного типа по Lauren 0,49 (95% ДИ: 0,33–0,64, для неопределенного типа по Lauren 0,55 (95% ДИ: 0,47–0,64) (рис. 5).
Площади под ROC кривыми для плотности опухоли в отсроченную фазу составили: для кишечного типа по Lauren 0,68 (95% ДИ: 0,59–0,76), для диффузного типа по Lauren 0,76 (95% ДИ: 0,69–0,83, для смешанного типа
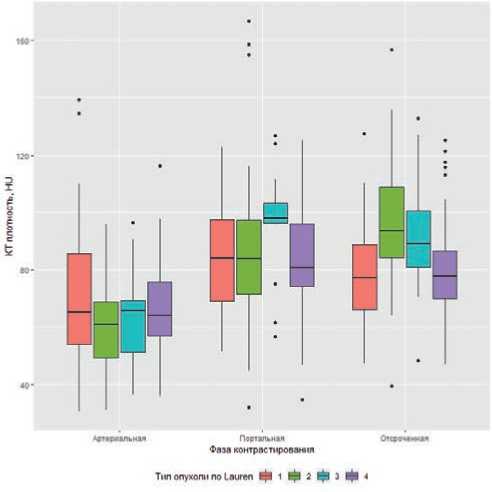
Рисунок 4. Степень усиления опухоли при внутривенном контрастировании в зависимости от типа РЖ по классификации Lauren. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
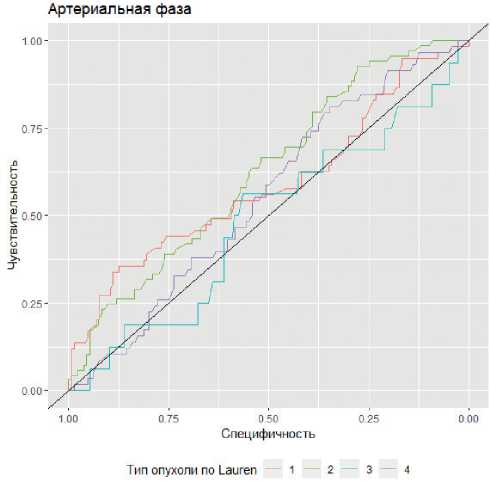
Рисунок 5. ROC кривые для артериальной фазы контрастирования в определении типа опухоли по Lauren.
Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
по Lauren 0,59 (95% ДИ: 0,45–0,73, для неопределенного типа по Lauren 0,64 (95% ДИ: 0,55–0,72) (рис. 6).
Из графика (рис. 6) следует, что на основании плотности опухоли в отсроченную фазу контрастирования возможно определение диффузного типа по Lauren. Чувствительность и специфичность при оптимальном пороге 87,6 HU составила 0,7 и 0,73 соответственно.
На рис. 7 представлены результаты оценки степени контрастирования опухолей различной формы. Статистически значимых различий среди опухолей одинаковой формы выявлено не было.
Накопление контрастного вещества в портальную фазу контрастирования при кишечном и неопределенном типах по Lauren составили 13,82 ± 18,41 HU и 15,75 ± 18,07 HU, что не имеет статистически значимых различий (p =0,9374). При диффузном и смешанном типах по Lauren степень накопления была статистически значимо ниже (p <0,01) и составила 26,38 ± 17,83 HU и 32,98 ± 15,19 HU.
Накопление контрастного вещества в отсроченную фазу при кишечном типе по Lauren составила –7,91 ± 17,26 HU, статистически значимо ниже, чем при диффузном типе по Lauren и составила 10,5 ± 19,86 HU (p <0,001). При смешанном типе по Lauren степень накопления, так же ниже, чем при диффузном типе Lauren (p =0,00492), и составила –5,91 ± 18,29 HU (рис. 8).
Наиболее точная разница плотности портальной и артериальной фазы определялась в выявлении опухолей смешанного типа по Lauren. Чувствительность и специфичность при оптимальном пороге 26,4 HU составляют 0,75
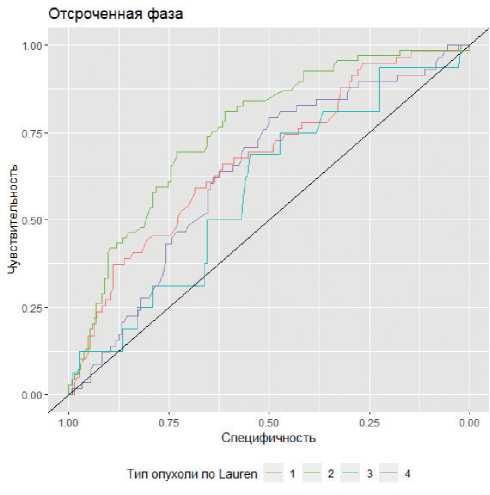
Рисунок 6. ROC кривые для отсроченной фазы контрастирования в определении типа опухоли по Lauren.
Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4— неопределенный тип.
и 0,72. Если степень накопления контрастного вещества опухолью в портальную фазу превышает 14 HU, чувствительность составляет 0,94 (95% ДИ: 0,81–0,1), специфичность 0,4 (95% ДИ: 0,33–0,47) (рис. 9).
Площади под ROC кривыми для плотности опухоли в отсроченную фазу контрастирования составили для кишечного типа по Lauren 0,69 (95% ДИ: 0,61–0,77), диффузного типа по Lauren 0,77 (95% ДИ: 0,7–0,84), смешанного типа по Lauren 0,61 (95% ДИ: 0,47–0,75, неопределенного типа по Lauren 0,57 (95% ДИ: 0,49–0,65).
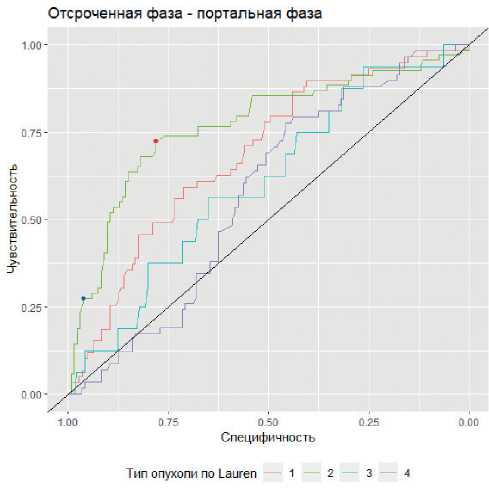
Из графика (рис. 10) следует, что наибольшую точность разницы плотности портальной и отсроченной фазы имеют в выявлении опухоли диффузного типа по
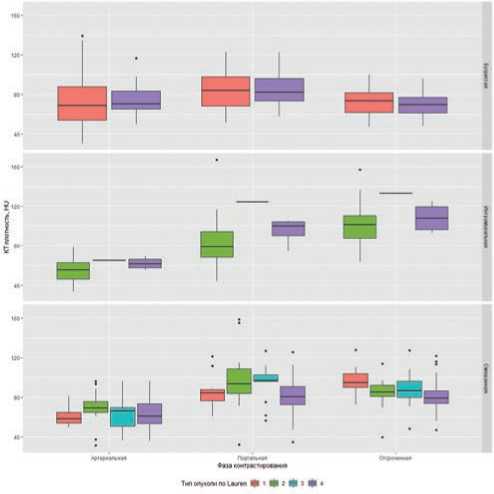
Рисунок 7. Плотность опухоли при различных типах РЖ по КТ-ПГГ и по Lauren. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
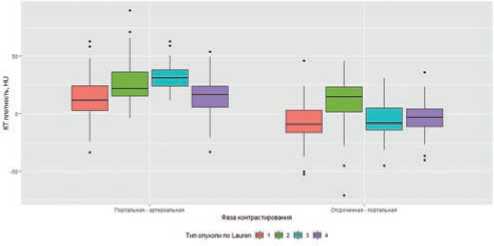
Рисунок 8. Степень усиления опухоли в портальную и отсроченную фазы контрастирования в зависимости от типа РЖ по классификации Lauren. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
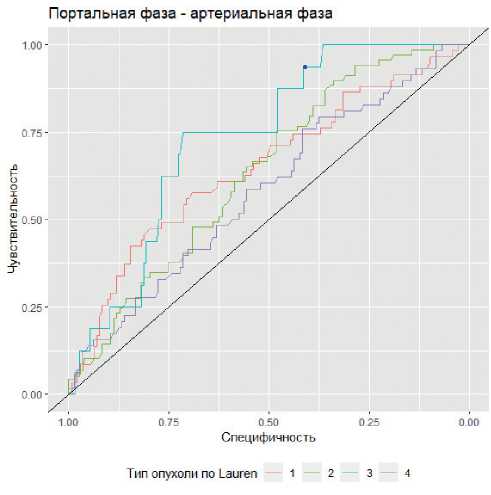
Рисунок 9. ROC кривые для разницы портальной и артериальной фазы контрастирования в определении типа опухоли по Lauren. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
Отсроченная фаза - портальная фаза
Специфичность
Тип опухоли по Lauren
Рисунок 10. ROC кривые для разницы портальной и отсроченной фазы контрастирования в определении типа опухоли по Lauren. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
Lauren. Чувствительность и специфичность при оптимальном пороге 4,6 HU составят 0,72 и 0,78 (на рис. 9 выделен красной точкой). Если степень накопления контрастного вещества опухолью в портальную фазу превышает 21 HU, чувствительность составила 0,28 (95% ДИ: 0,17–0,38), специфичность 0,96 (95% ДИ: 0,92–0,99) (на рис. 9 выделен синей точкой).
Из графика (рис. 11) следует, что все опухоли вне зависимости от их формы и типа по Lauren накапливают контрастное вещество в портальную фазу до 20,18 ± 18,94 HU. В зависимости от КТ-ПГГ типа опухоли и её типу по Lauren отмечаются статистически значимые различия в степени контрастирования (p <0,001). При попарном сравнении выявлено, что опухоли бугристого КТ-ПГГ типа накапливают контрастное вещество меньше, чем опухоли интрамурального КТ-ПГГ типа и диффузного типа по Lauren на 14,4 HU (p =0,0015), смешанного КТ-ПГГ типа и диффузного типа Lauren на 16,4 HU (p =0,0267), смешанного типа по Lauren на 19,7 HU (p =0,0049).
Выявлено, что опухоли кишечного типа по Lauren в зависимости от типа КТ-ПГГ накапливают контрастное вещество в отсроченную фазу по-разному (p < 0,05). Степень контрастирования опухолей бугристого КТ-ПГГ типа и кишечного типа по Lauren уменьшается на –11,69 ± 14,84 HU, опухолей смешанного КТ-ПГГ типа и кишечного типа по Lauren возрастает на 10,62 ± 16,92 HU (p <0,001). Между опухолями смешанного КТ-ПГГ типа и кишечного типа по Lauren и интрамурального КТ-ПГГ типа и диффузно-
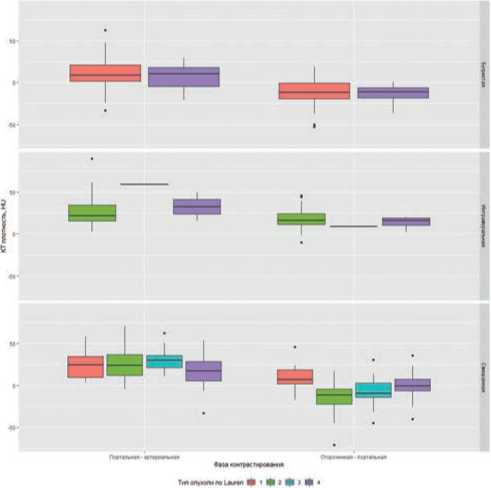
Рисунок 11. Степень усиления опухоли в портальную и отсроченную фазы контрастирования в зависимости от типа РЖ по КТ-ПГГ и классификации Lauren. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4— неопределенный тип.
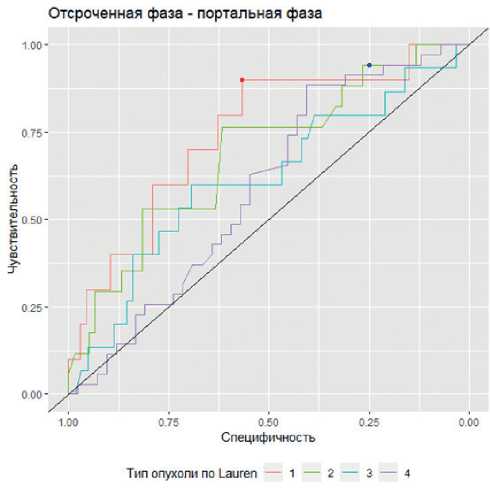
Рисунок 12. ROC кривые в определении типа опухоли по Lauren на основании разницы КТ плотности в отсроченную и портальную фазы контрастирования. Lauren 1 — кишечный тип, Lauren 2 — диффузный тип, Lauren 3 — смешанный тип, Lauren 4 — неопределенный тип.
го типа по Lauren различия в накоплении контрастного вещества были статистически не значимы (р =0,8469). Степень контрастирования опухолей интрамурального КТ-ПГГ типа и диффузного типа по Lauren увеличивается на 18,22 ± 11,89 HU, опухолей смешанного КТ-ПГГ типа и диффузного типа по Lauren уменьшается на –13,12 ± 20,97 HU (p <0,001). Опухоли смешанного типа по Lauren могут как накапливать, так и вымывать контрастное вещество в отсроченную фазу. Средняя степень контрастного усиления составила — 6,88 ± 18,51 и статистически значимо не отличалась от усиления опухолей смешанного типа по КТ-ПГГ и других типов по Lauren.
Площади под ROC кривыми для плотности опухоли в отсроченную фазу составили для опухолей кишечного типа по Lauren 0,74 (95% ДИ: 0,58–0,91), диффузного типа по Lauren 0,69 (95% ДИ: 0,54–0,83), смешанного типа по Lauren 0,62 (95% ДИ: 0,44–0,79), неопределенного типа по Lauren 0,59 (95% ДИ: 0,46–0,72) (рис. 12).
Таким образом, диагностическую ценность степени накопления контрастного вещества в отсроченную фазу имеет только для определения опухолей кишечного и диффузного типов по Lauren. При пороге –1 HU, чувствительность выявления кишечного типа по Lauren составила 0,9 (95% ДИ: 0,7–1), специфичность 0,57 (95% ДИ: 0,45– 0,69) (на рис. 11 выделен красной точкой). При пороге 10 HU, чувствительность выявления опухолей диффузного типа по Lauren составила 0,94 (95% ДИ: 0,82–1), специфичность 0,25 (95% ДИ: 0,15–0,37) (на рис. 11 выделен синей точкой).
Обсуждение
Полноценно характеризовать биологические свойства опухоли, как правило, возможно только после проведения оперативного вмешательства, при анализе всего массива опухоли, потому как патоморфологические данные биопсии в ряде случаев могут отличаться от данных послеоперационных [15]. По данным ряда исследований имеются различия патоморфологических данных биопсии и патоморфологических данных анализа операционного материала одних и тех же пациентов [16,17]. Расхождение результатов биопсии с операционным материалом в среднем составляет 18,1%, около 68,4% случаев со смешанным типом РЖ определяются как иной тип [18]. По данным различных авторов от 5,1% до 74% случаев диагностированного РЖ изначально трактуются как дисплазии и аденомы [19].
Диффузный рак является вторым по частоте встречаемости гистологическим типом РЖ (до 54% случаев от всех аденокарцином [20]), на перстневидноклеточный приходится до 28% [21]. РЖ диффузного типа характеризуется более агрессивными клинико-патологическими особенностями, особенно у молодых пациентов (младше 40 лет). Местно-распространенный диффузный РЖ сопровождается более низкой частотой радикальной хирургической резекции, а также является независимым фактором плохого прогноза с 5-летней выживаемостью не более 20% [22]. В свою очередь РЖ из плохо сцепленных клеток с обильной фиброзной стромой обладает наихудшим прогнозом, с 5-летней выживаемостью менее 15% [23]. Медиана безрецидивной и общей выживаемости для диффузного и кишечного типов РЖ по Lauren составляет 21,7 и 30,7 месяцев и 36 и 38,3 месяца соответственно [24]. Диффузный тип РЖ по Lauren — один из факторов риска развития метастазов в лимфатические узлы [25], он чаще метастазирует в брюшину, кости и яичники, реже в легкие и печень по сравнению с другими типами [26]. Частота перитонеального распространения при диффузном типе РЖ составляет 38–78%, тогда как среди опухолей кишечного типа перитонеальный карциноматоз наблюдается в 13–18% [27].
РЖ относится к категории опухолей, малочувствительных к противоопухолевой терапии, а также способных проявлять различную чувствительность к химиотерапевтическим препаратам и значительную гетерогенность в том числе с зависимости от типа опухоли по Lauren [28,29]. Тип РЖ по Lauren является независимым предиктором ответа опухоли на проведенную НАПХТ [30,31]. При кишечном типе ответ достигается в 32,9%, тогда как при диффузном и смешанном типах — в17,4% и в 18,4% соответственно [32].
Диффузные типы раков по классификации Lauren обладают принципиальными особенностями роста в виде интрамуральной и внутрислизистой инфильтрации, на поверхности слизистой проявляются минимально, а иногда, например, при Linitis plastica, могут не выявляться совсем [33–36]. В таком случае возможны ложноотри- цательные результаты биопсии [37]. Диагностика таких видов опухолей может быть затруднена с помощью эндоскопии. По данным литературы диффузный тип опухоли является одним из факторов риска недооценки глубины инвазии методом ЭУС [38]. Необходимо сделать акцент на выявление внутристеночной опухолевой инфильтрации с оценкой не только неровности контура и утолщения стенки, но и учитывая особенности контрастирования опухоли. Анализ характеристик опухолевой инфильтрации с помощью КТ имеет большой потенциал в определении типов РЖ по классификации Lauren, что в свою очередь может улучшить предоперационную оценку и оптимизировать тактику лечения [39,40].
Наши результаты показали, что тип РЖ по КТ-ПГГ в зависимости от формы опухоли имеет высокую дифференциальную ценность в определении типов по классификации Lauren. Отдельные категории по Lauren могут быть выделены на основании их денситометрических характеристик. Тем не менее показатели диагностической эффективности для них ниже, чем для формы опухоли. Вероятно, это обусловлено тем, что степень контрастного усиления зависит не только от характеристик микроциркуляции в ткани, но также от концентрации йода в контрастном веществе, скорости введения препарата, параметров центральной гемодинамики, напряжения на рентгеновской трубке. Все эти факторы, во-первых, повышают вариабельность измерений и, соответственно, снижают дифференциально диагностическую ценность, во-вторых, снижают воспроизводимость результатов. Однако когда мы говорим о разнице в степени усиления в разные фазы контрастирования, то некоторые количественные показатели могут быть преобразованы в качественные, лишенные вышеописанных недостатков. В частности, если разница плотности между отсроченной и портальной фазами больше нуля, то можно говорить о продолжающемся накоплении контрастного вещества — восходящем паттерне контрастирования. Из того, что разница между отсроченной и портальной фазами меньше, следует, что происходит вымывание контрастного вещества. Кривая изменения плотности в таком случае будет иметь форму пика.
Так, опухоли, имеющие бугристый тип по КТ-ПГГ, представлены только кишечным и неопределенным типом по Lauren. Дифференциальный диагноз между ними на основании степени накопления контрастного вещества невозможен. Выявленные нами статистически значимые различия между опухолями диффузного и смешанного типа по Lauren не имеют диагностической ценности, так как дифференциальный диагноз в данном случае проще провести на основании формы опухоли.
То же касается и интрамурального КТ-ПГГ типа опухолей, который преимущественно представлен диффузным типом по Lauren (91,2%). Редко встречающиеся интрамуральные опухоли неопределенного типа по Lauren, их нельзя отличить на основании особенностей накопления контрастного вещества.
Смешанный тип опухолей по Lauren может иметь только смешанный тип по КТ-ПГГ. Однако из-за того, что смешанный тип по КТ-ПГГ характерен и для других типов по Lauren, доля смешанных типов опухолей по Lauren в данной группе составляет 20%.
Проблема выделения опухолей смешанного типа по Lauren не может быть решена на основании степени контрастирования. Нами не было выявлено различий между смешанным типом и остальными типами по Lauren.
РЖ всех типов накапливают контрастное вещество в портальную фазу. Но в отсроченную фазу контрастирования опухоли кишечного типа по Lauren смешанного КТ-ПГГ типа накапливают контрастный препарат, т. е. имеют восходящий паттерн контрастирования. Это отличает их от кишечного типа по Lauren бугристого КТ-ПГГ типа, которые имеют пиковый паттерн контрастирования, и делает похожими на опухоли диффузного типа по Lauren интрамурального КТ-ПГГ типа.
Диффузные опухоли по Lauren смешанного КТ-ПГГ типа, напротив, в отличие от интрамурального типа, имеют пиковый паттерн контрастирования и по степени контрастного усиления значимо не отличаются от опухолей кишечного типа по Lauren бугристого КТ-ПГГ типа.
Опухоли смешанного типа по Lauren типа могут как накапливать, так и вымывать контрастное вещество в отсроченную фазу (иметь восходящий и пиковый паттерн), что делает невозможным дифференциальный диагноз.
Таким образом, в случае выявления опухоли смешанного типа по КТ-ПГГ и восходящего паттерна контрастирования мы не можем определить конкретный тип по Lauren, но можем исключить опухоли кишечного типа по Lauren. Оптимальным порогом согласно нашим результатом является –1 HU, при котором чувствительность выявления кишечного типа по Lauren составляет 90%, специфичность — 57%, прогностическая ценность положительного ответа — 15%, а прогностическая ценность отрицательного ответа — 97%. Из этого следует, что при разнице менее –1 HU, можно исключить из дифференциального ряда опухоли кишечного типа по Lauren.
При восходящем паттерне и разнице менее 8,3 HU чувствительность выявления диффузного типа по Lauren составляет 94%, специфичность 27%, прогностическая ценность положительного ответа 27%, а прогностическая ценность отрицательного ответа 94%. Из этого следует, что при разнице более 8,3 HU, можно исключить из дифференциального ряда опухоли диффузного типа по Lauren.
Выводы
Список литературы Компьютерно-томографическая пневмогастрография в определении типов рака желудка по классификации Lauren
- Sung H., Ferlay J., Siege R. L., Laversanne M., Soerjomataram I., Jemal A. et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA: a cancer journal for clinicians. 2021. № 71 (3). P. 209-249. DOI: 10.3322/caac. 21660.
- Cislo M., Filip A.A., Offerhaus G.J. A., Cisel B., Rawicz-Pruszynski K., Skierucha M. et al. Distinct molecular subtypes of gastric cancer: from Lauren to molecular pathology // Oncotarget. 2018. Vol. 9. № 27. P. 19427-19442. DOI: 10.18632 / oncotarget. 24827.
- Fonseca P. J., Carmona-Bayonas A., Hernandez R. et al. Lauren subtypes of advanced gastric cancer influence survival and response to chemotherapy: real-world data from the AGAMENON National Cancer Registry // British journal of cancer. 2017. Vol. 117. P. 775-782. DOI: 10.1038/bjc. 2017.245.
- Степанов И. В., Завьялова М. В., Григорьева Е. С., Букурова Ю. А., Афанасьев С. Г., Чердынцева Н. В. Клинико-морфологические и молекулярно-генетические особенности интестинального и диффузного типов карцином желудка // Сибирский онкологический журнал. 2010. №4 (40). С. 55-66. [Stepanov I.V., Zavyalova M.V., Grigorieva E. S., Bukurova Yu.A., Afanasyev S. G., Cherdyntseva N.V. Clinical-morphological and molecular-genetic features of intestinal and diffuse types of gastric carcinomas // Siberian Journal of Oncology. 2010. № 4 (40). C. 55-66.]
- Jianhui C., Ertao Z., Jianjun P., Zulekha Mungloo P., Jianbo X., Hui W. et al. Borrmann type IV is an independent poor prognostic factor in young gastric cancer patients // Ann Hematol Oncol. 2019. № 6 (10). P. 1274.
- Kayacetin S. Approach to gastric cancers // Journal of gastric disorders and therapy. 2016. № 2 (2). DOI: 10.16966 /23818689.119.
- Амелина И.Д., Мищенко A.B. Способ компьютерно-томографического исследования желудка. Патент РФ № 2621952. Заявл. 01.04.2016; Опубл. 08.06.2017. [Amelina I. D., Mishchenko A. V. Method of computed tomographic examination of the stomach. The patent of the Russian Federation No 2621952. 08.06.2017 (in Russian)].
- Breiman, L. Random Forests. Machine Learning. 2001; 45: 5-32. DOI: 10.1023/A:1010933404324.
- Kuhn M., Wing J., Weston S., Williams A., Keefer C., Engelhardt A., Cooper Т., Mayer Z., Kenkel B., Team R.C., Benesty M., Lescarbeau R., Ziem A., Scrucca L., Tang Y., Candan C. Caret: Classification and Regression Training [Internet]. R package version; 2021 may 15. [cited 2021 March 14]. URL: https://CRAN.R-project.org/ package = caret.
- Robin X., Turck N., Hainard A., Tiberti N., Lisacek F., Sanchez J., Müller M. pROC: an open-source package for R and S + to analyze and compare ROC curves [Internet]. BMC Bioinformatics, 12, 77. R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria [cited 2021 March 14]. URL: https://www.R-project.org/.
- Wickham H. GGPLOT2: Elegant Graphics for Data Analysis [Internet]. Springer-Verlag. New York, 2016. ISBN 978-3-319-24277-4. URL: https://ggplot2. tidyvers.
- Hothorn Т., Hornik K., Zeileis A. Unbiased Recursive Partitioning: A Conditional Inference Framework. Journal of Computational and Graphical Statistics. 2006; 15 (3): 651-674.
- Wickham H., Francois R., Henry L., Muller K. DPLYR: A Grammar of Data Manipulation [Internet]. Rpackage version 0.8.5. New York, 2020. URL: https://CRAN.R-project.org/package = dplyr.
- Wickham H., Henry L. TIDYR: Tidy Messy Data [Electronic resource]. R package version 1.0.2. New York, 2020. URL: https://CRAN.R-project.org/package = tidyr (date of request: 12.09.2021).
- Noh C.-K., Jung M.W., Shin S.J., Lee K. M., Yoo B.M., Lee K. Analysis of endoscopic features for histologic discrepancies between biopsy and endoscopic submucosal dissection in gastric neoplasms: 10-year results // Digestive endoscopy. 2019. Vol. 51, Is. 1. P79-85. DOI: 10.1016/j. dld. 2018.08.027.
- Lorant K., Roland K., Bianca O., Sorin Z. Histopathological lauren classification of gastric carcinoma with biopsy specimen and a histological difference with dysplasia // Clinical and medical investigations. 2018. Vol. 4 (1). P. 1-4. DOI: 10.15761 / CMI. 1000174.
- Soh J. S., Lim H., Kang H. S., Kim J. H., Kim K. C. Does the discrepancy in histologic differentiation between a forceps biopsy and an endoscopic specimen necessitate additional surgery in early gastric cancer? // World journal of gastrointestinal oncology. 2017. Vol. 9 (8). P. 319-326. DOI: 10.4251/wjgo. v9. i8.319.
- Komatsu S., Ichikawa D., Miyamae M., Kosuga Т., Konishi H., Shiozaki A. et al. Discrepancies in the histologic type between biopsy and resected specimens: A cautionary note for mixed-type gastric carcinoma // World journal of gastroenterology. 2015. Vol. 21 (15). P. 4673-4679. DOI: 10.3748/wjg. v21. i15.4673.
- Takao M., Kakushima N., Takizawa K., Tanaka M., Yamaguchi Y., Matsubayashi H. et al. Discrepancies in histologic diagnoses of early gastric cancer between biopsy and endoscopic mucosal resection specimens // Gastric cancer: official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association. 2012. Vol. 15 (1). P. 91-96. DOI: 10.1007 / s10120-011-0075-8.
- Kwon K.-J., Shim K.-N., Song E.-M., Choi J.-Y., Kim S.-E., Jung H.-K. et al. Clinicopathological characteristics and prognosis of signet ring cell carcinoma of the stomach // Gastric cancer. 2014. Vol. 17. P. 43-53. DOI: 10.1007 / s10120-013-0234-1.
- Ren J., Niu G., Wang X., Song Т., Hu Z., Ke C. Effect of age on prognosis of gastric signet-ring cell carcinoma: a seer database analysis // Medical science monitor: international medical journal of experimental and clinical research. 2018. Vol. 24. P. 8524-8532. DOI: 10.12659/MSM. 911766.
- Jianhui C., Ertao Z., Jianjun P., Zulekha M.P., Jianbo X., Hui W. et al. Borrmann Type IV is an independent poor prognostic factor in young gastric cancer patients // Ann Hematol Oncol. 2019. Vol. 6 (10). P. 1274.
- Dobritoiu M., Stepan A.E., Vere C.C., Simionescu C.E. Evaluation of gastric carcinomas histological patterns in relation to tumors aggressiveness parameters // Current health sciences journal. 2018. Vol. 44 (4). P. 342-346. DOI: 10.12865/CHSJ. 44.04.03.
- Achilli P., De Martini P., Ceresoli M., Mari G.M., Costanzi A., Maggioni D. et al. Tumor response evaluation after neoadjuvant chemotherapy in locally advanced gastric adenocarcinoma: a prospective, multi-center cohort study // Journal of gastrointestinal oncology. 2017. Vol. 8 (6). P. 1018-1025. DOI: 10.21037/jgo. 2017.08.13.
- Bravo Neto G. P., dos Santos E. G., Victer F. C., Carvalho C.E. Lymph node metastasis in early gastric cancer // Revista do Colegio Brasileiro de Cirurgioes. 2014. Vol. 41 (1). P. 11-17. DOI: 10.1590/s0100-69912014000100004.
- Riihimäki M., Hemminki A., Sundquist K., Sundquist J., Hemminki K. Metastatic spread in patients with gastric cancer // Oncotarget. 2016. Vol. 7 (32). P. 52307-52316. DOI: 10.18632/oncotarget. 10740.
- Hosogi H., Shinohara H., Tsunoda S. et al. Staging laparoscopy for advanced gastric cancer: significance of preoperative clinicopathological factors // Langenbeck's archives of surgery. 2017. Vol. 402 (1). P. 33-39. DOI: 10.1007 / s00423-016-1536-7.
- Coccolini F., Fugazzola P., Ansaloni L., Sartelli M., Cicuttin E., Leandro G. Advanced gastric cancer: the value of systemic and intraperitoneal chemotherapy // Acta bio-medica: atenei Parmensis. 2018. Vol. 89 (8-S). P. 104-109. DOI: 10.23750/ abm. v89i8-S. 7904.
- Ma J., Shen H., Kapesa L., Zeng S. Lauren classification and individualized chemotherapy in gastric cancer // Oncology letters. 2016. Vol. 11 (5). P. 2959-2964. DOI: 10.3892/ol. 2016.4337.
- Xu X., Zheng G., Zhang Т., Zhao Y., Zheng Z. Is pathologic tumor regression grade after neo-adjuvant chemotherapy a promising prognostic indicator for patients with locally advanced gastric cancer? A cohort study evaluating tumor regression response // Cancer chemotherapy and pharmacology. 2019. Vol. 84 (3). P. 635-646. DOI: 10.1007/s00280-019-03893-4.
- Neves Filho E., Pires A., de SantAna R. O., Rabenhorst S., Hirth C. G., da Cunha M. The association among HER2, MET and FOXP3 expression and tumor regression grading in gastric adenocarcinoma // APMIS: acta pathologica, microbiologica, et immunologica Scandinavica. 2018. Vol. 126 (5). P. 389-395. DOI: 10.1111/ apm. 12840.
- Lorenzen S., Blank S., Lordick F., Siewert J. R., Ott K. Prediction of response and prognosis by a score including only pretherapeutic parameters in 410 neoadjuvant treated gastric cancer patients // Annals of surgical oncology. 2012. Vol. 19 (7). P. 2119-2127. DOI: 10.1245/s10434-012-2254-1.
- Неред С. H., Клименков А. А., Стилиди И.С., Перевощиков А. Г., Делекторская В. В. Перстневидноклеточный рак желудка: клинико-морфологические аспекты, результаты хирургического лечения и прогноз // Вопросы онкологии. 2006. Т. 52, № 3. С. 294-300. [Nered S.N., Klimenkov A.A., Stilidi I.S., Perevoshchikov A.G., Delectorskaya V. V. Signet ring cell carcinoma of the stomach: clinical and morphological aspects, results of surgical treatment and prognosis // Voprosy of Oncology. 2006. T. 52, № 3. C. 294-300.]
- Непомнящая E.M., Кириченко Ю.Г., Гаврилова M.A. Особенности морфологической картины перстневидно-клеточного рака желудка // Сибирский онкологический журнал. 2009. № 2. С. 146-147. [Nepomnyashchaya E. M., Kirichenko Yu. G., Gavrilova M.A. Features of the morphological picture of signet ring cell carcinoma of the stomach // Siberian Journal of Oncology. 2009. № 2. C. 146-147.]
- Портной A. M., Вятчанин О. В., Сташук Г. А. Рак желудка. Проблемы современной лучевой диагностики // Радиология — Практика. 2003. №3. С. 11-30. [L.M. Portnoy, O.V. Vyatchanin, G.A. Stashuk. Stomach cancer. Problems of modern radiation diagnostics // Radiology — Practice. 2003. № 3. C. 11-30.]
- Mastoraki A., Papanikolaou I. S., Sakorafas G., Safioleas M. Facing the challenge of managing linitis plastica-review of the literature // Hepato-gastroenterology. 2009. Vol. 56 (96). C. 1773-1778.
- Muraoka S., Tsuchida K., Iwasaki M., Izawa N., Jinnai H., Komatsubara T. A case report of gastric linitis plastica diagnosed by endoscopic ultrasound-guided fine needle aspiration // Medicine. 2017. Vol. 96 (50). e8937. DOI: 10.1097 / MD. 0000000000008937.
- Ahn H.S., Lee H.J., Yoo M.W., Kim S.G., Im J.P., Kim S.H. Diagnostic accuracy of T and N stages with endoscopy, stomach protocol CT, and endoscopic ultrasonography in early gastric cancer // Journal of surgical oncology. 2009. Vol. 99 (1). P. 20-27. DOI: 10.1002/jso. 21170.
- Liu S., Liu S., Ji C., Zheng H., Pan X., Zhang Y. et al. Application of CT texture analysis in predicting histopathological characteristics of gastric cancers // European radiology. 2017. Vol. 27 (12). P. 4951-4959. DOI: 10.1007 / s00330-017-4881-1.
- Liu S., Shi H., Ji C., Zheng H., Pan X., Guan W. et al. Preoperative CT texture analysis of gastric cancer: correlations with postoperative TNM staging // Clinical radiology. 2018. Vol. 73 (8). 756. e1-756. e9. DOI: 0.1016 /j. crad. 2018.03.005.
- Амелина И. Д., Нестеров Д. В., Шевкунов А. Н., Карачун А. М., Пелипась Ю. В., Артемьева А. С. Способ определения типа рака желудка по классификации Lauren методом компьютерной томографии. Патент РФ № 2743221. Заявл. 12.10.2020; Опубл. 16.02.2021. [Amelina I.D., Nesterov D.V., Shevkunov L.N., Karachun A.M., Pelipas Yu.V., Artemyeva A. S. Method for determining the type of gastric cancer according to Lauren classification by computed tomography. RF patent No. 2743221. Appl. 12.10.2020; Publ. 16.02.2021. (in Russian)].
- Beasley, T. M., & Schumacker, R. E. (1995). Multiple Regression Approach to Analyzing Contingency Tables: Post Hoc and Planned Comparison Procedures. The Journal of Experimental Education, 64 (1), 79-93.


