Комплексная биохимическая характеристика брокколи и цветной капусты
Автор: Фатеев Дмитрий Андреевич, Соловьева Алла Евгеньевна, Шеленга Татьяна Васильевна, Артемьева Анна Майевна
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 6 (56), 2020 года.
Бесплатный доступ
Актуальность. Повсеместно культивируемый и востребованный вид овощных культур - капуста огородная Brassica oleracea L. - в процессе эволюции и доместикации разделился на три кластера: капуста листовая, кочанная и брокколи (цветная). Брокколи была выведена путем гибридизации из листовой капусты и является генетическим предшественником цветной. Брокколи и цветная капуста отличаются ценным биохимическим составом, эти культуры рекомендуются для ежедневного потребления. Материал и методика. Материал исследования включал 30 образцов брокколи и 35 образцов цветной капусты из коллекции ВИР, отражающих эколого-географическое и генетическое разнообразие капусты. Образцы капусты выращивали на научно-производственной базе «Пушкинские и Павловские лаборатории ВИР» (Санкт-Петербург), биохимический анализ проводили в лаборатории биохимии и молекулярной биологии ВИР с помощью газовой хроматографии/масс-спектрометрии. Результаты. Дана характеристика капустных культур вида капуста огородная Brassica oleracea L. (брокколи и цветная капуста) по основным наиболее важным биохимическим признакам качества. В результате применения метода газовой хроматографии/масс-спектрометрии к изучению биохимического состава в образцах брокколи и цветной идентифицировано 136 компонентов из групп органических кислот, свободных аминокислот, в том числе незаменимых, жирных кислот, в том числе незаменимых, многоатомных спиртов, сахаров, а также фенольных соединений, восков, нуклеозидов и др. Выявлены закономерности в накоплении питательных и биологически активных веществ культурами вида и отдельными образцами. Капуста огородная в пределах изученных разновидностей имеет сложный биохимический состав, характеризующий данные образцы как потенциально высокоценные (при этом роль и значение далеко не всех соединений в организации здорового питания человека известна), что подтверждает необходимость углубленного контроля биохимического состава растений при выведении новых сортов. Найдены образцы с оптимальным компонентным составом для сбалансированного питания человека, которые предлагается использовать в селекции на качество, в том числе получения сортов для здорового (функционального) и лечебно-профилактического питания населения РФ.
Брокколи, цветная капуста, генетические ресурсы, биохимический состав, полиморфизм признаков
Короткий адрес: https://sciup.org/140250337
IDR: 140250337 | УДК: (635.356+635.35):581.19 | DOI: 10.18619/2072-9146-2020-6-104-111
Текст научной статьи Комплексная биохимическая характеристика брокколи и цветной капусты
Капустные культуры отличаются большим разнообразием продуктовых органов (листья, кочан – сильно развитая верхушечная почка, кочанчики – развитые боковые почки, головка – скученное соцветие, стеблеплод – утолщенный стебель), высокой урожайностью; периодами вегетации. Отдельные сортотипы капустных культур пригодны для длительного хранения, что позволяет обеспечить потребление капусты в течение всего года. Особенность химического состава капустных культур – высокое содержание воды и низкое – жиров, что обусловливает низкую калорийность растений. Они отличаются относительно высоким уровнем углеводов, содержат белки, включающие незаменимые аминокислоты, многие минеральные элементы. Высокая ценность капустных культур для питания человека в первую очередь определяются богатым составом биологически активных веществ (БАВ) – ферментов, пигментов, витаминов, а также вторичных метаболитов. Селекцию на содержание и состав БАВ мировое научное сообщество объявило приоритетной в 21 веке [1].
Брокколи Brassica oleracea L. var. italica (ветвистая брокколи, спаржевая капуста) является родоначальной формой плотноголовчатой цветной капусты. Была получена путём гибридизации на территории Средиземноморья в VI–V веках до н. э. Брокколи произошла от итальянской листовой капусты, которую отбирали на раннее цветение, при интрогрессии генетического материала критской капусты B. cretica Lam [2]. Капуста цветная Brassica oleracea L. var. botrytis L. была выведена путем отбора из брокколи в Италии. Первые формы цветной капусты обладали желтоватой и зеленоватой головкой. Впоследствии появились белые и ярко-белые формы, которые несут до пяти рецессивных генов ярко-белой окраски. В XIV веке отдельные сорта цветной капусты начали выращивать во Франции, Италии, Голландии и Англии.
Капуста брокколи содержит сераорганические соединения, фенолы, витамины, минералы и другие фитокомпоненты. Соотношение этих составляющих обуславливает диетические и лечебно-профилактические свойства брокколи. Обладает антиоксидантными свойствами [3] и антимикробной активностью [4]. Потребление брокколи снижает риск развития определенных видов раковых [5,6] и сердечно-сосудистых заболеваний [7,8]. Цветная капуста во многом сходна по биохимическому составу с брокколи. В ней содержатся полноценные по аминокислотному составу белки, а благодаря наличию глюкозинолатов, метионина и холина она рекомендована лицам с заболеваниями печени, атеросклерозом и диабетом [9,10].
Головки цветной капусты содержат 8–12% сухого вещества, 1,7–4,2% сахаров, 1,6–2,5% белка, в среднем 48 мг/100 г аскорбиновой кислоты. Головки брокколи имеют более ценный состав по сравнению с цветной капустой. Брокколи содержит 10-16% сухого вещества, 2,3–8,4% сахаров, 1,9–4,2% белка, в среднем 89,2 мг/100 г аскорбиновой кислоты. Цветная капуста и брокколи богаты витаминами В1, В2, В3, B5, B6, B9, РР; солями калия, натрия, кальция, магния, железа, фосфора. Необходимость использования капустных культур в качестве ежедневной пищи описана во многих работах [11,12,13].
Мировая коллекция вида B. oleracea ВИР включает 2470 образцов из 95 стран, в том числе 670 образцов цветной капусты, 126 образцов брокколи. В ходе многолетних исследований коллекции капусты ВИР изучено более 80% образцов коллекции, определены особенности накопления основных элементов биохимического состава в зависимости от ботанической принадлежности, географического происхождения и распространения каждой культуры и сортотипа. Исследование химических элементов в рас- тительном сырье актуально как с теоретической, так и с практической точки зрения. Химические составляющие нативных комплексов растений могут быть использованы в качестве лекарственных и профилактических средств в терапии различных заболеваний, а также как маркеры и индикаторы при проведении биогеохимических, экологических и фитохимических исследований. Накопление отдельных элементов могут рассматриваться как проявление видоспецифичности растений. Кроме того, существует корреляция между концентрацией отдельных элементов растительной ткани и накоплением биологически активных веществ различного физиологического действия [14]. В последние годы новый методический подход, основанный на самом полном описании метаболитного профиля, т.е. его качественной и количественной характеристики, приобрел особую важность в физиологических исследованиях живых объектов. Согласно современным представлениям, метаболитный профиль есть суммарный результат деятельности клетки на молекулярно-генетическом и биохимическом уровнях. Анализ метаболомных профилей позволяет идентифицировать определенное число биохимических маркеров, отражающих активность биологических процессов, в том числе окультуривания и стрессовых факторов окружающей среды. Анализируя полученные метаболические профили, можно получить своеобразный «отпечаток» (fingerprint), отражающий физиологическое (метаболическое) состояние организма. Современные методы исследования биохимических соединений (хроматография с масс-спектрометрией и др.) позволяют изучить метаболиты, в том числе вещества, имеющие питательное и кормовое значение и др., в динамике, а также в различных условиях произрастания [15,16,17]. Таким образом, метаболомный подход к исследованию биохимического состава пищевых, кормовых и других культур с использованием газовой хромато-графии/масс-спектрометрии дает уникальную возможность определения количественного и качественного состава метаболитов. Такой подход позволит получить новые данные о биохимическом составе интересующих нас культур, сравнить хозяйственно-ценные признаки разных образцов. Исследовательские работы по изучению метаболомного профиля и вторичных метаболитов цветной капусты, при выращивании в различных условиях, проводились в Италии и Южной Корее [18,19]. Также проводятся исследования по метаболитному профилированию глюкозинолатов в брокколи и цветной капусте, с использованием жидкостной хроматографии и масс-спектрометрии [20,21]. Исследования, посвященные изучению профилей химических соединений, связанных с пищевыми и диетическими показателями качества, с использованием репрезентативной выборки образцов мировой коллекции брокколи и цветной капусты ВИР, отражающей разнообразие культуры, ранее не проводились.
Материал, место, методика исследований
Материал исследования включал 30 образцов капусты брокколи и 35 образцов цветной капусты из стержневой коллекции (табл. 1). Образцы капусты выращивали на научно-производственной базе «Пушкинские и Павловские лаборатории ВИР» (Санкт-Петербург), биохимический анализ проводили в лаборатории биохимии и молекулярной биологии ВИР. Подготовку проб осуществляли следующим образом: анализировали свежий материал, 5 растений каждого образца. Аскорбиновую кислоту определяли титрованием краской Тильманса [22]. Остальные компоненты определяли с помощью газовой хроматографии/масс-спектрометрии (ГХ-МС анализ).
Таблица 1. Образцы брокколи и цветной капусты Table 1. Accessions of broccoli and cauliflower
|
№ каталога |
Название |
Происхождение |
|
Брокколи |
||
|
к-190 |
Green Sprouting early strain |
США |
|
к-192 |
Green Sprouting 47 |
США |
|
к-196 |
Coastle 57051A |
Канада |
|
к-212 |
Coastle 87038 |
Канада |
|
к-252 |
Тонус |
ВНИИССОК |
|
к-276 |
Бонанза |
США |
|
к-284 |
Hybrid Express Corona |
Япония |
|
к-290 |
Дэнди Эрли (F 1 ) |
Япония |
|
к-292 |
Emerald City (F 1 ) |
Япония |
|
к-295 |
Southern Comet Hybrid |
Япония |
|
к-296 |
Cape Queen (F 1 ) |
Япония |
|
к-297 |
Marathon (F 1 ) |
Япония |
|
к-298 |
Everest (F 1 ) |
Канада |
|
к-299 |
Comanche (F 1 ) |
Япония |
|
к-300 |
Senshi (F 1 ) |
Япония |
|
к-301 |
Triathlon (F 1 ) |
Япония |
|
к-302 |
El Centro |
Великобритания |
|
к-304 |
Decathlon (F 1 ) |
Нидерланды |
|
к-305 |
Monterey (F 1 ) |
Япония |
|
к-306 |
Pentathlon (F 1 ) |
Япония |
|
к-309 |
Medway (F 1 ) |
Нидерланды |
|
к-310 |
Nutri-bud |
США |
|
вр.к-159 |
Sureen |
Нидерланды |
|
вр.к-194 |
Fordhook Late Hybrid |
Новая Зеландия |
|
вр.к-326 |
Patriot (F 1 ) |
Япония |
|
вр.к-332 |
Agassi (F 1 ) |
Нидерланды |
|
вр.к-333 |
25-91 RZ |
Нидерланды |
|
вр.к-335 |
OPV-12317 |
Испания |
|
вр.к-347 |
Brodway (F 1 ) |
Нидерланды |
|
вр.к-350 |
Furio |
Нидерланды |
|
Цветная капуста |
||
|
к-30 |
Geant Donois |
Франция |
|
к-457 |
Rezord |
Нидерланды |
|
к-517 |
Erfurter Zwerg |
Германия |
|
к-534 |
Датский рынок |
Германия |
|
к-540 |
Early Masterpiece |
Нидерланды |
|
к-568 |
Dippes Erfolg |
Германия |
|
к-576 |
Снежинка |
Россия |
|
к-584 |
Nano precocissimo di Jesi |
Италия |
|
к-591 |
Ерфуртско джудже |
Болгария |
|
к-605 |
Stella Nova |
Дания |
|
к-606 |
Bola de Nieve |
Аргентина |
|
к-609 |
Cambridge #6 |
Великобритания |
|
к-622 |
Stupicky obrovsky |
Чехия |
|
к-652 |
Fruhernte |
Германия |
|
к-655 |
Garant |
Дания |
|
к-673 |
Indian Star |
Индия |
|
к-678 |
Sakigake № 1 |
Япония |
|
к-690 |
Yarralong 30 |
Австралия |
|
к-699 |
Pusa Katki |
Индия |
|
к-709 |
Sitta |
Германия |
|
к-733 |
Aristokrat |
Германия |
|
к-759 |
Вартбуглард |
Германия |
|
к-774 |
Manly |
Великобритания |
|
к-784 |
Blancato SB introduction |
Нидерланды |
|
к-814 |
Masuda Nakate |
Япония |
|
к-834 |
Montalbo |
Нидерланды |
|
к-838 |
Roba |
Германия |
|
к-854 |
Позднеспелая 4 |
Китая |
|
к-855 |
Gigante de Napoles |
Аргентина |
|
к-880 |
Alpha Maveron |
Нидерланды |
|
к-904 |
Globe |
Индия |
|
к-933 |
Clivia |
Германия |
|
к-947 |
Szentesi korai |
Венгрия |
|
к-1017 |
June Monarch |
Великобритания |
|
к-1091 |
Aristo |
Чехия |
ГХ-МС исследование реализовано по протоколу анализа триметилсилильных производных, разработанному в БИН РАН. Растительный материал экстрагировали этанолом, затем выпаривали досуха на установке CentriVapConcentrator фирмы «Labconco» (США). Сухой остаток растворяли в пиридине, содержащем 1000 ppm трикозана, используемого в качестве внутреннего стандарта, затем вводили 20 мкл BSTFA ([N,О-бис-(триметил-силил)трифторацетамид]) (Supelco (US)). Для обеспечения достаточной полноты протекания реакции силилиро-вания, виалы выдерживали в течение 15 мин при температуре 100°С в специальном термоблоке. Образцы исследовали на хромато-масс-спектрометре фирмы Agilent 6850 с масс-селективным детектором Agilent 5975 D. Хроматографическое разделение проводили на капиллярной колонке Agilent HP-5MS, длиной 30 м, внутренним диаметром 0.25 мм и толщиной пленки неподвижной фазы 0.25 мкм в режиме линейного программирования температуры от 70° до 325° со скоростью 6°/мин. (50 мин), газ-носитель – гелий. Анализ проводился в режиме постоянства скорости газового потока через колонку (1 мл/мин). Температура испарителя 300°С, деление потока при вводе проб 1:20. Сканирование масс-спектров от 50 до 1050 а.е.м. со скоростью 2 скана/сек. Хроматограммы образцов регистрировали по полному ионному току.
Полученные результаты обрабатывались с помощью программы “UniChrom”, “AMDIS” и библиотек масс спектров NIST 2010, а также in-house библиотек Научного парка Санкт-Петербургского университета и Ботанического института Российской академии наук им. В.Л. Комарова [23]. Все данные представлены на сырое вещество.
Результаты
В результате ГХ-МС исследования установлено 136 компонентов биохимического состава образцов, взятых в изучение.
Идентифицировано 95 компонентов из групп органических кислот, свободных аминокислот, в том числе незаменимых, жирных кислот, в том числе незаменимых, многоатомных спиртов, сахаров, а также фенолсодержащих соединений, нуклеозидов и др.
Углеводный состав
80% сухого вещества капусты представлено углеводным комплексом, состоящим из сахара, крахмала, клетчатки, гемицеллюлозы и пектиновых веществ. Углеводный комплекс цветной капусты представлен 15 сахарами, у брокколи 13 сахарами. Содержание сахаров в брокколи (табл. 2) в среднем составило 1,82% (от 0,4 до 8,3%), в цветной капусте в среднем составило 2,35% (от 1,23 до 5,1%). Основная часть сахаров – это моносахара: у брокколи 1,56% (от 0,36 до 6,92%), у цветной 2,04 (от 1,06 до 3,9%). Олигосахара представлены дисахарами – сахарозой, мальтозой и рутинозой, трисахарами – раффинозой, тетрасахаром – стахиозой. Сумма олигосахаров, главным образом дисахаров, была примерно равна, у брокколи – 0,33% 0,32% (от 0,12 до 0,94 %), у цветной 0,33% (от 0,13 до 1,15%). Наблюдались различия в составе моносахаров и олигосахаров у брокколи и цветной капусты. Высокое суммарное содержание сахаров (более 4,0%) у позднеспелых образцов брокколи, у цветной капусты высокое суммарное содержание сахаров (более 3,0%) у скороспелых образцов. В брокколи в большем количестве встречалась фруктоза (0,72%), в цветной капусте было обнаружено больше глюкозы (0,77%). У части образцов цветной капусты были обнаружены трисахара (раффиноза) и тетрасахара (стахиоза). В целом, у изученных образцов идентифицировано 15 моно- и олигосахаров. Общими для всех образцов брокколи и цветной оказались фруктоза, глюко-
Таблица 2. Состав и содержание сахаров в брокколи и цветной капустах, в % Table 2. Composition and sugar content in broccoli and cauliflower, in %
|
Брокколи (13) |
Цветная (15) |
|
|
Фруктоза |
0,721±0,494* |
0,476±0,48 |
|
Глюкоза |
0,412±0,341* |
0,777±0,177 |
|
Манноза |
0,298±0,313* |
0,448±0,319 |
|
Сорбоза |
0,075±0,074 |
0,071±0,042 |
|
Галактоза |
0,056±0,044* |
0,267± 0,331 |
|
Ксилоза |
0,01 |
0,006±0,008 |
|
Рибоза |
0,003±0,003 |
0,003±0,003 |
|
Рамноза |
0,002* |
следы |
|
Ликсоза |
0,001±0,001 |
0,001±0,001 |
|
Арабиноза |
0,001 |
0,001 |
|
Альтроза |
следы |
0,01±0,005* |
|
Моносахара |
1,56±1,27 |
2,04±0,61 |
|
Сахароза |
0,315±0,307 |
0,305±0,197 |
|
Мальтоза |
0,003 |
0,007±0,006 |
|
Рутиноза |
следы |
0,002±0,001* |
|
Дисахара |
0,317±0,311 |
0,315±0,204 |
|
Раффиноза |
0,002±0,002 |
0,001±0,001 |
|
Трисахара |
0,002±0,002 |
0,001±0,001 |
|
Стахиоза |
следы |
0,001* |
|
Тетрасахара |
- |
0,001 |
|
Сумма |
1,819±1,464 |
2,35±0,75 |
-
1 – среднее значение
-
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
за, манноза, галактоза, сорбоза, сахароза и раффиноза. У брокколи 70% образцов содержали ликсозу. Отдельные образцы брокколи и цветной капусты содержали рибозу, арабинозу, раманозу, арабинозу, мальтозу, рутинозу и стахиозу.
Таблица 3. Состав и содержание метаболически активные производные сахаров в брокколи и цветной капусте, в мг/100 г Table 3. Composition and content of metabolically active sugar derivatives in broccoli and cauliflower, in mg/100 g
|
Брокколи |
Цветная |
|
|
Треоно-1,4-лактон |
1,75±0,8* |
0,3±0,11 |
|
Эритроно-1,4-лактон |
2,2±1,5* |
0,31±0,13 |
|
Глицерол-3-фосфат |
8,06±13,81* |
1,13±0,45 |
|
Глюкозо-1-фосфат |
следы |
2,22±0,87* |
|
Фруктозо-6-фосфат |
3,02±0,93 |
1,05±0,3 |
|
Метилглюкозид |
2,96±1,85* |
следы |
|
Метилглюкофуранозид |
1,81±1,44 |
4,63±1,01 |
|
Метиларбутин |
14,93±12,23* |
следы |
|
Сумма |
34,73±32,57 |
9,64±2,87 |
-
1 – среднее значение
-
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
Определены метаболически активные производные сахаров – лактонные (треоно-1,4 лактон, эритроно-1,4-лактон), фосфатные (глицерол-3-фосфат, глюкоза-1-фос-фат, фруктозо-6-фосфат) и метильные формы (метилглю-козид, метилпентафуранозид, метиларбутин). Суммарное содержание производных сахаров в брокколи составило 34,73 мг/100 г (от 6,1 до 137,6 мг/100 г), а в цветной капусте – 9,64 мг/100 г (от 1,3 до 94,3 мг/100 г) (табл. 3).
Органические кислоты
Капустные культуры обладают повышенным содержанием органических кислот в форме солей и свободном виде. Органические кислоты являются активными метаболитами углеводного обмена, обладают дезинфицирующей функцией, участвуют в процессах пищеварения, придают продуктам более яркий вкус. Они являются основными и промежуточными продуктами основных путей обмена веществ, играют защитную роль от биотических и абиотических факторов внешней среды [24]. Установлены общие для всех образцов 19 органических кислот, при этом 14 часто встречающиеся (табл. 4).
Таблица 4. Состав и содержание органических кислот в брокколи и цветной капусте, в мг/100 г
Table 4. Composition and content of organic acids in broccoli and cauliflower, in mg/100 g
|
Брокколи (19) |
Цветная (19) |
|
|
Яблочная |
80,32±52,02* |
134,54±56,76 |
|
Аскорбин. к-та |
56,19±26,27* |
26,71±4,02 |
|
Фосфорная |
25,88±23,01* |
15,92±6,61 |
|
Треоновая |
24,49±18,86* |
4,57±1,98 |
|
Лимонная |
20,57±17,82 |
25,01±17,21 |
|
Янтарная |
7,45±5,37* |
3,51±1,82 |
|
Молочная |
6,71±3,46* |
2,18±0,71 |
|
Глицериновая |
6,55±5,41* |
2,54±2,28 |
|
Метилмалоновая |
6,39 |
0,89 |
|
Рибоновая |
6,36±5,83* |
2,5±1,72 |
|
Глюконовая |
5,64±6,48* |
2,05±0,87 |
|
Щавелевая |
3,03±1,88* |
0,67±0,44 |
|
Абиетиновая |
2,92±1,51 |
следы |
|
Пировиноградная |
2,3±5,94 |
0,29±0,1 |
|
Фумаровая |
1,28±1,59 |
0,95±1,17 |
|
Винная |
1,24±0,64* |
0,14±0,06 |
|
Азелаиновая |
1,19±1,27* |
следы |
|
Малеиновая |
1,09±4,65 |
0,63±0,46 |
|
Мезоксалевая |
0,09±0,02* |
следы |
|
Аконитовая |
следы |
0,22±0,07* |
|
Глюкуроновая |
следы |
0,28* |
|
Галактуроновая |
следы |
0,31* |
|
Сумма |
257,39±182,1 |
223,3±97,61 |
-
1 – среднее значение
-
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
В целом соотношение кислот в цветной капусте и брокколи различалось. Количество яблочной и лимонной кислоты наблюдалось в 1,5 раза выше в цветной капусте (яблочной: 134,54 и 80,32 мг/100г; лимонной: 25,01 и 20,57 мг/100г), а аскорбиновой кислоты, фосфорной, треоновой было выше в брокколи (аскорбиновая: 26,71 и 56,19 мг/100г; фосфорная: 15,98 и 25,88 мг/100г; треоновая: 4,57 и 24,49 мг/100г). Рибоновая, глюконовая и эритроновая кислоты отражают процессы окисления соответствующих сахаров. Глицериновая кислота опосредовано характеризует процессы окисления триглицеридов жирных кислот. Молочная и винная кислоты – продукты гликолиза. Пировиноградная кислота участвует в обмене аминокислот. Щавелевая кислота – одна из самых распространенных продуктов обмена веществ, в брокколи ее содержалось в среднем 3,03 мг/100 г (диапазон изменчивости от 1,01 до 8,9 мг/100 г). В цветной капусте в подавляющем количестве определялись кислоты, составляющие процессы клеточного дыхания, в том числе цикла Кребса (яблочная, лимонная, аконитовая). Кроме того, идентифицированы лактонные и фосфатные формы кислот. Лактонные (треоно-1,4-лактон, глюконовая кислота-1,4-лактон) – биологически активные формы органических кислот, способные к связыванию тяжелых металлов, защищающие клетку от повреждения внешними факторами. Наличие фосфатных форм (глюконовая кислота-6-фос-фат) отражает активность процессов обмена в растении [25,26].
Содержание органических кислот в образцах брокколи в среднем составило 0,26% или 257,39 мг/100 г, при диапазоне колебаний от 0,11 до 0,53% (108,8 и 529,16 мг/100 г, соответственно), в цветной капусте суммарные показатели кислот были чуть ниже – 0,22% или 223,3 мг/100 г, а диапазон – от 0,07 до 0,48% (74,12 и 478,04 мг/100 г, соответственно). Наибольшее количество органических кислот отмечено у представителей двух позднеспелых образцов брокколи: Furio (0,53%) и Pentathlon (F1) (0,48%). У цветной капусты у трех образцов европейской селекции: Aristokrat (0,48%), June Monarch (0,47%) и Seoul (0,44%)
Фенольные соединения.
В брокколи найдены 15 летучих фенольных соединений (ФС): феруловая, гидроксикоричная, хлорогеновая, салициловая, 2,3-дигидроксибензойная никотиновая, бензойная, кофейная кислоты,конифериловый спирт, амирин, байкалин и токоферол. Семь относились к органическим кислотам (никотиновая, хинная, феруловая, кофейная, синаповая, хлорогеновая и др.), одно – к витаминам (токоферол).
В цветной капусте найдено только 5 фенольных соединений: хинная, хлорогеновая, никотиновая, кофейная кислоты и токоферол. ФС являются биологически активными веществами и участвуют в процессах дыхания, фотосинтеза, в формировании иммунитета и т.п. Суммарное содержание ФС в капусте брокколи изменялось в пределах от 13,4 до 121,2 мг/100 г, в цветной капусте этот диапазон от 5,3 до 33,8 мг/100 г (табл. 5). Основным ФС в этих капуст является хинная кислота, содержание которой составляет до 90% ФС. Отдельные образцы цветной капусты содержали кофейную кислоту и токоферол. Шикимовая кислота является показателем активности шикиматного пути синтеза ФС, концентрация которых изменяется в зависимости от силы воздействия факторов внешней среды на растение [24]. Наиболее высоким накоплением ФС в нашем исследовании выделились образец брокколи японской селекции Pentathlon (F 1 ), среднее содержание – 121,2 мг/100 г и образец цветной капусты китайской селекции Позднеспелая 4, среднее содержание – 33,8 мг/100 г.
Таблица 5. Состав и содержание фенольных соединений в брокколи и цветной капусте, в мг/100 г
Table 5. Composition and content of phenolic compounds broccoli and cauliflower, in mg/100 g
|
Брокколи (15) |
Цветная (5) |
|
|
Хинная |
34,99±26,41* |
14,96±5,99 |
|
Синаповая |
3,36±2,41* |
следы |
|
Шикимовая |
2,97±3,15* |
следы |
|
Конифериловый спирт |
2,35±3,31* |
следы |
|
Феруловая |
1,91±1,49* |
следы |
|
Гидроксикоричная |
1,69±1,83* |
следы |
|
Хлорогеновая |
1,62±1,57* |
0,36±0,16 |
|
Салициловая |
1,35±1,15* |
следы |
|
Амирин |
0,80±0,17* |
следы |
|
2,3-дигидроксибензойная |
0,41±0,88* |
следы |
|
Байкалин |
0,41±0,48* |
следы |
|
Никотиновая |
0,34±0,27* |
0,09±0,01 |
|
Бензойная |
0,27±0,27* |
следы |
|
Кофейная |
0,16±0,32 |
0,17±0,09 |
|
Токоферол |
0,12±0,07 |
0,09 |
|
Сумма |
52,75±43,81 |
15,67±6,09 |
-
1 – среднее значение
-
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
Аминокислоты
Аминокислоты участвуют в обмене азотистых веществ (исходное соединение при биосинтезе гормонов, витаминов, медиаторов, пигментов, пуриновых и пиримидиновых оснований, алкалоидов и др.). В составе небелковых азотсодержащих соединений вида капуста огородная найдены 23 свободных аминокислоты, включая незаменимые. Диапазон изменчивости аминокислот в образцах брокколи варьировал от 12,5 до 651,4 мг/100 г (среднее значение – 154,86 мг/100г). Накопление свободных аминокислот в образцах цветной капусты отмечалось несколько ниже – 6,57 до 169,1 мг/100 г (среднее значение – 81,32 мг/100 г). Общими у изученных образцов были: оксипролин, глутамин, серин, пролин, аспарагин, аланин, глицин, глутаминовая, аспарагиновая, гамма-аминомаслянная и пипеколовая кислоты. Большая часть изученных образцов коллекции содержала орнитин. У отдельных образцов брокколи были обнаружен норлейцин и N ацетил серин, а отдельные образцы цветной капусты содержали норвалин (табл. 6).
Таблица 6. Состав и содержание свободных аминокислот в брокколи и цветной капусте, в мг/100 г Table 6. Composition and content of free amino acids in broccoli and cauliflower, in mg/100 g
|
Брокколи (14) |
Цветная (15) |
|
|
Оксипролин |
62,94±56,68* |
6,31±4,31 |
|
Глутамин |
27,84±40,26 |
22,68±18,32 |
|
Глутаминовая к-та |
13,77±22,23 |
14,15±6,52 |
|
Серин |
12,41±18,03* |
7,09±3,38 |
|
Пролин |
9,23±11,15* |
2,61±2,14 |
|
Аспарагиновая к-та |
8,28±10,61 |
15,31±7,17 |
|
Аспарагин |
4,70±4,64 |
2,47±1,57 |
|
Аланин |
4,53±8,96 |
4,87±2,79 |
|
Норлейцин |
2,67±2,08* |
0,11 |
|
Гамма-аминомасляная к-та |
2,63±3,21* |
0,82±0,71 |
|
Глицин |
2,49±1,31* |
0,51±0,33 |
|
Пипеколовая к-та |
2,31±3,33 |
2,52±1,5 |
|
Орнитин |
1,06±0,96* |
0,56±0,35 |
|
N ацетил серин |
0,86* |
1,31±1,95 |
|
Сумма |
154,86±183,18 |
81,32±51,04 |
1 – среднее значение
-
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
Установлены особенности накопления незаменимых аминокислот: все образцы брокколи и цветной капусты накапливали метионин, фенилаланин, треонин, валин, триптофан и лейцин. Отдельные изученные образцы брок-
Таблица 7. Состав и содержание незаменимых аминокислот в брокколи и цветной капусте, в мг/100 г
Table 7. Composition and content of essential amino acid in broccoli and cauliflower, in mg/100 g
|
Брокколи (8) |
Цветная (7) |
|
|
Метионин |
6,47±7,29* |
0,15±0,11 |
|
Фенилаланин |
4,27±2,67* |
1,17±0,14 |
|
Треонин |
3,67±4,76 |
2,34±1,58 |
|
Валин |
3,32±3,47 |
2,46±1,1 |
|
Триптофан |
3,11±2,27* |
0,28±0,15 |
|
Лейцин |
1,38±1,28* |
0,26±0,12 |
|
Изолейцин |
0,33±0,32* |
- |
|
Тирозин |
0,24* |
- |
|
Сумма |
22,55±22,06 |
6,67±3,2 |
1 – среднее значение
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
коли накапливали изолейцин и тирозин. Нами выделены три образца брокколи с высоким содержанием свободных аминокислот (более 300 мг/100 г): Pentathlon (F 1 ) (651,4 мг/100 г), Fordhook Late Hybrid (F 1 ) (424,66 мг/100 г), Emerald City (F 1 ) (305,12 мг/100г) (табл. 7). Также выделены три образца цветной капусты с высоким содержанием свободных аминокислот (более 150 мг/100 г): Sakigake № 1 (169,1 мг/100 г), Pusa Katki (168,4 мг/100 г), Позднеспелая 4 (156,1 мг/100 г)
Жирные кислоты.
Найдено 6 жирных кислот, которые в организме человека присутствуют в свободном состоянии и в составе нейтральных жиров, фосфолипидов и других соединений, являются основными структурными компонентами биологических мембран. Жирные кислоты участвуют в одном из важнейших процессов в организме – окислении жирных кислот, которое дает около половины всей энергии, необходимой человеку. Суммарное содержание свободных жирных кислот в брокколи варьировало от 0,78 до 85,3 мг/100 г (среднее значение – 53,21 мг/100 г)(табл. 8), в цветной капусте содержание немного ниже – от 1,46 до 23,04 мг/100 г, при этом среднее значение – 7,95 мг/100 г. Жирные кислоты, найденные нами, делятся на насыщенные (пальмитиновая, стеариновая), моно- и полиненасы-щенные (олеиновая (омега-9)), в том числе незаменимые линолевая и линоленовая (омега-3). Все образцы капусты содержали пальмитиновую, линоленовую, линолевую, стеариновую кислоты. Отдельные образцы цветной капусты содержали олеиновую и церотиновую кислоты. Образец японской селекции Southern Comet Hybrid отличался наиболее высоким содержанием свободных жирных кислот – 85,3 мг/100 г.
Таблица 8. Состав и содержание свободных жирных кислот в брокколи и цветной капусте, в мг/100 г
Table 8. Composition and content of free fatty acids in broccoli and cauliflower, in mg/100 g
|
Брокколи (7) |
Цветная (8) |
|
|
Пальмитиновая |
18,47±7,42* |
2,24±1,18 |
|
Линоленовая |
12,69±11,01* |
3,02±2,02 |
|
Линолевая |
9,24±6,59* |
1,59±0,89 |
|
Стеариновая |
4,68±2,18* |
0,37±0,11 |
|
Олеиновая |
2,97±3,21* |
0,73±0,36 |
|
Ундециловая |
1,39* |
- |
|
Гидрокси октодекановая |
1,09 ±0,15* |
- |
|
Церотиновая |
- |
0,68* |
|
Моно ацил глицерол пальмитиновой кислоты |
4,07±2,91* |
следы |
|
Сумма |
53,21±33,47 |
7,95±5,56 |
1 – среднее значение
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
Спирты
В образцах капусты найдено 10 многоатомных спиртов, восемь из которых относится к сахароспиртам (инозитол, глицерол, галактинол, сорбитол, эритритол, ксилитол, арабинитол), один – простейший стабильный аминоспирт (этаноламин) и одноненасыщенный дитерпеновый спирт – фитол (табл. 9). Содержание спиртов в образцах капусты брокколи варьировало от 32,46 до 403,34 мг/100 г (среднее значение – 169,11 мг/100 г). Накопление многоатомных спиртов в образцах цветной капусты отмечалось в несколько раз ниже – от 7,7 до 45,2 мг/100 г (среднее значение – 31,06 мг/100 г). Самым широко представленным многоатомным спиртом для образцов Brassica оказался мио-инозитол (B8, содержание которого доходило до 363,38 мг/100 г в брокколи и до 39,5 мг/100 г – в цветной капусте. В 25% образцов брокколи огородной был найден сорбитол (образцы канадской и японской селекции) и у отдельных образцов – арабинитол. Все образцы брокколи и цветной капусты содержали мио-инозитол, глицерол и галактинол. Высоким накоплением спиртов выделился образец Furio (403,7 мг/100 г), где главным компонентом выступал мио-инозитол.
Таблица 9. Состав и содержание спиртов в брокколи и цветной капусте, в мг/100 г Table 9. Composition and alcohol content in broccoli and cauliflower, in mg/ 100 g
|
Брокколи (10) |
Цветная (7) |
|
|
Инозитол |
147,81±103,4* |
25,48±11,12 |
|
Глицерол |
6,72±3,79* |
1,07±0,35 |
|
Галактинол |
4,16±2,89 |
2,08±0,81 |
|
Сорбитол |
3,35±3,17* |
0,86±0,25 |
|
Фитол |
1,92±1,39* |
0,64±0,23 |
|
Эритритол |
1,41±1,47* |
0,31±0,1 |
|
Этаноламин |
1,35±2,15* |
следы |
|
Ксилитол |
1,27±1,13 |
0,62±0,22 |
|
Арабинитол |
1,12 ±0,55* |
следы |
|
Сумма |
169,11±119,94 |
31,06±13,08 |
1 – среднее значение
2 – стандартное отклонение
* – показатели, по которым найдены достоверные различия между изучаемыми группами образцов при 5% уровне значимости.
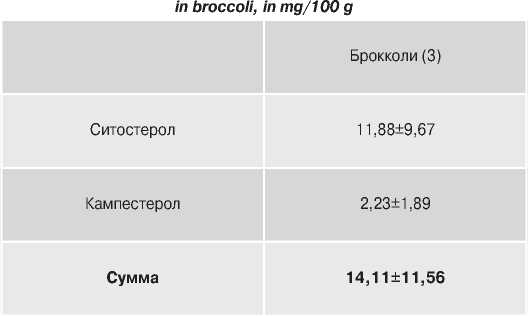
Фитостеролы.
Фитoстepoлы являются широким классом растительных веществ (порядка 100 соединений), чрезвычайно близких по структуре животному продукту – холестерину [27]. Они являются натуральными компонентами клеточных мембран растений. Структура фитостеролов подобна структуре холестерина, и они могут легко связываться с желчными и жирными кислотами вместо холестерина, снижая тем самым сорбцию холестерина в просвете кишечника и улучшая выведение его из организма. В изученных образцах были идентифицированы два фитостерола: ситостерол и кампестерол. Содержание фитостеролов в брокколи варьировало от 4,75 до 51,3 мг/100 г (в среднем – 14,11 мг/100 г), в цветной в незначительных количествах (табл. 10). В изученных нами образцах наиболее высокое накопление фитостеролов отмечалось в четырех образцах (более 20 мг/100 г): Monterey (F 1 ) (51,3), Furio (28,75), Pentathlon (F 1 ) (25,5), Medway (F 1 ) (24,36).
Таблица 10. Состав и содержание фитостеролов спиртов в брокколи, в мг/100 г
Table 10. The composition and content of phytosterols
Таким образом, в результате проведенных нами исследований с использованием метаболомного профилирования были получены новые данные о биохимическом составе брокколи и цветной капусты. Исследованный сложный биохимический состав капусты огородной в пределах изученных разновидностей характеризует их как потенциально высокоценные (при этом роль и значение далеко не всех соединений в организации здорового питания человека известна), что подтверждает необходимость продолжения углубленного контроля биохимического состава растений при выведении новых сортов. Дана качественная и количественная характеристика капустных культур вида капуста огородная Brassica oleracea L. (брокколи и цветная капуста) по основным наиболее важным биохимическим признакам качества: сахара и их производные, свободные и незаменимые аминокислоты, органические кислоты, жирные кислоты, фенольные соединения, спирты, фитостеролы. Выявлены достоверные различия при p>0,05 между образцами цветной капусты и брокколи в накоплении сахаров (фруктоза, глюкоза, маноза, галактоза, рамноза, альтроза, рутиноза, стахиоза) и их производных (треоно-1,4-лактон, эритроно-1,4-лактон, гли-церол-3-фосфат, глюкозо-1-фосфат, метилглюкозид, метиларбутин); органических кислот (яблочная, аскорбиновая, фосфорная,треоновая, янтарная, молочная, рибоновая, глюконовая, метилмалоновая, щавелевая, абиетиновая, винная, азелаиновая, мезоксалевая, аконитовая, глюкуроновая, галактуроновая); большинству фенольных соединений; свободных аминокислот (оксипролин, серин, пролин, норлейцин, гамма-аминомасляная кислота, глицин, орнитин, N ацетил серин); незаменимых аминокислот (метионин, фенилаланин, триптофан, лейцин, изолейцин); жирных кислот; многоатомных спиртов (инозитол, глицерол, сорбитол, фитол, эритритол, этаноламин, арабинитол). Выделены образцы с высоким содержанием отдельных питательных и биологически активных веществ. Выявленные различия в биохимическом составе позволяют обосновать необходи- мость увеличения в питании человека доли отдельных разновидностей капусты, например, брокколи, которая обладает более ценным биохимическим составом, чем цветная капуста. Найдены образцы с оптимальным компонентным составом для сбалансированного питания человека, которые предлагается использовать в селекции на качество, в том числе получения сортов для здорового (функционального) и лечебно-профилактического питания, и расширения ассортимента и сортимента капустных культур в рационе питания населения РФ.
Об авторах:
Dmitrii A. Fateev – Researcher, ,
Alla E. Solovyeva – Cand. Sci. (Biology),
Senior Researcher, ,
Tatiana V. Shelenga – Cand. Sci. (Biology),
Senior Researcher, ,
Anna M. Artemyeva – Cand. Sci. (Agriculture),
Lieder Researcher, ,
Список литературы Комплексная биохимическая характеристика брокколи и цветной капусты
- A proceeding of the XXVI International Horticultural Congress, Toronto, Canada, 11-17 August, 2002: viticulture - living with limitations.
- Артемьева А.М., Соловьева А.Е. Генетическое разнообразие и биохимическая ценность капустных овощных растений рода Brassica L. Вестник новосибирского государственного аграрного университета. 2018;49(4):50-61). DOI: 10.31677/2072-6724-2018-49-4-50-61
- Singh J., Rai M., Upadhyay A.K., Bahadur A., Chaurasia S.N., Singh, K. Antioxidant phytochemicals in broccoli (Brassica oleracea L. var. italica Plenck) cultivars. Journal of Food Science and Technology.Mysore. 2006;43: 391-393.
- Basten G.P., Bao Y., Williamson G. Sulforaphane and its glutathione conjugate but not sulforaphane nitrile induce UDP-glucuronosyl transferase (UGT1A1) and glutathione transferase (GSTA1) in cultured cells. Carcinogenesis. 2002;(23):1399-1404
- Verhoeven D., Goldbohm R.A., van Poppel Geert, Verhagen Hans, Brandt P.A. Epidemiological studies on brassica vegetables and cancer risk. Cancer Epidemiol Biomarkers. 5:733-748.
- Michaud D.S., Spiegelman D., Clinton S.K., Rimm E.B., Curhan G.C., Willett W.C., Giovannucci E.L. Fluid intake and the risk of bladder cancer in men. N. Engl. J. Med. 1999;(340):1390-1397.
- Yochum L., Kushi L.H., Meyer K., Folsom A.R. Dietary flavonoid intake and risk of cardiovascular disease in postmenopausal women. Am J Epidemiol. 1999;(149):943-949.
- Raiola A., Errico A., Petruk G., Monti D.M., Barone A., Rigano M.M. Bioactive Compounds in Brassicaceae Vegetables with a Role in the Prevention of Chronic Diseases. Molecules. 2017;23(1):15.
- DOI: 10.3390/molecules23010015
- Lippmann D., Lehmann C., Florian S., Barknowitz G., Haack M., Mewis I., Wiesner M., Schreiner M., Glatt H., Brigelius-Flohé R. Glucosinolates from pakchoi and broccoli induce enzymes and inhibit inflammation and colon cancer differently. Food Funct. 2014;(5):1073-1081.
- DOI: 10.1039/C3FO60676G
- Dos Reis L.C.R., Oliveira V.R., Hagen M.E.K., Jablonski A., Flores S.H., de Oliveira Rios A. Carotenoids, flavonoids, chlorophylls, phenolic compounds and antioxidant activity in fresh and cooked broccoli (Brassica oleracea var. Avenger) and cauliflower (Brassica oleracea var. Alphina F1). LWT Food Sci. Technol. 2015;(63):177-183.
- DOI: 10.1016/j.lwt.2015.03.089
- Ловкова М.Я., Рабинович А.М., Пономарева С.М., Бузук Г.Н., Соколова С.М. Почему растения лечат. М, 1990. [Lovkova M.Y., Rabinovich A.M., Ponomareva S.M., Buzuk G.N., Sokolova S.M. Why are plants treated? М., 1990. (In Russian)]
- Jahangir M., H. K. Kim, Y. H. Choi, R. Verpoorte. Health-Affecting Compounds in Brassicaceae. Food Sci. and Food Saf. 2009;8(2):31-43.
- DOI: 10.1111/j.1541-4337.2008.00065.x
- Tribulato A., Branca F., Ragusa L., Lo Scalzo R., Picchi V. Survey of Health-Promoting Compounds in Seeds and Sprouts of Brassicaceae. Acta Hortic. 2013;(1005):323-330.
- DOI: 10.17660/ActaHortic.2013.1005.37
- Novío S.,Cartea M. E.,Soengas P.,Freire-Garabal M., Núňez-Iglesias M. J. Effects of Brassicaceae Isothiocyanates on Prostate Cancer. Molecules. 2016;21(5),626.
- DOI: 10.3390/molecules21050626
- Лоскутов И.Г., Шеленга Т.В., Конарев А.В., Шаварда А.Л., Блинова Е.В., Дзюбенко Н.И Метаболомный подход к сравнительному анализу диких и культурных видов овса (Avena L.). Вавиловский журнал генетики и селекции. 2016;20(5):636-642.
- DOI: 10.18699/VJ16.185
- Конарев А.В., Шеленга Т.В., Перчук И.Н., Блинова Е.В., Лоскутов И.Г. Характеристика разнообразия овса (Avena L.) из коллекции ВИР - исходного материала для селекции на устойчивость к фузариозу. Аграрная Россия. 2015;(5):2-10.
- Puzanskiy R.K., Shavarda A.L., Tarakhovskaya E.R., Shishova M.F. Analysis of metabolic profile of Chlamydomonas reinhardtii cultivated under autotrophic conditions. Appl. Biochem. Microbiol. 2015;51(1):83-94.
- DOI: 10.1134/S0003683815010135
- Annunziata M.G., Carillo P., Fuggi A., Troccoli A., Woodrow P. Metabolic profiling of cauliflower under traditional and reduced tillage systems. Australian Journal of Crop Science. 2013:(7):1317-1323.
- Park S.Y, Lim S.H., Ha S.H., Yeo Y., Park W.T., Kwon D.Y., Park S.U., Kim J.K. Metabolite profiling approach reveals the interface of primary and secondary metabolism in colored cauliflowers (Brassica oleracea L. ssp. botrytis). J Agric Food Chem. 2013 Jul 17;61(28):6999-7007.
- DOI: 10.1021/jf401330e
- Capriotti, A. L., Cavaliere C., La Barbera G., Montone C.M., Piovesana S., Zenezini Chiozzi R., Laganà A. Chromatographic column evaluation for the untargeted profiling of glucosinolates in cauliflower by means of ultra-high performance liquid chromatography coupled to high resolution mass spectrometry. Talanta 2018;(179):792-802.
- Revelou P.K., Kokotou M.G., Constantinou-Kokotou V. Identification of Auxin Metabolites in Brassicaceae by Ultra-Performance Liquid Chromatography Coupled with High-Resolution Mass Spectrometry. Molecules (Basel, Switzerland). 2019;24(14).
- DOI: 10.3390/molecules24142615
- Ермаков А.И., Арасимович В.В., Ярош Н.П. Методы биохимического исследования растений. Л., 1987.
- Смоликова Г.Н., Шаварда А.Л., Алексейчук И.В., Чанцева В.В., Медведев С.С. Mетаболомный подход к оценке сортовой специфичности семян Brassica napus L. Вавиловский журнал генетики и селекции. 2015;19(1 ):121 -127.
- Yao S.Z., Chen P., Yang X.Y., Fung Y.S., Si S.H. Herbal Organic Acids. In Advanced Chromatographic and Electromigration methods in BioSciences, Edited by Deyl Z., Miksik I., Tagliaro F. and Tesarova E. J. of Chromatogr. Libray Series. 1998;(60):344-370.
- Ailia D., Vassiliev A., Jensen J. O., Schmidt T. J., Li Q. Methyl phosphate formation as a major degradation mode of direct methanol fuel cells with phosphoric acid based electrolytes. J. of Power Sources. 2015;(279):517-521.
- DOI: 10.1016/j.jpowsour.2015.01.010
- Caňete-Rodríguez A.M., Santos-Dueňas I.M., Jiménez-Hornero J.E., Ehrenreich A., Liebl W., García-García I. Gluconic acid: Properties, production methods and applications-An excellent opportunity for agro-industrial by-products and waste bio-valorization. Process Biochemistry. 2016;51(12):1891-1903.
- DOI: 10.1016/j.procbio.2016.08.028
- Teshima, S. In Physiology and Biochemistry of Sterols (G.W. Patterson and W.D. Nes, eds). AOCS, Champaign, IL. 1991. P.229.


