Комплексная иммуно-гормональная оценка риска возникновения рака молочной железы у женщин в постменопаузе
Автор: Глушков А.Н., Поленок Е.Г., Гуров Е.А., Гордеева Л.А., Мун С.А., Костянко М.В., Студенников А.Е., Елисейкин А.М., Захаров В.Н., Антонов А.В., Байрамов П.В., Вержбицкая Н.Е., Колпинский Г.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.24, 2025 года.
Бесплатный доступ
Цель исследования – определение индивидуальных комбинаций содержания в сыворотке крови эстрадиола и прогестерона (Е2 и Pg), антител классов А и G против Bp, E2 и Pg, и антиидиотипических антител класса G к E2 и Pg, значимо ассоциированных с возникновением рака молочной железы (РМЖ) у женщин в постменопаузе. Материал и методы. Обследовались 763 некурящие женщины: 206 здоровых и 557 больных РМЖ І стадии до начала лечения. Содержание в сыворотке гормонов и антител определяли с помощью конкурентного и неконкурентного иммуноферментных методов соответственно. CART-анализ (Classification and Regression Trees) полученных результатов выполняли с помощью программы Statistica 13.0. Результаты. Определены 7 групп в дереве решений по индивидуальным комбинациям IgG2-E2, E2, IgA1-E2, Pg и IgG1-Bp, значимо ассоциированным с риском РМЖ. Высокие уровни E2 в комбинации с высокими уровнями IgG1-Bp чаще обнаруживали у больных РМЖ, чем у здоровых женщин (54,2 vs 26,7 %; p<0,001; OR=3,3 [2,3–4,7]), так же как и низкие уровни Pg в комбинации с низкими уровнями IgG1-Bp и со средними уровнями IgG2-E2 (9,9 vs 3,9 %; p=0,01; OR=2,7 [1,3–5,8]). В остальных 5 группах различные комбинации высоких и низких уровней исследованных факторов встречались чаще (72,4 %) у здоровых женщин, чем у больных РМЖ (36,4%). Содержание в сыворотке E2 и Pg не связано с уровнями исследованных антител и анти-антител. Уровни антиидиотипических антител не коррелировали с уровнями соответствующих идиотипических антител. Заключение. Влияние E2 и Pg на возникновение РМЖ проявлялось только в комбинациях с IgG2-E2, IgA1-E2 и IgG1-Bp. Анализ антител против E2, Pg и Bp и соответствующих анти-антител рекомендуется для исследования иммунологических механизмов возникновения химически индуцированных гормонозависимых опухолей у человека.
Антитела, эстрадиол, прогестерон, бензо[а]пирен, рак молочной железы
Короткий адрес: https://sciup.org/140313327
IDR: 140313327 | УДК: 618.19-006:616-097.3:577.17 | DOI: 10.21294/1814-4861-2025-24-6-70-81
Текст научной статьи Комплексная иммуно-гормональная оценка риска возникновения рака молочной железы у женщин в постменопаузе
Рак молочной железы (РМЖ) остается основной онкологической патологией женского населения РФ и других стран [1, 2]. Несмотря на рост заболеваемости, смертность от РМЖ снижается благодаря ее раннему выявлению и повышению эффективности лечения. Для снижения заболеваемости продолжается поиск медикаментозных средств профилактики РМЖ, в частности среди селективных модуляторов эстрогеновых рецепторов и ингибиторов ароматазы [3–6]. Одной из основных проблем, сдерживающих развитие этого направления, является отсутствие надежных показаний для их применения у здоровых женщин – информативных критериев риска возникновения РМЖ. Использование таких критериев позволило бы повысить эффективность раннего выявления РМЖ и снизить заболеваемость благодаря на- значению химиопрофилактических средств при минимизации осложнений. В случаях семейного РМЖ рекомендуется анализ мутаций в генах BRCA1, BRCA2, PLB2, CHEK2, ATM [7] наряду с оценкой образа жизни, гормонального статуса, денситометрией молочной железы и других факторов. Для мультифакторных РМЖ необходимы дополнительные фенотипические предикторы.
Основанием для поиска таких предикторов являлись хорошо известные данные о ключевом значении в канцерогенезе молочной железы генотоксических метаболитов химических канцерогенов окружающей среды, в частности бензо[а] пирена (Bp) и эндогенного эстрадиола (E2). Обнаружены ассоциации образования ДНК-аддуктов этих низкомолекулярных соединений с риском возникновения РМЖ [8–12]. Будучи ковалентно связанными с макромолекулярными носителями, метаболиты Bp и E2 становятся гаптенами, способными индуцировать синтез соответствующих специфических антител. У больных РМЖ обнаружены повышенные уровни антител против Bp и E2 по сравнению со здоровыми женщинами [13].
Вместе с тем, известны взаимоусиливающие эффекты Bp и E2 на клетки молочной железы. Некоторые метаболиты Bp проявляли эстрогеновую или антиэстрогеновую активность, в частности, индуцировали или угнетали активность β-галактозидазы, связываясь с ER [14]. E2 стимулировал образование Bp-ДНК аддуктов в ER экспрессирующих клетках линии MCF-7 при их обработке совместно с Bp [15]. Нами обнаружены прямые корреляции между уровнями антител против Bp и E2 в сыворотке здоровых женщин и больных РМЖ, однако одновременно высокие их уровни встречались чаще у больных РМЖ, чем у здоровых лиц [16]. Очевидно, совместные специфичные иммунные реакции на указанные соединения отражают их участие в канцерогенезе молочной железы и одновременное образование ДНК-аддуктов с Bp и E2.
В сыворотке больных РМЖ выявлены антитела против рецепторов ERα в больших количествах, чем у здоровых женщин [17], а также антиидиоти-пические антитела, специфичные к моноклональным антителам против E2 и Pg, модулирующие содержание этих гормонов у здоровых женщин больше, чем у больных РМЖ [18].
Таким образом, в работах показано потенциальное значение антител против Bp, E2 и Pg, а также антиидиотипических анти-антител к E2 и Pg в определении риска возникновения РМЖ. Однако при этом антитела разных классов иммуноглобулинов описаны по отдельности; не учитывалось участие самих гормонов в совокупности с антителами в индукции РМЖ; проводилось сравнение здоровых женщин со всей когортой больных РМЖ, а не с больными в начальных стадиях опухолевого роста, что было не совсем корректно в поисках информативных предикторов РМЖ. Очевидно, что результирующая оценка взаимосвязей перечисленных факторов с риском возникновения РМЖ зависит от индивидуальных комбинаций их содержания в сыворотке крови здоровых женщин. При одновременном участии в канцерогенезе молочной железы стимулирующее или угнетающее действие одних может нивелироваться или усиливаться влиянием других. В итоге комбинации только некоторых из исследуемых факторов могут оказаться значимо ассоциированными с риском РМЖ.
Для оценки комбинированного влияния стероидных гормонов, идиотипических и антиидиотипи-ческих гормон-специфических антител и антител против химических канцерогенов окружающей среды целесообразно обследовать здоровых и больных РМЖ в постменопаузе, чтобы исключить циклические колебания гормонального статуса, и использовать CART-анализ (Classification and Regression Trees Analysis), применяемый в онкологии для решения подобных диагностических задач [19].
Цель исследования – определение индивидуальных комбинаций содержания в сыворотке крови E2 и Pg; антител классов A и G против Bp, E2 и Pg; антиидиотипических антител класса G к E2 и P, значимо ассоциированных с возникновением РМЖ у женщин в постменопаузе.
Материал и методы
Исследовали сыворотку крови 763 некурящих женщин в постменопаузе. Из них 206 условно здоровых женщин, составивших группу сравнения (возраст – 57,7 ± 5,8 года), и 557 женщин, больных РМЖ I стадии (возраст – 65,6 ± 8,0 лет). Все женщины исследуемой группы поступали в Кузбасский онкологический диспансер, г. Кемерово, с первично установленным диагнозом: Инвазивная карцинома молочной железы неспецифического типа. При дальнейшем обследовании у них были выявлены следующие молекулярно-биологические подтипы РМЖ: люминальный А – 48,7 %, люминальный В HER2 отрицательный – 40,9 %, люминальный В HER2 положительный – 1,4 %, HER2 положительный нелюминальный – 0,7 %, трижды негативный фенотип – 7,4 %. Все больные ранее не получали специального противоопухолевого лечения, в том числе гормонотерапию. В группу сравнения были отобраны женщины по следующим критериям: отсутствие какого-либо злокачественного новообразования, патологии молочной железы, некурящие, проживающие на территории Кемеровской области.
Содержание в сыворотке стероидных гормонов определяли с помощью коммерческих наборов «ИммуноФА-Эстрадиол», «ИммуноФА-ПГ» («Иммунотех», г. Москва) согласно инструкциям. Идиотипические антитела классов A и G против Bp, E2 и Pg (IgА1-Bp, IgА1-E2, IgА1-Pg, IgG1-Bp, IgG1-E2, IgG1-Pg) исследовали с помощью ELISA [20], используя адсорбированные на пластике конъюгаты указанных гаптенов с бычьим сывороточным альбумином и проявляя связавшиеся иммуноглобулины козьими антителами против IgА и IgG человека, меченными пероксидазой хрена (Invitrogen, США). Антиидиотипические антитела класса G, специфичные к E2 и Pg (IgG2-E2, IgG2-Pg), определяли с помощью ELISA [20], используя адсорбированные на пластике моноклональные антитела против E2 и Pg в наборах «ИммуноФА-Эстрадиол», «ИммуноФА-ПГ» («Иммунотех», г. Москва) в качестве антигенов и пероксидазные конъюгаты козьих антител против IgG человека. В представленной работе не исследовали содержание в сыворотке крови других иммунологических факторов, потенциально участвующих в канцерогенезе молочной железы: антиидиотипических антител к Вр (IgА2-Bp и IgG2-Bp) и антиидиотипических антител класса А к E2 и Pg (IgА2-E2 и IgА2-Pg).
Полученные результаты обрабатывали с помощью программы Statistica 13.0 (StatSoft Inc., USA). В базу данных были внесены показатели уровней исследованных антител (условные единицы, у.е.) и содержание гормонов (pmol/L) от здоровых женщин и больных РМЖ. Наблюдаемый дисбаланс выборок (соотношение 1:2,7) потребовал стратифицированного разделения данных на обучающую (608 наблюдений: 164 здоровые женщины и 444 больных РМЖ) и тестовую (154 наблюдения: 41 здоровая женщина и 113 больных РМЖ) выборки в пропорции 80:20 %. Для коррекции дисбаланса исключительно к обучающим данным применена техника SMOTE (Synthetic Minority Over-sampling Technique) с использованием библиотеки imbalanced-learn (Python 3.11) при параметре k_neighbors=5, что позволило синтезировать 280 дополнительных образцов миноритарного класса и сформировать сбалансированную обучающую выборку объемом 890 наблюдений (445 здоровых лиц и 445 больных РМЖ), тогда как тестовая выборка (n=154) сохранила исходный дисбаланс. На обработанных обучающих данных с использованием 10 потенциальных предикторов (8 иммунологических и 2 гормональных показателя) построено CART-дерево (Classification and Regression Trees) в программной среде Statistica 13.0 (модуль «Многомерные деревья классификации») со следующими параметрами: критерий ветвления – индекс Джини, минимальное число объектов в терминальном узле – 15, максимальная глубина дерева – 7 уровней. Для оценки различий между исследуемыми группами использовали непараметрический критерий χ2 с поправкой Йейтса на непрерывность вариации, т.к. распределение полученных показателей носило ненормальный характер согласно W-критерию Шапиро–Уилка. Критический уровень значимости – p<0,05. Ассоциации исследуемых показателей с риском возникновения РМЖ оценивали с помощью величины отношения шансов (ОR) с доверительным интервалом (CI) при 95 % уровне значимости.
Результаты
Результаты моделирования распределения здоровых женщин и больных РМЖ в соответствии с определенными параметрами исследованных 10 факторов сыворотки крови («дерево решений» по CART-анализу) представлены на рис. 1. Построенное CART-дерево достигло глубины 5 уровней с образованием 7 терминальных узлов, демонстрируя сложную иерархию иммунологических и гормональных маркеров. Анализ ветвления показал, что начальное разделение в корневом узле определялось уровнем IgG1-Bp с пороговым значением 7,6 у.е. Одна часть когорты с IgG1-Bp≤7,6 у.е. (n=409) направлялась в левую ветвь, а другая с IgG1-Bp>7,6 у.е. (n=481) – в правую ветвь дерева. Последующие уровни ветвления последовательно
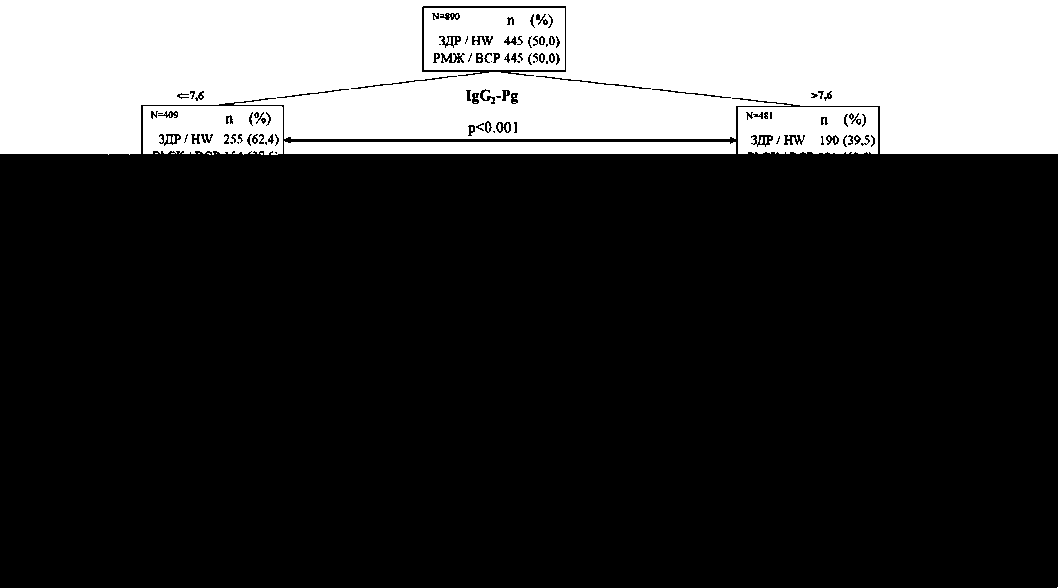
Рис. 1. CART-анализ исследуемых антител и гормонов в сбалансированной обучающей выборке 445 здоровых женщин (ЗДР) и 445 больных раком молочной железы (РМЖ). Примечание: рисунок выполнен авторами
Fig. 1. CART-analysis of studied antibodies and hormones in balanced training sampling of 445 healthy women (HW) and 445 breast cancer patients (BCP). Note: created by the authors
вовлекали остальные параметры, учитываемые при построении модели.
Среди 409 женщин с низкими уровнями IgG1-Bp (≤7,6 у.е.) 62,4 % были здоровыми, а 37,6 % – больными. Дальнейшее их разделение зафиксировано по уровням IgG2-E2. Среди 162 женщин с низкими уровнями IgG2-E2≤3,4 у.е. здоровых было 75,9 %, а больных – 24,1 %. Из 247 женщин с высокими уровнями IgG2-E2>3,4 у.е. 53,4 % было здоровых и 46,6 % – больных. В свою очередь, эта группа разделилась на две с более высокими уровнями IgG2-E2>5,4 у.е. (61 человек: 73,8 % здоровых и 26,2 % больных) и с IgG2-E2 в интервале 3,4 – 5,4 у.е. (186 человек: 46,8 % здоровых и 53,2 % больных). Последняя группа состояла из 2 подгрупп, различающихся по содержанию Pg: из 62 человек с низкими Pg≤645 pmol/L здоровых было 27,4 %, а больных – 72,6 %; из 124 человек с высокими Pg>645 pmol/L –56,5 и 43,5 % соответственно.
Правая ветвь дерева решений с высокими уровнями IgG1-Bp>7,6 у.е. сначала разделилась по содержанию E2. У 344 человек оно было высоким, >79 pmol/L. Среди них здоровых оказалось 30,8 %, а больных – 69,2 %. Группа с низким содержанием E2≤79 pmol/L разделилась на две подгруппы: с низкими уровнями IgA1-E2≤2,6 у.е. (80 человек – 77,5 и 22,5 % соответственно) и с высокими уров- нями IgA1-E2>2,6 у.е. (57 человек – 38,6 и 61,4 % соответственно).
Таким образом, с помощью CART-анализа выявлены значимые различия между здоровыми женщинами и больными РМЖ по частоте индивидуальных комбинаций 5 из 10 исследованных факторов сыворотки: IgG1-Bp, IgG2-E2, E2, Pg и IgA1-E2. Остальные факторы (IgA1-Bp, IgG1-E2, IgA1-Pg, IgG1-Pg и IgG2-Pg) не участвовали в формировании этих различий или их участие было незначительным. Используя этот алгоритм CART-анализа, построили модель распределения здоровых женщин и больных РМЖ с учетом 5 значимых факторов. В результате получили точно такое же распределение (дерево решений), как на рис. 1, а именно: 7 различных индивидуальных комбинаций 5 значимых факторов, по-разному представленных в модели у здоровых лиц и больных РМЖ.
В таблице 1 показано представительство каждой из этих комбинаций в сравниваемых группах. Удельный вес здоровых женщин был выше, чем больных РМЖ (p<0,001, OR=0,3), при наличии в сыворотке крови следующих комбинаций уровней анализированных факторов: IgG1-Bp≤7,6 у.е. + + IgG2-E2≤3,4 у.е. (позиция 1); IgG1-Bp≤7,6 у.е. + + IgG2-E2>5,4 у.е. (позиция 4); IgG1-Bp>7,6 у.е. + + E2≤79 pmol/L + IgA1-E2≤2,6 у.е. (позиция 5).
Таблица 1/table 1
Число и частота индивидуальных комбинаций исследованных антител и гормонов по сбалансированной обучающей выборке в CaRt-анализе у здоровых женщин и больных РМЖ number and frequency of revealed personal combinations of studied antibodies and hormones according to balanced training sampling in CaRt-analysis of healthy women and breast cancer patients
|
Комбинации антител и гормонов/ Combinations of hormones and antibodies |
Здоровые женщины/ Healthy women (n=206) |
РМЖ I стадии/ Stage I BC (n=557) |
χ2 (р) OR (95 %CI) |
|
1. IgG1-Bp≤7,6 + IgG2-E2≤3,4 |
123 (27,6 %) |
39 (8,8 %) |
51,9 (<0,001) 0,3 (0,2–0,4) |
|
2. IgG1-Bp≤7,6 + IgG2-E2 3,4–5,4 + Pg ≤645 |
17 (3,8 %) |
45 (10,1 %) |
12,6 (<0,001) 2,8 (1,6–5,0) |
|
3. IgG1-Bp≤7,6 + IgG2-E2 3,4–5,4 + Pg>645 |
70 (15,7 %) |
54 (12,1 %) |
2,1 (0,15) 0,7 (0,5–1,1) |
|
4. IgG1-Bp≤7,6 + IgG2-E2>5,4 |
45 (10,1 %) |
16 (3,6 %) |
13,8 (<0,001) 0,3 (0,2–0,6) |
|
5. IgG1-Bp>7,6 + E2≤79 + IgA1-E2≤2,6 |
62 (14,0 %) |
18 (4,0 %) |
25,4 (<0,001) 0,3 (0,2–0,4) |
|
6. IgG1-Bp>7,6 + E2≤79 + IgA1-E2>2,6 |
22 (5,0 %) |
35 (7,9 %) |
2,7 (0,10) 1,6 (0,9–2,8) |
|
7. IgG1-Bp>7,6 + E2>79 |
106 (23,8 %) |
238 (53,5 %) |
81,3 (<0,001) 3,7 (2,8–4,9) |
|
χ2 (р) 1–2 |
42,9 (<0,001) |
||
|
1–3 |
11,3 (<0,001) |
||
|
1–4 |
0,03 (0,87) |
||
|
2–3 |
12,9 (<0,001) |
||
|
2–4 |
24,6 (<0,001) |
||
|
3–4 |
4,5 (0,03) |
||
|
5–6 |
19,6 (<0,001) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Таблица 2/table 2
Число и частота индивидуальных комбинаций исследованных антител и гормонов в фактической выборке у здоровых женщин и больных раком молочной железы number and frequency of revealed personal combinations of studied antibodies and hormones in real sampling of healthy women and breast cancer patients
|
Комбинации антител и гормонов/ Combinations of hormones and antibodies |
Здоровые женщины/ РМЖ I стадии/ Healthy women Hea(ltnh=y2w06o)men Stage I BC (n=557) |
χ2 (р) OR (95 %CI) |
|
|
1. IgG1-Bp≤7,6 + IgG2-E2≤3,4 |
55 (26,7 %) |
49 (8,8 %) |
39,4 (<0,001) 0,3 (0,2–0,4) |
|
2. IgG1-Bp≤7,6 + IgG2-E2 3,4–5,4 + Pg ≤645 |
8 (3,9 %) |
55 (9,9 %) |
6,4 (0,01) 2,7 (1,3–5,8) |
|
3. IgG1-Bp≤7,6 + IgG2-E2 3,4–5,4 + Pg>645 |
26 (12,6 %) |
62 (11,1 %) |
0,19 (0,66) 0,9 (0,5–1,4) |
|
4. IgG1-Bp≤7,6 + IgG2-E2>5,4 |
19 (9,2 %) |
21 (3,8 %) |
7,9 (0,005) 0,4 (0,2–0,7) |
|
5. IgG1-Bp>7,6 + E2≤79 + IgA1-E2≤2,6 |
29 (14,1 %) |
25 (4,5 %) |
19,6 (<0,001) 0,3 (0,2–0,5) |
|
6. IgG1-Bp>7,6 + E2≤79 + IgA1-E2>2,6 |
14 (6,8 %) |
43 (7,7 %) |
0,1 (0,78) 1,1 (0,6–2,1) |
|
7. IgG1-Bp>7,6 + E2>79 |
55 (26,7 %) |
302 (54,2 %) |
46,3 (<0,001) 3,3 (2,3–4,7) |
|
χ2 (р) 1–2 |
25,3 (<0,001) |
||
|
1–3 |
9,7 (0,002) |
||
|
1–4 |
0,15 (0,69) |
||
|
2–3 |
5,0 (0,02) |
||
|
2–4 |
13,6 (<0,001) |
||
|
3–4 |
3,1 (0,08) |
||
|
5–6 |
8,7 (0,003) |
||
Примечание: таблица составлена авторами.
Note: created by the authors.
Не было различий по представительству здоровых и больных РМЖ (p>0,05, OR≈1) при наличии комбинаций: IgG1-Bp≤7,6 у.е. + IgG2-E2 в интервале 3,4 – 5,4 у.е. + Pg>645 pmol/L (позиция 3) и IgG1-Bp>7,6 у.е. + E2≤79 pmol/L + IgA1-E2>2,6 у.е. (позиция 6). Значительно чаще (в 2,2 раза) были представлены больные РМЖ (53,5 %), чем здоровые женщины (23,8 %; p<0,001, OR=3,7), при высоких уровнях IgG1-Bp>7,6 у.е. в комбинации с высоким содержанием E2>79 pmol/L (позиция 7).
Различия по представительству здоровых и больных женщин между выделенными в модельном CART-анализе 7 вариантами индивидуальных комбинаций анализируемых факторов, приведенные в табл. 1, позволят обсудить их потенциальную роль в канцерогенезе молочной железы.
Далее исследовали представительство этих 7 вариантов индивидуальных комбинаций 5 значимых факторов сыворотки, выявленных CART-анализом, в когорте из 206 здоровых женщин и 557 больных РМЖ, участвующих в данном исследовании. Выяснилось, что и те, и другие разделяются на такие же 7 комбинаций антител и гормонов (табл. 2). Ни в одном случае не обнаружено какого-либо другого индивидуального сочетания исследованных факторов. Более того, различия между фактически обследованными женщинами по представительству каждой из этих комбинаций почти полностью совпадали с рассчитанными по CART-анализу. Корреляции между фактическими и расчетными данными были значимыми (p<0,001) с rs=0,99 для здоровых и rs=0,97 для больных женщин. Различия между представительством каждой из 7 комбинаций исследованных факторов между здоровыми и больными по табл. 2 тоже полностью совпадали с приведенными в табл. 1. При этом комбинация высоких уровней IgG1-Bp>7,6 у.е. и Е2>79 pmol/L у больных РМЖ встречалась в 2 раза чаще, чем у здоровых женщин (54,2 vs 26,7 %, p<0,001).
Исследование значимости выделенных в CART-анализе 5 факторов, по которым здоровые женщины и больные РМЖ имели статистически значимые различия, показало, что, несмотря на определяющую роль IgG1-Bp в начальном разделении CART-дерева, анализ общей важности признаков (Gini Importance) выявил доминирование E2-ассоциированных факторов (рис. 2).. Наибольшую значимость проявили IgG2-E2 (100 %), E2 (90 %), IgA1-E2 (68 %). На 4-м месте оказался Pg (59 %), а исходный разделитель IgG1-Bp занял седьмую позицию (51 %). Вместе с тем, выяснилось, что уровни этих факторов коррелируют между собой и с уровнями других исследованных факторов сыворотки крови у здоровых лиц значимо (p<0,01), но с разной степенью:
– IgG2-E2 с IgG1-Bp (rs=0,43);
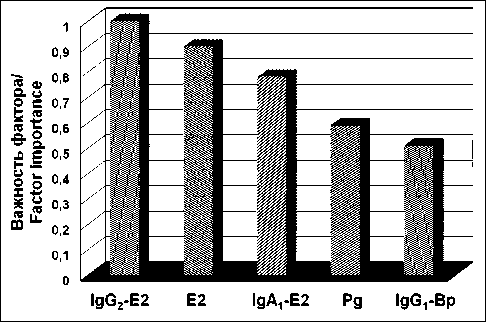
Рис. 2. Важность значимых факторов, выделенных в дереве решений по CART-анализу.
Примечание: рисунок выполнен авторами
Fig. 2. Importance of significant factors identified in the decision tree based on CART analysis. Note: created by the authors
– E2 с IgA1-E2 (rs=0,33);
– IgA1-E2 с IgA1-Bp (rs=0,61), с IgA1-Pg (rs=0,67);
– IgG1-Bp с IgA1-Bp (rs=0,31), с IgG1-E2 (rs=0,81), с IgG1-Pg (rs=0,66).
Содержание Pg не было взаимосвязано ни с одним из исследованных факторов.
Следует отметить хорошую воспроизводимость полученной CART-модели на независимой тестовой выборке. На обучающей выборке (164 здоровые женщины и 444 больных РМЖ) точность составляла 69,4 %, чувствительность – 71,5 %, специфичность – 67,4 %, F1 мера – 0,700. На тестовой выборке (41 здоровая женщина и 113 больных РМЖ) получены схожие результаты: 66,2; 65,5; 68,3 % и 0,740 соответственно.
Обсуждение
У здоровых женщин и больных РМЖ I стадии исследовали содержание в сыворотке 10 факторов: 2 стероидных гормонов, 6 идиотипических антител против классов A и G против Bp, E2 и Pg, а также 2 антиидиотипических антител класса G к E2 и Pg и с помощью CART-анализа определили наиболее значимые индивидуальные комбинации – потенциальные предикторы РМЖ.
Почти полное совпадение данных о представительстве выделенных комбинаций и у здоровых, и у больных в фактической когорте обследованных женщин с расчетными данными свидетельствовало об адекватности построенной модели ассоциаций указанных факторов по CART-анализу. Высокие значения коэффициентов корреляции между ними (rs=0,97, p<0,001) подтверждают это утверждение.
Сопоставление представительства каждой из 7 комбинаций у здоровых и больных РМЖ (табл. 2) позволяет сделать предположения о роли исследованных факторов в возникновении РМЖ. Среди женщин с одновременно низкими уровнями
IgG1-Bp≤7,6 у.е. и IgG2-E2≤3,4 у.е. (комбинация 1) удельный вес здоровых (26,7 %) был больше, чем больных (8,8 %), а при повышении уровня IgG2-E2 до значений 3,4–5,4 у.е. при тех же низких уровнях IgG1-Bp эти показатели составили 3,9 и 9,9 % соответственно, в комбинации с низким содержанием Pg≤645 pmol/L (комбинация 2); 12,6 и 11,1 % соответственно, в комбинации с высоким содержанием Pg>645 pmol/L (комбинация 3). Различия между ними были значимыми (1–2, p<0,001; 1–3, p=0,002; 2–3, p=0,02). У женщин с низкими уровнями IgG1-Bp≤7,6 у.е. в комбинации с более высокими уровнями IgG2-E2>5,4 у.е. (комбинация 4) доля больных РМЖ оказалась меньше, чем здоровых (3,8 vs 9,2 %). Это означало, что при низких значениях IgG1-Bp возрастание уровня IgG2-E2 с 3,4 до 5,4 у.е. было ассоциировано с повышением риска РМЖ (OR с 0,3 до 2,7), а дальнейшее возрастание уровня IgG2-E2 выше 5,4 у.е. – с понижением риска РМЖ (OR=0,4). То есть влияние IgG2-E2 на возникновение РМЖ у женщин с низкими уровнями IgG1-Bp было двухфазным – стимулирующим при возрастании с 3,4 до 5,4 у.е. и тормозящим при возрастании более 5,4 у.е.
Сопоставление комбинаций 2 и 3 с одинаковыми уровнями IgG1-Bp и IgG2-E2, но с разными уровнями Pg свидетельствовало о тормозящей возникновение РМЖ роли Pg: при низком его содержании (Pg≤645 pmol/L) OR=2,7, а при высоком OR=0,9. В 5 и 6-й комбинациях уровни IgG1-Bp были высокими – 7,6 у.е., а E2 – низкими ≤79 pmol/L. Среди женщин с одновременно низкими уровнями IgA1-E2≤2,6 у.е. доля здоровых была больше, чем больных (14,1 vs 4,5 %; OR=0,3), а с одновременно высокими уровнями IgA1-E2>2,6 у.е. они были равными (6,8 vs 7,7 %; OR=1,1). Различия по этим комбинациям оказались значимыми (p=0,003), что свидетельствовало о стимулирующей роли IgA1-E2 у женщин с низким содержанием в сыворотке E2 в комбинации с высокими уровнями IgG1-Bp. Одновременное повышение уровней IgG1-Bp и E2 (комбинация 7) встречалось у 26,7 % здоровых женщин и у 54,2 % больных РМЖ (OR=3,3; 2,3–4,7).
Полученные результаты соответствуют известным представлениям о стимулирующих канцерогенез молочной железы функциях E2 и тормозящих – Pg. Вместе с тем, выяснилось, что стимулирующее действие E2 проявлялось у женщин с высокими уровнями IgG1-Bp. Это не противоречило данным, полученным нами ранее, о повышении риска РМЖ при одновременно повышенных уровнях антител против Bp и E2 [16], поскольку содержание E2 в сыворотке здоровых женщин коррелировало с уровнем IgA1-E2, а IgA1-E2 – с IgA1-Bp (p<0,01). По-видимому, антитела против Bp, циркулирующие в сыворотке, действительно усиливают транспорт Bp из окружающей среды в кровь, как было показано в экспериментах in vitro (из апикального пространства монослоя эпителиальных клеток в базальное) [21], и способствуют накоплению Bp в органах-мишенях in vivo [22]. Таким образом, достигается двойное, взаимоусиливающее канцерогенное действие Bp и E2 [14, 15].
У женщин с низким содержанием E2 в комбинации с одновременно высокими уровнями антител против Bp и E2 (позиция 6) значение OR было выше (1,1), чем у женщин с высокими уровнями антител против Bp и низкими – против E2 (позиция 5), у которых OR=0,3 (p=0,003). То есть при «недостатке» E2 и антител против E2 повышение уровней антител против Bp не приводило к повышению риска возникновения РМЖ. Тормозящее канцерогенез действие повышенного содержания Pg проявлялось только у женщин с низкими уровнями IgG1-Bp и средними уровнями IgG2-E2 в интервале 3,4–5,4 у.е. (комбинация 3).
Интересно, что наиболее важными факторами в разделении исследованной когорты женщин на здоровых и больных по CART-анализу являлись не E2 и Pg, а антиидиотипические антитела IgG2-E2. Индукторами их образования у здоровых женщин могут быть соответствующие идиотипические антитела против E2, согласно классической теории об иммунологических сетях Йерне [23]. Однако нам не удалось найти корреляционные взаимосвязи между уровнями IgG2-E2 и антител против E2. Появление IgG2-E2 может быть ответом на соматические мутации ER, характерные для злокачественной трансформации клеток при РМЖ [24]. В этом случае антитела портив ER теоретически могут проявлять себя как антиидиотипические. In vitro установлено, что антиидиотипические антитела, реагирующие с моноклональными антителами против E2, демонстрировали E2-подобные эффекты [25]. Из сыворотки больных РМЖ выделены антитела против ER, стимулирующие пролиферацию ER-экспрессирующих клеток РМЖ [17], и этот эффект блокировался селективным модулятором ER [26]. По-видимому, анализ антиидиотипиче-ских антител к E2 или антител к ER, действительно, не менее важен, чем определение E2 в качестве фактора риска возникновения РМЖ.
Таким образом, установлено, что из 8 исследованных иммунологических факторов только IgG1-Bp, IgG2-E2 и IgA1-E2 проявили себя как предикторы РМЖ совместно с E2 и Pg. Однако в настоящей работе не было учтено потенциальное участие в иммуно-гормональной регуляции зло- качественной трансформации клеток молочной железы: антиидиотипических антител IgA2-Bp и IgG2-Bp, способных модулировать эффекты IgA1-Bp и IgG1-Bp; антиидиотипических IgA2-E2 и IgA2-Pg, способных модулировать действие соответствующих идиотипических антител против E2 и Pg и связываться с ER и PR, проявляемых с помощью ER и PR (в том числе мутантных форм) в качестве антигенов. Кроме того, дисбаланс между сравниваемыми группами (206 здоровых женщин и 557 больных РМЖ) мог вносить ошибку в CART-анализ используемой базы гормональных и иммунологических данных. Поэтому в дальнейших исследованиях целесообразно нивелировать этот дисбаланс и дополнить имеющуюся базу данных недостающими показателями других потенциальных участников канцерогенеза молочной железы.


