Комплексная лучевая диагностика первичных злокачественных опухолей печени
Автор: Бахшиев Б.А., Асадов А.С.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Целью настоящего исследования являлось сравнительная оценка методов медицинской визуализации и разработка системы лучевой диагностики опухолей печени. Было обследовано 16 больных с первичным раком печени(14-гепатоцеллюларная карцинома,2-холангиоцеллюларная карцинома). Диагноз опухоли печени был подтвержден по данным визуальных методов исследования, по результатам биохимических ( альфа-фетопротеин, СЕА, СА 19-9) и морфологических методов при динамическом контроле с помощью инструментальных методов. При УЗИ специфичность метода составила 74%, чувствительность - 70%. При КТ специфичность метода составила 92%, чувствительность - 89%. При МРТ исследовании специфичность и чувствительность составили 86% и 82% соответственно. Лабораторные исследования крови выявили увеличение концентрации АФП в несколько раз и у большинства больных этот показатель был выше 200 нг/мл. Обнаружено также статистически значимое повышение уровней СБА и СА-19-9, однако они были незначительны по сравнению с изменениями уровня АФП.
Рак печени, визуализация внутренних органов, дифференциальный диагноз
Короткий адрес: https://sciup.org/142211560
IDR: 142211560 | УДК: 615.47:616-073
Текст научной статьи Комплексная лучевая диагностика первичных злокачественных опухолей печени
Развитие и внедрение в клиническую практику новых средств визуализации внутренних органов существенно изменили диагностические возможности современной клинической медицины. Широкое применение новых технологий улучшило диагностику многих заболеваний, но диагностика очаговых поражений печени все еще остается сложной и во многом нерешенной проблемой современной онкологии [6, 7, 10]. Постоянно сохраняющаяся тенденция к неуклонному росту числа онкологических заболеваний делает актуальным раннее выявление очаговых изменений печени, дифференциацию доброкачественных и злокачественных очагов [9]. Развитие хирургических методов лечения опухолевых поражений печени повышает требования к максимально раннему выявлению патологических очагов в печени, так как это в значительной степени определяет своевременность и успех лечения [2].
Известно, что возможность выполнения радикальных оперативных вмешательств у онкологических больных напрямую зависит от распространенности опухолевого процесса, в том числе от наличия или отсутствия метастазов в печени [1]. Новые перспективы ранней диагностики, а также дифференциальной диагностики злокачественных и доброкачественных очаговых поражений печени открылись в результате разработки новых методов визуализаци – ультразвукового исследования (УЗИ), компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ).
В настоящее время УЗИ рассматривается как метод поиска первичного очага в печени. Доступность и простата выполнения исследования, отсутствие лучевой нагрузки на пациента и высокая чувствительность позволяют решать широкий круг диагностических задач, в частности выявлять очаговые образования в печени размерами менее 1 см, характеризовать их, изучать особенности васкуляризации опухоли, а также органный кровоток [8, 11]. Однако вследствие недостаточно высокой специфичности некоторые ультразвуковые признаки различных опухолей печени нуждаются в проверке и уточнении, поэтому в сложных и неоднозначных для диагностики случаях приходится прибегать к дополнительным методам исследования [6, 10].
Компьютерная томография (КТ) в настоящее время считается одним из классических методов выявлении и дифференциальной диагностики опухолевых поражений печени [5, 7]. К преимуществам КТ следует отнести высокую скорость исследования и возможность изучения денситометрических показателей исследуемых органов. Одним из решающих факторов диагностики очаговых поражений печени является внутривенное введение контрастных препаратов, что позволяет получать и оценивать артериальную, венозную и отсроченные фазы контрастирования. К сожалению, у целого ряда пациентов использование контрастных препаратов сопряжено с риском аллергических реакций. Поэтому пациенты, страдающие непереносимостью к йоду, не могут пройти КТ исследования печени. Кроме того, в ряде случаев у пациентов с опухолевыми поражениями печени наблюдается атипичная картина как самой ткани опухоли, так и накопления контрастного препарата в ней. Все это не позволяет рассматривать КТ как наиболее информативный метод выявления и дифференцирования очага в печени [3].
МРТ считается одним из лучших, безвредных и перспективных методов диагностики опухолевых изменений в печени. Высокая разрешающая способность метода дает возможность выявлять очаговые образования в паренхиме печени диаметром менее 1 см и применять для усиления высокоэффективные контрастные препараты, не содержащие йод. К достоинствам МРТ следует отнести возможность получения высококачественных изображений в любой, произвольно определяемой плоскости, что значительно повышает наглядность отображения патологических процессов и облегчает их топическую диагностику. Важнейшим моментом дифференциальной диагностики очаговых образований в печени методом МРТ, является применение различных контрастных препаратов, имеющих разные механизмы контрастирования [4, 7]. Для целей дифференциальной диагностики общепринятыми считаются критерии, выявляемые в различные фазы контрастирования (артериальную, венозную, отсроченную).
Несмотря на значительное число публикаций [4, 7], возможность каждого из перечисленных визуальных методов и тем более их сочетанного применения изучены недостаточно. В особенности это относится к организации диагностического процесса, к определению оптимальной тактики использования новых технологий. Применение сразу всего арсенала диагностических средств далеко не всегда обеспечивает желаемый эффект и экономически не оправдано. Необходимо создание диагностических программ, определяющих рациональный порядок выполнения различных исследований в зависимости от клинической картины болезни. Использование таких программ должно обеспечить большую надежность диагностики, экономию средств и времени специалистов и пациентов и уменьшение лучевой нагрузки [9].
Таким образом, высокая частота опухолей печени [13], недостаточная результативность [9] применяемых методов медицинской визуализации (УЗИ, КТ, МРТ) и необходимость повышения информативности за счет разработки рационального комплекса диагностических критериев [11] определяет актуальность данного исследования.
Цель настоящего исследования – сравнительная оценка методов медицинской визуализации и разработка системы лучевой диагностики для улучшения комплексной диагностики опухолей печени.
Материалы и методы
В основу работы положены результаты комплексного лучевого обследования 81 больных с опухольными поражениями печени. Диагноз опухоли печени были подтверждены по данным визуальных методов исследования, результатам и биохи- мических (α-фетопротеин, СЕА, СА 19-9) и морфологических методов и при динамическом контроле с помощью инструментальных методов. По характеру заболевания все больные были распределены на 3 группы: 1) первичные злокачественные опухоли печени – 16 больных; 2) метастатические опухоли печени – 27 больных; 3) доброкачественные опухоли печени – 38 больных. Возраст больных варьировал от 20 до 70 лет, наибольшую возрастную группу (более половины) составили больные от 41 до 60 лет. Мужчин было 39, женщин – 42.
В настоящую публикацию положены данные первой группы, которую составили больные со злокачественными опухолями печени. Среди них было 12 мужчин и 4 женщин, средний возраст – 55 лет. В клинической картине не удалось выделить специфических для первичного рака печени признаков. Большинство жалоб было связано с сопутствующим циррозом печени или осложнениями хронического гепатита. Клинические проявления первичного рака печени представлены в рис. 1.
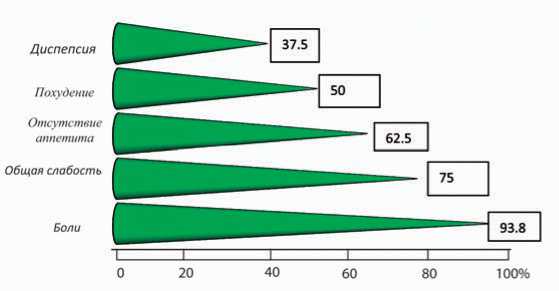
Рис. 1. Частота встречаемости клинических проявлений первичных злокачественных опухолей печени
Результаты
Клинические симптомы явились показанием к УЗИ печени. При УЗИ форма образования в 12 случаев была неправильной, у 4 больных опухоль была овальной формы. В большинство случаев опухоль имела неоднородную структуру, бугристые контуры и смешанную эхогенность. Нечеткость контуров опухоли, обусловленная инвазией опухолевой ткани в окружаю-
12.5%
□ Гиперххогенный □ Гипоэхогенный в Ихоэхогенный ■ Смешанный
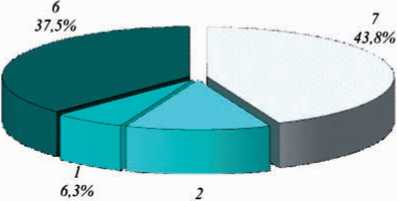
Рис. 2. Распределение больных с первичным раком печени по эхогенности патологического очага при УЗИ щую паренхиму печени, была обнаружена у 10 больных. Распространение очагов по эхогенности представлены в рис. 2.
Гипоэхогенный ободок «haлo», соответствующий внутрио-пухолевому слою пролиферирующих опухолевых клеток, был выявлен у 2 больных. Надо отметить, что такие высокоспецифичные УЗ-признаки первичного рака печени, как наличие нечеткого контура, неоднородность эхоструктуры, гипоэхо-генный ободок «haло» вокруг опухоли достаточны для постановки правильного диагноза, но полиморфизм проявлений первичного рака печени, вызванный различными стадиями процесса, затрудняет дифференциацию с метастазами и атипичной гемангимой. Иногда определенные трудности диагностики представляет первичный рак печени с внутриорганными метастазами и множественные метастазы в печень из опухолей других органов.
При КТ-исследовании из 16 больных первичным раком печени у 14 выявлен гепатоцеллюлярный рак, у 2 – холангиоцел-люлярный рак. В 13 случаев опухоль визуализировалась в виде гиподенсного образования, форма патологического очага была неправильной в 9, округлой – в 67 наблюдениях. В большинстве наблюдений отмечалась неровность и бугристость контура патологического образования. Нечеткость контуров отмечена в 12 случаев. На нативных томограммах первичный рак печени имеет вид солитарного очага низкой плотности. После внутривенного контрастирования (9 больных) происходит негомогенное контрастное усиление опухолевой ткани в раннюю артериальную фазу. Известно, что опухоль кровоснабжается из печеночной артерии, то контрастирование опухоли наступает раньше, чем контрастирование неизменной паренхимы печени, которая большую часть крови получает из воротной вены. В паренхиматозную фазу контрастирования наблюдалось вымывание контрастного вещества из ткани опухоли, которая становилась на КТ гиподенсной по сравнению с нормальной паренхимой.
Надо отметить, что многообразие первичного рака печени на КТ обусловливало трудности в его диагностике. Наибольшие затруднения вызывала диагностика первичного рака печени на фоне диффузных изменений в печени.
МРТ была выполнена у 5 больных первичным раком печени, которые относились к группе гепатоцеллюлярного рака. Интенсивность сигнала от опухоли на Т1- и Т2-изображениях была различной. Выявлено что, на Т1-изображениях без контрастного усиления первичный рак печени дает гипоинтенсив-ный сигнал по сравнению с окружающей паренхимой печени, а при Т2-изображениях гетерогенно-мозаичный, но в основном, гиперинтенсивный. Диагностика первичного рака с помощью МРТ, в отличие от метастазов, базируется на данных, получаемых на Т1-взвешенных изображениях: наличие капсулы у опухоли, внутриопухолевые перегородки, участки жировой дегенерации, кровоизлияния, тромбоз воротной и печеночных вен. Использование контрастных веществ различного механизма действия повышало эффективность выявления первичного рака печени, при этом механизм накопления и вымывания контрастного вещества из ткани опухоли при МРТ идентичен этому механизму при КТ. На Т2-взвешенных изображениях интенсивность сигнала от первичного рака печени значительно ниже, чем от метастазов и гемангиом. Этот дифференциальнодиагностический признак также способствовал правильному установлению диагноза и помогал решать вопрос о принадлежности образования в печени к доброкачественным или злокачественным новообразованиям.
Обсуждение
Из-за отсутствия патогномических клинических, лабораторных и лучевых симптомов, диагноз гепатоцеллюлярного рака ставится на основании определенных критериев. В прошлом веке основным диагностическим критерием при ГЦК считалось биопсия, а начиная с 2000-го года этим критерием стали принимать артериальную гиперваскуляризацию и повышение концентрации α -фетопротеина (АФП).
В 2000–2005-х годах основным диагностическим критерием при небольших образованиях размером в 1–2 см явилась биопсия, а при образованиях более 2-х см – характерное контрастирование в 2-х контрастных исследованиях или сочетание такого контрастирования в одном исследовании с увеличением концентрации АФЛ более 400 нг/мл. Начиная с 2010-го года при образованиях любой величины наличие характерного контрастирования стали принимать как основной диагностический признак ГЦК. Следует отметить, что этот признак можно наблюдать и при других злокачественных опухолях, однако выявление узлов на фоне цирроза характерно для ГЦК. Мы считаем, что если первое контрастное обследование дает негативный результат, то можно порекомендовать второе такое обследование. Если в обоих обследованиях не наблюдается специфического контрастирования и не отмечается повышения уровня АПФ, то можно провести биопсию.
В конце прошлого века возможность ранней диагностики ГЦК составляла 5–10%. С 1990 по 2010 года с применением в клинической практике лучевой диагностики и определением онкомаркеров эти показатели повысились до 30–40%. В 2010–2020-е годы ожидается повышение этих показателей до 40–60%. Несмотря на то, что в настоящее время онкомаркеры (АФП, СЕА, СА 19-9) и диагностические методы (УЗИ, КТ и МРТ) являются широко используемыми ранними диагностическими методами исследования, только у 40% выявляемых больных ГЦК можно проводить радикальное лечение. Имея в виду, что прогноз ГЦК в большинстве случаев зависит от его ранней диагностики, мы считаем, что больным, включенным в группу высокого риска, и особенно больным с циррозом печени, один раз в 6–12 месяцев нужно проводить контрастное обследование и определять содержание АФП.
Учитывая вышеуказанное, диагностические методы ГЦК можно характеризовать следующим образом. При УЗИ ГЦК наблюдалась в виде гипоэхогенного (12,5%), гиперэхогенного (43,8%), изоэхогенного (6,3%) и смешанной эхогенности (37,5%) патологического очага. При этом специфичность метода соста- вила 74%, а чувствительность – 70%. Специфичность и чувствительность УЗИ при небольших и поверхностных опухолях была низка.
При КТ-исследовании ГЦК часто была видна гиподенсных (81,3%), редко изоденсных (6,3%) и гиперденсных (12,4%) опухолей. В опухолях обнаруживались некроз, фиброз и кальцина-ты. Наблюдалось характерное для ГЦК контрастирование: в артериальной фазе, а в венозной фазе – вымывание контрастного вещества. По этим признакам ГЦК отличается от регенеративных и дипластических узлов, а также от аденомы и гемангимо-мы. С другой стороны, КТ-обследование дает нам возможность отличить ГЦК от холангиокарциономы, которая в большинстве случаев поражает центральную часть печени. При первичном раке печени КТ была более информативна со специфичностью 92% и чувствительностью – 89%.
МРТ-обследование дает нам возможность обнаруживать опухоли размером меньше 1-го см. В большинстве случаев ГЦК в Т1-режиме гипоинтенсивна, а в Т2-режиме – мозаично
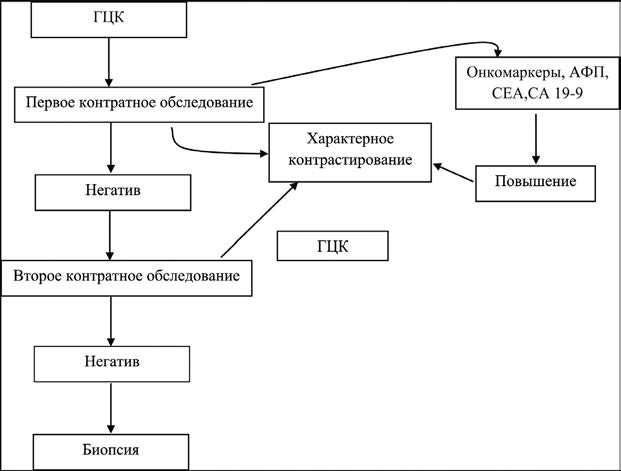
Рис. 3. Диагностический алгоритм при ГЦК
гетерогенно. Для МРТ специфичность составляет 86%, а чув-ствитльность – 82%. При контрастном усилении на МРТ ГЦК была видна как гиперваскулированная опухоль, а в некоторых случаях обнаруживалась инвазия сосудов.
Лабораторные исследования крови, проведенные больным ГЦК, выявили увеличение концентрации АФЛ в несколько раз и у большинства больных этот показатель был выше 200 нг/мл.
Между размерами опухоли и содержанием АФП отмечалась положительная корреляция. Обнаружено также статистически значимое повышение уровней СЕА и СА 19-9, однако оно было незначительным по сравнению с изменением уровня АФП.
В виду того, что есть вероятность повышение концентрации онко-маркеров СЕА и СА 19-9 при опухолях других локализаций (желудок, поджелудочная железа, легкие и т.д.) и при неопухолевых заболеваниях (цирроз, хронический гепатит, панкреатит), мы считаем, что использование этих 2-х показателей более целесообразно в целях контроля за эффективностью лечения и дальнейшего прогнозирования заболевания.
Список литературы Комплексная лучевая диагностика первичных злокачественных опухолей печени
- Амирасланов. А.T., Байрамов Р.Б. Абдоминальная онкология (руководство). Баку: «Техсил», 2004. 320 с.
- Байрамов H.Й. Хирургические болезни печени. Баку: «Нурлан» 2012. 324 c.
- Баxмутова Е.Е. Роль болюсного контрастного усиления томографическиx изображений в дифференциальной диагностике гиперваскулярныx очаговыx образований печени. Автореф. дисс..канд. мед. наук. М., 2010. 17 с.
- Березин С.М., Тютин Л.А. Динамическая контрастная МРТ в исследовании васкуляризации опуxолей печени//Медицинская визуализация. 1999. № 4. С. 40-43.
- Габуния Р.И., Колесникова Е.К. Компьютерная томография в клинической диагностике. М.: Медицина, 1995. 352 с.
- Земляной Н.В. Новые теxнологии в диагностике и лечении очаговыx и диффузныx заболеваний печени. Автореф. дис. …докт. мед. наук. Санкт-Петербург, 1998. 38 с.
- Зубарев А.В. Методы медицинской визуализации -УЗИ, КТ, МРТ в диагностике опуxолей и кист печени. М.: Изд-во «Видар», 1995. С. 10-14.
- Митьков В.В. Практическое руководство по ультразвуковой диагностике. М.: «Видар-М», 2003. 698 с.
- Розова Н.К. Лучевая дифференциальная диагностика опухолей печени. Автореф. дис.. докт. мед. наук. М., 1995. 40 с.
- Черкес Л.В. Лапароскопическая визуальная и ультразвуковая диагностика опуxолевого поражения печени. Автореф. дис. … канд. мед. наук. М., 2007. 19 с.
- Яценко Т.Г. Сравнительная оценка методов диагностики новообразований печени. Дис..канд. мед. наук. Уфа, 2003. 18 с.
- Lin Z.Y., Wang L.Y., Wang J.H. et al. Clinical utility of color Doppler sonography in the differentiation of hepatocellular carcinoma from metastases and hemangioma//J. Ultrasound Med., 1997. Vol. 16, № 1. P. 51-58.
- Shariff M., Cox I., Gomaa A., Khan S. Hepatocellular carcinoma: current trends in World Wide epidemiology, risk factors, diagnosis and therapeutics//Expert. Rev. Gastroenterol. Hepatol., 2009. №. 4. p. 353-367.


