Комплексная оценка системного и локального иммунитета, факторов воспаления и клинических показателей у больных раком желудка
Автор: Хакимова Г.Г., Трякин А.А., Заботина Т.Н., Хакимова Ш.Г.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 т.10, 2020 года.
Бесплатный доступ
Цель. Изучить состояние системного иммунитета и локального иммунитета у больных аденокарциномой желудка. Материалы и методы. С 2017 по 2018 г. в ФГБУ НМИЦ онкологии им. Н.Н. Блохина 45 первичных больных с аденокарциномой желудка (25 пациентов имели I-III стадии, 20 - IV стадию) получили хирургическое лечение или химиотерапию, соответственно. Забор биологического материала (периферической крови, опухолевой ткани) осуществлялся перед лечением. Методом проточной цитометрии оценивали процентное содержание степени инфильтрации опухолевой ткани лимфоцитами (CD45 +CD14-TILs), число Т-клеток (CD3 +CD19-TILs), В-клеток (CD3-CD19 +TILs), NK-клеток (CD3-CD16+CD56+TILs), CD16 и CD8 эффекторных клеток и их цитотоксического потенциала (ЦТП) (CD16+Perforin +TILs; CD16ЦТПTILs), (CD8 + Perforin + TILs; CD8ЦТПTILs), регуляторных Т-клеток - NKT-клеток (CD3 + CD16 + CD56 + TILs), CD4 (CD4 +CD25 +CD127-TILs) и CD8 (CD8 +CD11b-CD28-TILs) регуляторных клеток и данные параметры системного иммунитета. Методом иммуногистохимии исследовались интратуморальные и стромальные CD4 +TILs, CD8 +TILs субпопуляции лимфоцитов, их соотношение (CD4 + / CD8 + TILs). Проведена оценка прогностической значимости иммунных клеток, факторов воспаления (нейтрофильно-лимфоцитарного индекса, тромбоцитарно-лимфоцитарного индекса) и клинических характеристик (возраст пациента, стадия заболевания, степень дифференцировки, тип по Lauren и статус MSI для общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП). Результаты. Фактором благоприятного прогноза в отношении ВБП у пациентов с локализованными и местно-распространенными формами рака желудка явилось повышение числа CD3 +CD19-TILs (ОР 0,865,95%ДИ 0,782- 0,957, р = 0,005), а неблагоприятного прогноза - повышение NK-клеток (ОР 1,382, 95%ДИ 1,087-1,758, р = 0,008). Отмечено негативное влияние увеличения содержания NK-клеток, уровня нейтрофилов в периферической крови на ОВ пациентов с метастатическим раком желудка (мРЖ) (ОР 1,42, 95% ДИ 1,06 -1,89, р = 0,017), (ОР 1,64, 95% ДИ 1,12-2,40, р = 0,011). Увеличение возраста больных, уровня нейтрофилов и тромбоцитов (ОР 1,106, 95%ДИ 1,002-1,199, р = 0,015; ОР 1,714, 95% ДИ 1,063-2,764, р = 0,027 и ОР 1,017, 95% ДИ 1,006-1,029, р = 0,003) снижают показатель ВБП у пациентов с мРЖ. Вывод. Показатели локального иммунитета, клеточного состава периферической крови, характеризующие системную воспалительную реакцию, и показатели системного иммунитета служат дополнительными прогностическими факторами при раке желудка.
Аденокарцинома желудка, клеточный иммунитет, локальный иммунитет, субпопуляция лимфоцитов, нейтрофильно-лимфоцитраный индекс, тромбоцитарно-лимфоцитарный индекс
Короткий адрес: https://sciup.org/140257648
IDR: 140257648 | DOI: 10.18027/2224-5057-2020-10-4-5-15
Текст научной статьи Комплексная оценка системного и локального иммунитета, факторов воспаления и клинических показателей у больных раком желудка
МАТЕРИАЛЫ И МЕТОДЫ
Лабораторные методы
Анализ показателей субпопуляций лимфоцитов периферической крови и опухолевой ткани осуществлялся методом проточной цитометрии в целях определения структуры иммунных клеток: степени инфильтрации опухолевой ткани лимфоцитами (CD45+CD14-TILs), число Т-клеток (CD3+CD19-TILs), В-клеток (CD3-CD19+TILs), NK-клеток (CD3-CD16+CD56+TILs), эффекторных клеток CD16 (CD16+Perforin +TILs), CD8 (CD8+Perforin +TILs)
и их цитотоксического потенциала — CD16ЦТПTILs и CD8ЦТПTILs, субпопуляций регуляторных Т-клеток — NKT-клеток (CD3+CD16+CD56+TILs), регуляторных CD4 (CD4+CD25+CD127-TILs) и CD8 (CD8+CD11b-CD28-TILs) клеток и данных показателей клеточного иммунитета. В целях определения пространственного распределения интратуморальных (iTILs) и стромальных (sTILs) субпопуляций лимфоцитов методом иммуногистохимии исследовались показатели субпопуляций CD4+TILs, CD8+TILs и соотношения CD4+/CD8+TILs. Для выявления прогностической ценности клинических маркеров воспаления был проведен расчет следующих соотношений (по результатам клинического анализа крови на этапе исходной оценки): 1) нейтрофильно-лимфоцитарный индекс (НЛИ); 2) тромбоцитарно-лимфоцитарный индекс (ТЛИ).
Проточно-цитометрический анализ
Структуру субпопуляций иммунокомпетентных клеток оценивали по связыванию с моноклональными антителами различной специфичности методом многопараметро-вого количественного анализа на проточном цитометре FACSCalibur (BD Biosciences). Для каждого образца анализировали не менее 500–5000 клеток в CD45+гейте. Использовали DotPlot-анализ цитограмм с коммерческим программным обеспечением BD CellQuest PRO software (BD Biosciences). Дальнейшую обработку FSC-файлов первичных цитометрических данных проводили с использованием программного пакета WinMDI, версия 2.8.
Иммуногистохимический анализ
На образцах из парафиновых тканей, фиксированных формалином, использовались следующие первичные моноклональные антитела: клон анти-CD4 113 (разведение 1:200; Sino Biological, BDA, Beijing, PR China) и клон анти-CD8SP16 (разведение 1:150; Thermo Scientific, Fremont, CA). Количество иммунных клеток определяли отдельно в интратуморальной и перитуморальной ткани. С помощью микроскопического исследования (×400; BX51; Olympus, Токио, Япония) каждое сечение оценивали на наличие иммунных клеток. Количество иммунных клеток в 10 полях накапливалось и затем усреднялось для расчета среднего числа для 1 компьютеризированного 400-кратно увеличенного микроскопического поля (0,1590 мм 2 /поле).
Статистическая обработка результатов
Статистическая обработка материала и расчеты показателей проведены с использованием статистического пакета программ Statistica for Windows v. 10 и SPSS v21. Достоверность различий между количественными показателями вычисляли по критерию t Стьюдента для нормально распределенных величин или по непараметрическим критериям Манна–Уитни и Вилкоксона. Для сравнения качественны × 2 параметров применяли точный критерий Фишера и χ2. Различия считали значимыми при p <0,05 (95% точности). Степень взаимосвязи параметров оценивали с помощью корреляционного анализа по Спирмену.
Статистическая обработка материала и расчеты показателей проведены с использованием статистического пакета лицензионных программ Statistica для Windows v. 10 (однофакторный анализ, корреляционный анализ по Спирмену, описательная статистика сравнения количественных показателей по Манну–Уитни, анализ Каплана–Майера) и SPSS v21 (ROC-кривые, многофакторный анализ). Количественные переменные отклонялись от нормального распределения (тест Колмогорова–Смирнова) и представлены медианой с указанием 25-го и 75-го квартилей. Категориальные переменные выражали в процентах и абсолютных значениях.
Статистическую значимость различий между количественными показателями вычисляли по t-критерию Стьюдента по непараметрическим критериям Манна–Уитни и Вилкоксона. Для сравнения качественных параметров применяли точный критерий Фишера и χ 2 . Различия считали значимыми при p <0,05 (допустимый уровень α-ошибки 5%). Степень взаимосвязи параметров оценивали с помощью корреляционного анализа по Спирмену. Определение границ с оптимальным соотношением чувствительности и специфичности выполняли методом построения ROC-кривой.
Основные оцениваемые параметры
Основными конечными точками в данном исследовании были ОВ и ВБП. ОВ определяли как время от момента постановки диагноза РЖ до момента смерти пациента от любой причины либо до даты последнего контакта с больным. ВБП определяли как время от начала лечения заболевания до времени регистрации роста имеющихся проявлений болезни либо появления новых метастатических очагов. Сравнение кривых выживаемости — с использованием log-rank-теста. Показатели выживаемости рассчитывали из реальных данных о длительности жизни каждого больного на момент завершения исследования с использованием методики Каплана–Мейера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристика пациентов
В исследование было включено 45 пациентов РЖ — 19 (42,2%) мужчин и 26 (57,8%) женщин. Возраст пациентов варьировал от 37 до 80 лет (средний возраст 60,9±10,9 года, медиана 62 года). В зависимости от разбиения пациентов на возрастные группы — до 45 лет, 46–60 лет и старше 60 лет — пациенты преимущественно относились к III группе (18 (72,0 %) и 9 (45%) к I и II группам, соответственно. Двадцать пять (55,6%) пациентов с локализованным РЖ получили на первом этапе хирургическое лечение (из них 16 (64%) пациентов получали адъювантную терапию) и 20 (44,4%) пациентов с IV стадией получили химиотерапию (II группа) в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» в 2017–2018 гг. Среднее время наблюдения за больными составило 16,4±6,2 мес. (от 0,7 до 23,6 мес, медиана 18,5 мес). В I и II группах, по гистологическому строению опухоль была преимущественно низкодифференцированной (56% и 60%) и представлена кишечным типом Lauren (64% и 60%). В хирургической группе у 2 пациентов (4%) имел место высокий уровень MSI.
Исследование клеточного иммунитета в периферической крови
Полученные результаты представлены в табл. 1.
|
Показатели клеточного иммунитета в крови |
Хирургическая группа (I) (n= 25) |
Химиотерапевтическая группа (II) (n= 20) p |
P |
||
|
медиана |
квартили |
медиана |
квартили |
||
|
CD3 +CD19 - |
74,3 |
71,4–84,7 |
72,5 |
64,2–81,8 |
0,560 |
|
CD3-CD19 + |
1,6 |
1,3–2,2 |
1,0 |
0,6–1,5 |
0,017 |
|
CD3-CD16 +CD56 + |
11,8 |
7,3–25,0 |
21,3 |
9,4–30,4 |
0,140 |
|
CD3 +CD4 + |
39,7 |
29,6–45,5 |
37,3 |
32,0–49,1 |
0,828 |
|
CD3 +CD8 + |
32,8 |
23,0–41,2 |
24,7 |
20,5–33,6 |
0,074 |
|
CD16 +Perforin+ |
12,1 |
8,5–18,7 |
19,1 |
14,6–27,2 |
0,016 |
|
CD16ЦТП |
66,7 |
42,5–75,5 |
81,9 |
63,0–90,3 |
0,010 |
|
CD8 +Perforin+ |
19,0 |
14,6–25,3 |
23,5 |
12,8–27,3 |
0,515 |
|
CD8ЦТП |
55,6 |
42,9–66,3 |
64,3 |
52,0–72,7 |
0,084 |
|
CD3 +CD16 +CD56 + |
15,9 |
8,7–25,1 |
11,1 |
8,7–18,4 |
0,167 |
|
CD4 +CD25 +CD127 - |
7,7 |
6,2–9,1 |
6,9 |
5,4–8,4 |
0,134 |
|
CD8 +CD11b-CD28 - |
9,5 |
6,2–13,7 |
11,3 |
7,7–13,2 |
0,457 |
Исследование клеточного состава опухолевой ткани методом проточной цитометрии
Полученные результаты представлены в табл. 2.
Подгрупповой анализ опухоль-инфильтрирующих лимфоцитов (TILs) у 45 пациентов РЖ показал, что медиана процентного содержания TILs (CD45+CD14-TILs) достоверно выше у пациентов с I–III стадиями заболевания по сравнению с мРЖ — 6,8% против 3,4% (р =0,001). Напротив, медиана процентного содержания NK-клеток (CD3-CD16+CD56+TILs) повышается по мере увеличения стадии заболевания с 3,2% в I группе до 6,9% во II группе (р =0,019). Медиана процентного содержания эффекторных CD16 (CD16+Perforin +TILs)
у пациентов мРЖ достоверно выше по сравнению с пациентами с локализованными формами РЖ 4,3–0,5%, (р =0,002). Схожая закономерность выявлена и для клеток-эффекторов CD8 (CD8+Perforin + TILs) и CD8ЦТП, составив 7,7–1,8% (р =0,002) и 16,7–4,6% (р =0,034), соответственно. Высокое содержание NKT-клеток (CD3+CD16+CD56+TILs) отмечено у больных мРЖ по сравнению с I–III стадиями заболевания (11,2% и 5,1%, р =0,002).
Исследование клеточного состава опухолевой ткани методом иммуногистохимии
Полученные результаты представлены в табл. 3.
При проведении подгруппового анализа субпопуляций лимфоцитов CD4+TILs, CD8+TILs, соотношения CD4+/CD8+TILs методом иммуногистохимии выявлено, что число стромальных TILs статистически значимо выше в I группе по сравнению со II, у пациентов которой данные субпопуляции sTILs не встречались (медианы 21,9 про-
|
Показатели клеточного иммунитета в ткани |
Хирургическая группа (I) (n= 25) |
Химиотерапевтическая группа (II) (n= 20) |
p |
|||
|
Медиана |
Квартили |
Медиана |
Квартили |
|||
|
CD4+ TILs (кл/п. зр.) |
CD4 +TILs |
22,2 |
10,5–38,5 |
0,4 |
0–1,1 |
0,001 |
|
CD4 +iTILs |
1,1 |
0,4–7,4 |
0,2 |
0–1,1 |
0,021 |
|
|
CD4 +sTILs |
21,9 |
7,7–26,5 |
0 |
0–0 |
0,003 |
|
|
CD8+ TILs (кл/п. зр.) |
CD8 +TILs |
53,5 |
39,1–106,9 |
3,0 |
0–9,0 |
0,002 |
|
CD8 +iTILs |
24,1 |
4,9–37,3 |
3,0 |
0–9,0 |
0,0027 |
|
|
CD8 +sTILs |
38,0 |
11,7–54,9 |
0 |
0–0 |
0,004 |
|
|
CD4+/CD8+ TILs |
CD4+/CD8+TILs |
0,35 |
0,19–0,54 |
0,04 |
0–0,32 |
0,001 |
|
CD4+/CD8+iTILs |
0,06 |
0,007–0,59 |
0,04 |
0–0,27 |
0,157 |
|
|
CD4+/CD8+sTILs |
0,48 |
0,20–0,61 |
0 |
0–0 |
0,002 |
|
Исследование показателей клинических маркеров воспаления
Полученные результаты представлены в табл. 4.
За время наблюдения с медианой 18,5 (15,2–20,4) месяцев от прогрессирования основного заболевания умерли 3 (12%) из 25 больных I группы и 10 (50%) из 20 пациентов II группы (р =0,007). Прогрессирование заболевания зарегистрировано у 29 (62,2%) пациентов: у 20 (100%) во II группе и у 9 (36%) в 1-й. В I группе 1-годичная ОВ составила 92,0 ± 5,4%, во II-й — 70,0 ± 10,2%; 1-годичная ВБП — 64,0 ± 9,6% и 10,0 ± 6,7%, соответственно.
Для определения независимых прогностических признаков, влияющих на показатели ВБП и ОВ, выполнен последовательный регрессионный анализ Кокса. В него были включены показатели системного и локального иммунитета, а также показатели системного воспаления, определенные методом проточной цитометрии и иммуногистохимии.
Для оценки прогностической ценности индексов на выживаемость, мы использовали:
— НЛИ <1,43 — низкий, НЛИ =1,43–3,05 — нормальный и НЛИ >3,05 — высокий уровень;
— ТЛИ <111,6 — низкий, ТЛИ = 111,6–208,7 — нормальный и ТЛИ >208,7 — высокий уровень.
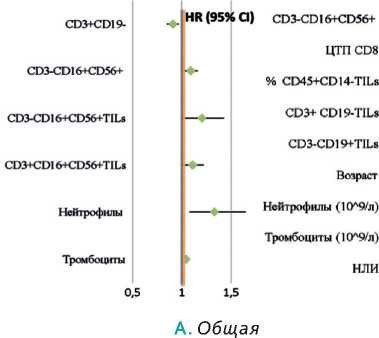
По данным однофакторного анализа (ОФА) для ОВ I группы достоверно значимыми оказались CD3+TILs (относительный риск (ОР) 0,894; 95% доверительный интервал (ДИ) 0,813–0,983; р =0,021), CD3+CD8+TILs (ОР 0,782; 95%ДИ0,631–0,970; р =0,026) и CD8+CD11b-CD28-TILs (ОР 0,935; 95%ДИ0,885–0,989; р =0,018), соответственно (рис. 1).
Для ВБП больных I группы достоверно значимыми оказались CD3+TILs (ОР 0,915, 95%ДИ0,862–0,971, р =0,003), CD3-CD16+CD56+TILs (ОР 1,195; 95%ДИ 1,042–1,369; р =0,011), ТЛИ по диапазонам (ОР 0,21; 95%ДИ 0,06–0,72; р =0,013), CD4+/CD8+iTILs (ОР 3,26; 95%ДИ 1,09–9,78; р =0,035), соответственно (рис. 1, 2).
По данным однофакторного анализа для ОВ II группы достоверно значимыми оказались уровни нейтрофилов (ОР 1,33; 95%ДИ 1,08–1,65; р =0,008), тромбоцитов (ОР 1,01; 95%ДИ 1,00–1,02; р =0,006), CD3+CD19- (ОР 0,91; 95%ДИ 0,085–0,97; р =0,007) и CD3-CD16+CD56+ (ОР 1,09; 95%ДИ 1,02–1,16; р =0,007) периферической крови, а также CD3-CD16+CD56+TILs (ОР 1,202; 95%ДИ 1,011–1,429;
СПЗ+TILs
CD3+CD8+TILS
CD8-KD1 1Ь-CD28-TILS

А. Общая выживаемость
CD3+TlLs
CD4+/CD8+iTILs
ТЛИ по диапозонам
CD3-CD16+CD56+TILS

Б. Выживаемость без прогрессирования
Рисунок 1. Величина рисков, влияющих на ОВ и ВБП у больных I группы.
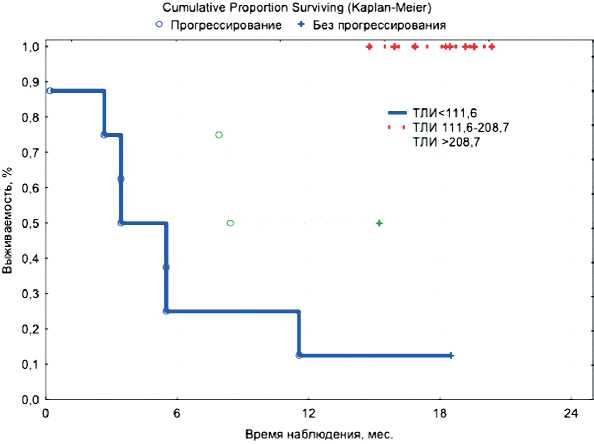
Рисунок 2. Влияние тромбоцитарно-лимфоцитарного индекса на ВБП у больных I группы.
р =0,037) и CD3+CD16+CD56+TILs (ОР 1,112; 95%ДИ 1,012– 1,221; р =0,027) опухолевой ткани (рис. 3).
Для ВБП II группы достоверно значимыми оказались возраст пациентов (ОР 1,06; 95%ДИ 1,01–1,12; р =0,012), уровень нейтрофилов (ОР 1,34; 95%ДИ 1,07–1,67; р =0,010), тромбоцитов (ОР 1,01; 95%ДИ 1,01–1,02; р =0,0006), НЛИ (ОР 2,80; 95%ДИ 1,36–5,75; р =0,005), CD3-CD16+CD56+ (ОР 1,05; 95%ДИ 1,01–1,10; р =0,023) и ЦТПCD16 (ОР 1,06; 95%ДИ 1,01–1,11; р =0,018) периферической крови, а также CD45+CD14-TILs (ОР 1,003; 95%ДИ 1,000–1,006; р =0,041), CD3+CD19-TILs (ОР 0,952; 95%ДИ 0,908–0,998; р =0,041), CD3-CD19+TILs (ОР 1,058; 95%ДИ 1,001–1,117; р =0,045) опухолевой ткани (рис. 3–6).
Выполнение многофакторного регрессионного анализа по Коксу для ОВ I группы не позволило построить значимую математическую модель с независимыми факторами. Однако многофакторный регрессионный анализ по Коксу
выживаемость
Рисунок 3. Величина рисков, влияющих на ОВ и ВБП у больных II группы.
Б. Выживаемость без прогрессирования
для ВБП показал, что увеличение относительного содержания Т-клеток (CD3+CD19-TILs) является благоприятным фактором прогноза у больных I группы (ОР 0,865, 95% ДИ 0,782–0,957, р =0,005). Напротив, повышение NK-клеток (CD3-CD16+CD56+TILs) ухудшает показатель ВБП (ОР 1,382, 95% ДИ 1,087–1,758, р =0,008).
Многофакторный регрессионный анализ по Коксу для ОВ II группы показал, что увеличение уровня нейтрофилов в периферической крови (ОР 1,64, 95% ДИ 1,12–2,40, р =0,011), а также увеличение инфильтрации опухолевой ткани NK-клетками (CD3-CD16+CD56+TILs) (ОР 1,42, 95%ДИ 1,06–1,89, р =0,017) являются факторами неблагоприятного прогноза для ОВ у больных мРЖ.
Многофакторный регрессионный анализ по Коксу для ВБП II группы продемонстрировал, что увеличение возраста (ОР 1,106, 95%ДИ 1,020–1,199, р =0,015), уровня нейтрофилов (ОР 1,714, 95%ДИ 1,063–2,764, р =0,027) и тромбоцитов (ОР 1,017, 95%ДИ 1,006–1,029, р =0,003) ухудшают показатель выживаемости без прогрессирования у больных мРЖ.
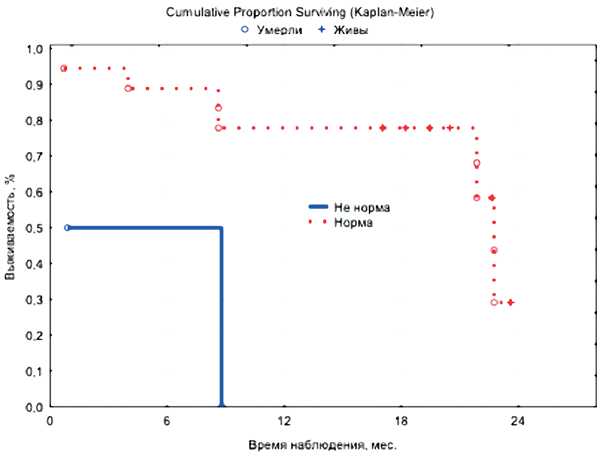
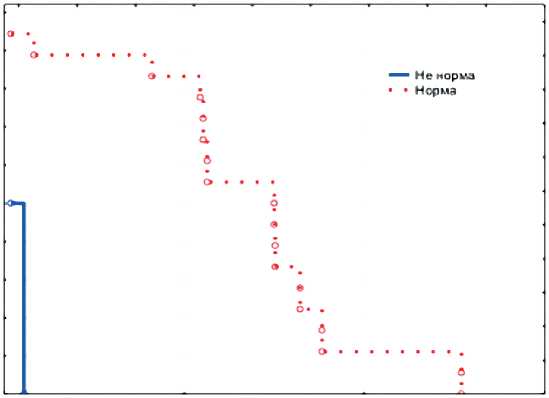
Рисунок 4. Влияние уровня нейтрофилов (норма/не норма) на показатели выживаемости: А — ОВ; Б — ВБП у больных II группы
0,0
Cum^a’w Proportion SurvMng (Kaplan-Meter) о Прогрессирование ♦ Без прогрессмроавамия
VO
0.9
0.8
0.7
0.4
0.3
0.2
0.1
£ 0.6
Время наРлодемя, мае
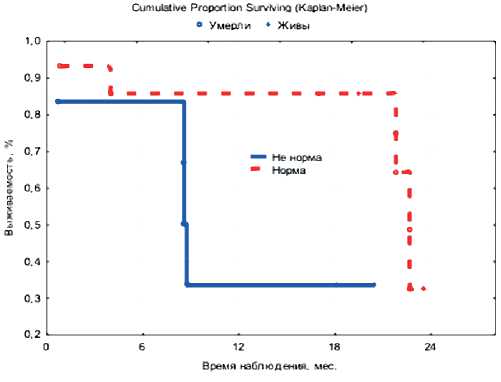
Рисунок 5. Влияние уровня тромбоцитов (норма/не норма) на показатели выживаемости: А — ОВ; Б — ВБП у больных II группы
uumuiaiive иоролюп surviving (карап-ме-ег) о Прогрессиревание ♦ Без прогрессирования
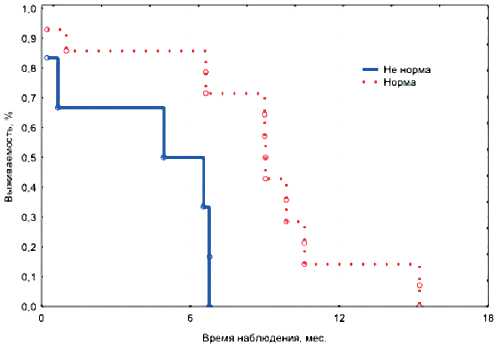
ОБСУЖДЕНИЕ
Развитие злокачественной неоплазии является сложным процессом, зависящим от взаимодействия отдельных клеток в опухоли, микроокружения и иммунной системы, которые могут как стимулировать, так и подавлять рост и инвазию опухоли [12]. Результаты данного исследования, где содержание Т-клеток является фактором благоприятного прогноза для ОВ больных мРЖ, а увеличение NK-клеток ухудшает показатели ОВ и ВБП у больных мРЖ согласуются с исследованием Bass et al. [13]. Исследование сопряженности 2-х групп (Т-клеток и NK-клеток) 152 образцов периферической крови больных РЖ показало, что у пациентов группы Т-клеток в сравнении с группой NK-клеток значимо чаще наблюдается инвазия опухоли в пределах слизистой (Т1) — 32,6% против 14,3% (р =0,03) — и чаще диагностируется I стадия заболевания:
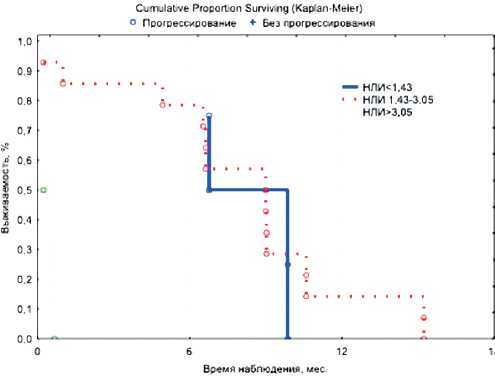
Рисунок 6. Влияние нейтрофильно-лимфоцитарного индекса на ВБП у больных II группы.
36,8% против 19%, (р =0,01). У пациентов группы NK-клеток чаще наблюдаются метастазы в лимфатические узлы второго порядка — 38% против 17,6% (р = 0,02) — и отдаленные метастазы (19,5% против 4%, р =0,03) в сравнении с противоположной группой [13]. С одной стороны, приведенные выше данные позволяют предположить, что существуют процессы взаиморегуляции между указанными направлениями дифференцировки предшественников Т-и NK-клеток. Возможно, подобный баланс является одним из механизмов адаптации при развитии стресс-реакции. С другой стороны, такая сопряженность может говорить об обратном: указанные клетки близки по происхождению, но их лимфопоэз идет независимо, поэтому факторы, вызывающие угнетение Т-клеток, не влияют на NK-клетки, которых продуцируется «нормальное» количество, и их становится «относительно» больше (и наоборот).
Полученные нами результаты свидетельствуют о возможности использования показателей клеточного иммунитета опухолевой ткани, системного иммунитета и воспалительного ответа у больных РЖ в качестве дополнительных прогностических маркеров оценки ВБП и ОВ.
Список литературы Комплексная оценка системного и локального иммунитета, факторов воспаления и клинических показателей у больных раком желудка
- Бережная Н. М. Взаимодействие клеток системы иммунитета с другими компонентами микроокружения. Онкология. 2009; 1 (2): 86–93.
- Mantovani A. et al. Tumor immunity: effector response to tumor and role of the microenvironment. Lancet 2008; 371 (9614): 771–83.
- Тупицын Н. Н. Иммунофенотип рака молочной железы. В кн.: Рак молочной железы. Под ред. Н. Е. Кушлинского, С. М. Портного, К. П. Лактионова. М.: Издательство РАМН, 2005; с. 174–97.
- Balch C., Riley L., Bae T. et al. Patterns of human tumor infiltrating lymphocytes in 120 human cancers. Arch Surg 1990; 125 (2): 200–5.
- Galon J., Pages F. et al. Cancer classification using the immunoscore: a worldwide task force. J Transl Med 2012; 10: 205.
- Zamarron B. F., Chen W. Dual roles of immune cells and their factors in cancer development and progression. Int J Biol Sci. 2011; 7 (5): 651–658.
- Ruffell B., DeNardo D. G., Affara N. I. et al. Lymphocytes in cancer development: polarization towards protumor immunity. Cytokine Growth Factor Rev. 2010; 21: 3–10.
- Shen Z. Zhou S., Wang Y. et al. Higher intratumoral infiltrated Foxp3 + Treg numbers and Foxp3 + / C8 + ratio are associated with adverse prognosis in resectable gastric cancer. J Cancer Res Clin. Oncol. 2010; 136:1585–1595.
- Mori M., Shuto K., Kosugi C. et al. An increase in the neutrophil to lymphocyte ratio during adjuvant chemotherapy indicates a poor prognosis in patients with stage II or III gastric cancer. BMC Cancer. 2018;18 (1):1261.
- Passardi A., Scarpi E., Cavanna L. et al. Inflammatory indexes as predictors of prognosis and bevacizumab efficacy in patients with metastatic colorectal cancer. Oncotarget 2016;7 (22):33210–9. DOI: 10.18632 / oncotarget. 8901.
- Gunaldi M., Goksu S., Erdem D. et al. Prognostic impact of platelet / lymphocyte and neutrophil / lymphocyte ratios in patients with gastric cancer: a multicenter study. Int J Clin Exp Med. 2015;8 (4):5937–42.
- Zheng X., Song X., Shao Y. et al. Prognostic role of tumor-infiltrating lymphocytes in gastric cancer: A meta-analysis. Oncotarget. 2017; 8. 10.18632 / oncotarget. 18065.
- Cancer Genome Atlas Research N. Comprehensive molecular characterization of gastric adenocarcinoma. Nature.2014; 513: 202–209.
- Müller P., Rothschild S. I., Arnold W. et al. Metastatic spread in patients with non-small cell lung cancer is associated with a reduced density of tumor-infiltrating T cells. Cancer Immunol Immunother 2016; 65: 1–1.
- Kollmann D., Ignatova D., Jedamzik J. et al. Expression of programmed cell death protein 1 by tumor-infiltrating lymphocytes and tumor cells is associated with advanced tumor stage in patients with esophageal adenocarcinoma. Ann Surg Oncol 2017; 24: 2698–706.
- Huszno J., Nożyńska E. Z., Lange D. et al. The association of tumor lymphocyte infiltration with clinicopathological factors and survival in breast cancer. Pol J Pathol 2017; 68: 26–32.
- Lu J., Xu Y., Wu Y. et al. Tumor-infiltrating CD8 + T cells combined with tumor-associated CD68 + macrophages predict postoperative prognosis and adjuvant chemotherapy benefit in resected gastric cancer. BMC Cancer 2019; 920 (19).
- Ebihara T., Sakai N., Koyama S. Suppression by sorted CD8 + CD11b-cells from T-cell growth factor-activated peripheral blood lymphocytes on cytolytic activity against tumor in patients with gastric carcinoma. Eur J of Cancer 1991; 27 (12): 1654–7 / 19. Hou J., Yu Z., Xiang R. et al. Correlation between infiltration of FOXP3 + regulatory T cells and expression of B7‑H1 in the tumor tissues of gastric cancer. Exp Molecular Pathol 2014; 96 (3): 284–91.
- Yuan X. L., Chen L., Li M-X. et al. Elevated expression of Foxp3 in tumor-infiltrating Treg cells suppresses T-cell proliferation and contributes to gastric cancer progression in a COX - 2‑dependent manner. Clin Immunol 2010; 134 (3): 277–88.
- Peng L. S., Mao F. Y., Zhao Y. L. et al. Altered phenotypic and functional characteristics of CD3 + CD56 + NKT-like cells in human gastric cancer. Oncotarget 2016; 7 (34): 55222–30. DOI: 10.18632 / oncotarget. 10484
- Takeuchi H., Maehara Y., Tokunaga E. et al. Prognostic Significance of Natural Killer Cell Activity in Patients With Gastric Carcinoma: A Multivariate Analysis. Am J Gastroenterol 2001; 96 (2): 574–8.


