Комплексная оценка субхронического низкодозового воздействия доксорубицина на модели крыс линии Wistar
Автор: Асанов М.А., Поддубняк А.О., Мухамадияров Р.А., Синицкая А.В., Хуторная М.В., Синицкий М.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 т.39, 2024 года.
Бесплатный доступ
Обоснование. Доксорубицин - химиотерапевтический антибиотик из класса антрациклинов, обладающий кумулятивными и дозозависимыми кардиотоксическими эффектами. Кардиотоксические свойства доксорубицина проявляются в характерных патологиях сердца. Доксорубицин имеет и генотоксические свойства, его часто используют для моделирования острого генотоксического воздействия на моделях мелких лабораторных животных.Цель исследования: определить роль патологического изменения различных органов и систем организма у крыс линии Wistar в контексте развития кардиотоксических эффектов, вызванных субхроническим кумулятивным воздействием доксорубицина, с использованием цитогенетических методов и электронной микроскопии.Материал и методы. В исследование были включены две группы самцов крыс линии Wistar: экспериментальная группа (10 крыс, еженедельная инъекция доксорубицина в хвостовую вену в дозировке 2 мг/кг в течение 4 нед.) и контрольная группа (10 крыс, еженедельная инъекция 0,9% NaCl в хвостовую вену в течение 4 нед.). Для оценки генотоксических эффектов использовали микроядерный тест. Визуализацию структуры миокарда и печени проводили при помощи сканирующей электронной микроскопии в обратно рассеянных электронах с помощью электронного микроскопа.Результаты. В результате анализа в экспериментальной группе было показано статистически значимое увеличение медианы количества полихроматических эритроцитов с микроядром (3,2% относительно 0,8% в контроле), а также снижение медианы доли полихроматические эритроцитов в общем пуле проанализированных клеток. В экспериментальной группе отмечали выраженную гетерогенность морфологического строения миокарда, а именно неравномерное утолщение кардиомиоцитов и сократительных волокон. Митохондрии были локализованы группами в электронно-прозрачных участках цитоплазмы. При анализе электронных микрофотографий гепатоцитов крыс, получавших доксорубицин, были обнаружены дегенеративные изменения структуры печени.Заключение. Результаты нашего исследования дают представления о подостром влиянии малой дозы доксорубицина на сердце, печень и систему кроветворения крыс линии Wistar. Нами были предложены механизмы взаимодействия важных органов и систем организма, подвергшихся воздействию доксорубицина, на фоне общего патологического состояния.
Кардиотоксичность, гепатотоксичность, генотоксичность, доксорубицин, электронная микроскопия, микроядро
Короткий адрес: https://sciup.org/149147164
IDR: 149147164 | УДК: 616-006.6-092.9:577.21 | DOI: 10.29001/2073-8552-2024-39-4-171-179
Текст научной статьи Комплексная оценка субхронического низкодозового воздействия доксорубицина на модели крыс линии Wistar
Химиотерапевтический антибиотик доксорубицин принадлежит к классу антрациклинов и воздействует не только на злокачественные, но и на здоровые клетки, в том числе и в нецелевых органах. Как и многим антра-циклиновым препаратам, доксорубицину свойственна кумулятивная и дозозависимая кардиотоксичность [1]. Кардиотоксические эффекты доксорубицина проявляются в дисфункции левого желудочка, необратимой дегенеративной кардиомиопатии и застойной сердечной недостаточности [2]. Стоит отметить, что результаты эхокардиографии не всегда показывают изменения структуры и микросреды пораженного сердца в результате воздействия доксорубицина [3].
Антрациклины, в том числе митомицин С и доксорубицин, часто используются в качестве агентов для моделирования сердечно-сосудистых заболеваний у мелких лабораторных животных в исследованиях, посвященных поиску и тестированию новых стратегий терапии [4], а также при изучении влияния генотоксического стресса на организм [5]. К сожалению, большинство научных работ направлено на изучение влияния острого генотоксического и цитотоксического стрессов, вызванных высокими дозами доксорубицина [6].
В настоящее время имеются обширные исследования механизмов, обусловливающих кардиотоксичность, гепатотоксичность и ряд других негативных эффектов доксорубицина. Источники литературы описывают три главных механизма токсичности доксорубицина, приводящих к гибели клеток, в частности кардиомиоцитов: образование активных форм кислорода, «отравление» топоизомеразы и митохондриальная дисфункция [7]. Однако на настоящий момент крайне мало исследований, описывающих взаимодействие органов и систем организма, подвергшихся воздействию доксорубицина, в контексте общего патологического фона. Нарушение функций органов и клеточного метаболизма, угнетение процесса кроветворения, образование хромосомных аберраций и другие патологические процессы, возможно, также играют важную роль в формировании доксорубицин-индуцирован-ной кардиотоксичности.
Цель исследования: определение роли патологического изменения различных органов и систем организма и их взаимосвязь у крыс линии Wistar в контексте развития кардиотоксических эффектов, вызванных субхроническим кумулятивным воздействием доксорубицина, с использованием цитогенетических методов и электронной микроскопии.
Материал и методы
Формирование исследуемых групп
В исследование были включены 20 самцов крыс линии Wistar в возрасте 10 нед. с массой тела в среднем 250 г, взятых из вивария отдела экспериментальной медицины НИИ комплексных проблем сердечно-сосудистых заболеваний (Кемерово, Россия). Животные, получавшие инъекции 0,9% раствора NaCl в хвостовую вену раз в неделю на протяжении 4 нед., составляли контрольную группу. Крысы, получавшие инъекции доксорубицина (2 мг/кг массы тела, кумулятивная доза 8 мг/кг) в хвостовую вену раз в неделю на протяжении 4 нед., входили в экспериментальную группу. Животных содержали в условиях 12-часовой смены дня и ночи. Еда и вода были доступны на протяжении всего эксперимента.
Раствор доксорубицина готовили непосредственно перед использованием ( ex tempore ). Доза доксорубицина соответствовала дозировкам, применяемым в клинической практике [8]. Содержание животных и манипуляции над ними проводили в соответствии с положениями Европейской конвенции о защите позвоночных животных, которых используют для экспериментальных целей (Страсбург, 1986). Протокол (№ 5 от 13.04.2021 г.) исследования одобрен локальным этическим комитетом НИИ комплексных проблем сердечно-сосудистых заболеваний (Кемерово).
Пробоподготовка костного мозга
После эвтаназии лабораторным животным в асептических условиях удаляли бедренную кость и очищали ее от мышечной ткани. На проксимальном конце каждой бедренной кости удаляли эпифизы. Затем проводили смыв костного мозга 1 мл эмбриональной телячьей сыворотки (Sigma-Aldrich, США) в 1,5 мл пробирку типа Эппендорф. Полученную суспензию центрифугировали при 1000 об/ мин на протяжении 5 мин. Надосадочную жидкость удаляли и добавляли 500 мкл свежей сыворотки, после чего снова центрифугировали и частично удаляли надосадочную жидкость, оставляя примерно 50–100 мкл в зависимости от количества клеток [9].
Подготовка цитогенетических препаратов
Небольшую каплю клеточной суспензии помещали на край обезжиренного предметного стекла, затем резким движением растягивали каплю по поверхности другим обе- зжиренным предметным стеклом (под углом в 45°). Стекла с мазками сушили несколько минут на воздухе, далее проводили фиксацию в метаноле не более 5 мин и опять сушили при комнатной температуре 24 ч. Препараты окрашивали 2% раствором красителя Гимза в течение 10 мин, промывали проточной водой и высушивали на воздухе [9].
Цитогенетический анализ
Полихроматические эритроциты (ПХЭ) анализировали при 1000-кратном увеличении с помощью оптического микроскопа (Axiostar Plus, Zeiss, Германия). На каждом препарате подсчитывали не менее 1000 безъядерных ПХЭ, выявляя эритроциты с микроядрами (МЯ) (рис. 1). Также на каждом препарате подсчитывали 200 эритроцитов, определяя количество нормахроматофильных эритроцитов (НХЭ) и ПХЭ, после чего рассчитывали долю ПХЭ. Критерии идентификации ПХЭ, НХЭ и МЯ соответствовали критериям OECD (2014) Test № 474.
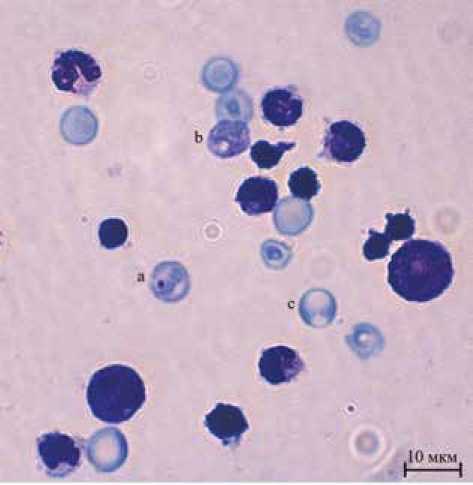
Рис. 1. Препарат смыва костного мозга из бедренной кости крысы (a – полихроматофильный эритроцит с микроядром; b – полихроматофильный эритроцит без аномалий; c – нормахроматофильный эритроцит)
Fig. 1. Bone marrow swab (a – polychromatophilic erythrocyte with micronucleus; b – polychromatophilic erythrocyte without anomalies; c – normachromic erythrocyte)
Исследование ультраструктуры эксплантирован-ных образцов сердца и печени методом сканирующей электронной микроскопии в обратно рассеянных электронах
Морфологические методы оценки ультраструктуры клеток находят широкое применение в экспериментах in vivo и позволяют получить объективную информацию о состоянии тканей и органов. Эксплантированные образцы сердца и печени фиксировали в забуференном 4% параформальдегиде в течение 24 ч, затем постфиксиро-вали 1% четырехокисью осмия в 0,1 M фосфатном буфере в течение 12 ч. Далее образцы обезвоживали в серии спиртов возрастающей концентрации, окрашивали 2%-м уранилацетатом (Electron Microscopy Sciences, США) в 95%-м этаноле, обезвоживали 99,7%-м изопропанолом
(BioVitrum, Россия) в течение 5 ч и ацетоном (Реахим, Россия) в течение 1 ч, пропитывали смесью ацетона с эпоксидной смолой Epon (812) (Electron Microscopy Sciences, США) в соотношении 1 : 1 (6 ч), после чего переносили в свежую порцию эпоксидной смолы (на 24 ч) и проводили ее полимеризацию в емкостях FixiForm (Electron Microscopy Sciences, США) при 60 °С. Затем образцы в эпоксидных блоках подвергали шлифовке и полировке на установке TegraPol-11 (Struers, США).
Контрастирование цитратом свинца проводили по Рейнольдсу в течение 7 мин путем нанесения раствора на поверхность шлифованного образца с последующей его отмывкой бидистиллированной водой. Далее осуществляли напыление на полированную поверхность эпоксидных блоков углерода (толщина покрытия – 10– 15 нм) с помощью вакуумного напылительного поста (EM ACE200, Leica) [9].
Визуализацию структуры образцов выполняли при помощи сканирующей электронной микроскопии в об- ратно рассеянных электронах в электронном микроскопе Hitachi-S-3400N (Hitachi, Япония) в режиме BSECOMP при ускоряющем напряжении 10 кВ.
Статистический анализ результатов исследования проводили с помощью пакетов прикладных программ StatSoft STATISTICA 10.0, GraphPad Prism 6. Проверяли нормальность распределения количественных показателей с помощью критерия Колмогорова – Смирнова. Так как распределения не были нормальными, при сравнении количественных показателей в двух независимых группах использовали критерий Манна – Уитни. Критический уровень значимости составлял р = 0,05.
Результаты
Микроядерный тест
В результате проведенного цитогенетического анализа было показано статистически значимое различие между контрольной и экспериментальной группами по уровню ПХЭ c МЯ ( p < 0,001, рис. 2a).
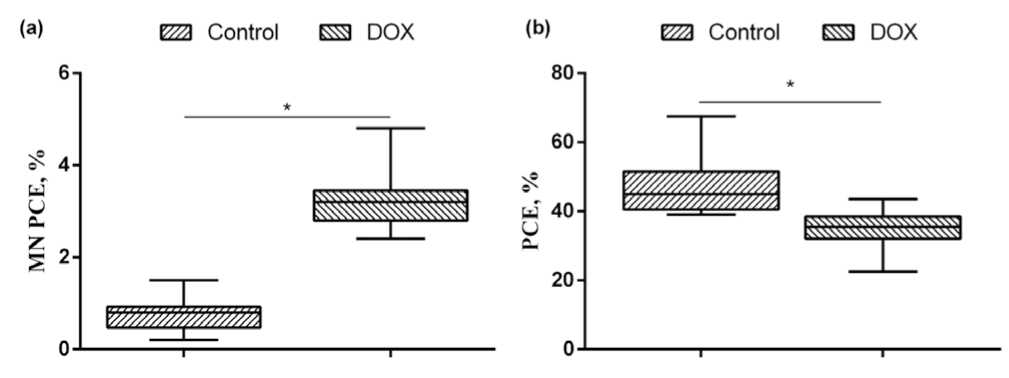
Рис. 2. Микроядерный тест; a – процентное содержание полихроматофильных эритроцитов с микроядром, b – доля полихроматофильных эритроцитов в общем пуле проанализированных клеток (* – статистически значимое различие между группами); Control – контрольная группа; DOX – экспериментальная группа; MN – micronuclei – микроядро; PCE – polychromatic erythrocyte – полихроматофильный эритроцит
Fig. 2. Micronucleus assay; (a) – percentage of polychromatophilic erythrocytes with a micronucleus, (b) – percentage of polychromatophilic erythrocytes per 200 cells (* – significant difference between groups); Control – control group; DOX – experimental group; MN – micronuclei; PCE – polychromatic erythrocyte
Одиним из этапов микроядерного теста костного мозга является анализ 200 эритроцитов и подсчет доли ПХЭ для понимания изменения эритропоэза. Согласно ГОСТу № 34660-2020, доля ПХЭ должна стремиться к 50%. Было установлено, что крысы из экспериментальной группы характеризовались значительным снижением количества ПХЭ по сравнению с контрольной группой ( p = 0,001, см. рис. 2b).
Электронная микроскопия
Электронно-микроскопическое исследование сердца контрольных крыс показало классическую интактную ультраструктуру тканей сердца без явных нарушений во внеклеточных и внутриклеточных пространствах (рис. 3a, c, e, g). Крупные кровеносные сосуды на периферии сердца содержали небольшое количество эритроцитов (см. рис. 3a, c, e). Мышечные волокна локализовались параллельно друг другу, имели равномерную электронную плотность. Митохондрии располагались упорядоченно в виде однослойной цепочки вдоль сократительных волокон, об- ладали округло-овальной формой. Ядра кардиомиоцитов обычно светлые с одним, реже с двумя или тремя ядрышкам (см. рис. 3c, e, g). В крупных и мелких сосудах не выявлялись признаки застоя крови. Лейкоциты в просвете сосудов отсутствовали (см. рис. 3a, c, e).
В экспериментальной группе отмечали выраженную гетерогенность морфологического строения миокарда (рис. 3b, d, f, h). Крупные и мелкие сосуды содержали большое количество эритроцитов, присутствовали небольшие очаги геморрагий (см. рис. 3b, d, f), что указывает на проявление застоя крови. Регистрировали нарушение упорядоченного расположения кардиомиоцитов, что проявлялось в появлении участков с извилистым расположением кардиомиоцитов и их неравномерном утолщении. Сократительные волокна также имели извилистую структуру (см. рис. 3d). Митохондрии располагались менее упорядоченно, иногда располагались кучно, наслаиваясь друг на друга. В кардиомиоцитах наблюдали признаки дегенерации миофибрилл и вакуолизации цитоплазмы (см. рис. 3h).
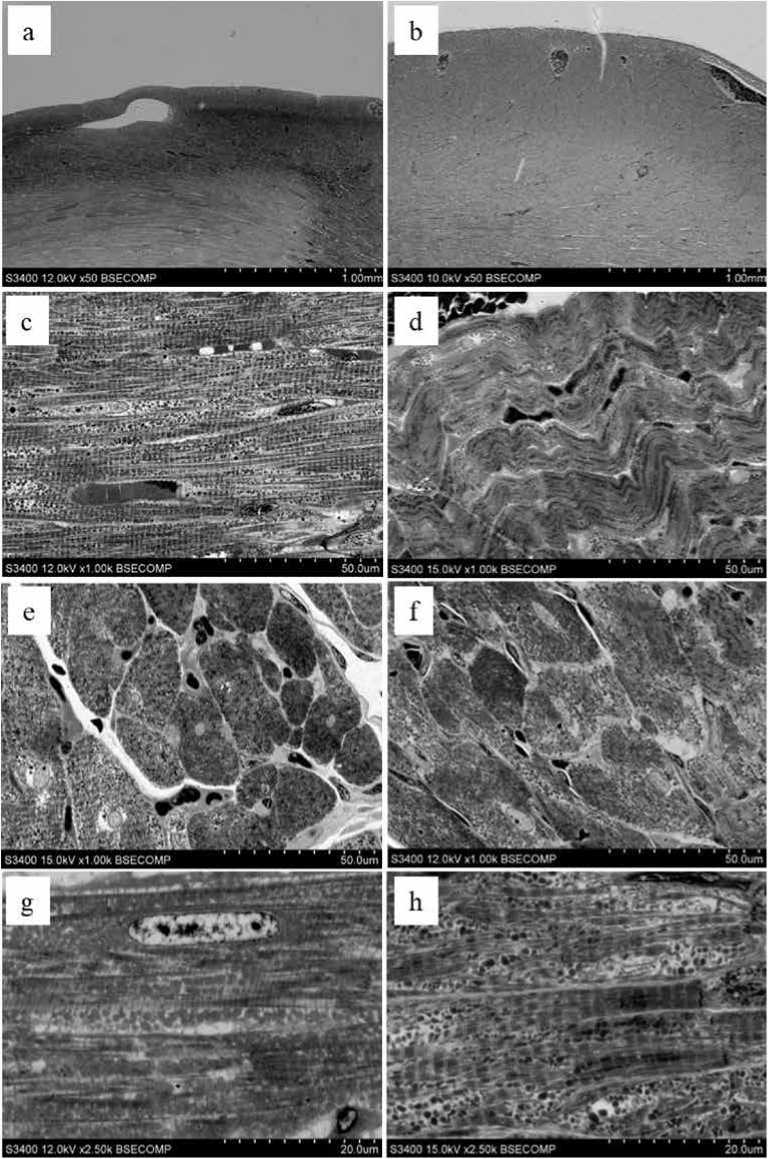
Рис. 3. Ультраструктурное строение сердца крысы: a – контрольная группа, × 50; отсутствие геморрагий периферических сосудов миокарда; b – экспериментальная группа с доксорубицином, × 50; сосуды миокарда полнокровны; с – (продольное сечение), e (поперечное сечение) – контрольная группа, × 1000; упорядоченная локализация кардиомиоцитов, умеренное кровенаполнение капилляров в толще миокарда; d (продольное сечение), f (поперечное сечение) – экспериментальная группа с доксорубицином, × 1000; извилистость мышечных волокон, избыточное кровенаполнение капилляров; g – контрольная группа, × 2500; митохондрии расположены равномерно в прямом контакте с сократительными волокнами; h – экспериментальная группа с доксорубицином, × 2500; гетерогенность волокон кардиомиоцитов, митохондрии локализованы группами в электронно-прозрачных участках цитоплазмы
Fig. 3. Ultrastructure of the rat heart: a – control group, × 50; absence of hemorrhage of peripheral vessels of the myocardial wall; b – experimental group with doxorubicin, × 50; the vessels of the myocardial wall are excessively filled with blood; c (longitudinal section), e (cross section) – control group, × 1000; ordered localization of cardiomyocytes, moderate blood supply to capillaries in the thickness of the myocardium; d (longitudinal section), f (cross section) – experimental group with doxorubicin, × 1000; tortuosity of muscle fibers, excessive blood filling of capillaries; g – control group, × 2500; mitochondria are evenly distributed in direct contact with contractile fibers; h – experimental group with doxorubicin, × 2500; heterogeneity of cardiomyocyte fibers, mitochondria are localized in groups in electron-transparent areas of the cytoplasm
Выявлены различия в структурной организации печеночных долек между контрольной и экспериментальной группами (рис. 4). В контрольной группе гепатоциты обладали характерной паренхимной формой с типичной цитоплазмой и органеллами (см. рис. 4a, c). Ядра имели округлую или эллиптическую форму, ядерная мембрана чистая, неповрежденная, митохондрии присутствуют в большом количестве. Печеночные дольки были четкими и полными, балки долек прямые (см. рис. 4a). Электронные микрофотографии гепатоцитов крыс, получавших доксорубицин, показали дегенеративные изменения структуры клеток печени. К ним относятся вакуолизация цитоплазмы и набухание митохондрий (см. рис. 4b, d). Наличие значительной вакуолизации цитоплазмы гепатоцитов, протекающей по типу гидропической дистрофии, и периферическая локализация митохондрий были характерными особенностями ультраструктуры гепатоцитов в этой группе. Вероятно, что вакуолизация цитоплазмы гепатоцитов является следствием набухания эндоплазматической сети.

Рис. 4. Ультраструктурное строение печени крысы: a – контрольная группа, × 500; сохранность балочной структуры печени, наличие венозных и желчных капилляров, центральное расположение ядра, отсутствие кровоизлияния; b – экспериментальная группа с доксорубицином, × 500, наличие вакуолей преимущественно вблизи ядра, ядро децентрализовано; c – контрольная группа, × 5000, сохранность эндоплазматического ретикулума (ЭПР), отсутствие набухания ЭПР, отсутствие вакуолизации, регулярное расположение митохондрий; d – экспериментальная группа с доксорубицином, × 5000, пристеночное расположение электронно-плотной цитоплазмы, соединяющей митохондрии
Fig. 4. Ultrastructure of the rat liver: a – control group, × 500; preservation of the membrane structure of the liver, presence of venous and bile capillaries, central location of the nucleus, absence of hemorrhage; b – experimental group with doxorubicin, × 500, the presence of vacuoles mainly near the nucleus, the nucleus is decentralized; c – control group, × 5000, preservation of the endoplasmic reticulum (ER), absence of ER swelling, absence of vacuolization, regular arrangement of mitochondria; d – experimental group with doxorubicin, × 5000, near-wall location of electron-dense cytoplasm connecting mitochondria
Обсуждение
Актуальность изучения влияния доксорубицина in vivo объясняется важностью роли антрациклиновых препаратов в клинике, поскольку у большинства пациентов кар-диотоксические эффекты развиваются спустя некоторое время после первоначального воздействия препарата. Характер воздействия доксорубицина может дифференцироваться в зависимости от сроков возникновения негативных эффектов. Так, можно выделить острый (возникает непосредственно во время лечения); ранний (проявляется в течение года после терапии); поздний от- вет (возникает через несколько лет) [10]. Поэтому важно спрогнозировать тяжесть токсических эффектов антра-циклина, которая, безусловно, будет зависеть от дозировки и времени терапии.
В последние годы прослеживается тенденция к снижению дозировки и длительности времени инфузии доксорубицина для предотвращения возникновения его токсических эффектов. Например, Y. Kalender и соавт. изучали гепатотоксические эффекты доксорубицина в экспериментальной модели при использовании внутривенных инъекций в дозировке 5 мг/кг в неделю на протяжении 6 нед. [11]. Ученые из Словакии в своем исследовании кардиотоксических эффектов доксорубицина использовали меньшую дозировку: 7 внутрибрюшинных инъекций 2,15 мг/кг доксорубицина в течение 3-недельного периода (общая кумулятивная дозировка составляла 15 мг/кг) [12]. В исследовании P.Y. Chen и соавт. была использована группа 4-недельных крыс, получавших доксорубицин в дозировке 2,5 мг/кг внутрибрюшинно каждые 3 дня в течение 3 нед. [13]. Они наблюдали снижение массы сердца этих крыс, нарушение расположения кардиомиоцитов, увеличение накопления коллагеновых волокон, усиление фиброза. Однако результат эксперимента на изолированном сердце крысы не показал статистически значимых изменений сердечной функции во время воздействия доксорубицина [14]. Стоит отдельно отметить работу российских исследователей. Е.Ю. Подъячева и соавт. исследовали профиль молекулярных маркеров фиброза при введении крысам линии Wistar различных доз доксорубицина (кумулятивная доза 5, 10 и 15 мг/кг) [15]. Результаты исследования на основе эхокардиографии и гистохимического метода показали морфологические, в том числе фиброзные, изменения миокарда левого желудочка и развитие диастолической дисфункции у крыс экспериментальных групп.
В настоящем исследовании с помощью сканирующей электронной микроскопии была проанализирована ультраструктура сердца крысы. Нами была отмечена несвойственная нормальной морфологии сердца локализация кардиомиоцитов, структура сократительных волокон, а также нарушение организации цитоплазмы и органелл внутри кардиомиоцитов.
Известно, что доксорубицин индуцирует процесс апоптоза посредством различных механизмов. Одним из таких механизмов является окислительный стресс с образованием свободных радикалов кислорода. Благодаря доксорубицину, свободные радикалы накапливаются в митохондриях, далее происходит ингибирование белков, противодействующих апоптозу, активация проапопти-ческих белков. В итоге это приводит к дестабилизации митохондриальной мембраны, высвобождению цитохрома С и к гибели кардиомиоцитов [16]. Помимо вышеуказанного механизма важную роль в клеточном старении кардиомиоцитов, апоптозе и в целом кардиотоксичности играют такие процессы, как перегрузка кардиомиоцитов кальцием, аутофагия и ферроптоз [11].
Патологические процессы в печени и еу дисфункция влияют на физиологические процессы во всем организме в целом и в сердце в частности. В данной работе были продемонстрированы гепатотоксические эффекты субхронического воздействия малой дозы доксорубицина. Известно, что депо железа находится в печени. В печени свободные радикалы, продуцируемые доксорубицином, реагируют с Fe3+ в окислительно-восстановительной реакции. Образуется комплекс, который может восстанавливать кислород до перекиси водорода, генерировать супероксидные анионные и гидроксильные радикалы [11]. В ответ на высвобождение свободных радикалов повышается уровень антиоксидантных ферментов в печени, что указывает на гепатотоксическое действие доксорубицина [11]. Естественно, гепатотоксические эффекты сопровождаются снижением функциональной способности печени, что в свою очередь приводит к выпадению значимого гуморального звена сердечно-сосудистой регуляции и гомеостаза [17]. При дисфункции печени увеличивается запас липидов, из-за чего усиливается глюконеогенез.
Далее повышается уровень глюкозы в крови, в итоге возрастает риск развития сердечной недостаточности и кардиомиопатии [17].
Микроядерный тест в ПХЭ млекопитающих обладает высоким потенциалом и специфичностью для быстрого и эффективного скрининга генотоксических эффектов различных мутагенов. Ранее мы использовали микроя-дерный тест для определения генотоксического потенциала митомицина С (ММС) при хроническом воздействии на мышей, нокаутных по гену аполипопротеина Е [18]. В настоящем исследовании мы выявили 4-кратное преобладание ПХЭ с МЯ в группе крыс линии Wistar, экспонированных доксорубицином. Уровень МЯ в ретикулоцитах (ПХЭ) отражает количество хромосомных аберраций, которые возникли в результате ошибок при репликации генетического материала и/или воздействия генотоксических агентов, каким и является доксорубицин.
Интересен процесс непосредственного взаимодействия мутагена и ДНК. Согласно литературе, доксорубицин является интеркалятором ДНК, предпочитающим участки с высоким содержанием оснований GC. Доксорубицин образует водородные связи с гуанином на одной цепи и опосредованно через формальдегид ковалентно связывается также с гуанином на противоположной цепи [19]. Далее образуются кросс-сшивки, приводящие к двойным разрывам ДНК и, как итог, к формированию МЯ [20]. Учитывая тот факт, что кардиомиоциты являются клетками с очень низким пролиферативным потенциалом, генотоксический эффект доксорубицина будет иметь накопительный характер. Возможно, накопление хромосомных аберраций в кардиомиоцитах приводит к запуску механизма апоптоза, так как он является одним из основных путей гибели клеток с генетическими повреждениями [8].
Согласно протоколу микроядерного теста, дополнительно нами были проанализированы 200 клеток, включающие как НХЭ, так и ПХЭ, для определения нарушения эритропоэза, а также подсчитано их соотношение. Контрольная группа характеризовалась нормальным соотношением клеток, а в экспериментальной группе наблюдался явный сдвиг к преобладанию НХЭ. Снижение количества ПХЭ может происходить из-за воздействия доксорубицина с последующим ингибированием деления клеток, гибели эритробластов и в конечном итоге удалением поврежденных клеток [8]. Нарушение эритропоэза, заключающееся в снижении количества незрелых эритроцитов, приводит к эритропении, характеризующейся патологическим снижением уровня эритроцитов в кровеносной системе, уменьшением количества кислорода, развитием гипоксии органов, в особенности сердца [21]. Учитывая непосредственную кардиотоксичность доксорубицина, гипоксия как дополнительный фактор может увеличить риск развития заболеваний сердца.
Заключение
Таким образом, результаты нашего исследования дают представление о подостром влиянии малой дозы доксорубицина на сердце, печень и систему кроветворения крыс линии Wistar. Нами были предложены механизмы взаимодействия важных органов и систем организма, подвергшихся воздействию доксорубицина, на фоне общего патологического состояния. В дальнейшем следует определить характер токсичесих эффектов более низких и оптимальных доз мутагена в контексте субхронического кумулятивного воздействия.
Список литературы Комплексная оценка субхронического низкодозового воздействия доксорубицина на модели крыс линии Wistar
- Argun M., Üzüm K., Sönmez M.F., Özyurt A., Derya K., Çilenk K.T. et al. Cardioprotective effect of metformin against doxorubicin cardiotoxicity in rats. Anatol. J. Cardiol. 2016;16(4):234. https://doi.org/10.5152/akd.2015.6185.
- Guo R., Hua Y., Ren J., Bornfeldt K.E., Nair S. Cardiomyocyte-specific disruption of Cathepsin K protects against doxorubicin-induced cardiotoxicity. Cell Death Dis. 2018;9(6):692. https://doi.org/10.1038/s41419-018-0727-2.
- Anghel N., Herman H., Balta C., Rosu M., Stan M.S., Nita D. et al. Acute cardiotoxicity induced by doxorubicin in right ventricle is associated with increase of oxidative stress and apoptosis in rats. Histol. Histopathol. 2018;33(4):365. https://doi.org/10.14670/hh-11-932.
- Yu Q., Li Q., Na R., Li X., Liu B., Meng L. et al. Impact of repeated intravenous bone marrow mesenchymal stem cells infusion on myocardial collagen network remodeling in a rat model of doxorubicin-induced dilated cardiomyopathy. Mol. Cell Biochem. 2014;387(1-2):279-285. https://doi.org/10.1007/s11010-013-1894-1.
- Hajra S., Patra A.R., Basu A., Bhattacharya S. Prevention of doxorubicin (DOX)-induced genotoxicity and cardiotoxicity: Effect of plant derived small molecule indole-3-carbinol (I3C) on oxidative stress and inflammation. Biomed. Pharmacother. 2018;101:228-243. https://doi.org/10.1016/j.biopha.2018.02.088.
- Jain A.K., Pandey A.K. In vivo micronucleus assay in mouse bone marrow methods. Mol. Biol. 2019;2031:135-146. https://doi.org/10.1007/978-1-4939-9646-9_7.
- Christidi E., Brunham L.R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 2021;12(4):339. https://doi.org/10.1038/s41419-021-03614-x.
- Boriollo M.F.G., Alves V.E., Silva T.A., Silva J.J., Barros G.B.S. Dias C.T.S. et al. Decrease of the DXR-induced genotoxicity and nongenotoxic effects of Theobroma cacao revealed by micronucleus assay. Braz. J. Biol. 2021;81(2):268-277. https://doi.org/10.1590/1519-6984.223687.
- Mukhamadiyarov R.A., Bogdanov L.A., Glushkova T.V., Shishkova D.K., Kostyunin A.E., Koshelev V.A. et al. EMbedding and backscattered scanning electron microscopy: a detailed protocol for the whole-specimen, high-resolution analysis of cardiovascular tissues. Front. Cardiovasc. Med. 2021;8:739549. https://doi.org/10.3389/fcvm.2021.739549.
- Robert J. Long-term and short-term models for studying anthracycline cardiotoxicity and protectors. Cardiovasc. Toxicol. 2007;7:135-139. https://doi.org/10.1007/s12012-007-0022-4.
- Kalender Y., Yel M., Kalender S. Doxorubicin hepatotoxicity and hepatic free radical metabolism in rats. The effects of vitamin E and catechin. Toxicology. 2005;209(1):39-45. https://doi.org/10.1016/j.tox.2004.12.003.
- Ivanová M., Dovinová I., Okruhlicová L., Tribulová N., Simončíková P., Barteková M. et al. Chronic cardiotoxicity of doxorubicin involves activation of myocardial and circulating matrix metalloproteinases in rats. Acta Pharmacol. Sin. 2012; 33(4):459-469. https://doi.org/10.1038/aps.2011.194.
- Chen P.Y., Hou C.W., Shibu M.A., Day C.H., Pai P., Liu Z.R. et al. Protective effect of Co-enzyme Q10 on doxorubicin-induced cardiomyopathy of rat hearts. Environ. Toxicol. 2017;32(2):679-689. https://doi.org/10.1002/tox.22270.
- Henderson K.A., Borders R.B., Ross J.B., Abdulalil A., Gibbs S., Skowronek A.J. et al. Integration of cardiac energetics, function and histology from isolated rat hearts perfused with doxorubicin and doxorubicin-ol; a model for use in drug safety evaluations. J. Pharmacol. Toxicol. Methods. 2018;94(2):54-63. https://doi.org/10.1016/j.vascn.2018.08.004.
- Подъячева Е.Ю., Шмакова Т.В., Андреева Д.Д., Торопов Р.И., Чебуркин Ю.В., Данильчук М.С. и др. Профиль молекулярных маркеров фиброза у крыс при воздействии различных доз доксорубицина. Журнал эволюционной биохимии и физиологии. 2023;59(2):121- 130. https://doi.org/10.31857/S0044452923020043.
- Liao H.E., Shibu M.A., Kuo W.W., Pai P.Y., Ho T.J., Kuo C.H. et al. Deep sea minerals prolong life span of streptozotocin-induced diabetic rats by compensatory augmentation of the IGF-I-survival signaling and inhibition of apoptosis. Environ. Toxicol. 2016;31(7):769-781. https://doi.org/10.1002/tox.22086.
- Nakashima M., Nakamura K., Nishihara T., Ichikawa K., Nakayama R., Takaya Y. et al. Association between cardiovascular disease and liver disease, from a clinically pragmatic perspective as a cardiologist. Nutrients. 202315(3):748. https://doi.org/10.3390/nu15030748.
- Asanov M.A., Shishkova D.K., Poddubnyak A.O., Sinicky M.Yu., Sinickaya A.V., Khutornaya M.V., et al. Dose-response assessment of mitomycin C genotoxic effect on ApoE knockout mice. J. Evol. Biochem. Physiol. 2023;59(5):1693-1699. https://doi.org/10.1134/S0022093023050198.
- Yang F., Teves S.S., Kemp C.J., Henikoff S. Doxorubicin, DNA torsion, and chromatin dynamics. Biochim. Biophys. Acta. 2014;1845:84-89. https://doi.org/10.1016/j.bbcan.2013.12.002.
- Ефимов В.А., Федюнин С.В. Кросс-сшитые нуклеиновые кислоты: получение, структура и биологическая роль. Успехи биологической химии. 2010;50:259-302. Efimov V.A., Fediunin S.V. Cross-linked nucleic acids: production, structure and biological role Uspekhi biologicheskoi khimii. 2010;50:259-302. (In Russ.). https://doi.org/10.1073/pnas.1821022116.
- Rymer J.A., Rao S.V. Anemia and coronary artery disease: pathophysiology, prognosis, and treatment. Coron. Artery Dis. 2018;29(2):161-167. https://doi.org/10.1097/MCA.0000000000000598.


