Комплексная оценка воспалительного статуса в диагностике ранних послеоперационных инфекционных осложнений у пациентов с колоректальным раком
Автор: Гарманова Т. Н., Агапов М. А., Маркарьян Д. Р., Какоткин В. В., Картошкин А. А., Кривоносова Д. А., Казаченко Е. А., Галлямов Э. А.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 3 (51), 2022 года.
Бесплатный доступ
Цель: Оценить роль воспалительных маркеров в ранней диагностике осложнений хирургического лечения пациентов с колоректальным раком. Методы: исследование было проведено на базе «Медицинского научно-образовательного центра МГУ имени М.В. Ломоносова» с 2019 по 2021 год. В исследование были включены все пациенты, проходившие оперативное лечение по поводу колоректального рака на базе 1 хирургического отделения МНОЦ МГУ им. М.В. Ломоносова. В исследовании были изучены клинические и лабораторные данные на основании материалов историй болезни пациентов с II-III стадией колоректального рака, которым было проведено радикальное лечения в объеме резекции части толстой кишки с лимфодиссекцией с формированием первичного анастомоза. Всем пациентам в плановом порядке выполнялась проктография в раннем послеоперационном периоде.Результаты: В исследование были включены 80 пациентов с колоректальным раком I-III стадии, у 26 из которых выявлены инфекционные осложнения, в том числе клинически незначимая несостоятельность кишечного анастомоза. В результате анализа имеющихся данных были показаны статистически значимые различия между группами на 2 день послеоперационного периода по абсолютному уровню лейкоцитов (p=0.01), гемоглобина (p=0,07), общего белка (p=0,02) и С-реактивного белка (p=0,03).Заключение: Повышение уровня маркеров воспалительного ответа, таких как количество лейкоцитов, уровень общего белка и уровень С-реактивного белка, могут наблюдаться уже на относительно ранних сроках послеоперационного периода у пациентов с инфекционными осложнениями, в том числе с клинически незначимой несостоятельностью кишечного анастомоза. Это позволяет выделить группу пациентов, требующих более пристального мониторинга в послеоперационном периоде.
Колоректальный рак, рак прямой кишки, рак ободочной кишки, маркеры воспаления, инфекционные осложнения
Короткий адрес: https://sciup.org/142235702
IDR: 142235702 | УДК: 616-089-06 | DOI: 10.38181/2223-2427-2022-3-20-31
Текст научной статьи Комплексная оценка воспалительного статуса в диагностике ранних послеоперационных инфекционных осложнений у пациентов с колоректальным раком
За 2020 год во всем мире было диагностировано 1 931 590 новых случаев колоректального рака, что составило 10% от всех онкологических диагнозов для обоих полов и всех возрастов (третий самый частый диагноз в структуре онкологической заболеваемости). В том же году от колоректального рака умерло 935 173 человек [1-4].
В 2020 году в Российской Федерации было диагностировано 77 213 (35 684 мужчин и 41 529 женщин) новых случаев колоректального рака, что составило 13,1% среди всех новых онкологических диагнозов за год. По статистическим данным за 2020 колоректальный рак занял первое место среди онкологических диагнозов по популяции (исключая рак кожи, не связанный с меланомой). Заболеваемость составила 27,8 на 100000, а смертность – 13,9 [1].
Хирургическое лечение является пока основным радикальным методом лечения локализованного рака толстой кишки, оно также может быть показано отдельным пациентам с потенциально операбельными метастазами. Однако хирургическое лечение имеет достаточно высокий процент инфекционных осложнений,в частности несостоятельность кишечного анастомоза (НА) (от 8 до 30%), раневая инфекция, инфекционно-воспалительные заболевания дыхательной, мочеполовой систем. Эти осложнения приводят не только к утяжелению течения в раннем послеоперационном периоде,но и по данным исследований с общей выборкой пациентов 34 300 к увеличению количества местных рецидивов и снижению общей выживаемости [5-8].
Помимо изученных факторов риска, таких как сопутствующие заболевания, пол, возраст, вредные привычки, распространенность и локализация опухоли, наличие или отсутствие неоадьюватной терапии, наличие осложнений онкологического процесса, появляются данные о новых возможных причинах возникновения инфекционных осложнений у пациентов после оперативного лечения колоректального рака. Существуют данные о том, что системная воспалительная реакция любой этиологии ухудшает онкологический прогноз у больных колоректальным раком. По своей сути послеоперационные осложнения становятся причиной усиления воспалительного ответа в организме человека,который считается основной причиной увеличения вероятности рецидивирования онкологических заболеваний [5].
Однако клинические проявления инфекционных послеоперационных осложнений манифестируют обычно лишь к концу первой недели после операции, когда уже развивается выраженный воспалительный процесс. Более того, у пациентов с клинически незначимой несостоятельностью кишечного анастомоза соответствующие проявления не развиваются, а при отсутствии плановой проктографии несостоятельность остается не диагностированной [9-12]. На этом этапе лучевые методы диагностики лишь уточняют характер осложнений [13, 14]. Поэтому значительный интерес представляют методы ранней их диагностики, возможной коррекции и оценка необходимости модификации послеоперационного периода.
Материалы и методы
Целью данной работы стало изучение возможности использования маркеров воспаления в ранней диагностике инфекционных осложнений хирургического лечения колоректального рака.
Дизайн исследования
Исследование является ретроспективным одноцентровым когортным. Работа выполнена на базе 1 хирургического отделения медицинского научно-образовательного центра (МНОЦ) МГУ им. М.В. Ломоносова и основана на результатах клинического наблюдения, обследования и хирургического лечения пациентов с колоректальным раком. В исследовании проводилось изучение клинических и лабораторных данных на основании материалов историй болезни пациентов с II-III стадией колоректального рака,которым было проведено радикальное лечения в объеме резекции толстой кишки с рас- ширенной лимфодиссекцией с формированием первичного анастомоза. В исследование были включены все пациенты, проходившие лечение за период с 2016 по 2019 год.
Критерии включения в исследование:
-
• Возраст от 18 лет;
-
• Верифицированный рак толстой кишки без отдаленного метастазирования,потенциально радикально ре-зектабельный;
-
• Отсутствие в анамнезе ранее установленного злокачественного новообразования иных локализаций;
-
• Отсутствие тяжелых инфекционных заболеваний (ВИЧ-инфекция, туберкулез, сифилис, прогрессирующее течение вирусных гепатитов В и С);
-
• Отсутствие декомпенсированных хронических заболеваний (ХСН IIA и выше, тяжелый сахарный диабет, тяжелая легочная гипертензия, рецидивирующая ТЭЛА) или хронических заболеваний в стадии обострения (ХОБЛ).
В исследовании были оценены потенциальные специфические для пациента и интраоперационные факторы риска: пол, ИМТ, предоперационная альбуминемия, использование стероидов, предоперационный лейкоцитоз и уровень С-реактивного белка, сердечно-сосудистые или респираторные заболевания, индекс Американского общества анестезиологов, подготовка кишечника, оперативный доступ (лапароскопия или лапаротомия), уровень анастомоза и техника формирования (аппаратный или ручной), наличие протективной стомы, длительность операции, наличие дренажа, периоперационное переливание крови.
В послеоперационном периоде оценивалась температура тела, абдоминальные симптомы, наличие перистальтики, характер отделяемого по дренажу (если есть).
В исследовании были оценены лабораторные маркеры воспалительного ответа (уровень в периферической крови лимфоцитов, нейтрофилов, С-реактивного белка, альбумина) в до- (однократный забор за неделю до операции) и послеоперационном периоде (1, 2, 3 день). Также был проведен анализ лабораторных данных, которые не связанны с воспалительным ответом напрямую, такие как гемоглобин, гематокрит, АЧТВ, МНО, уровень глюкозы и билирубина.
Инфекционно-воспалительными осложнениями считали все случаи несостоятельности кишечного анастомоза (независимо от клинической значимости), раневую инфекцию, пневмонию, инфекции мочевыводящих путей.
Несостоятельность кишечного анастомоза определяли при условии наличия одного из следующих крите- риев:наличие гноя или кишечного содержимого в дренаже, наличие жидкостного скопления в области анастомоза по данным послеоперационной КТ, затек контраста за пределы анастомоза при выполнении проктогра-фии, явная несостоятельность анастомоза, выявленная при повторной операции по поводу послеоперационного перитонита.
Всем пациентам после передней, низкой передней или брюшноанальной резекции прямой кишки, не имеющим клинических проявлений несостоятельности анастомоза на 7-е сутки послеоперационного периода рутинно выполняли проктографию с водорастворимым контрастным препаратом.Пациентам с клиническими проявлениями несостоятельности кишечного анастомоза проктографию проводили непосредственно в момент появления клинических симптомов.В положении больного на левом боку в задний проход вводили водорастворимое рентгеноконтрастное вещество — урографин 76% в объеме 100 мл. Выполняли 2 рентгенограммы в прямой и боковой проекциях до и после опорожнения. Выход контрастного вещества за пределы кишечной стенки в области скрепочного шва трактовали как рентгенологические признаки несостоятельности анастомоза (НА).
В случае выявления НА последнюю классифицировали в зависимости от выраженности клинических проявлений (степень А, В или С) в соответствии с классификацией International Study Group of Rectal Cancer [23] (табл. 1). Инфекцию мочевыводящих путей диагностировали на основании данных посева мочи с подсчетом уровни бактериурии. Послеоперационные инфекции раны диагностировали по клинической симптоматике с выполнением посева раневого отделяемого. Пневмония диагностировалась на основании клинических симптомов, данных лабораторных и инструментальных методов обследования.
Статистические методы
Все полученные данные вносились в электронную базу данных в программе MS Excel. Статистическая обработка выполнялась в программе IBM SPSS Statistics 28 и Statistica 13.
Для проверки распределения всех анализируемых количественных показателей на нормальность использовался одновыборочный критерий Колмогорова-Смирнова и критерий Шапиро-Уилка, уровень значимости – 0,05. При p >0,05 подтверждается гипотеза об отсутствии различий между наблюдаемым распределением признака и теоретически ожидаемым нормальным распределением.
Для определения различий между группами с ненормальным распределением использовался непараметрический U-критерий Манна-Уитни для сравнения двух независимых выборок, если распределение не отличалось от нормального — использовался t-тест.
Для определения значимости различий между средними значениями в нескольких независимых группах был использован дисперсионный анализ ANOVA с проверкой апостериорных критериев (Тьюки HSD) для определения различающихся групп. Отличия считали статистически значимыми при уровне значимости р <0,05.
Прогностическая значимость биомаркера оценивалась с помощью построение кривых характеристик (ROC) и расчета площади под кривой ROC (AUROC).
Результаты
В результате изучения архивных материалов историй болезней пациентов с колоректальным раком в исследование было включено 80 пациентов, из них у 26 были зарегистрированы послеоперационные инфекционные осложнения (32,5%). Средний возраст пациентов составил 66,63 ± 11.9 лет для группы без осложнений и 66,0 ± 14,0
лет для группы с осложнениями, значимых различий не получено. Средний индекс массы тела составил 24.44 ± 4,21 для группы без осложнений и 26.49 ± 5.09 для группы с осложнениями. Соотношение мужчин к женщинам в обеих выборках составило 1:1, в частности для выборки без инфекционных осложнений – 26 мужчин и 28 женщин, для выборки с осложнениями – 14 мужчин и 12 женщин.
Все пациенты исходно имели индекс ASA II (American Society of Anesthesiology), что говорит о наличии нетяжелых системных заболеваний в этой группе и учитывает коморбидные состояния. Злокачественное новообразование правой половины ободочной кишки было у 16 пациентов (20%), левых отделов у 30 (37,5% ) и прямой кишки у 34 пациентов (42,5%). Распределение пациентов по локализации опухолевого процесса различалось между группами с преобладанием пациентов с раком прямой кишки в группе с послеоперационными инфекционными осложнениями (33,4% vs 61,5%), обусловленным в основном несостоятельностью колоректального анастомоза после оперативного лечения рака прямой кишки (табл. 2).
Таблица 1
Классификация степени тяжести НА согласно классификации International Study Group of Rectal Cancer
Table 1.
Anastomosis leakage severity according to the classification of the International Study Group of Rectal Cancer
|
Степень тяжести |
Клиническая картина |
|
Рентгенологическая (А) |
Отсутствие симптоматики и необходимости лечения, возможность выявления только при помощи лучевых методов диагностики |
|
Клинически симптомная (В) |
Необходимость активной терапии, назначение антибактериальных препаратов, дренирование абсцессов, трансанальный лаваж, но без релапаротомии |
|
Клинически выраженная (С) |
Наличие явлений перитонита, необходимость релапаротомии |
Таблица 2
Распределение пациентов в зависимости от локализации опухолевого процесса
Table 2.
Patient distribution according to the tumor localization
|
Локализация опухолевого процесса |
Группа без НА |
Группа с НА |
||
|
n |
% |
n |
% |
|
|
Правые отделы ободочной кишки |
15 |
23,43 |
1 |
6,25 |
|
Левые отделы ободочной кишки |
28 |
43,75 |
2 |
12,5 |
|
Прямая кишка |
21 |
32,82 |
13 |
81,25 |
|
Всего |
64 |
16 |
||
У большей части пациентов операция была выполнена через лапароскопический доступ,только в 2слу-чаях (2,5%) был использован лапаротомический доступ, конверсии доступа не было. У всех пациентов было выполнено аппаратное формирование анастомоза.
В раннем послеоперационном периоде (до 30 дней) летальных исходов и случаев возврата пациентов в стационар после выписки не было зарегистрировано.
Общая частота септических осложнений составила 32,5% (у 25 из 80 больных было хотя бы одно инфекционное осложнение). Из них несостоятельность кишечного анастомоза у 16 пациентов, раневая инфекция у 5 пациентов, инфекция мочевыводящих путей у 2 и пневмония у 2 пациентов.
У 11 из 16 пациентов возникла несостоятельность кишечного анастомоза степени B и C, что потребовало повторного вмешательства (табл. 3).
Кроме того, 5 пациентам с гнойными раневыми осложнениями проводилась ревизия, санация и частичное раскрытие раны, ни одному пациенту не потребовалась повторное оперативное вмешательство.
Средняя продолжительность пребывания в стационаре составила 11,4 ± 5,84 (диапазон 6–36; медиана 10 дней). У пациентов с несостоятельностью анастомоза она была больше, чем у пациентов без несостоятельности (13,9 против 9,6 дня; p = 0,017).
Частота септических осложнений не коррелировала с полом, возрастом, проведением периоперационного пе-
Распределение пациентов в зависимости от типа несостоятельности
Patient distribution according to the anastomosis leakage type
Таблица 3
Table 3.
|
Тип несостоятельности анастомоза |
Группа без НА |
|
|
n |
% |
|
|
A |
5 |
31,25 |
|
B |
3 |
18,75 |
|
C |
8 |
50 |
|
Всего |
16 |
|
0.0 10
Осложнения
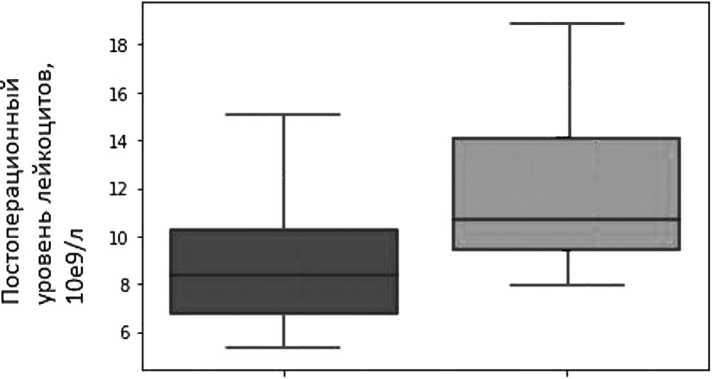
Рис. 1. Постоперационный уровень лейкоцитов в группах с и без осложнений (p=0,01) Fig. 1. Postoperative leukocyte level in groups with and without complications (p=0,01)
реливанием крови,наличием превентивной стомы и сопутствующими заболеваниями.
Из проанализированных лабораторных параметров выявлено возникновение статистически значимого различия уровня лейкоцитов крови, начиная со 2 суток послеоперационного периода (8,96 ± 3,22* 109/л vs 11,87 ± 3,32*109/л, p =0.01) у пациентов с несостоятельностью анастомоза (НА) (рис. 1).
Также на вторые сутки послеоперационного периода у пациентов с НА продемонстрировано статистически значимое (p=0,03) увеличение уровня С-реактивного белка (средне значение 134,5± 27,41 и 52,32 ± 26,41 мг/л соответственно) (рис. 2). (табл. 4).
Кроме того, в группе с НА продемонстрировано статистически значимое (p=0,02) снижение уровня общего белка сыворотки крови в постоперационном периоде по сравнению с группой без осложнений. Среднее значение этого параметра составило 55,07 ± 4,06 и 61,84 ± 9,15 г/л соответственно (рис. 3).
Также мы отметили у пациентов с НА значительное
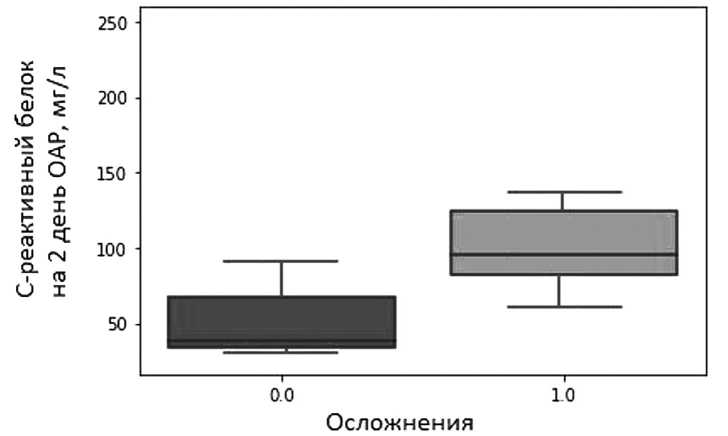
Рис. 2. Постоперационный уровень лейкоцитов в группах с и без осложнений (p=0,01) Fig. 2. Postoperative leukocyte level in groups with and without complications (p=0,01)
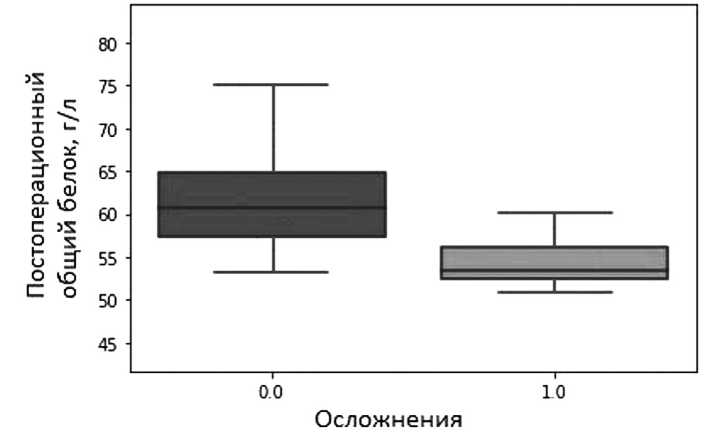
Рис. 3. Постоперационный уровень лейкоцитов в группах с и без осложнений (p=0,01)
Fig. 3. Postoperative leukocyte level in groups with and without complications (p=0,01)
снижение уровня гемоглобина ( p =0,07) в постоперационном периоде по сравнению с группой без осложнений. Среднее значение этого параметра составило 10,64 ± 1,45 и 12,2 ± 1,54 г/дл соответственно (рис. 4).
Стоит отметить,что данные об уровне гемоглобина получили пограничные значения p-value (0,07), что в общепринятой практике не считается статистически значимым изменением. Но учитывая небольшой объем имеющейся выборки мы сочли необходимым включить полученные данные, так как есть шанс, что при увеличении массива анализируемых данных будет получен более однозначный результат. Не было получено статистически значимых отличий в таких параметрах, как пред- и постоперационные уровень альбумина, фибриногена, абсолютный уровень тромбоцитов, нейтрофилов, лимфоцитов, а также предоперационные значения лейкоцитов, общего белка и гемоглобина.
У пациентов с раневой инфекцией,инфекций мочеполовой и пневмонией также отмечалось изменение уровня маркеров воспаления,но в боле поздние сроки, чем у пациентов с НА. Так, у них было выявлено значимое по сравнению с пациентами без осложнений повы-
Таблица 4
Средние значения уровней СРБ и лейкоцитов (WBC) у пациентов с и без НА
Mean values of CRP and leukocyte (WBC) levels in patients with and without anastomosis leakage
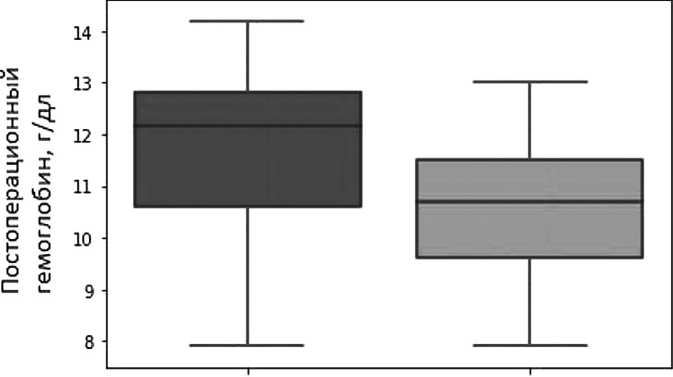
Table 4.
|
После операционный день |
Без осложнений |
С осложнениями |
p |
|
|
СРБ (мл/л) |
2 |
52,32 ± 26,41 |
134,5± 27,41 |
0,02 |
|
4 |
67,56±21,56 |
174,8±48,7 |
<0,001 |
|
|
6 |
67,9±26,56 |
151,7±39,6 |
<0,001 |
|
|
Уровень лейкоцитов*109/мм3 |
2 |
8,96 ± 3,22 |
11,87 ± 3,32 |
0,01 |
|
4 |
7,8±2,34 |
10,074±3,67 |
0,01 |
|
|
6 |
8,1±2,78 |
10,115±4,56 |
0,01 |
00 10
Осложнения
Рис. 4. Постоперационный уровень гемоглобина в группах с и без осложнений(p=0,07).
Fig. 4. Postoperative hemoglobin level in groups with and without complications (p=0,07).
шение уровня лейкоцитов до 11,8± 3,32 *109/мм3 ( р =0,034), повышение уровня СРБ до 98,8±38 ,7 мл/л ( р =0,004) на 6 сутки послеоперационного периода.
Важно отметить, что уровень С-реактивного белка не различался у пациентов с несостоятельностью кишечного анастомоза типа А и типов В и С,что подтверждает значимость данного параметра в выявлении микродефектов анастомоза до этапа развития симптомов воспаления.
Прогностическая значимость в диагностике НА уровня лейкоцитоза (AUROC) составила 0,749 (95% ДИ: 0,690, 0,815); уровня СРБ 0,921 (95% ДИ: 0,89, 0,962). Комбинация уровня лейкоцитоза и уровня СРБ дали небольшое увеличение прогностической ценности до 0,96.
При анализе клинических проявлений инфекционных осложнения было выявлено,что у пациентов с инфекционными осложнениями на 2 сутки после операции не отмечалось статистически значимого различия по температурной реакции, наличию или отсутствию перистальтики, а также по наличию напряжения мышц передней брюшной стенки. Таким образом, в нашем исследовании клинические данные не позволили на 2сутки после операции заподозрить наличие инфекционно-воспалительных осложнений.
Обсуждение
В некоторых работах начала 2000х годов показано, что до 40% клинически значимой несостоятельности анастомоза диагностируется после выписки из больницы и требуют повторной госпитализации в связи с возникновением симптомов [15-16]. Этот показатель, безусловно, увеличивается в эпоху хирургии с более ранней выпиской из стационара (обычно уже на четвертые сутки после операции). При этом тяжесть и сроки лечения несостоятельности увеличиваются при более позднем начале лечения [17]. Эти факты обуславливают необходимость наличия простого и надежного метода раннего выявления инфекционных осложнений,в том числе несостоятельности кишечных анастомозов. Не менее важным является доказанный в наблюдательных исследованиях факт значительного снижения общей выживаемости больных колоректальным раком после задокументированной несостоятельности [18]. Walker KG et al. [19] обнаружили, что 5-летняя общая выживаемость больных колоректальным раком с несостоятельностью кишечного анастомоза составила 44% по сравнению с 64% среди пациентов без несостоятельности; статистически показана отрицательная корреляция несостоятельности и общей и ракоспецифической выживаемости.
Наличие послеоперационных осложнений после операции по поводу КРР связано со снижением долгосрочной выживаемости,независимо от самого пациента,стадии заболевания и вида лечения [20]. В систематическом обзоре и мета-анализе результатов лечения 21902 пациента, включенных в 21исследование,у больных с несостоятельностью анастомоза был выявлен вдвое больший риск локального рецидивирования и увеличение на 75% вероятности смерти от колоректального рака по сравнению с теми, у кого анастомоз был состоятелен. В более позднем мета-анализе данных 20755 пациентов с различными солидными опухолями показано негативное влияние инфекционных осложнений на канцер-специфичес-кую и общую выживаемость [21].
Зарегистрированная частота несостоятельности кишечного анастомоза варьируются от 5 до 30% (обычный диапазон значимых несостоятельностей от 3 до 16% ) [16, 22–23], в нашем исследовании этот показатель составил 20%.
Интересно, что по нашим данным предоперационный уровень СРБ не влиял на вероятность послеоперационных инфекционных осложнений, однако это может быть связано с недостаточным количеством пациентов в выборке. Хотя в литературе встречается мнение о том, что уровень СРБ наряду с количество нейтрофилов, лимфоцитов, моноцитов, тромбоцитов в периферической крови,концентрацией альбумина могут иметь прогностическую ценность как для оценки текущего заболевания, так и для прогнозирования осложнений и выживаемости в постоперационном периоде [21].
В отношении клинических данных, Bellows et al. счи-тает,что самые ранние клинические предикторы несостоятельности кишечного анастомоза появляются только с 4 и последующих послеоперационных дней [22].
В исследованиях по оценке роли воспалительных маркеров как предикторов послеоперационных хирургических и нехирургических осложнений получены разнородные данные.
Диагностическая точность СРБ на 2 и 4-ый послеоперационные дни как предиктор септических осложнений после плановой колоректальной хирургии составляет 0,80 и 0,88 соответственно [12]. По данным отечественных авторов чувствительность СРБ в диагностике всех видов несостоятельности кишечного анастомоза составляет 0,67 и 0,91 для клинической и рентгенологической несостоятельности [12].
Корнер и соавт. опубликовали работу, в которой показали, что чувствительность уровня СРБ в диагностике несостоятельности кишечного анастомоза на 3-ий послеоперационный день составляет 82% [24], P. Ortega-Debal-lon [25] оценили этот параметр как 80,4% на 4-ый послеоперационный день.При этом авторы показали, что уровень СРБ выше 190 мг/л является показанием к проведению диагностического поиска несостоятельности анастомоза, в других же работах указывается, что этот уровень должен быть более 140 мг/л [26]. По данным систематического обзора уровень СРБ 144,5 мг/л и выше на 3-й послеоперационный день позволяет прогнозировать последующее развитие несостоятельности анастомоза с чувствительностью 79% и специфичностью 60% [27, 28, 29].
В нашей работе средний уровень СРБ у пациентов с несостоятельностью кишечного анастомоза составил 134,5± 27,41 мг/л мг/л на 2 сутки послеоперационного периода, что несколько ниже, чем в ряде исследований. Тем не менее,отмечалось повышение уровня этого показателя как у пациентов с клинически значимой, так и клинически незначимой несостоятельностью кишечного анастомоза.
В нашей работе количество лейкоцитов периферической крови, также начиная со 2ого послеоперационного дня было значительно выше у больных с инфекционными осложнениями. Добавление этого параметра дает некоторое увеличение прогностической значимости. По данным литературы для диагностики несостоятельности анастомоза основным является уровень СРБ, добавление других биомаркеров не приводит к улучшению диагностической точности [28]. Также у пациентов отмечалось снижение уровня общего белка сыворотки крови. Следует отметить сравнительно невысокие показатели чувствительности и специфичности уровня белка как маркера воспалительного ответа, которые не превышают 80% [30].
На наш взгляд уровень оценка воспалительного статуса в послеоперационном периоде имеет значение не только для ранней диагностики инфекционных заболе-ваний,но также может использоваться как маркер необходимости проведения плановой проктографии, что в нашей работе позволило увеличить число выявленных несостоятельностей кишечного анастомоза с 13,75% до 20%, что достаточно полно соответствует литературным данным [12].
Определение уровня СРБ и уровня лейкоцитов периферической крови на 2-3 сутки послеоперационного периода целесообразно использовать для ранней диагностики инфекционных осложнений в колоректальной хи- рургии. Этот комплекс может использоваться в том числе и для определения показаний к проведению плановой проктографии у пациентов с превентивной стомой и отсутствием клинических проявлений инфекционновоспалительных осложнений.
Заключение
Уровень С-реактивного белка в раннем послеоперационном периоде на 2-3 сутки является достаточно точным маркером клинически значимой и незначимой несостоятельности анастомоза,в сочетании с оценкой уровня лейкоцитов и уровнем белка может быть использован в качестве ранних предикторов данных осложнений. Значение СРБ >130 мг/л, уровень лейкоцитов 11*109/мм3 и уровень белка менее 55 г/л могут использоваться в качестве индикаторов наличия инфекционновоспалительных осложнений у пациентов после оперативного лечения колоректального рака.
Список литературы Комплексная оценка воспалительного статуса в диагностике ранних послеоперационных инфекционных осложнений у пациентов с колоректальным раком
- https://gco.iarc.fr (дата обращения: 01.08.2022).
- Seydaoğlu G, Özer B, Arpacı N, Parsak CK, Eray IC. Trends in colorectal cancer by subsite, age, and gender over a 15-year period in Adana, Turkey: 1993-2008. Turk J Gastroenterol. 2013;24(6):521-31. https://doi.org/10.4318/tjg.2013.0726
- Thörn M, Bergström R, Kressner U, Sparén P, Zack M, Ekbom A. Trends in colorectal cancer incidence in Sweden 1959-93 by gender, localization, time period, and birth cohort. Cancer Causes Control. 1998 Mar;9(2):145-52. https://doi.org/10.1023/a:1008826109697.
- Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001 Sep;2(9):533-43. Erratum in: Lancet Oncol 2001 Oct;2(10):596. https://doi.org/10.1016/S1470-2045(01)00486-7
- Гарманова Т.Н., Бредихин М.И., Тулина И.А., Царьков П.В. Роль воспаления в течении и лечении колоректального рака. Исследования и практика в медицине. 2018. Т. 5. № 4. С. 36-45 https://doi.org/10.17709/2409-2231-2018-5-4-4
- McArdle CS, McMillan DC, Hole DJ. Impact of anastomotic leakage on long-term survival of patients undergoing curative resection for colorectal cancer. Br J Surg. 2005 Sep;92(9):1150-4. https://doi.org/10.1002/bjs.5054
- Eriksen MT, Wibe A, Norstein J, Haffner J, Wiig JN; Norwegian Rectal Cancer Group. Anastomotic leakage following routine mesorectal excision for rectal cancer in a national cohort of patients. Colorectal Dis. 2005 Jan;7(1):51-7. https://doi.org/10.1111/j.1463-1318.2004.00700.x
- Dulk M, Marijnen CA, Collette L, Putter H, Påhlman L, Folkesson J, Bosset JF, Rödel C, Bujko K, van de Velde CJ. Multicentre analysis of oncological and survival outcomes following anastomotic leakage after rectal cancer surgery. Br J Surg. 2009 Sep;96(9):1066-75. https://doi.org/10.1002/bjs.6694
- Lagoutte N, Facy O, Ravoire A, Chalumeau C, Jonval L, Rat P, Ortega-Deballon P. C-reactive protein and procalcitonin for the early detection of anastomotic leakage aſter elective colorectal surgery: pilot study in 100 patients. J Visc Surg. 2012;149(5):e345-9. https://doi.org/10.1016/j.jviscsurg.2012.09.003
- O'Malley RB, Revels JW. Imaging of Abdominal Postoperative Complications. Radiol Clin North Am. 2020 Jan;58(1):73-91. https://doi.org/10.1016/j.rcl.2019.08.007
- Gore RM, Berlin JW, Yaghmai V, Mehta U, Newmark GM, Ghahremani GG. CT diagnosis of postoperative abdominal complications. Semin Ultrasound CT MR. 2004 Jun;25(3):207-21. https://doi.org/10.1053/j.sult.2004.03.003
- Шелыгин Ю.А., Тарасов М.А., Сухина М.А., Зароднюк И.В., Рыбаков Е.Г. Прокальцитонин и С-реактивный белок - ранние предикторы несостоятельности низких колоректальных анастомозов. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017;27(1):93-100 https://doi.org/10.22416/1382-4376-2017-27-1-93-100
- Chia WK, Ali R, Toh HC. Aspirin as adjuvant therapy for colorectal cancer--reinterpreting paradigms. Nat Rev Clin Oncol. 2012 Oct;9(10):561-70. https://doi.org/10.1038/nrclinonc.2012.137
- Cho E, Smith-Warner SA, Spiegelman D, Beeson WL, van den Brandt PA, Colditz GA, Folsom AR, Fraser GE, Freudenheim JL, Giovannucci E, Goldbohm RA, Graham S, Miller AB, Pietinen P, Potter JD, Rohan TE, Terry P, Toniolo P, Virtanen MJ, Willett WC, Wolk A, Wu K, Yaun SS, Zeleniuch-Jacquotte A, Hunter DJ. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies. J Natl Cancer Inst. 2004 Jul 7;96(13):1015-22. https://doi.org/10.1093/jnci/djh185
- Hyman N, Manchester TL, Osler T, Burns B, Cataldo PA. Anastomotic leaks after intestinal anastomosis: it's later than you think. Ann Surg. 2007 Feb;245(2):254-8. https://doi.org/10.1097/01.sla.0000225083.27182.85
- Alves A, Panis Y, Trancart D, Regimbeau JM, Pocard M, Valleur P. Factors associated with clinically significant anastomotic leakage after large bowel resection: multivariate analysis of 707 patients. World J Surg. 2002 Apr;26(4):499-502. https://doi.org/10.1007/s00268-001-0256-4
- Kingham TP, Pachter HL. Colonic anastomotic leak: risk factors, diagnosis, and treatment. J Am Coll Surg. 2009 Feb;208(2):269-78. https://doi.org/10.1016/j.jamcollsurg.2008.10.015
- Overview of colon resection // www.uptodate.com URL: https://www.uptodate.com/contents/overview-of-colon-resection (дата обращения: 10.09.2021).
- Walker KG, Bell SW, Rickard MJ, Mehanna D, Dent OF, Chapuis PH, Bokey EL. Anastomotic leakage is predictive of diminished survival after potentially curative resection for colorectal cancer. Ann Surg. 2004 Aug;240(2):255-9. https://doi.org/10.1097/01.sla.0000133186.81222.08
- Artinyan A, Orcutt ST, Anaya DA, Richardson P, Chen GJ, Berger DH. Infectious postoperative complications decrease long-term survival in patients undergoing curative surgery for colorectal cancer: a study of 12,075 patients. Ann Surg. 2015 Mar;261(3):497-505. https://doi.org/10.1097/SLA.0000000000000854
- Roxburgh CS, McMillan DC. Role of systemic inflammatory response in predicting survival in patients with primary operable cancer. Future Oncol. 2010 Jan;6(1):149-63. https://doi.org/10.2217/fon.09.136
- Bellows CF, Webber LS, Albo D, Awad S, Berger DH. Early predictors of anastomotic leaks after colectomy. Tech Coloproctol. 2009 Mar;13(1):41-7. https://doi.org/10.1007/s10151-009-0457-7
- Kingham TP, Pachter HL. Colonic anastomotic leak: risk factors, diagnosis, and treatment. J Am Coll Surg. 2009 Feb;208(2):269-78. https://doi.org/10.1016/j.jamcollsurg.2008.10.015
- Kørner H, Nielsen HJ, Søreide JA, Nedrebø BS, Søreide K, Knapp JC. Diagnostic accuracy of C-reactive protein for intraabdominal infections after colorectal resections. J Gastrointest Surg. 2009 Sep;13(9):1599-606. https://doi.org/10.1007/s11605-009-0928-1
- Ortega-Deballon P, Radais F, Facy O, d'Athis P, Masson D, Charles PE, Cheynel N, Favre JP, Rat P. C-reactive protein is an early predictor of septic complications after elective colorectal surgery. World J Surg. 2010 Apr;34(4):808-14. https://doi.org/10.1007/s00268-009-0367-x
- Welsch T, Müller SA, Ulrich A, Kischlat A, Hinz U, Kienle P, Büchler MW, Schmidt J, Schmied BM. C-reactive protein as early predictor for infectious postoperative complications in rectal surgery. Int J Colorectal Dis. 2007 Dec;22(12):1499-507. https://doi.org/10.1007/s00384-007-0354-3
- Лядов В.К., Гарипов М.Р., Полушкин В.Г., Тарасов Н.А., Аюпов Р.Т., Феоктистов Д.В. С-реактивный белок как ранний маркер несостоятельности швов толстокишечного анастомоза после резекции толстой кишки по поводу рака. Систематический обзор и метаанализ. Хирургия. Журнал им. Н.И. Пирогова. 2020;8:82-87 https://doi.org/10.17116/hirurgia202008182
- Smith SR, Pockney P, Holmes R, Doig F, Attia J, Holliday E, Carroll R, Draganic B. Biomarkers and anastomotic leakage in colorectal surgery: C-reactive protein trajectory is the gold standard. ANZ J Surg. 2018 May;88(5):440-444. https://doi.org/10.1111/ans.13937
- Кубышкин В.А., Самоходская Л.М., Королев Ю.М. Роль маркеров системного воспалительного ответа в послеоперационном периоде. Обзор. Хирургическая практика. 2021;(1):30-38 https://doi.org/10.38181/2223-2427-2021-1-30-38
- Labgaa I, Joliat GR, Kefleyesus A, Mantziari S, Schäfer M, Demartines N, Hübner M. Is postoperative decrease of serum albumin an early predictor of complications after major abdominal surgery? A prospective cohort study in a European centre. BMJ Open. 2017 Apr 8;7(4):e013966. https://doi.org/10.1136/bmjopen-2016-013966


