Комплексное исследование показателей кроветворения у необлучённых мышей, контактировавших с облучёнными особями
Автор: Когарко И.Н., Петушкова В.В., Когарко Б.С., Нейфах Е.А., Ктиторова О.В., Ганеев И.И., Селиванова Е.И., Кузьмина Н.С.
Рубрика: Научные статьи
Статья в выпуске: 4 т.34, 2025 года.
Бесплатный доступ
В работе продемонстрирован радиационноиндуцированный «эффект свидетеля» на межорганизменном уровне, о чём свидетельствуют результаты экспериментов, полученных при комплексном анализе кроветворных органов и клеток периферической крови совместно содержавшихся облучённых и необлучённых мышей. Показано, что у необлучённых мышей, контактировавших с облучёнными животными (клетка с перегородкой), через 3е сут с начала эксперимента наблюдается значимое снижение относительного количества лимфоцитов (p=0,047), сопровождающееся увеличением процентного содержания эозинофилов (p=0,05). Последний показатель существенно повышен и у животных«свидетелей», содержавшихся в клетке без перегородки (p=5E5). На 14е сут в обоих вариантах эксперимента также наблюдалось высокозначимое возрастание относительного количества эозинофилов по сравнению с контролем (p=4E3 и p=8E4 для клетки без перегородки и с перегородкой соответственно). В те же сроки отмечена тенденция к возрастанию числа нормохроматофильных эритроцитов с микроядрами (клетка с перегородкой, p=0,09). У необлучённых животных«свидетелей» в отдалённом периоде (30е сут) с начала эксперимента продолжается увеличение содержания эозинофилов (клетка без перегородки, p=2E5) по сравнению с неэкспонированным контролем. На 60е сут у этих необлучённых мышей отмечено снижение абсолютного количества лейкоцитов, процентного содержания лимфоцитов и повышение доли нейтрофилов по сравнению с контрольной группой (p=0,06, p=0,038, p=0,02 соответственно), а на 90е сут выявлены тенденция к повышению частоты моноцитов (p=0,05) и значимое снижение ядросодержащих клеток косного мозга (p=0,02). При содержании облучённых и необлучённых особей в клетке с перегородкой у мышей«свидетелей» на 30е сут отмечалось снижение процентного содержания лимфоцитов (p=0,01), сопровождавшееся возрастанием количества нейтрофилов (p=0,04), моноцитов (p=0,04) и эозинофилов (p=0,08). На 90е сут у этих животных выявлено значимое снижение доли лимфоцитов (p=0,01) наряду с возрастанием относительного количества эозинофилов (p=0,02) и моноцитов (p=0,05), а также тенденция к увеличению уровня нормохроматофильных эритроцитов с микроядрами по сравнению с контрольной группой (p=0,06). Таким образом, показаны системные нарушения кроветворения у необлучённых мышей, контактирующих с облучёнными животными, с превалированием отдалённых эффектов, сопровождающихся существенным изменением процентного соотношения лейкоцитов различных субпопуляций.
Ионизирующее излучение, мыши, костный мозг, селезёнка, тимус, лейкоциты, лимфоциты, эритроциты, облучённые и необлучённые животные, индукция радиационно-индуцированного «эффекта свидетеля», фактор контакта, радиобиология
Короткий адрес: https://sciup.org/170211338
IDR: 170211338 | УДК: 539.1.047:591.11.599.323.4 | DOI: 10.21870/0131-3878-2025-34-4-40-56
Текст научной статьи Комплексное исследование показателей кроветворения у необлучённых мышей, контактировавших с облучёнными особями
На протяжении последних десятилетий ведутся многочисленные работы по исследованию количественных и качественных закономерностей различных радиобиологических эффектов. Отдельным направлением исследований становится выявление «немишенных эффектов» ионизирующего излучения, когда нарушения возникают не только в облучённых клетках, но и в соседствующих, а также в дистанционно расположенных интактных клетках. Данный эффект был назван «эффектом свидетеля». Это явление, при котором необлучённые клетки-«свидетели»
находятся в непосредственном контакте с облучёнными клетками или в той среде, в которой находились экспонированные клетки, и они как бы подвергаются точно таким же воздействиям радиации, как и облучённые клетки [1, 2].
Радиационно-индуцированный «эффект свидетеля» на клеточном уровне – in vitro – широко освещается в литературе и показан на лимфоцитах человека [3]; фибробластах NHLF человека [4]; на клетках гепатомы [5]; глиобластомы [6], а также HeLa [7]. К настоящему времени лишь немногочисленные исследователи «эффекта свидетеля» in vivo перешли на межорганизменный уровень. В частности, Mothersill C. и соавт. осуществили эксперимент на рыбах [8]; Reis P. и соавт. – на Daphnia magna [9] и лишь отдельными лабораториями в качестве объекта изучения «эффекта свидетеля» на межорганизменном уровне были использованы мыши [2, 10] и крысы [11]. В целом, результаты перечисленных работ на межорганизменном уровне недостаточно освещают механизмы появления и течение обнаруженного «эффекта свидетеля».
Ранее были представлены исследования на отдельных популяциях клеток периферической крови (ПК) мышей-«свидетелей», контактировавших с облучёнными мышами в клетках с перегородкой и без [1, 2, 12, 13], где рассматривалась роль каждой популяции клеток в отдельности в проявлении общебиологического эффекта – «эффекта свидетеля».
Целью настоящего комплексного исследования являлось выявление «эффекта свидетеля» на межорганизменном уровне при изучении показателей кроветворной системы необлу-чённых животных (мыши), контактирующих с особями, подвергшимися радиационному воздействию. Оценивали изменения костного мозга, селезёнки, тимуса, лейкоцитарную формулу ПК, повреждения клеточного генома (микроядра в полихроматофильных и нормохроматофильных эритроцитах, т.е. микроядра в ПХЭ и НХЭ) в отдельные временные точки после начала эксперимента: на 3-и, 7-е, 14-е, 30-е, 60-е и 90-е сут.
Материалы и методы
Исследование проводили на базе вивария экспериментального отдела ФГБУН УНПЦ РМ ФМБА России. Биологическим объектом исследования являлись 60 мышей (белые беспородные мыши-самки, сток CD1) в возрасте 2,5 мес. и массой тела 23-26 г к началу опыта. При обращении с экспериментальными животными соблюдались международные правила [14, 15] и требования Комитета по биоэтике (Протокол № 7 от 04.07.2014 г. Этического комитета ФГБУН УНПЦ РМ). До начала эксперимента мыши проходили 2-недельный карантин. Животные содержались при искусственном освещении, получая питьевую воду ad libitum и стандартный полнорационный корм в виварии конвенционального типа. Подстилом служили гранулы древесины лиственных пород, замена производилась 1 раз в неделю.
Облучение и схема контакта животных. Источником облучения являлась радиобиологическая гамма-установка ИГУР-1M (4Х 137Cs), мощность дозы составила 0,79 Гр/мин при неравномерности поля не более 5%. Животные (n=20) были облучены в дозе 3 Гр и сразу после воздействия были рассажены для контакта с необлучёнными мышами (n=20). Животные содержались по следующей схеме: пять облучённых мышей находились в контакте с пятью необлу-чёнными мышами-«свидетелями». В двух из четырёх клеток были созданы условия для свободного контакта между животными, в двух других клетках облучённые и необлучённые мыши были разделены металлической сеткой. Изолированно содержались клетка с облучённым контролем и необлучённым контролем. Для решения поставленных задач в итоге было создано 6 экспериментальных групп мышей. Длительность эксперимента составила 90 дней.
Исследование крови и кроветворных органов. Проводился анализ клеточного состава ПК. В определённые значимые временные промежутки, а именно на 3-и, 7-е, 14-е, 30-е, 60-е и 90-е сут после облучения и начала контакта мышей, отбирали кровь из хвостовой вены животных. Использовался гемоцитометр Пикоскель PS-4 (ООО «НПФ «Лабовэй») для подсчёта числа лейкоцитов. С целью определения лейкоцитарной формулы были приготовлены мазки крови, которые фиксировались в течение 3 мин метанолом, высушивались, окрашивались по Романовскому-Гимза и кодировались. С использованием микроскопов Axio Scop A1 и Axio Image M2 (Ziess) оценивали процентное содержание лимфоцитов, моноцитов, эозинофилов и нейтрофилов в лейкоцитарной формуле крови (200 лейкоцитов).
По стандартной методике оценивали также число микроядерных эритроцитов. Для этого было проанализировано 1000 ПХЭ и 2000 НХЭ.
На 90-е сут после начала эксперимента проводили забой животных. Для анализа кроветворных органов выделяли селезёнку и тимус, из одной бедренной кости получали костный мозг (КМ). Селезёнку и тимус взвешивали. В КМ, селезёнке и тимусе с помощью гемоцитометра Пи-коскель PS-4 оценивали число ядросодержащих клеток. Для определения числа эритроцитов с микроядрами в КМ из второй бедренной кости готовили мазок КМ.
Статистический анализ. Для каждой исследуемой позиции сравнивали средние значения с использованием t-критерия Стьюдента (p<0,05). Учитывали факторы: гамма-облучение или его отсутствие, срок после начала контакта, вид контакта - с перегородкой или без неё. Для статистического анализа использовали пакет R [16].
Результаты
В наших предыдущих публикациях детально изложены результаты изучения различных показателей кроветворения у мышей, подвергшихся воздействию радиации (облучённая группа), и у необлучённых – мышей-«свидетелей» [1, 2, 12, 13]. Так как в данной работе приводятся итоговые результаты, полученные при анализе комплекса изученных показателей, в табл. 1-3 представлены только значимые отличия от необлучённого контроля (или на уровне явной тенденции, 0,05≤p≤0,1).
Изменение показателей кроветворения у облучённых мышей. В группе мышей, подвергшихся радиационному воздействию, спустя 3-14 сут после начала эксперимента наблюдается высокозначимое снижение абсолютного количества лейкоцитов ПК, которое почти в 2-6 раз было ниже такового показателя в необлучённом контроле (р=4Е-9; р=3Е-8; р=5Е-7 для 3, 7 и 14 сут соответственно), табл. 1.
Лейкоцитарная формула крови тоже претерпевает значимые радиационно-индуцированные нарушения, которые, как правило, соответствуют временному периоду 7-14 сут после облучения. Эти изменения проявляются снижением относительного количества лимфоцитов на 7-е сут после начала эксперимента (p=0,04) и возрастанием процентного содержания нейтрофилов (p=0,03). На 14-е сут наблюдаются эффекты противоположной направленности: уровень лимфоцитов увеличивается (p=0,03), а относительное содержание нейтрофилов существенно снижается (p=0,01). Последний показатель остаётся значимо пониженным и на 30-е сут после облучения (p=0,03), причём в этой «экспериментальной точке» отмечена тенденция к несколько повышенному уровню лимфоцитов крови (p=0,08). Значимо повышенное относительное содержание эозинофилов отмечается на 14-е сут после начала эксперимента (p=0,02), и тенденция к такому изменению сохраняется вплоть до 30 сут (p=0,10). Отклонений от контроля в процентном содержании моноцитов у облучённых животных не выявлено на протяжении всего эксперимента.
Показано, что на 90-е сут после начала эксперимента количество ядерных клеток КМ у облучённых мышей значимо снижено по сравнению с контрольным уровнем (p=0,01), рис. 1. В этот срок наблюдается и тенденция к снижению массы тимуса (p=0,1), рис. 2.
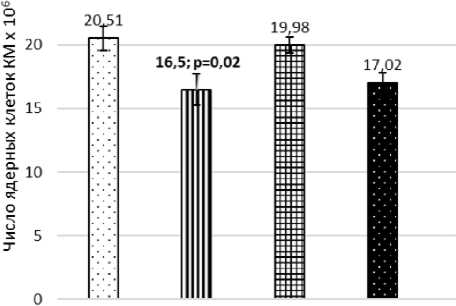
Биоконтроль Свидетели Свидетели Гамма без neper. с neper. контр
Рис. 1. Изменение числа ядросодержащих клеток в КМ мышей на 90-е сут после начала эксперимента, х10 6 .
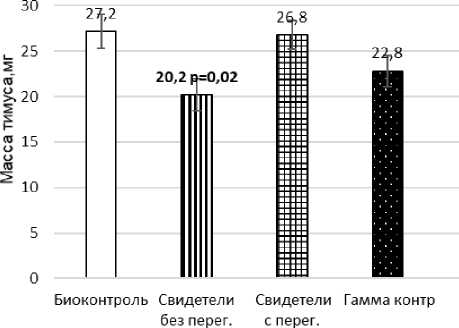
Рис. 2. Изменение массы тимуса мышей на 90-е сут после начала эксперимента, мг.
На протяжении всего временного периода (3-90 сут после облучения) у экспонированных мышей по сравнению с контрольной группой отмечается значимое повышение уровня НХЭ с микроядрами в ПК. Существенное увеличение частоты ПХЭ с микроядрами наблюдается на 7-е и 14-е сут после начала эксперимента.
Изменения показателей кроветворения у мышей-«свидетелей» в ближайшие сроки после начала эксперимента (3-14 сут). У необлучённых мышей-«свидетелей» (клетка с перегородкой) через 3 сут после начала эксперимента отмечалось значимое снижение процентного содержания лимфоцитов по сравнению с контрольным уровнем (p=0,047), сопровождающееся явной тенденцией к возрастанию относительного количества эозинофилов (р=0,05). Высокозначимое увеличение последних наблюдается и при содержании необлучённых мышей с облучёнными особями в клетке без перегородки (р=5Е-5).
На 7-е сут после начала эксперимента изменений формулы крови у мышей-«свидетелей» не выявлено. Лишь отмечена тенденция к увеличению НХЭ с микроядрами при содержании не-облучённых мышей с облучёнными в клетке с перегородкой (p=0,1).
На 14-е сут после начала эксперимента у неэкспонированных мышей, содержащихся с облучёнными особями, выявлено значимое увеличение в крови процентного содержания эозинофилов по сравнению с контролем (p=0,004 и р=8Е-4) для животных в клетке без перегородки и с перегородкой соответственно. Отмечена и некоторая тенденция к возрастанию уровня НХЭ с микроядрами (животные в клетке с перегородкой, p=0,09).
Изменения показателей кроветворения у мышей-«свидетелей» в отдалённом периоде после начала эксперимента (30-90 сут). У необлучённых животных, содержавшихся с облучёнными особями в клетках без перегородки (табл. 2, тактильный контакт), на 30-е сут выявлено высокозначимое увеличение по сравнению с неэкспонированным контролем (р=2Е-5) процентного содержания эозинофилов крови. При этом же варианте эксперимента на 90-е сут у мышей-«свиде-телей» выявлена тенденция к повышению относительного количества моноцитов (p=0,05).
Выраженные эффекты*, зарегистрированные у облучённых мышей (сравнение с необлучёнными особями)
Таблица 1
|
Показатель |
Время после начала эксперимента, сутки |
||||||||||||
|
3 |
7 |
14 |
30 |
60 |
90 |
||||||||
|
К |
О |
К |
О |
К |
О |
К |
О |
К |
О |
К |
О |
||
|
Количество лейкоцитов ПК, х10 6 /мл |
12,0±0,9 |
2,2±0,1 р=4Е-9 |
12,3±0,9 |
3,0±0,3 р=3Е-8 |
13,9±0,8 |
7,0±0,4 р=5Е-7 |
– |
– |
– |
– |
– |
– |
|
|
Лейкоцитарная формула крови (% клеток) |
лимфоциты |
– |
– |
81,3±2,7 |
73,7±2,1 p=0,04 |
79,9±1,3 |
83,4±0,7 p=0,03 |
79,5±0,9 |
81,7±0,9 p=0,08 |
– |
– |
– |
– |
|
нейтрофилы |
– |
– |
17,7±2,7 |
26,0±2,1 p=0,03 |
19,0±1,4 |
14,7±0,7 p=0,01 |
19,0±1 |
16,0±0,8 p=0,03 |
– |
– |
– |
– |
|
|
моноциты |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
|
эозинофилы |
– |
– |
0,4±0,2 |
0 р=0,1 |
0,5±0,2 |
1,4±0,3 р=0,02 |
0,8±0,2 |
1,3±0,2 р=0,10 |
– |
– |
– |
– |
|
|
Масса тимуса, мг |
27,2±1,9 |
22,8±1,7 р=0,10 |
|||||||||||
|
Количество ядерных клеток КМ, х 10 6 |
20,5±1,0 |
17,0±0,8 р=0,01 |
|||||||||||
|
Кол-во нормохроматофильных эритроцитов с МЯ в ПК, ‰ |
1,1±0,2 |
2,0±0,2 р=0,005 |
1,2±0,1 |
2,7±0,4 р=5Е-4 |
0,6±0,1 |
2,4±0,2 р=1,1Е-6 |
0,6±0,1 |
1,0±0,1 р=0,037 |
0,4±0,1 |
1,1±0,1 р=0,003 |
0,3±0,1 |
1,3±0,2 р=1Е-4 |
|
|
Кол-во полихроматофильных эритроцитов с МЯ в ПК, ‰ |
– |
– |
0,6±0,3 |
2,8±0,7 р=0,01 |
0,6±0,3 |
2,8±0,3 р=1,1Е-4 |
– |
– |
0,2±0,2 |
1,2±0,3 р=0,018 |
– |
– |
|
Примечание: * – представлены только показатели, по которым зарегистрированы значимые отличия (или тенденция к ним) облучённых мышей от особей необлучённого контроля. Жирным шрифтом выделены значения р<0,05; ПК – периферическая кровь; КМ – костный мозг; МЯ – микроядра; К – необлучённый контроль, О – облучённые мыши.
Радиация и риск. 2025. Том 34. № 4 ЕСТЕСТВЕННЫЕ НАУКИ Научные статьи
Таблица 2
Выраженные эффекты*, зарегистрированные у необлучённых мышей-«свидетелей», находившихся в одной клетке без перегородки с облучёнными особями
|
Показатель |
Время после начала эксперимента, сутки |
||||||||||||
|
3 |
7 |
14 |
30 |
60 |
90 |
||||||||
|
К |
С |
К |
С |
К |
С |
К |
С |
К |
С |
К |
С |
||
|
Количество лейкоцитов ПК, х10 6 /мл |
– |
– |
– |
– |
– |
– |
– |
10,1±0,4 |
8,6±0,7 p=0,06 |
– |
– |
||
|
Лейкоцитарная формула крови (% клеток) |
лимфоциты |
– |
– |
– |
– |
– |
– |
79,5±0,9 |
76,1±1,8 p=0,10 |
80,8±1,7 |
76,0±1,3 p =0,038 |
– |
– |
|
нейтрофилы |
– |
– |
– |
– |
– |
– |
17,2±1,7 |
22,0±0,9 p=0,02 |
– |
– |
|||
|
моноциты |
– |
– |
– |
– |
– |
– |
0,6±0,2 |
1,6±0,5 p=0,10 |
– |
– |
0,7±0,2 |
1,6±0,4 p=0,05 |
|
|
эозинофилы |
0,4±0,2 |
1,8±0,1 р=5Е-5 |
– |
– |
0,5±0,2 |
2,5±0,6 р=4Е-3 |
0,8±0,2 |
3,8±0,5 р=2Е-5 |
– |
– |
– |
– |
|
|
Масса тимуса, мг |
27,2±1,90 |
20,2±1,8 p=0,02 |
|||||||||||
|
Количество ядерных клеток КМ, х10 6 |
20,5±1 |
16,5±1,2 p=0,02 |
|||||||||||
|
Кол-во нормохроматофильных эритроцитов с МЯ в ПК, ‰ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
Примечание: * – представлены только показатели, по которым зарегистрированы значимые отличия (или тенденция к ним) мышей-«свидетелей» от особей необлучённого контроля. Жирным шрифтом выделены значения р<0,05; ПК – периферическая кровь; КМ – костный мозг; МЯ – микроядра; К – необлучённый контроль, С – мыши-«свидетели».
Радиация и риск. 2025. Том 34. № 4 ЕСТЕСТВЕННЫЕ НАУКИ Научные статьи
Таблица 3
Выраженные эффекты*, зарегистрированные у необлучённых мышей-«свидетелей», находившихся в одной клетке с перегородкой с облучёнными особями
|
Показатель |
Время после начала эксперимента, сутки |
||||||||||||
|
3 |
7 |
14 |
30 |
60 |
90 |
||||||||
|
К |
С |
К |
С |
К |
С |
К |
С |
К |
С |
К |
С |
||
|
Количество лейкоцитов ПК, х10 6 /мл |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
|
Лейкоцитарная формула крови (% клеток) |
лимфоциты |
82,9±1,6 |
78,2±1,5 p=,047 |
– |
– |
– |
– |
79,5±0,9 |
70,4±3 p=0,01 |
– |
– |
75,6±1,1 |
67,0±2,6 p=0,01 |
|
нейтрофилы |
– |
– |
– |
– |
– |
– |
19,0±1 |
25,7±2,8 p=0,04 |
– |
– |
– |
– |
|
|
моноциты |
– |
– |
– |
– |
– |
– |
0,6±0,2 |
1,7±0,4 p=0,04 |
– |
– |
0,7±0,2 |
4,4±1,8 p=0,05 |
|
|
эозинофилы |
0,4±0,2 |
1,4±0,4 р=0,05 |
– |
– |
0,5±0,2 |
2,2±0,4 р=8Е-4 |
0,8±0,2 |
2,0±0,6 р=0,08 |
– |
– |
1,4±0,2 |
3,1±0,7 р=0,02 |
|
|
Масса тимуса, мг |
– |
– |
|||||||||||
|
Количество ядерных клеток КМ, х10 6 |
– |
– |
|||||||||||
|
Кол-во нормохроматофильных эритроцитов с МЯ в ПК, ‰ |
– |
– |
1,2±0,1 |
1,6±0,2 р=0,10 |
0,6±0,1 |
1,0±0,2 р=0,09 |
– |
– |
– |
– |
0,3±0,1 |
0,8±0,3 р=0,06 |
|
Примечание: * – представлены только показатели, по которым зарегистрированы значимые отличия (или тенденция к ним) мышей-«свидетелей» от особей необлучённого контроля. Жирным шрифтом выделены значения р<0,05; ПК – периферическая кровь; КМ – костный мозг; МЯ – микроядра; К – необлучённый контроль, С – мыши-«свидетели».
Радиация и риск. 2025. Том 34. № 4 ЕСТЕСТВЕННЫЕ НАУКИ Научные статьи
На 60-е сут после облучения выявлена явная тенденция к снижению уровня лейкоцитов (количество клеток в 1 мкл крови) у необлучённых животных, содержавшихся с облучёнными особями в клетках без перегородки, по сравнению с контрольной группой (p=0,06). В остальных экспериментальных «точках» значимых отличий (или близких к статистической значимости) по этому показателю между мышами-«свидетелями» и контрольными необлучёнными животными группы сравнения не наблюдалось.
Наряду с вышесказанным снижением абсолютного количества лейкоцитов крови у мышей-«свидетелей» (клетка без перегородки) на 60-е сут после облучения выявлены также изменения в формуле крови. А именно: отмечено статистически значимое снижение (по сравнению с контрольной необлучённой группой) относительного количества лимфоцитов (p=0,038) и повышение процентного содержания нейтрофилов (p=0,02). Значимого повышения уровня эритроцитов с микроядрами не выявлено.
У необлучённых животных, содержавшихся с облучёнными особями в клетках с перегородкой (табл. 3, обонятельный контакт), также выявлены изменения в формуле крови. У этих мышей на 30-е сут после начала эксперимента отмечалось значимое снижение процентного содержания лимфоцитов (p=0,01), что сопровождалось существенным (или близким к значимому) возрастанием относительного количества нейтрофилов (p=0,04), моноцитов (p=0,04), эозинофилов (p=0,08).
У необлучённых мышей-«свидетелей» (клетка с перегородкой) через 90 сут после начала эксперимента отмечалось значимое снижение процентного содержания лимфоцитов (p=0,01), что сопровождалось существенным возрастанием (или тенденцией к этому) относительного количества эозинофилов (p=0,02) и моноцитов (p=0,05). Кроме того, выявлена явная тенденция к увеличению уровня НХЭ с микроядрами у этих необлучённых животных по сравнению с группой неэкспонированного контроля (p=0,06). Отмечено, что на 90-е сут после начала эксперимента количество ядерных клеток КМ у необлучённых мышей, содержавшихся с облучёнными особями в клетках без перегородки, значимо снижено по сравнению с контрольным уровнем (p=0,02), рис. 1. В этот срок наблюдается и существенное снижение массы тимуса (p=0,02), рис. 2. Обнаружено некоторое увеличение веса и числа ядерных клеток селезёнки у необлучённых мышей [12].
Обсуждение и заключение
Результаты комплексного изучения показателей кроветворения у необлучённых мышей, контактировавших с особями, подвергшимися радиационному воздействию, свидетельствуют о системных нарушениях в их организме. Это проявляется существенными изменениями со стороны лейкоцитарной формулы крови (рис. 3 и 4; табл. 1 и 2), центральных органов кроветворе-ния/иммунопоэза (костный мозг и тимус), тенденцией к возрастанию уровней клеток с повреждённым геномом (нормохроматофильные эритроциты с микроядрами [1]). Изменения практически тех же параметров отмечены и для облучённых мышей, однако их выраженность, как правило, превышает таковую для животных-«свидетелей». Следует подчеркнуть, что у мышей, подвергшихся радиационному воздействию, наблюдаемые изменения крови (резкое падение абсолютного количества лейкоцитов на 3-14-е сут, снижение относительного количества лимфоцитов на 7-е сут с последующим возрастанием этого показателя на 14-е сут по сравнению с контролем и т.д.) носят краткосрочный характер и закономерно нормализуются, как правило, к 30 сут после начала эксперимента.
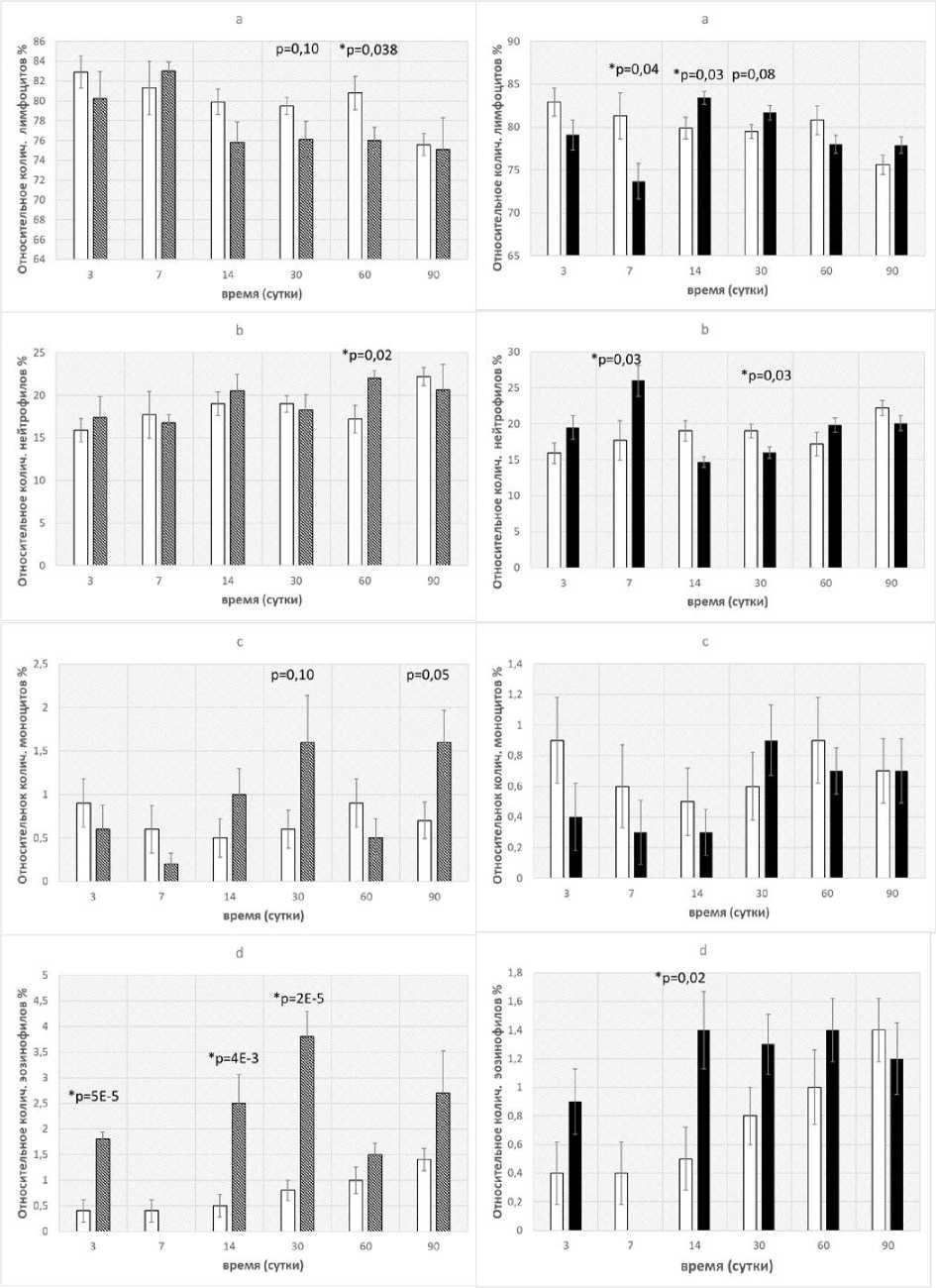
Рис. 3. Сравнение изменений лейкоцитарной формулы крови у мышей-«свидетелей» (слева), содержавшихся с облучёнными животными без перегородки, и облучённого контроля (справа). a) лимфоциты; b) нейтрофилы; c) моноциты; d) эозинофилы.
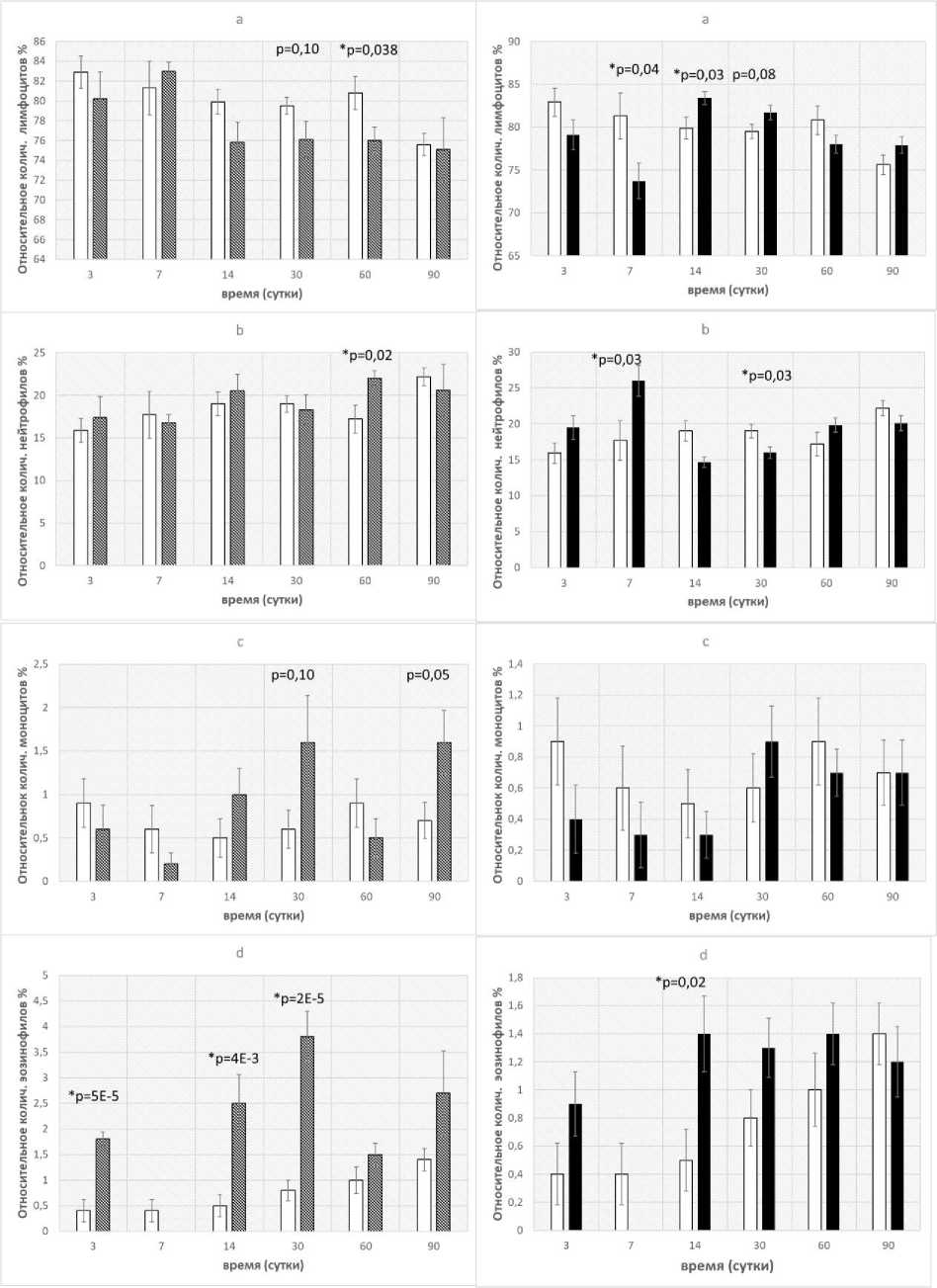
Рис. 4. Сравнение изменений лейкоцитарной формулы крови у мышей-«свидетелей» (слева), содержавшихся с облучёнными животными с перегородкой, и облучённого контроля (справа). a) лимфоциты; b) нейтрофилы; c) моноциты; d) эозинофилы.
На наш взгляд, можно выделить следующие особенности нарушений лейкоцитарной формулы крови (направленность эффекта, время его проявлений, клеточная популяция, для который он зарегистрирован) у необлучённых животных, находившихся в контакте с экспонированными особями:
-
1. Краткосрочные эффекты (3-14 сут после начала эксперимента) у мышей-«свидетелей» характеризовались значимым изменением какого-либо одного показателя, преимущественно относительного содержания в крови эозинофилов (при совместном содержании облучённых и не-облучённых животных в клетке как с перегородкой, так и без неё) и лимфоцитов в клетке с перегородкой.
-
2. Долгосрочные эффекты (30-90 сут) у необлучённых мышей-«свидетелей» в обоих вариантах эксперимента продемонстрировали выраженные изменения в лейкоцитарной формуле крови, т.е. в процентном соотношении лейкоцитов различных субпопуляций [13].
-
3. Как в ближайшие, так и в отдалённые сроки после начала эксперимента наблюдаемые эффекты у мышей-«свидетелей» характеризовались отсутствием постоянства проявлений на протяжении всего рассматриваемого временного периода. А именно: зарегистрированные в те или иные «экспериментальные точки» изменения в лейкоцитарной формуле крови сменялись периодами её нормализации. По-видимому, это связано с соотношением выраженности наблюдаемых изменений и восстановительных процессов, протекающих в кроветворной системе мы-шей-«свидетелей».
Итак, в представленной работе были получены статистически значимые результаты (или тенденция к ним), свидетельствующие об индукции «эффекта свидетеля» на межорганизменном уровне и регистрируемого у необлучённых мышей, содержащихся с облучёнными животными в клетках как без перегородки, так и с перегородкой. В этом исследовании проведён анализ «эффекта свидетеля» на всех уровнях кроветворной системы животного (мыши), что представляется новым подходом к выяснению некоторых механизмов, лежащих в основе понимания терминологии, связанной с рассматриваемым феноменом. Приведённые в работе данные констатируют радиационно-индуцированный «эффект свидетеля» в костномозговых клетках у необлучённых животных, содержащихся с облучёнными в одной клетке без перегородки (тактильный контакт), что является важнейшим результатом для дальнейшего понимания процесса кроветворения у неэкспонированных мышей-«свидетелей».
Отметим также, что выявленные изменения показателей ПК у необлучённых мышей («эффект свидетеля») различаются по времени их проявления в различных субстанциях (лимфоциты, нейтрофилы, моноциты, эозинофилы и эритроциты).
Все перечисленные ранее качественные и количественные показатели, свидетельствующие об изменениях в кроветворных органах животных и в популяции клеток ПК, указывают на реальность индукции «эффекта свидетеля» на межорганизменном уровне, при этом каждая субпопуляция лейкоцитов специфично демонстрирует данный феномен. Так, лимфоциты в определённые временные промежутки (3, 30, 60 и 90 сут) в том или другом варианте эксперимента демонстрируют индукцию «эффекта свидетеля» у необлучённых животных, помещённых в одну клетку с облучёнными мышами. Для моноцитов и нейтрофилов на 30-е и 90-е сут, а для эозинофилов – на 3-и, 14-е, 30-е и 90-е сут зарегистрированы проявления рассматриваемого феномена. Такого рода результаты возможны, т.к. каждая популяция клеток ПК выполняет свою регуляцию ряда физиологических процессов. Таким образом, вышеперечисленные морфофункциональные изменения в клеточном составе кроветворных органов и в популяции клеток ПК необлучённых мышей свидетельствуют об индукции «эффекта свидетеля» – «немишенного» пострадиационного феномена, реализующегося на межорганизменном уровне при контакте необлучённых и облучённых животных.
Результаты, полученные на эритроцитах в микроядерном тесте, свидетельствуют о нарушениях целостности ДНК клеток организма необлучённых мышей-«свидетелей». Все вышеперечисленные изменения у этих необлучённых животных являются результатом высвобождения химических или биологических медиаторов из области облучения, продуктов радиационно-индуцированного окислительного стресса. Наличие проявлений «эффекта свидетеля» по комплексу проанализированных показателей, включая клетки КМ и форменные элементы ПК, может служить доказательством распространённости и специфичности рассматриваемого явления. Несмотря на то, что механизмы «эффекта свидетеля» в полной мере не изучены, этот феномен ассоциирован с повреждением ДНК клеток необлучённых животных за счёт переноса выделяемых облучёнными особями специфических компонентов, таких как окисленная ДНК, микро РНК, образованные при действии радиации реактивные формы кислорода. В ответ на это лимфоциты, макрофаги и другие клеточные элементы выделяют противовоспалительные цитокины и другие белково-пептид-ные сигнальные молекулы, которые переносятся к необлучённым клеткам и через активацию МАRKs и Nf-kB вызывают экспрессию Соx-2, что в дальнейшем приводит к образованию реактивных форм азота NO, вызывая вторичное воздействие ионизирующего излучения [17].
По имеющимся литературным данным, полученным в результате исследований in vitro и in vivo , выделяются два пути передачи сигналов «эффекта свидетеля»: через щелевые контакты и путём секреции химических факторов во внеклеточную среду [18], причём второй путь переноса химических сигналов возможен в отдалённые ткани и органы, а также при межорганизменных взаимодействиях. Такой путь передачи факторов «эффекта свидетеля» может приводить к увеличению сестринского хроматидного обмена [19], изменениям уровня цитокинов, NO, ROS и других. После проведённого анализа полученных в настоящей работе результатов и при сравнении с литературными данными предполагается, что результаты исследования «эффекта свидетеля» возможно применить к выяснению результатов применения лучевой терапии онкологических больных. Предполагается, что облучённые клетки опухоли могут оказывать воздействие на необ-лучённые опухолевые клетки за счёт факторов «эффекта свидетеля», что предусматривает определённые перспективы увеличения эффективности проведения радиотерапии при снижении дозы радиотерапии на пациентов.
К сожалению, существует отрицательное влияние «эффекта свидетеля», которое заключается в нарушении жизнедеятельности клеток в прилегающей ткани: цитогенетических повреждениях, генетической нестабильности, изменением метаболизма клеток вплоть до того, что образо- вание свободных радикалов (как пример) может продолжаться в течении нескольких лет после воздействия радиотерапии и возникновения «эффекта свидетеля» [20]. Необходимо проведение большего количества клинических исследований по влиянию «эффекта свидетеля», при этом с формированием базы данных о пациентах. Очевидно, что исследования на межорганизменном уровне «эффекта свидетеля» впоследствии могут внести большой вклад в эффективность назначения и проведения радиотерапии, может позволить понять механизмы и причины возникновения «эффекта свидетеля» при заболеваниях, вызванных ионизирующим излучением, таких как радиационно-индуцированные болезни сердца, поражение нервной системы, заболевания кожи, заболевания глаз.
Работа выполнена рамках темы Государственного задания Минобрнауки России «Молекулярная и химическая физика биологических процессов», регистрационный номер 125012200614-6, регистрационный номер ПТНИ (заявки): 1024040100181-4. Частично работа выполнена в рамках подтемы Государственного задания Минобрнауки России «Разработка прогностической модели оценки индивидуальных рисков индукции отдалённых генетических и эпигенетических нарушений в организме человека, подвергшегося генотоксическому воздействию» (номер госрегистрации № 125091010190-9).


