Комплексное обеспечение биосовместимости материалов
Автор: Фетисов Геннадий Павлович, Гончарова Юлия Павловна, Монахова Мария Игоревна
Журнал: НБИ технологии @nbi-technologies
Рубрика: Технические инновации
Статья в выпуске: 5, 2011 года.
Бесплатный доступ
В статье рассматриваются проблемы биосовместимости материалов с позиции их структуры, технологии получения, методов финишной обработки деталей, улучшения биосовместимости известных материалов.
Биосовместимость, имплантаты, фазовый состав, ультразвуковая обработка, алмазная обработка, ионно-плазменное напыление
Короткий адрес: https://sciup.org/14968182
IDR: 14968182 | УДК: 539,577.1
Текст научной статьи Комплексное обеспечение биосовместимости материалов
Прогресс во многих областях современной медицины связан с появлением сложных технических устройств, разработкой новых технологий и материалов, однако на сегодняшний день остается актуальной и практически важной проблема улучшения медико-биологических свойств медицинских изделий. Имплантируемые на длительный срок медицинские изделия относятся к самому высокому классу потенциального риска, и требования к материалам, из которых они изготовлены, должны быть высокими и строго обоснованными.
Основные области применения имплантатов известны:
-
- травматология: спицы, пластины, шурупы, эндопротезы;
-
- искусственные сосуды, стенты, сердечные клапаны;
-
- вшитые под кожу приборы: кардиостимуляторы, диабетическая инсулиновая помпа;
-
- стоматологические протезы;
-
- офтальмология: искусственный хрусталик, искусственная сетчатка, микроскопическая пластинка, излучающая у -лучи при онкологических заболеваниях.
Круг применения имплантатов, несомненно, будет расширяться. Особенно благодаря усилиям биотехнологов, разработки которых направлены на уменьшение объема использования в эндопротезировании уже освоенных металлов и полимерных материалов. Таким образом, создано поле для реальной конкуренции между этими двумя направлениями.
Действительно, уже первые достижения биотехнологов впечатляют. Прежде всего, это имплантаты на основе так называемой «живой» ткани [1, с. 48].
Потребность в таком материале очень велика сегодня – только примерно 50 млн американцев обязаны жизнью органной терапии в той или иной ее форме, и каждый пятый (!) житель развитых стран старше 65 лет прибегает к данной процедуре.
Искусственные ткани обладают важным достоинством: они могут иметь разную форму – от простых агрегатов до объемных конструкций.
Заменители кожи, хрящей уже помогли тысячам пациентов. Проходят клинические испытания искусственный мочевой пузырь, роговица глаза, бронхиолы и кровеносные сосуды, функциональные лоскуты мышечной ткани сердца.
В США к концу 2008 г. было произведено различных продуктов тканевой инженерии приблизительно на 1,5 млн долларов. Понятно, что это только начало и к настоящему времени данная цифра существенно изменилась в сторону ее увеличения.
И все-таки несомненные, удивительные успехи биоинженерии не снимут в ближайшие годы проблему изготовления имплантатов из традиционных материалов – металлов, их спла- вов, полимеров. У биотехнологов на пути реализации их планов возникают очень сложные препятствия. В частности, необходимость воспроизвести не только точную биологическую характеристику оригинала, но и сложнейшую микроархитектуру биопротеза. Так, ткань печени должна обеспечивать ее функциональное назначение – отфильтровывать токсины.
При использовании в биоинженерии стволовых клеток выявились опасения относительно влияния некоторых их разновидностей на возникновение онкологических образований. Велика пока и сложность материалов «живых» тканей.
Все это не уменьшает актуальности исследования биосовместимости традиционных материалов. В зависимости от исследуемого материала, а также условий проведения эксперимента эти металлы ведут себя по-разному. Они могут накапливаться в различных органах, перераспределяться, приводить к образованию различного рода злокачественных образований, а также постепенно выводиться из организма. При решении вопроса о потенциальной опасности предполагаемых к применению в медицине материалов учитываются накопленные в токсикологии знания свойств элементов и химических соединений, их предельно допустимые концентрации в организме.
Мы исходили из того, что биосовместимость материалов – это не постоянное свойство. Возьмем пример с золотом. В прошлом оно считалось весьма биоинертным металлом. В древнем Египте, как указывают археологические исследования, использовались золотые пластинки – вставки для протезирования поврежденных костей черепа.
На наноуровне золото имеет прямо противоположное воздействие на организм человека. Так, по данным института гигиены Волгограда [2, с. 474], эксперимент на мышцах, инъецированных нанозолотом, показал, что в тканях печени возникают островки скопления частичек нанозо-лота, а значит, функция печени будет нарушена.
Известно, что основным путем повышения био- и гемосовместимости имплантатов является создание новых материалов. Второй путь является наиболее распространенным подходом к улучшению медико-технических свойств медицинских изделий, так как дает возможность целенаправленно изменять только физико-химические и биологические свойства поверхности.
В данной статье приведены сведения о некоторых технологиях, позволяющих изменить в лучшую сторону биологическую совместимость уже известных и апробированных материалов и подтверждающих положение о необходимости обеспечивать биосовместимость всеми возможными средствами, а не считать ее постоянной, неизменяющейся в силу конкретных условий, состояния материала и т. п.
В качестве первого примера рассматривается вопрос о повышении биосовместимости деталей имплантатов в хирургической травматологии (пластин, винтов, спиц, фиксаторов и т. п.).
В этой области в настоящее время большое внимание материаловедов, конструкторов, технологов и медиков привлекают к себе коррозионно-стойкие аустенитные хромазотистые безникелевые стали (21–24 % Cr; 1,2–1,3 % N), которые обладают в 2–3 раза большей прочностью при том же относительном удлинении по сравнению с широко применяемыми в медицине аустенитными хромоникелевыми (12Х18Н10Т) и хромоникельмолибденовыми (08Х17Н13МЗТ) сталями, а также превосходят по механическим свойствам некоторые титановые (ВТ-6, ВТ 1-00) и циркониевые (Н-1, Н-2,5) сплавы. Но, к сожалению, как аустенитные хромоникелевые стали (12Х18Н9Т), которые допущены для широкого применения в остеосинтезе – оперативном лечении переломов (ОСТ 64-1-152-80 «Элементы соединения костей»), так и предлагаемые для широкого применения аустенитные хромазотистые стали не обладают желаемой биоинертностью. Например, согласно литературным данным, при использовании спиц для остеосинтеза из стали 12Х18Н9Т у 7,8 % больных возникает воспаление, обусловленное недостаточной биоинертностью материала спиц, что связывают с высоким содержанием в стали никеля. Это и предопределяет большую перспективность использования хромазотистой без-никелевой стали как материала для имплантатов. С другой стороны, в эндопротезировании применялись и применяются металлы, которые имеют хорошую биоинертность. Это тантал, ниобий, цирконий, титан и их соединения, сплавы на основе кобальта (ситаллы, комохромы) и другие. Недостатками этих материалов являются их весьма высокая стоимость и не всегда оптимальные механические свойства.
Поэтому весьма перспективным способом дальнейшего повышения биоинертности имплантатов из титана является формирование на их поверхности многофункциональных защитных покрытий из перечисленных выше металлов и сплавов (в частности, циркония, ниобия и их соединений). Работа выполнялась совместно МАИ, ИМЕТ РАН, ЦИТО.
Подробности технологии нанесения покрытия для данной статьи несущественны. Приведем только основное: метод нанесения – ионноплазменный; материал катодов: титан ВТ1-00 (чистота 99,9 %), цирконий (чистота 99,9 %), ниобий (чистота 99,9 %); подложки из хромазотистой стали: Х24Al (Cr– 24 %; N – 1,2 %), X21Al (Cr – 21 %; N – 1,3 %); очистка ионами аргона; для функционирования нитридов использован азот, оксикарбидов – углекислый газ.
Исследования включили в себя полный объем определения структуры покрытия, фазового состава, его механических свойств и исследования биосовместимости при длительных испытаниях (до 100 суток) на живых организмах (крысах).
Рентгеноструктурное исследование поверхности образцов хромазотистой стали с покрытиями и без них показало, что хромазотистая сталь после закалки и отпуска состоит из аустенита ( γ -фаза). После биоиспытаний структура стали без покрытия практически не изменилась, период решетки γ -фазы остался прежним, однако на некоторых диф-рактограммах появилась слабая линия (возможно, α -фаза).
Образцы стали с циркониевым покрытием содержат после биоиспытаний в поверхностном слое α -Zr с ГПУ-структурой и сильной текстурой типа (100), а также фазу γ -Fe (с ГЦК-решет-кой). Есть вероятность присутствия следов α -Fe и ZrC. При этом α -Zr формирует достаточно тонкую пленку (толщиной до 4 мкм), «прозрачную» для рентгеновских лучей. Нитрид циркония формируется в виде тонкой пленки (1 мкм) с чрезвычайно дисперсной субструктурой.
Хромазотистая сталь, напыленная ниобием, содержит покрытие из Nb (с ОЦК-ре-шеткой), характеризующееся сильной текстурой (110) и дисперсностью блоков. Образцы, напыленные ниобием в атмосфере азота, содержат покрытие из NbN с кубической структурой типа В1 и чрезвычайно дисперсной субструктурой: размер блоков 40–60 Е.
Оксикарбиды циркония и ниобия представляют собой наноструктурные «рентгеноаморфные» покрытия типа ZrC x O y и NbC x O y соответственно (табл. 1).
Материал покрытия характеризуется большими остаточными микронапряжениями. Толщина покрытия 1–4 мкм. Для уточнения состава этих покрытий был использован метод ОЖЕ-спектроскопии. По данным количественного анализа, покрытие на основе ZrC x O y содержит 40 % Zr, 24 % С и 36 % О (ат.%), что соответствует стехиометрическому составу оксикарбида типа ZrO2Zr0,91C. Покрытие на основе NbC x O y содержит 42 % Nb, 34 % С и 24 % О (ат.%), что соответствует стехиометрическому составу оксикарбида типа Nb2O5Nb0,95C.
Фазовый состав покрытий образцов хромазотистой стали
Таблица 1
|
Условное обозначение |
Характеристика имплантата |
Фазовый состав |
Толщина, мкм |
|
Эталон 1* |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Без покрытия. До испытаний |
г |
– |
|
Без покрытия |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Без покрытия. После испытаний |
г + (б) |
– |
|
Эталон 2* |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С. Без покрытия. До испытаний |
г |
– |
|
Без покрытия |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С. Без покрытия. После испытаний |
г + б (следы) |
– |
|
Zr |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Катод Zr. Среда формирования покрытия – вакуум, продолжительность – 10 мин |
Покрытие б –Zr (с текстурой) + ZrC |
4 |
Окончание таблицы 1
|
Условное обозначение |
Характеристика имплантата |
Фазовый состав |
Толщина, мкм |
|
Zr |
Хромазотистая сталь (21 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С. Катод Zr. Среда формирования покрытия – вакуум, продолжительность – 20 мин |
Подложка г -Fe + б-Fe |
– |
|
ZrN |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С. Катод Zr. Среда формирования покрытия – N 2 , продолжительность – 11 мин |
Покрытие ZrN, подложка г-Fe |
0,8–1,0 |
|
ZrC x O у |
Хромазотистая сталь (24 % Cr; 1,2 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Катод Zr. Среда формирования покрытия – СО 2 , продолжительность – 11 мин |
«Рентгеноаморфное» покрытие (РАМ-фаза), подложка г-Fe + б-Fe |
– |
|
Nb |
Хромазотистая сталь (21 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Катод Nb. Среда формирования покрытия – вакуум, продолжительность – 20 мин |
Покрытие Nb (ОЦК) с текстурой (110), подложка г-Fe + б-Fe (следы) |
– |
|
Nb |
Хромазотистая сталь (21 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С. Катод Nb. Среда формирования покрытия – вакуум, продолжительность – 20 мин |
– |
– |
|
NbN |
Хромазотистая сталь (21 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Катод Nb. Среда формирования покрытия – N 2 , продолжительность – 10 мин |
Подложка г-Fe + б-Fe |
– |
|
NbN |
Хромазотистая сталь (21 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С. Катод Nb. Среда формирования покрытия – N 2 , продолжительность – 10 мин |
Покрытие NbN (с кубической дисперсной структурой типа В1) |
1,5 |
|
NbC x O y |
Хромазотистая сталь (2 1 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С, отпуск 400 °С. Катод Nb. Среда формирования покрытия – СО 2 , продолжительность – 10,5 мин |
«Рентгеноаморфное» покрытие (РАМ-фаза) + подложка г-Fe |
1,4–2,8 |
|
NbC x O y |
Хромазотистая сталь (21 % Cr; 1,3 % N). Термообработка – закалка 1 200 °С. Катод Nb. Среда формирования покрытия – СО 2 , продолжительность – 10,5 мин |
– |
– |
Оценка биоактивности (табл. 2) осуществлялась по 11 основным морфологическим признакам тканевой реакции на имплантацию, выраженность которых оценивалась по 5-балльной системе: 0 – отсутствие признака; 1 – признак слабо выражен; 2 – умеренно выражен; 3 – сильно выражен; 4 – максимально выражен. Сумма баллов признаков 1–9 является индексом биоактивности материала по его тканевой реакции. Чем меньше этот индекс, тем больше биоинертность материала. У животных, выведенных из опыта через три месяца после имплантации, гистологическому (микроструктурному) изучению подвергались также внутренние органы: печень, почки, селезенка.
Исследование показало, что по степени биологической инертности все образцы хромазотистых сталей с покрытиями распределяются следующим образом: наивысшей инертностью обладают образцы с покрытиями на основе циркония (рис. 1), его нитридов и оксикарбидов; далее (табл. 3) следуют образцы стали с покрытиями на основе ниобия, напыленными в вакууме и азоте; затем образцы, напыленные титаном, ниобием в углекислом газе; и, наконец, образцы хромазотистой стали без покрытия.
Интересно отметить, что биосовместимость титана (9,5), материала широко применяемого для эндопротезирования, лучше, чем у стали (16,8). Но за счет технологических мер (в данном случае нанесения подобранного нами покрытия) его биосовмес-тимсть повысилась (балльная оценка снизилась до 3). А это значит, что в 3 раза снижается вероятность различного рода осложнений при имплантации.
Изучалось и влияние технологии механической обработки на биосовместимость, которая, как известно, определяется и состоянием поверхности. Весьма часто от имплантата требуется минимальная шероховатость его поверхности. В противном случае может нарушаться структура крови, увеличивается вероятность образования тромбов.
Таблица 2
Основные критерии балльной оценки биоактивности имплантатов
|
Признак |
Характеристика признака |
|
1. Нейтрофильная инфильтрация |
Нейтрофил – белая кровяная клетка, захватывающая бактерии и играющая защитную роль. Инфильтрация – это процесс перехода нейтрофилов из сосудов в ткань при воспалении |
|
2. Макрофаги на границе имплантата |
Макрофаг – крупная тканевая клетка, захватывающая инородные вещества и играющая защитную роль в иммунитете |
|
3. Макрофаги в капсуле |
В зрелых капсулах их не должно быть, в менее зрелых они присутствуют |
|
4. Включения пигментов в макрофагах |
Включение железа (по биологическому опыту) в основном осуществляется из ге-моседерина |
|
5. Гигантские клетки |
Крупные многоядерные тканевые клетки, возникающие при слиянии макрофагов в случае невозможности полного удаления инородного вещества (в том числе имплантата) |
|
6. Лимфоцитарная инфильтрация |
Лимфоциты – мелкие белые кровяные клетки, проникающие при воспалении из сосудов в ткань и играющие важнейшую роль в иммунитете |
|
7. Плазматические клетки |
Индикаторы иммунных процессов, в них вырабатываются антитела |
|
8. Дистрофия фибробластов |
Фибробласты – клетки, вырабатывающие коллаген. Дистрофия фибробластов – это процесс разрушения внутриклеточных структур, возникающий ближе к металлу во внутреннем слое капсулы |
|
9. Дистрофия коллагеновых волокон |
Коллагеновые волокна состоят из белка – коллагена и обеспечивают прочность соединительной ткани. Дистрофия коллагеновых волокон – частичное разрушение внутриволоконннных структур |
|
10. Плотность фибробластов |
Это плотность расположения фибробластов на единицу площади. Чем более стабильная (зрелая) соединительная ткань, тем меньше плотность фибробластов и выше плотность коллагеновых волокон, и наоборот |
|
11. Плотность коллагеновых волокон |
Это плотность их расположения на единицу площади ткани |
а
б
Рис. 1. Толщины капсул, сформированных за 30 суток вокруг имлантатов из хромазотистой стали без покрытия ( а ) и с циркониевым покрытием ( б). х 200
Нами рассматривалась технология финишной механической обработки материалов, в том числе углеродных, алмазным инструментом с наложением ультразвука при изменении параметров технологического процес- са. В данном случае за критерий состояния биосовместимости принимали величину шероховатости поверхности образцов. Некоторые результаты экспериментов приведены на рисунках 2–6.
Таблица 3
Балльная оценка тканевой реакции на имплантацию в течение 100 суток образцов хромазотистой стали с покрытиями на основе Zr, Nb и Ti
|
Признаки |
Сталь без покрытия |
Покрытие |
||||||
|
Zr |
ZrN |
ZrC x O y |
Nb |
NbN |
NbC x O y |
Ti |
||
|
1. Нейтрофильная инфильтрация |
1,8 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
|
2. Макрофаги на границе имплантата |
2,3 |
1 |
2 |
1 |
1 |
1 |
1 |
2,0 |
|
3. Макрофаги в капсуле |
2,5 |
0,5 |
1 |
1 |
1 |
1 |
2 |
1,0 |
|
4. Включения пигментов в макрофагах |
2 |
0,5 |
1 |
0 |
0,5 |
0,5 |
1 |
1,0 |
|
5. Гигантские клетки |
1,5 |
0 |
0 |
0 |
0 |
0 |
1 |
1,0 |
|
6. Лимфоцитарная инфильтрация |
2 |
0 |
1 |
1 |
1 |
1 |
2 |
1,0 |
|
7. Плазматические клетки |
1,2 |
0 |
0 |
0 |
0 |
0 |
1 |
1,0 |
|
8. Дистрофия фибробластов |
1,7 |
1 |
0 |
0 |
1,5 |
0,5 |
2 |
1,5 |
|
9. Дистрофия волокон соединительной ткани |
1,8 |
1 |
0 |
0 |
0 |
0 |
1,5 |
1,0 |
|
10. Плотность фибробластов |
2,7 |
4 |
2 |
2 |
2 |
2 |
3 |
3,5 |
|
11. Плотность волокон соединительной ткани |
2 |
1 |
4 |
4 |
4 |
4 |
3 |
1,0 |
|
Толщина капсулы (мкм) |
87,4 |
27,7 |
26,2 |
21,7 |
52 |
53,4 |
72,5 |
50,4 |
|
Инденкс биоактивности (по № 1–9) |
16,8 |
4 |
5 |
3 |
6 |
4 |
12,5 |
9,5 |
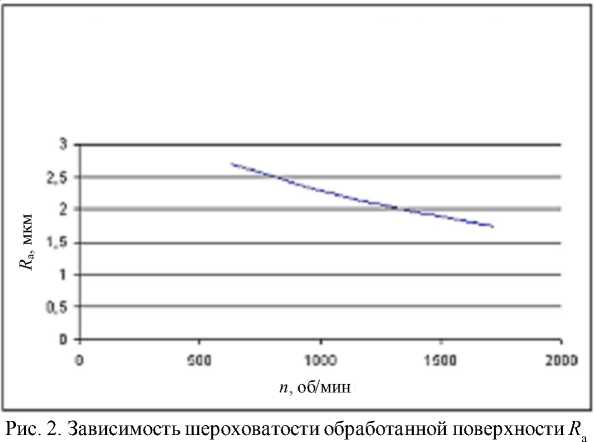
при ультразвуковом алмазном сверлении глубоких отверстий от частоты вращения трубчатого инструмента n
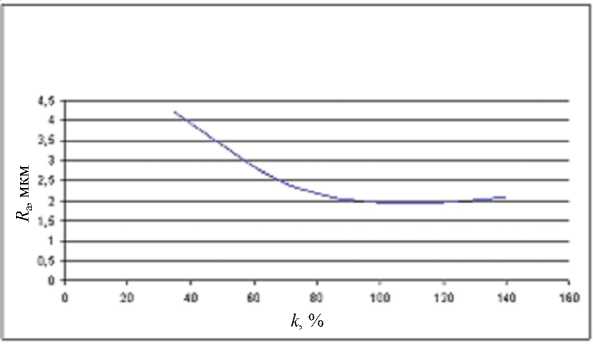
Рис. 3. Зависимость шероховатости обработанной поверхности R а при ультразвуковом сверлении от концентрации алмазов k
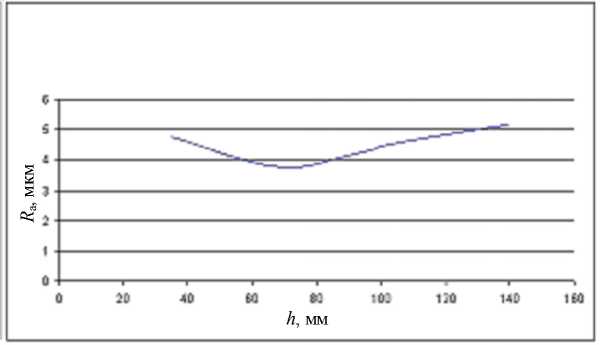
Рис. 4. Зависимость шероховатости обработанной поверхности R а при ультразвуковом сверлении от глубины обработки h
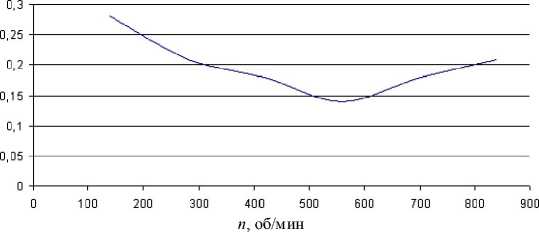
Рис. 5. Зависимость шероховатости обработанной поверхности R а при ультразвуковой доводке от частоты вращения инструмента n . 40/28, Р ст = 300 г, А = 12 мкм, S = 0,15 мм/об
|
0,4 - 0,35 - 2 0,3 - 1 0,25- ^ 0,2 0,15 - 0.1 - 0,05 - |
|
|
50 100 150 200 250 300 Р ст, г |
|
Рис. 6. Зависимость шероховатости обработанной поверхности Rа при ультразвуковой доводке от статической нагрузки Рст 160/125, n = 600 об/мин, S = 0,01 мм/об, А = 10 мкм и перспективы развития в условиях Волгоградс- техн. конф., г. Волгоград, 17–18 дек. 2009 г. – Вол-кой области : сб. материалов 2-й Всерос. науч.- гоград : Изд-во ВолГУ, 2009. – С. 474–475.
COMPLEX MAINTENANCE OF BIOCOMPATIBILITY
G.P. Fetisov, Yu.P. Goncharova, M.I. Monakhova
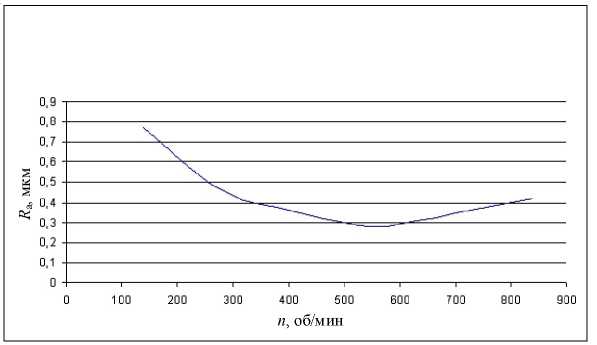
Рис. 5а. Зависимость шероховатости обработанной поверхности R а при ультразвуковой доводке от частоты вращения инструмента n . 160/125, Р ст = 200 г, А = 10 мкм, S = 0,05 мм/об
Во всех исследуемых вариантах чистота поверхности существенно повышалась при наложении ультразвуковых колебаний на рабочий инструмент. Особенно это важно при обработке материалов на основе углерода, углеплас-тов, применяемых в ряде эндопротезов.
И еще одно соображение по комплексной оценке биосовместимости – нельзя при ее оценке не учитывать условия, при которых осуществлялась постановка имплантата. Проблема в данном случае заключается не только в соблюдении стерильности (предупреждения от попадания опасных микроорганизмов), но и в отсутствии частиц в атмосфере, способных изменить биосовместимость в худшую сторону. В ряде случаев такая проблема решается с помощью создания так называемых «чистых комнат». На основе анализа этого вопроса на нашей ка-
федре в 2010 г. специально был выполнен дипломный проект.
Естественно, биосовместимость материалов определяется и характером культуры производства, соблюдением всех требований к составу материала, его чистоте и т. п.
Такой многофакторный подход должен лежать в основе выбора материала имплантата, а также стремления повысить его биосовместимость, сохранить ее в процессе постановки имплантата.
Список литературы Комплексное обеспечение биосовместимости материалов
- В мире науки. -2009. -№ 7.
- Филатов, Б. Н. Гигиенические и токсикологические проблемы производства и применения нанопродуктов/Б. Н. Филатов//Нанотехнологии и наноматериалы: современное состояние и перспективы развития в условиях Волгоградской области: сб. материалов 2-й Всерос. науч.-техн. конф., г. Волгоград, 17-18 дек. 2009 г. -Волгоград: Изд-во ВолГУ, 2009. -С. 474-475.


