Комплексное воздействие низкоинтенсивного лазерного излучения и пептидного ингибитора калиевых каналов на выживаемость клеток меланомы
Автор: Погодина Евгения Сергеевна, Расторгуева Евгения Владимировна, Юрова Елена Валерьевна, Белобородов Евгений Алексеевич, Сугак Дмитрий Евгеньевич, Саенко Юрий Владимирович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2022 года.
Бесплатный доступ
Меланома отличается агрессивным течением и наличием большого количества метастазов уже во время установления диагноза. Для ее лечения применяют фотодинамическую терапию (ФДТ). Однако скопление фотосенсибилизаторов отмечается не только в злокачественной опухоли, но и в органах с высоким уровнем метаболической активности. Недостатки методов терапии меланомы возможно устранить, используя комплексное воздействие лазерного излучения и местного применения ингибиторов клеточных процессов. Цель исследования. Изучить воздействие низкоинтенсивного лазерного излучения и биотоксина Kappa-theraphotoxin-Gr1b (Kappa-TRTX-Grlb) на выживаемость опухолевых клеток меланомы A875. ' Материалы и методы. Клетки меланомы А875 подвергали воздействию токсина Kappa-TRTX-Gr1b и лазерному облучению. Изучался уровень апоптоза, некроза в клетках с использованием методов флуоресцентной микроскопии. Для оценки цитотоксического ответа клеток меланомы А875 использовали систему xCELLigence. Результаты. Максимальное количество апоптотических и некротических клеток отмечено в группе, где использовали комбинацию токсина Kappa-TRTX-Grlb с последующим воздействием лазерного излучения с длиной волны 1265 нм на опухолевые клетки А875. Это обусловлено ингибированием калиевых каналов внутриклеточных мембран клеток пептидом Kappa-TRTX-Grlb, которые связаны с реализацией процесса апоптоза. Выводы. Селективное ингибирование калиевых каналов при патологических процессах можно расценить как значимое дополнение к комплексной терапии поверхностных злокачественных новообразований. Совместное применение токсина и облучения позволит потенцировать действие друг друга и избежать основных недостатков, которые связаны с применением ФДТ. Такой подход сохранит все преимущества, которые обусловлены местным применением и точным воздействием на злокачественную опухоль.
Апоптоз, некроз, лазерное излучение, ингибитор калиевых каналов
Короткий адрес: https://sciup.org/14123686
IDR: 14123686 | УДК: 616.5-006.81-085:615.849.19:577.17
Текст научной статьи Комплексное воздействие низкоинтенсивного лазерного излучения и пептидного ингибитора калиевых каналов на выживаемость клеток меланомы
Введение. Меланома характеризуется агрессивным течением и наличием большого количества метастазов уже на момент установления диагноза. В большинстве случаев для лечения рака кожи различных локализаций и на любых стадиях используют фотодинамическую терапию (ФДТ). ФДТ вызывает накопление фотосенсибилизаторов в злокачественной опухоли. Однако их значимое количество также отмечается в коже, слизистых оболочках и органах с высоким уровнем метаболической активности [1]. В связи с этим появляется необходимость в разработке новых методов, которые позволят избежать систем- ного действия фотосенсибилизаторов, ведущего к тяжелым побочным эффектам.
Недостатки методов терапии меланомы возможно устранить, используя комплексное воздействие лазерного излучения и местного применения ингибиторов клеточных процессов. Лазерное излучение оказывает влияние на процессы окислительного фосфорилирования в митохондриях, индукции внутриклеточного окислительного стресса и увеличения синтеза АТФ. Установлено, что лазерное облучение с длиной волны 1260–1270 нм увеличивает концентрацию активных форм кислорода (АФК), которые играют ключевую роль в запуске апоптоза опухолевых клеток [2, 3]. В свою очередь в процессе клеточной гибели существенную роль играют ионные (Ca2+, Na+, Cl-, К+) каналы, регулирующие пролиферацию клеток. Наиболее значимыми для развития меланомы являются калиевые каналы, которые принимают активное участие в ангиогенезе и метастазировании опухоли [4]. Поэтому их ингибирование коррелирует с дефицитом питательных веществ и кислорода, поставляемых к опухолевым клеткам, что приводит к деградации последних. Кроме того, калиевые каналы контролируют гомеостатические параметры, к которым относится внутриклеточная концентрация ионов, pH в цитозоле клеток и их объем [5]. Для подавления течения физиологических и физико-химических процессов с участием калиевых каналов клеток меланомы появилась возможность использовать таргетные лекарственные препараты с последовательностью природных пептидов – токсинов членистоногих. В настоящее время именно они являются перспективным и многообещающим средством в терапии многих заболеваний, в число которых входят и онкологические [6].
Селективное ингибирование калиевых каналов при патологических процессах можно расценить как важное дополнение к комплексной терапии поверхностных злокачественных новообразований. Совместное использование токсина и облучения лазером позволит потенцировать их действие и избежать основных недостатков, сопряженных с применением ФДТ. Кроме того, такой подход сохраняет все преимущества, связанные с местным применением и точным воздействием на злокачественную опухоль.
Цель исследования. Изучить воздействие низкоинтенсивного лазерного излучения (НИЛИ) и биотоксина Kappa-theraphotoxin-Gr1b (Kappa-TRTX-Gr1b) на выживаемость опухолевых клеток меланомы A875.
Материалы и методы. В экспериментах использовали клеточную линию меланомы человека A875 (RRID:CVCL_4733). Культивирование клеток проходило в СO2-инкубаторе МСО-18AIC СО2 (Helicon, Япония), в котором поддерживалась температура 37 °С, концентрация СО2 5 % и влажность 98 %. Для клеток использовали среду RPMI-1640 с L-глутами- ном («ПанЭко», Россия) с 10 % эмбриональной бычьей сывороткой (Biosera, Франция) и 5 мкг/мл гентамицина («ПанЭко», Россия). За сутки до проведения эксперимента клетки сеяли в 8-луночные слайд-флаконы (SPL Lifesciences, Южная Корея) в концентрации 4·104 на ячейку. Облучение клеток меланомы производили в логарифмической фазе роста в камере настольного инкубатора UNO H501-T (Okolab, Италия). Клетки подвергали воздействию лазерного излучения (лазер Yenista optics osics) с длиной волны 1265 нм в течение 30 мин. Мощность дозы составляла 4,2 мВт при фокусном расстоянии 1,5 см. Высота водяного столба над клетками составляла 0,5 мм.
Наличие апоптоза и некроза определяли с использованием флуоресцентного красителя YO-PRO (Thermo Fisher Scientific, США). Результат окрашивания оценивали с помощью инвертированного микроскопа Nikon Ti-S (Nikon, Япония) и ПК с программой Nikon NIS-elements 4.0. Обработку полученных изображений осуществляли в компьютерной программе ImageJ (Национальный институт здоровья, США). Скорректированную интегральную флуоресценцию клетки (СИФК) вычисляли по формуле СИФК (CTFC) = интегральная плотность – (площадь выделенной клетки × фоновое значение флуоресценции) [7].
Математическое моделирование пептида осуществляли с использованием электронного ресурса PatchDock [8]. Аминокислотные последовательности биотоксина отбирали с помощью открытой базы данных UniProt [9]. Синтез пептида выполняли на автоматическом пептидном синтезаторе ResPep SL (Intavis, Германия) на основе твердофазного синтеза с использованием защитной Fmoc-группы на смоле TentaGel в соответствии со стандартным протоколом производителя. Очистку и анализ последовательностей производили методом ВЖЭХ на хроматографе NGC Quest™ 10 Chromatography System (Bio-Rad, США). Масс-спектрометрический анализ осуществляли на программно-аппаратном комплексе MALDI-TOF MS серии FLEX (Bruker, США).
Для оценки цитотоксического ответа клеток меланомы А875 использовали E-планшеты системы xCELLigence. Биотоксин Kap-pa-theraphotoxin-Gr1b и менадион, который использовали в качестве положительного контроля [10], добавляли после 25 ч с момента пассажа клеток. Нормализованный клеточный индекс вычисляли по формуле NCIti= =CIti/CInml_time, где CIti – клеточный индекс в реальном времени, CInml_time – клеточный индекс в момент нормализации времени. Нормализованный клеточный индекс во время точки нормализации равен единице [11].
Результаты. Чистота раствора синтезированного пептида Kappa-TRTX-Gr1b показана на хроматограмме (рис. 1). Наличие в растворе нежелательных примесей указывает на необходимость его очистки. Как правило, она проводится, если хроматографический анализ показал, что чистота пептида составила менее 95 %.
На рис. 1 показано, что чистота пептида Kappa-TRTX-Gr1b равна 95,7 %. Очистка исследуемого пептида не проводилась. Кроме того, анализ пиков хроматограммы биотоксина Kappa-TRTX-Gr1b (табл. 1), в котором учитывались данные их параметров (площадь, высота, процентное соотношение площадей), также говорит об отсутствии необходимости очистки.
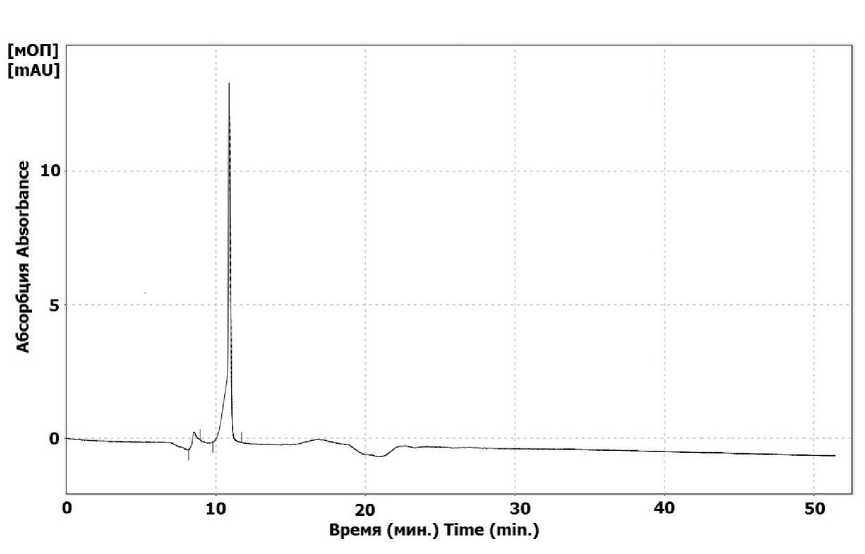
Рис. 1. Хроматограмма синтезированного токсина Kappa-TRTX-Gr1b
Fig. 1. Synthesized toxin Kappa-TRTX-Gr1b chromatogram
Таблица 1
Table 1
Параметры пиков токсина Kappa-TRTX-Gr1b
Kappa-TRTX-Gr1b toxin peak parameters
|
№ |
Время уд. (мин) Retention time (min.) |
Момент начала (мин) Beginning (min.) |
Момент завершения (мин) Ending (min.) |
Площадь (мОП с) Area (mAU sec.) |
Высота (mОП) Height (mAU sec.) |
Площадь (%) Area (%) |
|
11 |
8,538 |
8,183 |
8,957 |
8,643 |
0,490 |
4,3 |
|
22 |
10,887 |
9800 |
11,727 |
190,512 |
13,468 |
95,7 |
|
Суммарное значение Total value |
199,155 |
13,958 |
100 |
Масс-спектрограмма синтезированного токсина Kappa-TRTX-Gr1b представлена на рис. 2. Показано, что молекулярная масса ис-след уемого пептида меньше теоретической массы на 6 DA.
Такая разница в массе указывает на правильную конформацию пептида, которая заключается в образовании трех дисульфидных мостиков. Таким образом, данные, полученные при анализе синтезированного токсина Kappa-TRTX-Gr1b, подтверждают его высокий уровень стабильности и чистоты.
Цитотоксический ответ клеток A875 после воздействия на них биотоксина Kappa-TRTX-Gr1b и менадиона представлен на рис. 3.
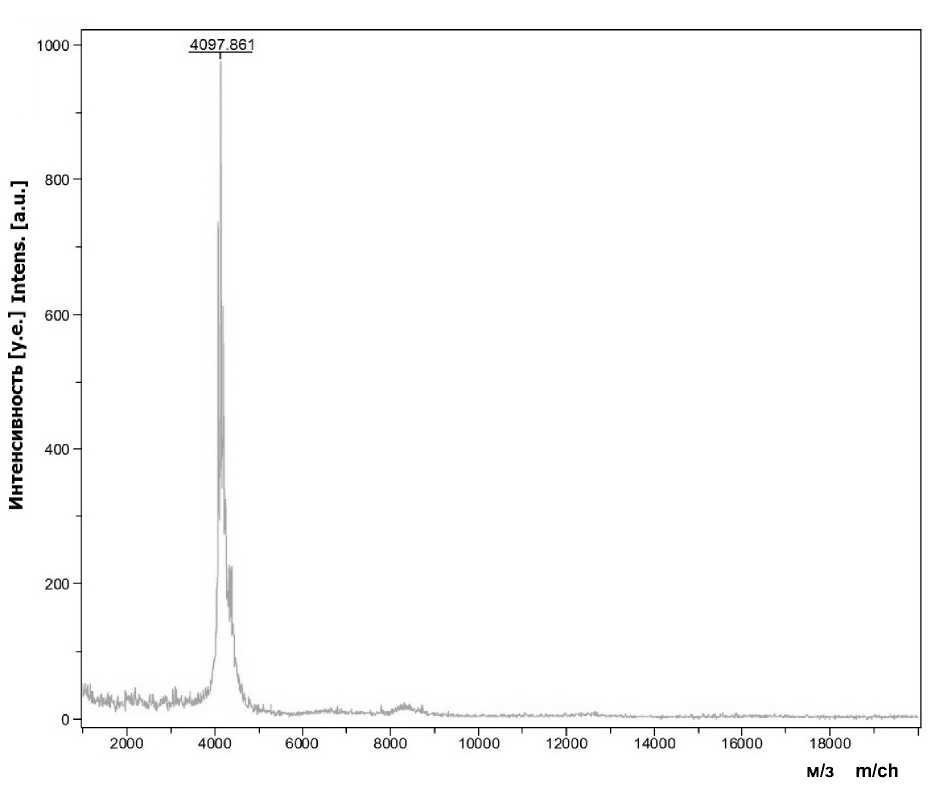
Рис. 2. Масс-спектрограмма биотоксина Kappa-theraphotoxin-Gr1b (м/з – отношение массы к заряду; интенсивность – интенсивность сигнала ионов)
Fig. 2. Mass spectrogram of Kappa-theraphotoxin-Gr1b biotoxin (m/ch – mass-to-charge ratio; intensity – ion signal intensity)
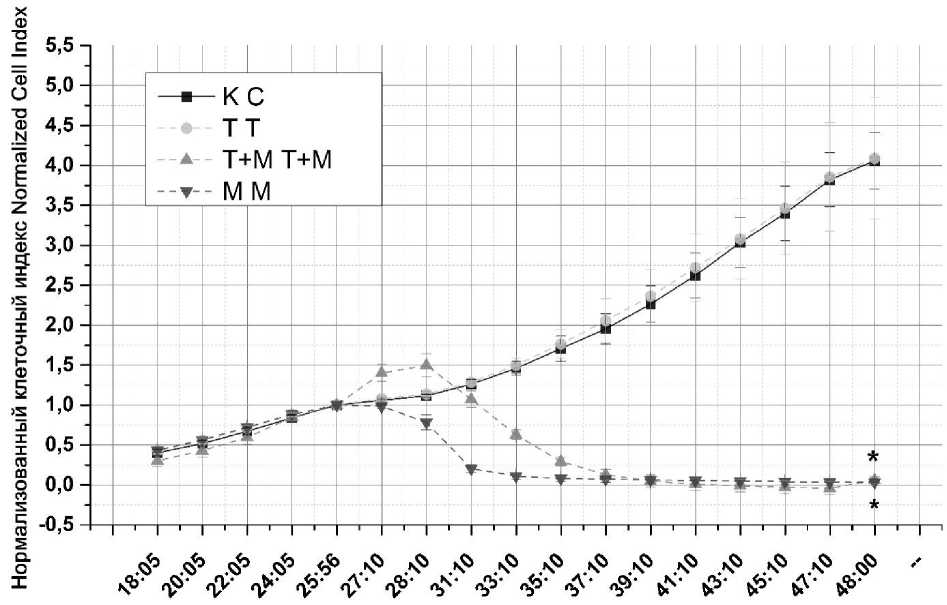
Время ( ч.) Time ( h.)
Рис. 3. Цитотоксический ответ клеток меланомы А875 на воздействие токсина Kappa-TRTX-Gr1b и менадиона (К – контрольная группа; Т – токсин Kappa-TRTX-Gr1b; Т+М – комплекс токсина Kappa-TRTX-Gr1b и менадиона; М – менадион, * – достоверное отличие между экспериментом и контролем (p<0,05))
Fig. 3. Cytotoxic response of A875 melanoma cells to Kappa-TRTX-Gr1b toxin and menadione
(C – control group; T – Kappa-TRTX-Gr1b toxin; T+M – complex of Kappa-TRTX-Gr1b toxin and menadione; M – menadione, * – the difference is significant between experiment and control groups (p<0.05))
В ходе эксперимента отмечено, что комплексное воздействие токсина Kappa-TRTX-Gr1b и менадиона на клетки А875 провоцирует рост, а через 3 ч инкубации спад нормализованного клеточного индекса. Полученные данные говорят о том, что данный комплекс вызывает гибель клеток путем некроза, так как рост нормализованного клеточного индекса (НКИ) свидетельствует об увеличении объема клеток. Инкубация с одним менадионом уменьшала объем клеток и вызывала снижение НКИ. Следовательно, клеточная гибель была реализована путем апоптоза. Значимых различий между клетками контрольной группы и клетками, к которым добавлен токсин Kappa-TRTX-Gr1b, не обнаружено. Таким образом, воздействие токсина Kappa-TRTX-Gr1b на опухолевые клетки, которое запускает процесс клеточной гибели, можно усилить, ис- пользуя дополнительные стимулы. В качестве таких стимулов для опухолевых клеток меланомы целесообразнее применять лазерное излучение.
Оценка апоптоза в культуре клеток меланомы человека A875 после воздействия на них токсина Kappa-TRTX-Gr1b и лазерного излучения показана на рис. 4.
При применении лазерного излучения с длиной волны 1265 нм наибольшее количество клеток с признаками апоптоза отмечено в группах Т/Л, Л и Т (рис. 4). В группе, в которой клетки сначала облучены лазером, а затем проинкубированы с токсином Kappa-TRTX-Gr1b, отмечен низкий уровень апоптоза.
Оценка некроза в культуре клеток меланомы человека A875 после воздействия на них токсина Kappa-TRTX-Gr1b и лазерного излучения показана на рис. 5.
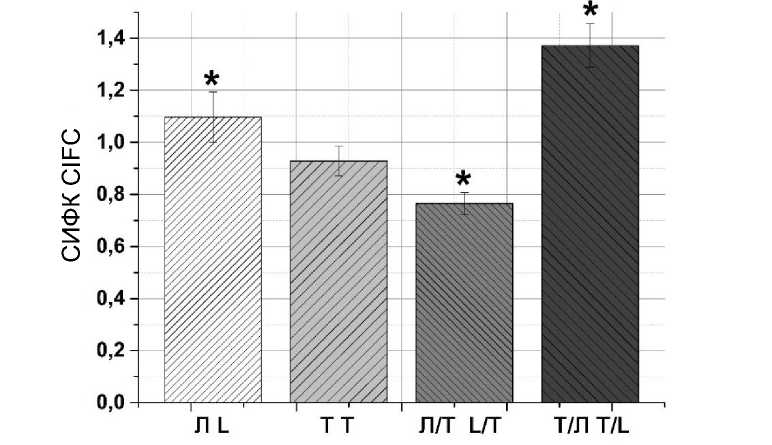
Рис. 4. Оценка апоптоза в культуре клеток меланомы человека A875 после воздействия токсина Kappa-TRTX-Gr1b и лазерного излучения с длиной волны 1265 нм
(Л (лазер) – клетки, которые облучены лазером, Т (токсин) – клетки, которые подвергались воздействию токсина Kappa-TRTX-Gr1b, Л/Т (лазер/токсин) – клетки, которые облучены лазером, а затем инкубировались с токсином Kappa-TRTX-Gr1b, Т/Л (токсин/лазер) – клетки, которые подвергались воздействию токсина Kappa-TRTX-Gr1b, а затем облучению лазером; СИФК – отношение значения скорректированной интегральной флуоресценции эксперимента к контролю, * – достоверное отличие между экспериментом и контролем (p<0,05). На рис. 5 обозначения те же)
Fig. 4. Evaluation of apoptosis in A875 human melanoma cell culture after exposure to Kappa-TRTX-Gr1b toxin and 1265 nm laser radiation
(L (laser) – laser-irradiated cells, T (toxin) – Kappa-TRTX-Gr1b toxin-exposed cells,
L/T (laser / toxin) – cells initially irradiated with laser and then incubated with Kappa-toxin TRTX-Gr1b, T/L (toxin/laser) – cells exposed to Kappa-TRTX-Gr1b toxin and then laser irradiation;
CIFС – ratio of corrected integral fluorescence (in the experiment) to the control, * – the difference is significant between experiment and the control groups (p<0.05). In Fig. 5 designations are the same)
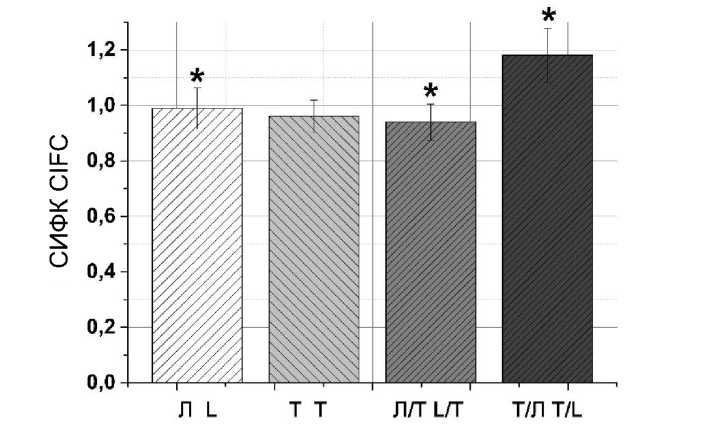
Рис. 5. Оценка некроза в культуре клеток меланомы человека A875
после воздействия токсина Kappa-TRTX-Gr1b и лазерного излучения с длиной волны 1265 нм
Fig. 5. Evaluation of necrosis in A875 human melanoma cell culture after Kappa-TRTX-Gr1b toxin exposure and laser radiation (wavelength 1265 nm)
Максимальное количество клеток с признаками некроза выявлено в группе, в которой клетки подвергались воздействию токсина Kappa-TRTX-Gr1b, а затем лазерного излучения (рис. 5). Незначительная разница в количестве некротических клеток имела место в группах, где клетки подвергались только облучению или действию токсина Kappa-TRTX-Gr1b. Самый низкий уровень некроза отмечен в группе, в которой клетки после облучения инкубировали с токсином Kappa-TRTX-Gr1b. Таким образом, проведенные эксперименты показали, что на жизнеспособность клеток меланомы A875 значительный эффект оказывает комбинация пептида Kappa-TRTX-Gr1b с последующим воздействием лазерного излучения.
Обсуждение. Увеличение числа апопто-тических и некротических клеток отмечено во всех экспериментальных группах. Однако их максимальное количество было зафиксировано в группе, где использовали комбинацию токсина Kappa-TRTX-Gr1b с последующим облучением лазером опухолевых клеток А875. Данные, полученные в работе L. Leanza et al., показали, что ингибирование калиевых каналов митохондрий с использованием фармакологических препаратов индуцирует апоптоз в опухолевых клетках, что способствует сокращению объема опухоли меланомы на 90 % [12]. Калиевые каналы называют новой онкологической мишенью, так как их ингибирование вызывает апоптоз [13]. Это связано с гиперполяризацией мембранного потенциала митохондрий, высвобождением цитохрома С и продукцией активных форм кислорода, что приводит к гибели опухолевых клеток [14]. Эти данные подтверждают наше предположение о том, что высокий процент апоптотиче-ских и некротических клеток в группе, которая подвергалась комплексному воздействию, обусловлен ингибированием калиевых каналов внутриклеточных мембран клеток пептидом Kappa-TRTX-Gr1b.
Поскольку цитохром-с-оксидаза является основным клеточным хромофором, который располагается во внутренней мембране митохондрий, то последующее облучение лазером также вызывает каскад реакций, влияющих на функционирование клеток. Возбуждение ци-тохром-с-оксидазы лазерным излучением способствует росту электрохимического протонного градиента, который приводит к усиленному синтезу АТФ [15]. Образование комплекса цитохрома С с оксидом азота подавляет клеточное дыхание за счет вытеснения кислорода в состоянии стресса. Maegawa et al. показали, что облучение лазером меняет кластерную структуру воды, которая является одним из фотоакцепторов клетки [16]. Это приводит к изменениям гидрофобных взаимодействий белков и процессов, в которых они участвуют. Chung et al. продемонстрировали, что молекулярный кислород, который также является фотоакцептором клетки, под воздействием облучения переходит в синглетный кислород 1О 2 и вносит значительный вклад в биоэффекты [17]. Следственно, воздействие лазерного излучения с длинной волны 1265 нм приводит к изменению мембранного потенциала митохондрий, окислению белков и ДНК, что в конечном итоге провоцирует гибель опухолевых клеток [18, 19].
Заключение. Таким образом, корректно подобранный диапазон волн [20] и аминокислотные последовательности токсина Kappa-TRTX-Gr1b оказывали негативное влияние на жизнеспособность опухолевых клеток меланомы. В рамках работы показано, что использование указанной комбинации оказывало более значимое воздействие, чем раздельное применение этих факторов. Полученные данные могут стать основой для создания нового подхода в терапии, который сохранит все преимущества, связанные с местным применением и точным воздействием на злокачественную опухоль.
Список литературы Комплексное воздействие низкоинтенсивного лазерного излучения и пептидного ингибитора калиевых каналов на выживаемость клеток меланомы
- Park J., Lee Y.-K., Park I.-K., Hwang S.R. Current Limitations and Recent Progress in Nanomedicine for Clinically Available Photodynamic Therapy. Biomedicines. 2021; 9 (l): 85.
- Хохлова А.В., Золотовский И.О., Погодина Е.С., Саенко Ю.В., Столяров Д.А., Ворсина С.Н., Соколовский С.Г., Фотиади А.А., Лямина Д.А., Рафаилов Э.У. Воздействие лазерного излучения с длиной волны 1265 нм на культуру клеток аденокарциномы человека. Наноиндустрия. 2019; 12 (2): 86-95.
- Khokhlova A., Zolotovskii I., Sokolovski S. The light-oxygen effect in biological cells enhanced by highly localized surface plasmon-polaritons. Sci. Rep. 2019; 9: 18435.
- Böhme I., Schönherr R., Eberle J., Bosserhoff A.K. Membrane Transporters and Channels in Melanoma. Rev. Physiol. Biochem. Pharmacol. 2021; 181: 269-374.
- CapatinaA.L., Lagos D., Brackenbury W.J. Targeting Ion Channels for Cancer Treatment: Current Progress and Future Challenges. In: Reviews of Physiology, Biochemistry and Pharmacology. Berlin, Heidelberg: Springer; 2020: 1-43.
- Yavari B., Mahjub R., Saidijam M., Raigani M., Soleimani M. The Potential Use of Peptides in Cancer Treatment. Curr. Protein Pept. Sci. 2018; 19 (8): 759-770.
- McCloy R.A., Rogers S., Caldon C.E., Lorca T., Castro A., Burgess A. Partial inhibition of Cdk1 in G2 phase overrides the SAC and decouples mitotic events. Cell Cycle. 2014; 13 (9): 1400-1412.
- PatchDock Server: Molecular Docking Algorithm Based on Shape Complementarity Principles. URL: https://bioinfo3d.cs.tau.ac.il/PatchDock/ (дата обращения: 04.02.2022). DOI: 10.1093/nar/gki481.
- UniProt: Открытая база данных последовательностей белков. URL: https://www.uniprot.org/uni-prot/P56853 (дата обращения: 04.02.2022).
- Hegazy M.F., Fukaya M., DawoodM. Vitamin K3 thio-derivative: a novel specific apoptotic inducer in the doxorubicin-sensitive and -resistant cancer cells. Invest. New Drugs. 2020; 38 (3): 650-661.
- RTCA Software Manual - Software Version 2.1.0, ACEA Biosciences. USA; 2017.
- Leanza L., Henry B., Sassi N. Inhibitors of mitochondrial Kv1.3 channels induce Bax/Bak-independent death of cancer cells. EMBO Mol. Med. 2012; 4 (7): 577-593.
- Checchetto V., Prosdocimi E., Leanza L. Mitochondrial Kv1.3: A New Target in Cancer Biology? Cell Physiol. Biochem. 2019; 53 (S1): 52-62.
- Bortner C.D., Cidlowski J.A. Ion channels and apoptosis in cancer. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014; 369: 1638.
- Hamblin M.R. Mechanisms and Mitochondrial Redox Signaling in Photobiomodulation. Photochem. Photobiol. 2018; 94 (2): 199-212.
- Maegawa Y., Itoh T., Hosokawa T., Yaegashi K., Nishi M. Effects of near-infrared low-level laser irradiation on microcirculation. Lasers Surg. Med. 2000; 27 (5): 427-437.
- Chung H., Dai T., Sharma S.K., Huang Y.Y., Carroll J.D., Hamblin M.R. The nuts and bolts of low-level laser (light) therapy. Ann. Biomed. Eng. 2012; 40 (2): 516-533.
- Eells J.T., Wong-Riley M.T., VerHoeve J. Mitochondrial signal transduction in accelerated wound and retinal healing by near-infrared light therapy. Mitochondrion. 2004; 4 (5-6): 559-567.
- Pastore D., Greco M., Passarella S. Specific helium-neon laser sensitivity of the purified cytochrome c oxidase. Int. J. Radiat. Biol. 2000; 76 (6): 863-870.
- Tam S. Y., Tam V.C.W., Ramkumar S., Khaw M.L., Law H.K. W., Lee S. W.Y. Review on the Cellular Mechanisms of Low-Level Laser Therapy Use in Oncology. Front. Oncol. 2020; 10: 1255.


