Комплексный анализ токсичности при проведении неоадъювантной химиолучевой терапии у больных местнораспространенным раком желудка
Автор: Скоропад Виталий Юрьевич, Кудрявцев Дмитрий Дмитриевич, Аникина Екатерина Николаевна, Полуэктова Марина Викторовна, Титова Людмила Николаевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.17, 2018 года.
Бесплатный доступ
Цель работы - анализ частоты развития и степени тяжести токсических реакций со стороны периферической крови, печени, поджелудочной железы в процессе проведения и после завершения неоадъювантной химиолучевой терапии в составе комбинированного лечения больных местнораспространенным раком желудка. Материал и методы. В МРНЦ им. А.Ф Цыба - филиале ФГБУ «НМИЦ радиологии» МЗ РФ проведена II фаза клинического исследования эффективности комбинированного лечения больных местнораспространенным раком желудка с неоадъювантной химиолучевой терапией и последующей гастрэктомией с лимфодиссекцией в объеме D2. Основными критериями включения были: морфологически подтвержденный рак желудка, клиническая стадия сT3-4N0, сT2-4N1-3; М0. Всем больным до начала неоадъювантной терапии выполнялось комплексное обследование, включая СКТ органов грудной и брюшной полоcтей и лапароскопию для исключения перитонеального канцероматоза. Лучевая терапия проводилась в СОД 45 Гр по методике дневного дробления дозы (1 + 1,5 Гр) на фоне модифицированной схемы CAPOX. Хирургическое лечение в объеме гастрэктомии/субтотальной резекции желудка планировали через 4-6 нед после завершения курса химиолучевой терапии. Оценка токсичности неоадъювантной химиолучевой терапии проводилась с помощью шкалы NCI CTC, версия 3.0. В работе представлена оценка гематологической токсичности, а также токсических проявлений со стороны печени и поджелудочной железы - органов, попадающих в 90-100 % изодозу. Результаты. Среди токсических реакций в процессе и после завершения неоадъювантной химиолучевой терапии преобладали: тромбоцитопения, нейтропения и лейкопения I-II степени, что не требовало назначения дополнительной симптоматической терапии. Лучевая терапия в полном объеме была завершена у 45 (98 %) больных. Химиотерапия в полном объеме была завершена у 42 (91 %) пациентов. Медиана срока между окончанием химиолучевой терапии и хирургическим вмешательством составила 44 дня. Хирургическое лечение после завершения химиолучевой терапии было выполнено у 100 % больных, в том числе R0 резекции - у 93 % больных. Заключение. Предложенная методика предоперационной химиолучевой терапии удовлетворительно переносится больными, в большинстве случаев может быть завершена в полном объеме и не препятствует выполнению последующего хирургического лечения, включая расширенно-комбинированные вмешательства.
Рак желудка, неоадъювантная химиолучевая терапия, токсичность, комбинированное лечение
Короткий адрес: https://sciup.org/140254185
IDR: 140254185 | УДК: 616.33-006.6-08-059-06:615.849.1+615.28 | DOI: 10.21294/1814-4861-2018-17-3-20-27
Текст научной статьи Комплексный анализ токсичности при проведении неоадъювантной химиолучевой терапии у больных местнораспространенным раком желудка
Улучшение отдаленных результатов лечения большинство авторов связывает с развитием комплексной терапии, включающей наряду с хирургическим лечением химиотерапию, лучевую терапию, а также их комбинации [4, 5]. Однако до настоящего времени не определен оптимальный состав адъювантной терапии, а также временные интервалы ее проведения. Потенциально предоперационная терапия имеет существенные преимущества: максимально раннее начало системного лечения; локо-регионарное воздействие на первичный процесс и регионарные метастазы, позволяющее добиться регрессии опухоли вплоть до ее эрадикации; снижение биологического потенциала диссеминированных раковых клеток. По данным ряда зарубежных авторов, применение предоперационной химиолучевой терапии позволяет увеличить частоту радикальных (R0) операций, а также приводит к достижению полного и выраженного терапевтического патоморфоза у 30–40 % больных [6–9]. В МРНЦ разработана и внедрена оригинальная методика неоадъювантной химиолучевой терапии (НХЛТ) [10]. С учетом того, что в последующем больному выполняется радикальная операция, важнейшее значение приобретает безопасность неоадъювантной терапии.
Целью исследования явился анализ частоты развития и степени тяжести токсических реакций со стороны периферической крови, печени, поджелудочной железы.
Материал и методы
В таблице суммированы данные о степени токсичности при проведении НХЛТ у больных
Таблица
Частота токсических проявлений во время неоадъювантной химиолучевой терапии и после ее завершения
|
Критерии токсичности |
Степень токсичности |
||||
|
Всего |
I степень |
II степень |
III степень |
IV степень |
|
|
Анемия |
5 (11 %) |
4 (9 %) |
1 (2 %) |
- |
- |
|
Тромбоцитопения |
22 (48 %) |
21 (46 %) |
- |
1 (2 %) |
- |
|
Нейтропения |
18 (40 %) |
10 (22 %) |
8 (18 %) |
- |
- |
|
Лейкопения |
17 (37 %) |
10 (22 %) |
7 (15 %) |
- |
- |
|
Гиперамилаземия |
3 (7 %) |
3 (7 %) |
- |
- |
- |
|
Билирубин общий |
10 (22 %) |
9 (20 %) |
1 (2 %) |
- |
- |
|
ЩФ |
13 (29 %) |
13 (29 %) |
- |
- |
- |
|
АСТ |
17 (38 %) |
17 (38 %) |
- |
- |
- |
|
АЛТ |
12 (27 %) |
12 (27 %) |
- |
- |
- |
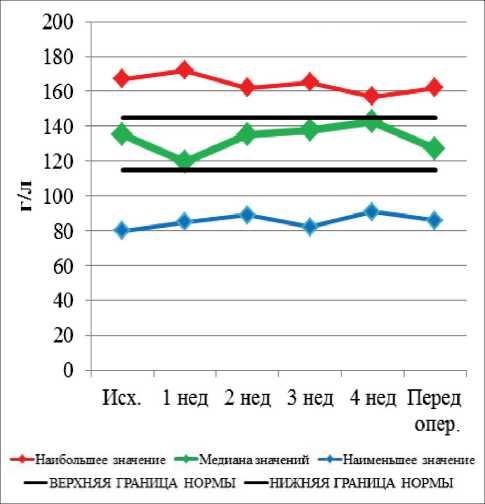
Рис. 1. Динамика уровня гемоглобина при проведении неоадъювантной химиолучевой терапии и после ее завершения
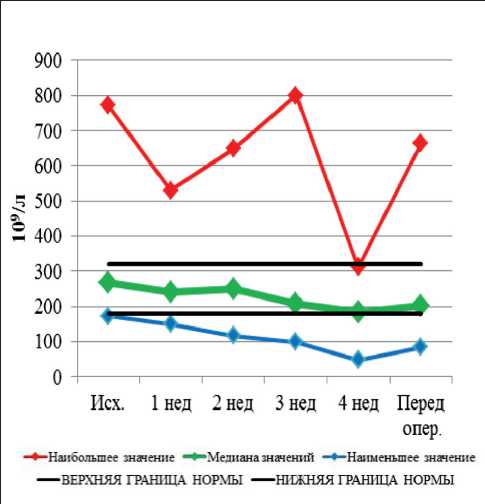
Рис. 2. Динамика уровня тромбоцитов при проведении неоадъювантной химиолучевой терапии и после ее завершения
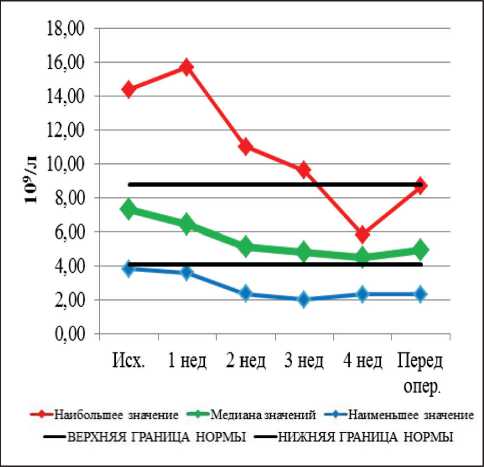
Рис. 3. Динамика уровня лейкоцитов при проведении неоадъювантной химиолучевой терапии и после ее завершения
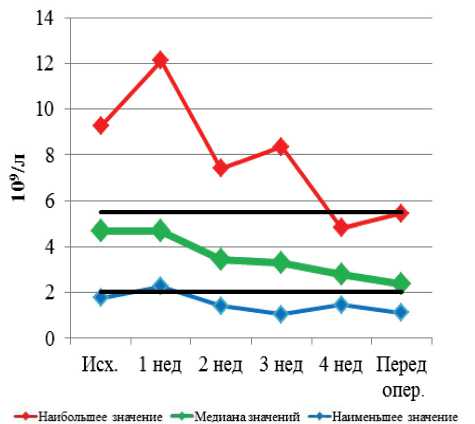
--ВЕРХНЯЯ ГРАНИЦА НОРМЫ --НИЖНЯЯ ГРАНИЦА НОРМЫ
Рис. 4. Динамика уровня нейтрофилов при проведении неоадъювантной химиолучевой терапии и после ее завершения
Динамика гематологических и биохимических показателей при проведении неоадъювантной хи-миолучевой терапии и после ее завершения представлена на рис. 1–9. Перед НХЛТ у 14 пациентов наблюдалась анемия I–II ст., которая сохранялась в течение всего курса лечения у 10 больных, при
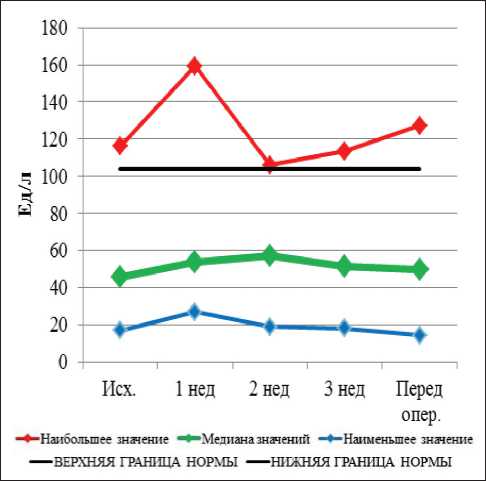
Рис. 5. Динамика уровня амилазы при проведении неоадъювантной химиолучевой терапии и после ее завершения
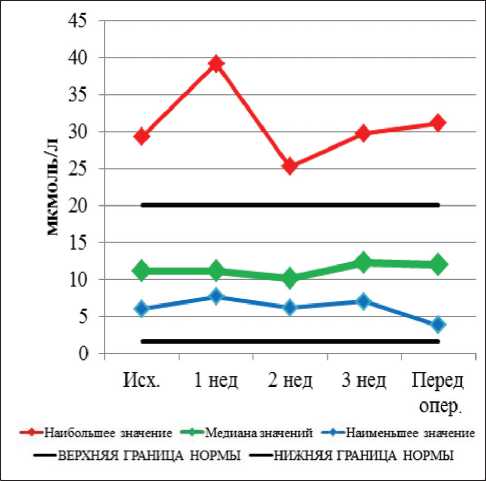
Рис. 6. Динамика показателей общего билирубина при проведении неоадъювантной химиолучевой терапии и после ее завершения
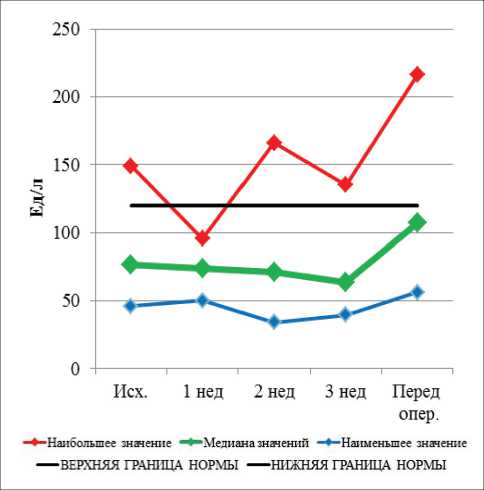
Рис. 7. Динамика показателей щелочной фосфатазы при проведении неоадъювантной химиолучевой терапии и после ее завершения
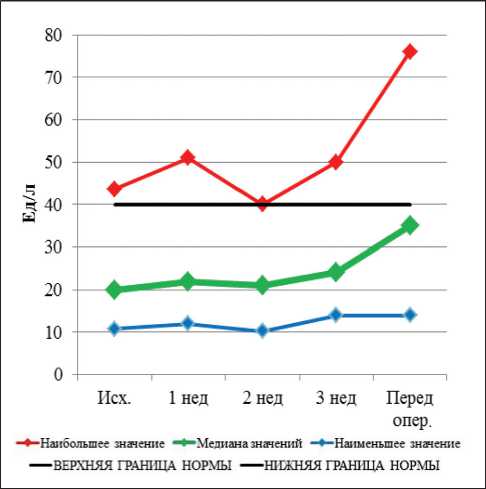
Рис. 8. Динамика показателей АСТ при проведении неоадъювантной химиолучевой терапии и после ее завершения
этом в 4 случаях показатели достигли нормальных значений. Среди больных с нормальным исходным показателем гемоглобина анемия I и II ст. развилась у 2 больных. Перед операцией анемия I ст. имела место в 4 случаях. Тромбоцитопения перед началом НХЛТ была выявлена у 1 больного, она сохранялась в течение всего курса лечения. У 7 больных тромбоцитопения I ст. наблюдалась на 2-й нед лечения, у 11 – на 3-й нед. Перед операцией тромбоцитопения I ст. сохранялась в 11 случаях. Лейкопения (ЛП) I ст. перед началом НХЛТ наблю- далась в одном случае. На 2-й нед ЛП I ст. выявлена у 3 больных, II ст. – у 2 пациентов. На 3-й нед лечения ЛП I ст. наблюдалась в 9 случаях, II ст. – в 2 случаях. К 4-й нед ЛП I и II ст. сохранялась только у 2 пациентов. Лейкопения I–II ст. перед хирургическим лечением имела место в 6 случаях, III и IV ст. токсичности не наблюдались. Показатели нейтрофилов перед началом НХЛТ у всех больных были в пределах нормальных значений. В течение курса лечения нейтропения I и II ст. наблюдалась в 4 случаях. Перед хирургическим лечением
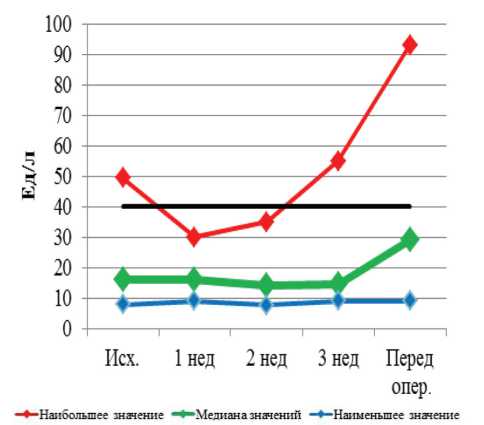
--ВЕРХНЯЯ ГРАНИЦА НОРМЫ --НИЖНЯЯ ГРАНИЦА НОРМЫ
Рис. 9. Динамика показателей АЛТ при проведении неоадъювантной химиолучевой терапии и после ее завершения нейтропения I–II ст. наблюдалась у 16 больных. Таким образом, изменения периферической крови наиболее часто выражались в снижении уровня тромбоцитов, лейкоцитов, нейтрофилов (37–48 %). Существенно реже наблюдалась анемия (11 %).
Перед началом НХЛТ уровень амилазы был в пределах нормальных значений у всех больных. В процессе лечения повышение уровня амилазы крови имело место у 3 больных, во всех случаях – I степени. К моменту выполнения операции повышение уровня амилазы крови не наблюдалось ни у одного пациента. Полученные данные свидетельствуют о высокой радио- и химиорезистентности поджелудочной железы. До начала лечения повышенный уровень щелочной фосфатазы (ЩФ) наблюдался у 2 больных, он сохранялся в течение всего курса лечения. Повышение уровня общего билирубина наблюдалось у 4 больных и сохранялось в течение всего курса лечения у 2 больных, у других 2 больных к моменту операции данный показатель нормализовался. Повышенный уровень АСТ I ст. наблюдался у одного пациента, что сохранилось вплоть до операции. Повышение уровня АЛТ I ст. перед НХЛТ наблюдалось у 1 пациента, а после начала лечения этот показатель у больного пришел в норму. В процессе лечения к концу 1-й нед уровень щелочной фосфатазы был в пределах нормы у всех больных; повышение уровня общего билирубина I ст. выявлено у 1 пациента. Повышение уровня АСТ I степени зарегистрировано у 1 пациента, а повышение АЛТ не наблюдалось. К концу 2-й нед НХЛТ не отмечалось новых случаев повышения печеночных показателей. В конце
3-й нед курса предоперационного лечения новых случаев повышения ЩФ не было, повышенный уровень общего билирубина I ст. имел место у одного пациента. Повышение уровня АСТ I ст. зарегистрировано у 2 больных, АЛТ I ст. – у 1 больного. Непосредственно перед операцией повышение уровня щелочной фосфатазы I ст. было выявлено у 13 пациентов; общего билирубина I ст. – у 6, II ст. – у 1 пациента. Перед операцией повышение уровня АСТ I ст. выявлено у 13 пациентов, АЛТ I ст. – у 10 пациентов.
В целом лучевая терапия была завершена в запланированном объеме у 44 (98 %) больных и только в одном случае была прервана на дозе 37,5 Гр. Химиотерапия была завершена в запланированном объеме у 41 (91 %) больного. Введение оксалиплатина было проведено у всех 100 % больных; прием капецитабина в 4 случаях был прерван в течение последней недели курса в связи с развитием токсических явлений.
Полученные нами результаты хорошо коррелируют с данными ряда зарубежных авторов, показавших в клинических исследований в рамках I–II фаз, что неоадъювантная химиолучевая терапия удовлетворительно переносится больными и может быть успешно завершена в 90 % и более случаев [9, 14–16].
Заключение
Данная работа проводилась в рамках выполнения тем государственного задания МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России за 2015 – 2016 гг. и первую половину 2017 г., промежуточные итоги выполнения которых нашли отражение в обобщающей публикации [17].
Список литературы Комплексный анализ токсичности при проведении неоадъювантной химиолучевой терапии у больных местнораспространенным раком желудка
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015 Mar 1; 136 (5): E359-86. DOI: 10.1002/ijc.29210
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2016 г. (заболеваемость и смертность). М., 2017. 30.
- Takebayashi K., Murata S., Yamamoto H., Ishida M., Yamaguchi T., Kojima M., Shimizu T., Shiomi H., Sonoda H., Naka S., Mekata E., Okabe H., Tani T. Surgery-induced peritoneal cancer cells in patients who have undergone curative gastrectomy for gastric cancer. Ann Surg Oncol. 2014; Jun 21 (6): 1991-97. DOI: 10.1245/s10434-014-3525-9
- Macdonald J.S., Smalley S.R., Benedetti J., Hundahl S.A., Estes N.C., Stemmermann G.N., Haller D.G., Ajani J.A., Gunderson L.L., Jessup J.M., Martenson J.A. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001 Sep 6; 345 (10): 725-30.
- Cunningham D., Allum W. H., Stenning S.P., Thompson J.N., Van de Velde C.J., Nicolson M., Scarffe J.H., Lofts F.J., Falk S.J., Iveson T.J., Smith D.B., Langley R.E., Verma M., Weeden S., Chua Y.J., MAGIC Trial Participants. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006; 355 (1): 11-20. DOI: 10.1056/NEJMoa055531


