Композиционные биоматериалы ГАП-Ti: получение, структура, свойства
Автор: Скачкова О.В., Скачков В.М., Богданова Е.А., Широкова А.Г., Григоров И.Г., Сабирзянов Н.А.
Журнал: Вестник Бурятского государственного университета. Химия. Физика @vestnik-bsu-chemistry-physics
Статья в выпуске: 2-3, 2016 года.
Бесплатный доступ
Проведены исследования по нанесению на пористый титан биоактивного слоя из гидроксиапатита (ГАП). Установлены оптимальные условия создания композиционных материалов для изготовления имплантатов на основе ГАП. Целью исследования является изучение адгезионной прочности биоактивного покрытия на металлической матрице. Сравнительная оценка различных методов показала, что вакуумная пропитка является наиболее предпочтительным методом для получения функциональных биологически активных покрытий.
Биоматериалы, гидроксиапатит, титан, пористость, композиты, суспензия, адгезия
Короткий адрес: https://sciup.org/148316651
IDR: 148316651 | УДК: 661.635.41; | DOI: 10.18101/2306-2363-2016-2-3-47-56
Текст научной статьи Композиционные биоматериалы ГАП-Ti: получение, структура, свойства
Создание материалов, необходимых для производства имплантатов, способных выдерживать биомеханические нагрузки в организме и не отторгаться им, является важной задачей в области костного замещения, так как с увеличением продолжительности жизни человека и ухудшением экологической обстановки все чаще возникает потребность замены жизнеобеспечивающих систем организма искусственно созданными моделями. В ИХТТ УрО РАН проведен цикл работ по созданию биокомпозитов на основе высокопористых ячеистых материалов, покрытых гидроксиапатитом (ГАП) [1, 2]. При отработке способа нанесения покрытия ГАП с целью сохранения его фазового состава и биологической активности использовали щадящие методы (вакуумное импрегнирование; вакуумное импрегнирование с последующим центрифугированием; ультразвуковая обработка). В качестве материала металлического каркаса были выбраны
Таблица
Результаты обработки пористого титана суспензией ГАП различными способами
|
Порист ость, % |
№ опыта |
m исходная , г |
m конечная , г |
∆m, г |
∆m, % |
Σ∆m, г |
Σ∆m, % |
|
способ 1 - вакуумная пропитка, сушка на воздухе, н.у. |
|||||||
|
28 |
1 |
0,89100 |
0,89800 |
0,00700 |
0,79 |
0,00700 |
0,79 |
|
2 |
0,89800 |
0,90300 |
0,00500 |
0,56 |
0,01200 |
1,35 |
|
|
3 |
0,90300 |
0,91000 |
0,00700 |
0,78 |
0,01900 |
2,13 |
|
|
4 |
0,91000 |
0,91500 |
0,00500 |
0,55 |
0,02400 |
2,69 |
|
|
5 |
0,91500 |
0,92000 |
0,00500 |
0,55 |
0,02900 |
3,25 |
|
|
40 |
1 |
0,83000 |
0,85700 |
0,02700 |
3,25 |
0,02700 |
3,25 |
|
2 |
0,85700 |
0,86800 |
0,01100 |
1,28 |
0,03800 |
4,58 |
|
|
3 |
0,86800 |
0,88000 |
0,01200 |
1,38 |
0,05000 |
6,02 |
|
|
4 |
0,88000 |
0,88600 |
0,00600 |
0,68 |
0,05600 |
6,75 |
|
|
5 |
0,88600 |
0,89700 |
0,01100 |
1,24 |
0,06700 |
8,07 |
|
|
45 |
1 |
0,37700 |
0,40400 |
0,02700 |
7,16 |
0,02700 |
7,16 |
|
2 |
0,40400 |
0,41500 |
0,01100 |
2,72 |
0,03800 |
10,07 |
|
|
3 |
0,41500 |
0,42000 |
0,00500 |
1,20 |
0,04300 |
11,41 |
|
|
4 |
0,42000 |
0,42100 |
0,00100 |
0,24 |
0,04400 |
11,67 |
|
|
5 |
0,42100 |
0,42800 |
0,00700 |
1,66 |
0,05100 |
13,53 |
|
|
способ 2 - вакуумная пропитка, центрифугирование (1 мин, 3500 об./мин), сушка на воздухе, н.у. |
|||||||
|
28 |
1 |
1,05400 |
1,06600 |
0,01200 |
1,14 |
0,01200 |
1,14 |
|
2 |
1,06600 |
1,07300 |
0,00700 |
0,66 |
0,01900 |
1,80 |
|
|
3 |
1,07300 |
1,07600 |
0,00300 |
0,28 |
0,02200 |
2,09 |
|
|
4 |
1,07600 |
1,08200 |
0,00600 |
0,56 |
0,02800 |
2,66 |
|
|
5 |
1,08200 |
1,08400 |
0,00200 |
0,18 |
0,0300 |
2,85 |
|
|
40 |
1 |
0,76600 |
0,78900 |
0,02300 |
3,00 |
0,02300 |
3,00 |
|
2 |
0,78900 |
0,79400 |
0,00500 |
0,63 |
0,02800 |
3,66 |
|
|
3 |
0,79400 |
0,81100 |
0,01700 |
2,14 |
0,04500 |
5,87 |
|
|
4 |
0,81100 |
0,81100 |
- |
- |
0,04500 |
5,87 |
|
|
5 |
0,81100 |
0,81700 |
0,00600 |
0,74 |
0,05100 |
6,66 |
|
|
45 |
1 |
0,51000 |
0,54000 |
0,03000 |
5,88 |
0,03000 |
5,88 |
|
2 |
0,54000 |
0,54800 |
0,00800 |
1,48 |
0,03800 |
7,45 |
|
|
3 |
0,54800 |
0,55700 |
0,00900 |
1,64 |
0,04700 |
9,22 |
|
|
4 |
0,55700 |
0,55700 |
- |
- |
0,04700 |
9,22 |
|
|
5 |
0,55700 |
0,55900 |
0,00200 |
0,36 |
0,04900 |
9,61 |
|
|
способ 3 - ультразвуковая обработка (40°С, 1 ч), сушка на воздухе, н.у. |
|||||||
|
28 |
1 |
1,31285 |
1,31900 |
0,00615 |
0,47 |
0,00615 |
0,47 |
|
2 |
1,31900 |
1,32700 |
0,00800 |
0,61 |
0,01415 |
1,08 |
|
|
3 |
1,32700 |
1,33400 |
0,00700 |
0,52 |
0,02115 |
1,61 |
|
|
4 |
1,33400 |
1,33400 |
- |
- |
0,02115 |
1,61 |
|
|
5 |
1,33400 |
1,34100 |
0,00700 |
0,52 |
0,02815 |
2,12 |
|
|
40 |
1 |
0,79755 |
0,81700 |
0,01945 |
2,43 |
0,01945 |
2,43 |
|
2 |
0,81700 |
0,82400 |
0,00700 |
0,86 |
0,02645 |
3,32 |
|
|
3 |
0,82400 |
0,83400 |
0,01000 |
1,21 |
0,03645 |
4,57 |
|
|
4 |
0,83400 |
0,83700 |
0,00300 |
0,36 |
0,03945 |
4,95 |
|
|
5 |
0,83700 |
0,84400 |
0,00700 |
0,84 |
0,04645 |
5,82 |
|
|
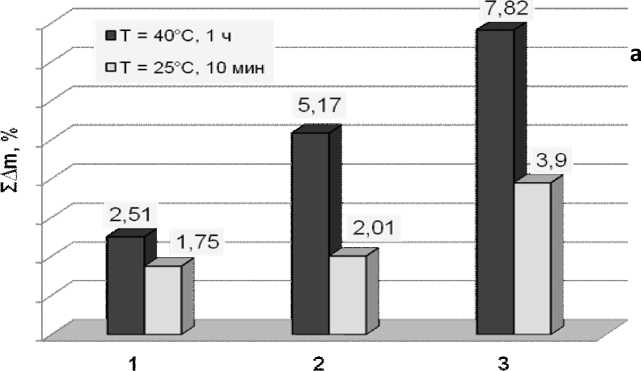
45 |
1 |
0,71600 |
0,73400 |
0,01800 |
2,51 |
0,01800 |
2,51 |
|
2 |
0,73400 |
0,75300 |
0,01900 |
2,59 |
0,03700 |
5,17 |
|
|
3 |
0,75300 |
0,77200 |
0,01900 |
2,52 |
0,05600 |
7,82 |
|
|
4 |
0,77200 |
0,77900 |
0,00700 |
0,91 |
0,06300 |
8,80 |
|
|
5 |
0,77900 |
0,79000 |
0,01100 |
1,41 |
0,07400 |
10,34 |

Рис. 1. Микрофотографии покрытия, нанесенного ультразвуковой пропиткой титановой матрицы в суспензии ГАП: 1 - компактный титан; 2 - пористый титан (28%); 3 - пористый титан (40%); 4 - пористый титан (45%).


Рис. 2. Микрофотографии покрытия нанесенного на титан пористостью 45% (1) и 40% (2 ) ультразвуковой обработкой при T =25 ° C, 10 мин (а) и T =40 ° C, 1 ч (б)
стадия обработки
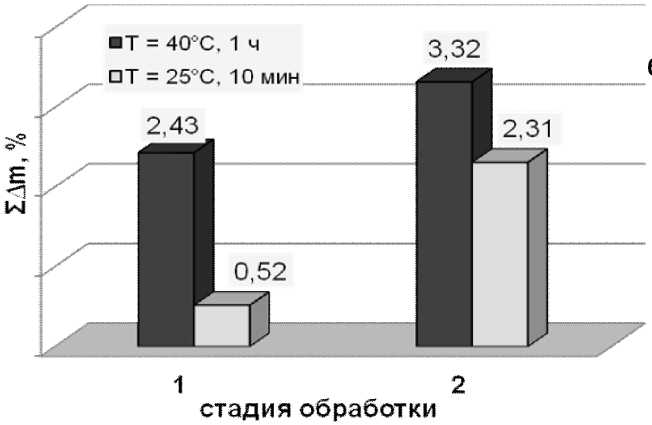
Рис. 3. Оценка зависимости изменения массы образца в результате ступенчатого насыщения суспензией ГАП от режима ультразвуковой обработки: а - пористый титан (45%); б - пористый титан (40%)
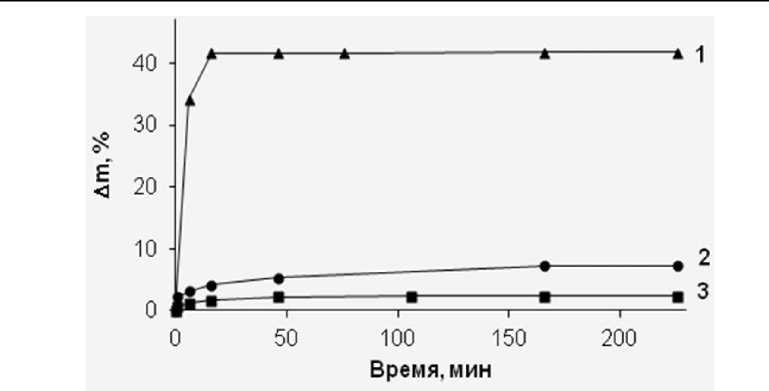
Рис. 4. Разрушение ГАП-покрытия методом центробежного отрыва (F центр. ∼ 200 ⋅ 10-5 Н): 1 - компактный титан; 2 – пористый титан (28%);
3 – пористый титан (45%)
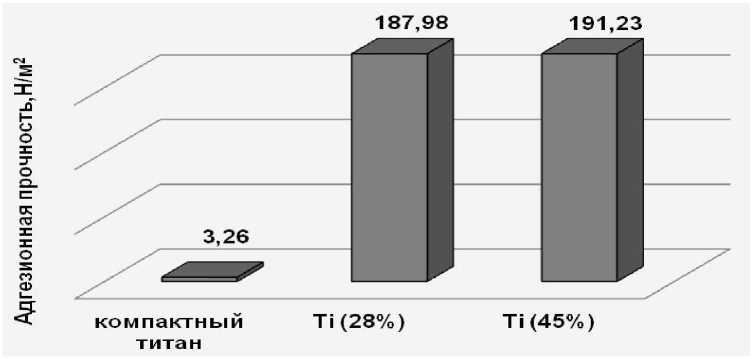
Рис. 5. Адгезионная прочность ГАП-покрытия, нанесенного методом вакуумного импрегнирования на титан различной пористости компактный и пористый титан (пористость 28, 40 и 45%), а в качестве биоактивного покрытия – суспензия ГАП, полученная осаждением из растворов в соответствии с патентом [3]. Морфологию поверхности образцов, покрытых ГАП, изучали на сканирующем электронном микроскопе JSM-6390 LA (JEOL, Япония).
Результаты исследований по дозированному заполнению ГАП порового пространства титана (пористость 28%, 40%, 45%) приведены в табл. Анализ полученных данных позволяет признать наиболее эффективным способ 1, который дает прирост массы образца 13.53% на 5-ой стадии обработки.
Дополнительное центрифугирование и термическая обработка в способе 2 не увеличивают этот показатель.
Применение ультразвука для нанесения ГАП на титановую матрицу приводит к быстрому росту его массы лишь на начальной стадии обработки. Наилучшие сорбционные свойства при всех способах обработки проявили образцы титана с пористостью 45%. При этом быстрый рост слоя ГАП приводит к возникновению в нем высоких внутренних напряжений, снижающих адгезию и приводящих к растрескиванию и отслаиванию биоактивного слоя от поверхности металла (рис. 1).
Также в ходе исследований было установлено, что температурный режим и длительность ультразвуковой обработки металлической матрицы в суспензии ГАП оказывают влияние на равномерность и качество нанесения покрытия (рис. 2). Показано, что даже незначительное повышение температуры (до 40°С) и увеличение времени обработки способствуют более равномерному заполнению пористого материала суспензией ГАП. При этом насыщение пористого материала суспензией ГАП протекает более полно при длительной ультразвуковой обработке и нагреве. Увеличение массы на каждой стадии обработки титана различной пористости ∼ 2 раза превышает прирост массы, полученный при обработке металлической матрицы при Т = 25°С в течение 10 мин (рис. 3).
Одной из важных эксплуатационных характеристик, обеспечивающих условия продолжительного функционирования имплантата в организме, является адгезионная прочность покрытия.
Целью данной работы являлось изучение механических свойств ГАП-покрытий, полученных предлагаемыми авторами способами. Существуют различные методы определения адгезии [4, 5], но не все они могут быть использованы для оценки сцепления покрытия, нанесенного на пористые металлические материалы. В данной работе прочность сцепления ГАП-покрытия с титановой матрицей оценивали ультразвуковым воздействием на образец (35 кГц, 1 ч) и методом центробежного отрыва (центростремительное ускорение 500 м/c2). По полученным методом центробежного отрыва данным была рассчитана адгезионная прочность покрытий на титане различной пористости в соответствии с формулой:
P= F центр. /S = m ω2 ⋅ r/S, где
P - адгезионная прочность, H/м2; m - масса покрытия, кг; ω - угловая скорость вращения в момент разрыва, с-2; r – расстояние от центра масс до оси вращения центрифуги, м; S – площадь контакта покрытия и подложки, м2.
Проведенные исследования показали, что ультразвуковое воздействие не приводит к значительному разрушению покрытия вне зависимости от пористости образца. Прочность сцепления в этом случае определяется способом нанесения: убыль массы покрытия, нанесенного методом вакуумного импрегнирования, составляет 0.16 мас.%, тогда как убыль массы покрытий, нанесенных центрифугированием и ультразвуковой обработкой, составила 0.28 и 0.3 мас.% соответственно.
Воздействие на образец центробежной силы указывает на наименьшую прочность сцепления покрытия с металлическим каркасом в случае компактного титана. Разрушение покрытия (27 мас.%) происходит даже при незначительных нагрузках (центростремительное ускорение 15 м/c2), дальнейшее увеличение нагрузки до 500 м/c2 приводит к потере 42% массы покрытия. Отслаивание биоактивного слоя от поверхности компактного титана, объясняется значительными внутренними напряжениями в покрытии вследствие его толщины и низкой механической прочности. Причем, самопроизвольное разрушение и отслаивание микроучастков покрытия происходит даже на этапе его нанесения на компактный титан в отличие от пористого титана. При воздействии центробежной силы на образцы с матрицей из пористого титана, как и при ультразвуковом воздействии, было установлено, что наиболее прочными являются покрытия, полученные методом вакуумного импрегнирования (рис. 4), причем с увеличением пористости титана прочность сцепления покрытия с металлом возрастает. Потеря массы биоактивного слоя на титане с пористостью 45 и 28%, составила 2.3 и 7.3 мас.% соответственно. Таким образом, увеличение пористости металлической матрицы позволяет значительно повысить прочностные характеристики покрытия (рис. 5).
Морфология играет определяющую роль в функциональном статусе кости, методом сканирующей электронной микроскопии было проведено морфологическое исследование синтезированного материала, а также построены 3 D -изображения поверхности из 2 D -изображения псевдорельефа [6]. Морфологию поверхности изучали на сканирующем электронном микроскопе, а формирование 2 D -изображения «псевдорельефа» осуществляли в режиме регистрации отраженных электронов, что позволяло получить композиционное, топографическое или общее изображение рельефа. 3 D -изображение формировали из 2 D с помощью дополнительного использования функции 2/3 ( Create 3 D by 2 D ) программы ScanMaster , управляющей работой сканирующего зондового микроскопа СММ- 2000 АТ (рис. 6).
Скорость остеогенеза на поверхности покрытия имплантата определяется не только химическими свойствами материала, а во многом – поверхностным рельефом и микрошероховатость поверхности является ключевым фактором для формирования костной ткани при адгезии остеобластов в организме [7].
Проведенные исследования позволили оценить преимущества использования пористого титана в качестве основы биокомпозита, вследствие того, что он не требует предварительной обработки поверхности и способен обеспечить формирование прочной системы «покрытие – кость». Открытая пористость и неровность рельефа титановой матрицы значительно повышает адгезию наносимого ГАП-покрытия за счет механического сцепления его частиц с основой, «прорастания» внутрь образца и повторения микрорельефа металла слоями. Установлены оптимальные пористость титановой матрицы (45%) и метод нанесения ГАП-покрытия (вакуумная пропитка), обеспечивающие получение равномерного, микрошероховатого и прочного покрытия, что дает основание рекомендовать полученный биокомпозит для производства костных имплантатов.

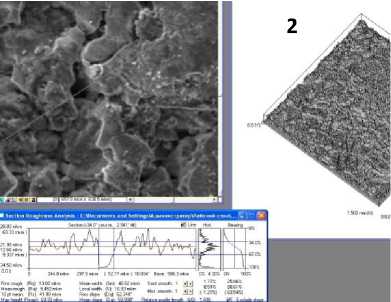
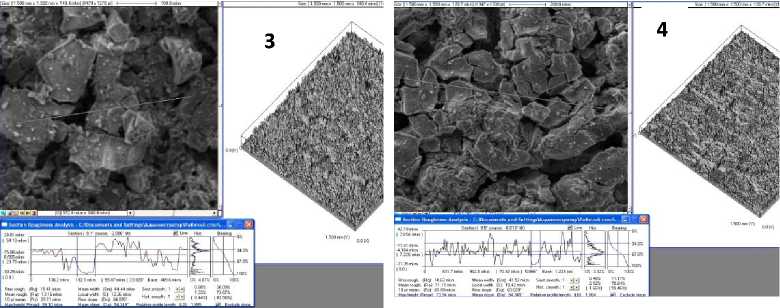
Рис. 6. 3D -визуализация рельефа и профиль сечения поверхности титана, покрытого ГАП: 1 - покрытие на компактном титане; 2 - покрытие, нанесенное на пористый титан (45%) методом вакуумного импрегнирования; 3 - покрытие, нанесенное на пористый титан (45%) методом вакуумного импрегнирования, дополненное центрифугированием; 4 - покрытие, полученное ультразвуковой пропиткой пористого титан (45%) суспензией ГАП
Результаты этих исследований показывают целесообразность и необходимость проведения дальнейших работ по изучению взаимодействия компонентов гетерогенных и коллоидных систем с участием кальцийфосфорных соединений, описанию их физико-химических свойств и установлению корреляции факторов, влияющих на биологическую активность и эффективность фармакологического действия.
Работа выполнена при финансовой поддержки РФФИ (проект № 15-2904868).
Список литературы Композиционные биоматериалы ГАП-Ti: получение, структура, свойства
- Борисов С. В., Богданова Е. А., Григоров И. Г. и др. Патент РФ № 2541174. - 2014.
- Широкова А. Г., Богданова Е. А., Скачков В. М. и др. Способ получения биомедицинского материала. Заявка на патент РФ № 2015116024. - 22.04.2015.
- Сабирзянов Н. А., Богданова Е. А., Хонина Т. Г. Патент РФ № 2406693. - 2010.
- Лунёв В. М., Немашкало О. В. Адгезионные характеристики покрытий и методы их измерения // ФIП ФИП PSE. - 2010. - Т. 8, № 1. - С. 64-71.
- Ковачич Л. Склеивание металлов и пластмасс // Под ред. А. С. Фрейдина. М.: Химия, 1985. 240 с.
- Grigorov I. G., Shirokova A. G., Bogdanova E.A. et al. SEM Study of the microstructure of biocomposites based on highly porous honeycomb materials. Physical and chemical aspects of the study of clusters, nanostructures and nanomaterials. - 2015. - V. 7. - P. 179-185.
- Den Braber E. T. Quantitative analysis of fibroblast morphology an microgrooved surfaces with various groove and ridge dimensions // Biomaterials. - 1996. - V. 17, № 21. - P. 2037-2044.


