Композитные магнитовосприимчивые фотокатализаторы на основе оксидов Fe3O4/SiO2/TiO2
Автор: Горшков Александр Андреевич, Авдин Вячеслав Викторович, Жеребцов Дмитрий Анатольевич, Морозов Роман Сергеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 т.15, 2023 года.
Бесплатный доступ
В работе изучены композитные материалы на основе оксидов Fe3O4/SiO2/TiO2 , синтезированные золь-гель методом. На первой стадии наночастицы магнетита осаждали гидроксидом натрия из смеси водных растворов сульфатов железа(II) и (III) при непрерывном воздействии ультразвука, после чего отмывали дистиллированной водой и сушили под вакуумом. На второй стадии полученные частицы магнетита покрывали оксидом кремния по методу Штобера путём диспергирования их при воздействии ультразвука в растворе тетраэтоксисилана в н-пропаноле с последующим гидролизом тетраэтоксисилана в присутствии водного раствора аммиака, отмывкой и сушкой под вакуумом полученных материалов. На третьей стадии в композит вводили фотокаталитически активные частицы на основе оксида титана методом замены растворителя путём диспергирования образцов в водном растворе пероксотитановой кислоты и добавления н-пропанола при интенсивном перемешивании с последующей активацией кипячением в смеси вода/этанол 1:1, отмывкой и сушкой под вакуумом. Изучено влияние на свойства образцов цитратной стабилизации и разделения частиц магнетита на стадии их синтеза на «лёгкую» и «тяжёлую» магнитные фракции, а также прокаливания образцов при температуре 450 °С. Исследованы фотокаталитические свойства синтезированных образцов в процессе фотодеструкции метилового оранжевого, а также их магнитная извлекаемость из суспензии. Выполнена физико-химическая характеризация образцов на сканирующем электронном микроскопе высокого разрешения методом энергодисперсионной рентгеновской спектроскопии, порошковой рентгеновской дифракции, термического анализа (ТГ-ДСК), совмещённого с масс-спектрометрией газообразных продуктов термолиза. Обнаружено, что композиты на основе смешанного оксида титана-кремния имеют более высокую фотокаталитическую активность, чем получаемые по аналогичной методике композиты на основе чистого диоксида титана. Полученные фотокатализаторы можно использовать для очистки воды от красителей с последующим извлечением при помощи магнита.
Диоксид титана, анатаз, диоксид кремния, композитные фотокатализаторы, фотокаталитическая активность, фотокаталитические тесты, деструкция метилового оранжевого
Короткий адрес: https://sciup.org/147239542
IDR: 147239542 | УДК: 544.032.72+544.478-03 | DOI: 10.14529/chem230113
Текст научной статьи Композитные магнитовосприимчивые фотокатализаторы на основе оксидов Fe3O4/SiO2/TiO2
В последние десятилетия стали актуальными проблемы, связанные с загрязнением воды и воздуха стойкими органическими соединениями, возникающими из антропогенных источников [1]. Усовершенствованные окислительные процессы для удаления этих загрязнений могут являться эффективной альтернативой существующим методам [2]. Фотокатализ – это быстро развивающаяся технология очистки воды, которая считается одним из наиболее эффективных методов удаления загрязнений из окружающей среды. Фотокатализ имеет ряд важных преимуществ по сравнению с обычными каталитическими процессами, которые включают длительные этапы, повышенные температуры и давление. Как правило, фотокаталитическое окисление эффективно используется для удаления низких концентраций загрязнений, то есть в системах доочистки [3].
Диоксид титана является основой многих коммерческих катализаторов, используемых для фотодеструкции широкого круга загрязнений. Основными преимуществами TiO2 являются простота его синтеза и универсальность применения [4, 5]. Благодаря значительному количеству исследований, уникальные фотокаталитические свойства диоксида титана, которые способствуют окислению стойких органических загрязнений в CO2 и H2O при ультрафиолетовом (УФ) облучении, хорошо известны [6–8]. Одной из главных проблем, ограничивающих использование фото-каталитического метода для очистки воды, является то, что абсолютно все коммерчески доступные фотокатализаторы представлены в виде наночастиц, которые крайне проблематично удалить из воды после завершения очистки [9]. Данное ограничение можно преодолеть путём нанесения фотокаталитически активного диоксида титана на инертную легкоизвлекаемую подложку [10– 13]. Оптимальный выбор метода иммобилизации фотокаталитического материала, а также материала носителя чрезвычайно важен для эффективного функционирования фотокаталитической системы.
Для синтеза носителей и наноструктурированных фотокаталитических покрытий широко применяются методики, основанные на золь-гель процессах, преимуществами которых являются их относительная простота, отсутствие необходимости в дорогостоящих и высокотоксичных реагентах, а также возможность в широком диапазоне варьировать условия синтеза с целью получения образцов с заданными характеристиками [14–16].
В данной работе в качестве носителя фотокатализатора выбраны композитные частицы Fe 3 O 4 /SiO 2 . Магнетит, обладающий высокой магнитной восприимчивостью, обеспечивает лёгкость извлечения частиц из очищенной воды методом магнитной сепарации. Пористые частицы аморфного диоксида кремния образуют агрегаты с частицами магнетита и за счёт развитой поверхности и большого количества поверхностных гидроксильных групп способствуют адсорбции субстрата. В данной работе представлены исследования трёхкомпонентных композитных материалов Fe3O4/SiO2/TiO2, синтезированных золь-гель методом, модифицированных разными способами. Исследована фотокаталитическая активность полученных композитов в реакции деструкции метилового оранжевого. Исследовано влияние различных воздействий на физикохимические свойства полученных материалов.
Экспериментальная часть
Для синтеза образцов использовали следующие реактивы: сульфат железа(II) семиводный, сульфат железа(III) девятиводный, водный раствор гидроксида натрия 40 % масс., тетраэтоксисилан, насыщенный водный раствор аммиака, оксисульфат титана, водный раствор пероксида водорода 32 % масс., 0,1 н. соляную кислоту. В качестве растворителей использовали дистиллированную воду, этанол и н-пропанол (спирты – в виде азеотропов с водой). В фотокаталитиче-ских исследованиях в качестве модельного загрязнения применили метиловый оранжевый (МО). Оксисульфат титана приобретён у Sigma-Aldrich, все остальные реактивы – у компании Реахим.
Навески брали на весах Sartorius серии СРА, 5 знак точности (0,01 мг). рН определяли иономером Sartorius РР-25. Для синтеза использовали магнитную мешалку BIOSAN MSH-300, ультразвуковой диспергатор МЭФ93.Т (интенсивность ультразвукового облучения – 250 Вт/см2, частота – 22 кГц), вакуумный сушильный шкаф Binder VD 115 (8 мБар), центрифугу Hermle LaborTechnic Z383 (9000 об/мин). Магнитную сеперацию осуществляли при помощи неодимового магнита класса N45 (цилиндр, d = 50 мм, h = 30 мм, B R = 1,35 Тл). Концентрацию красителя определяли при помощи спектрофотометра УФ и видимого диапазона Shimadzu UV-2700 по заранее построенному градуировочному графику зависимости оптической плотности раствора при длине волны 498 нм от концентрации метилового оранжевого в растворе. Исследования морфологии и определение элементного состава выполняли на сканирующем электронном микроскопе Jeol JSM-7001F с приставкой EDS Oxford INCA X-max 80. Термоаналитические исследования проводили на синхронном термическом анализаторе Netzsch STA Jupiter 449F1 с держателем для ТГ/ДСК типа S. Использовали корундовые микротигли (80 мкл) с крышечкой с газообменным отверстием, окислительную атмосферу (сухой воздух), скорость продувки 50 мл/мин. Газообразные продукты термолиза анализировали на квадрупольном масс-спектрометре QMS 403C Aëolos. Предварительно в режиме сканирования определили, что из всех термолизных газов достоверно фиксируются только ионные токи для 18 и 44 Да (вода и углекислый газ соответственно). Для всех образцов в режиме мониторинга записаны масс-спектры для ионных токов массовых чисел 18 и 44. Рентгенофазовый анализ порошков проводили на анализаторе Rigaku Ultima IV с излучением CuKα (длина волны 1,54056 Å). Фотокаталитическую активность определяли при помощи светодиодного облучателя (395 нм, полуширина пика излучения – 2 нм). Рабочая освещённость в реакторе, определённая методом актинометрии [17, 18], составила 600 Вт/м2.
Исследования проведены на оборудовании научно-образовательного центра «Нанотехнологии» Южно-Уральского государственного университета.
Все образцы, в том числе промежуточные продукты, после завершения синтеза пятикратно отмывали дистиллированной водой (согласно предварительным экспериментам, этого достаточно для отсутствия в промывных водах противоионов исходных солей), затем сушили при температуре 50 °С в течение 48 часов в вакуумном сушильном шкафу. Так как все образцы содержат магнетит, извлечение частиц из водных сред проводили при помощи неодимового магнита. Корректировку рН осуществляли 0,1 н. соляной кислотой или насыщенным водным аммиаком.
Магнетит получали осаждением из смеси водных растворов солей железа. За основу взяты методики, описанные в [19, 20]. 2,80 г FeSO 4 ∙7H 2 O и 5,50 г Fe 2 (SO 4 ) 3 ∙9H 2 O растворяли в 450 мл дистиллированной воды при температуре 70 °С при непрерывном воздействии ультразвука и перемешивании магнитной мешалкой. Раствором гидроксида натрия pH смеси доводили до 10. В течение всего процесса и ещё час после завершения поддерживали температуру 70 °С, УЗ-облучение и перемешивание реакционной смеси, после чего раствор охлаждали до комнатной температуры, образцы отмывали и сушили. Практический выход составил 95 % масс.
Формирование композитов с диоксидом кремния осуществляли методом щелочного гидролиза тетраэтоксисилана (ТЭОС) по методу Штобера [21–23]. Процесс осуществляли на ледяной бане при облучении ультразвуком. 1,00 г порошка магнетита диспергировали в растворе, содержащем 1 мл ТЭОС в 25 мл н-пропанола, в течение часа. После этого вливали 250 мл насыщенного водного раствора аммиака. Реакционную смесь выдерживали в указанных условиях в течение часа, после чего полученный материал отмывали и сушили. Практический выход составил 87 % масс.
На полученные агрегаты Fe 3 O 4 /SiO 2 наносили фотокаталитически активные частицы диоксида титана методом замены растворителя; за основу взяли методику, описанную в [24]. Из водного раствора оксисульфата титана осаждали гидроксид титана при помощи раствора гидроксида натрия до достижения значения pH 5. Свежеосаждённый гидроксид титана отделяли от реакционной смеси при помощи центрифуги, отмывали водой и растворяли в перекиси водорода, получая пероксотитановую кислоту. На ледяной бане под воздействием ультразвука 0,60 г порошка Fe 3 O 4 /SiO 2 диспергировали в 50 мл н-пропанола в течение часа, затем вливали 50 мл водного раствора пероксотитановой кислоты (pH 3, 1,30 моль/л по титану). Реакционную смесь выдерживали на ледяной бане при облучении ультразвуком в течение часа, после этого помещали на встряхи-ватель на сутки, затем пятикратно отмывали дистиллированной водой. С целью увеличения поверхности отмытые частицы кипятили с обратным холодильником в течение суток в 50% об. водном этаноле при pH 5, отмывали и сушили. Практический выход составил 87 % масс. Данный образец обозначили «МST».
Известно, что ζ-потенциал наночастиц магнетита при значении pH около 9 близок к нулю, что приводит к их агрегации [25]. Агломераты наночастиц в подобных условиях теряют коллоидную стабильность, и одним из методов предотвращения этого является цитратная стабилизация. Предполагается, что при этом ζ-потенциал наночастиц значительно повышается, цитрат-ионы создают структурно-механический барьер, в результате чего частицы способны оставаться стабильными в широком диапазоне значений pH [26]. Навеску порошка магнетита массой 2,50 г диспергировали в 100 мл раствора цитрата натрия (25 г/л) и выдерживали при 70 °С и УЗ-облучении в течение часа. Из маточного раствора при помощи неодимового магнита извлекли две фракции – тяжёлую (Mch) и лёгкую (Mcℓ). Mch собирали в течение часа, Mcℓ – в течение последующих 12 часов. Масса порошка тяжёлой фракции после высушивания составила 1,38, лёгкой – 1,03 г. Суммарный практический выход составил 48,2 % масс. Обе фракции привели во взаимодействие с диоксидом кремния по методике, описанной выше. Практический выход композита Fe 3 O 4 /SiO 2 на основе тяжёлой фракции (MchS) составил 88, лёгкой (McℓS) – 92 % масс.
Из обеих фракций получили композиты с диоксидом титана по двум разным методикам. Навеску композита Fe3O4/SiO2 массой 0,60 г диспергировали в 50 мл н-пропанола в течение часа на ледяной бане под воздействием ультразвука. После этого быстро и аккуратно разделяли суспензию на две равные части и, не прекращая перемешивание, прилили к первой половине 25 мл водного раствора пероксотитановой кислоты (1,30 моль/л, pH 3, образцы обозначили MchST и McℓST для тяжёлой и лёгкой фракций соответственно). Ко второй половине суспензии прилили 6,70 мл ТЭОС, затем 25 мл водного раствора пероксотитановой кислоты (1,30 моль/л, pH 9; образцы обозначили MchSST и McℓSST). Реакционные смеси в обеих методиках выдержали на встряхивателе в течение суток. Все четыре полученных образца подвергли процедуре увеличения поверхности кипячением в смеси вода – этанол по методике, описанной выше. Практический выход составил: для МchST – 56, для МchSST – 50, для МcℓST – 73, для МcℓSST – 70 % масс. Данные образцы разделили на две части, одну из которых прокалили в муфельной печи при температуре 450 °С в течение часа. В обозначениях прокалённых образцов добавили букву «t».
Исследовали фотокаталитическую активность всех восьми модифицированных, а также исходного образца МST. Навеску порошка композита массой 0,05 г поместили в кварцевый стакан, добавили 25 мл раствора МО с концентрацией 6,0 мг/л (pH 6). Выдержали смесь в темноте при нагревании до 65 °С в течение получаса, чтобы завершить теневую адсорбцию (в том числе активированную адсорбцию), после чего отобрали первую пробу, центрифугировали её 10 мин и в фугате определили концентрацию МО. Затем пробу вместе с отделёнными частицами образца вернули в стакан. Раствор поместили на магнитную мешалку под УФ-облучение на 60 мин, затем выдержали над неодимовым магнитом в темноте в течение часа, декантировали, центрифугировали и отобрали вторую пробу, в которой измерили концентрацию и вычислили процент фотодеструкции метилового оранжевого. Холостой опыт провели в тех же условиях, но без добавления фотокатализатора. Образцы высушили и вычислили процент извлекаемости частиц магнитом.
Обсуждение результатов
Значения адсорбции, проценты фоторазложения МО и магнитной извлекаемости образцов приведены в табл. 1. Из необработанных термически образцов в условиях эксперимента меньше всего МО адсорбировалось на немодифицированном композите MST. Очевидно, что цитратная обработка способствует насыщению поверхности образцов ОН- и карбоксилатными группами, повышающими адсорбционную способность образцов. Прокаливание приводит к выгоранию цитратов и, по-видимому, агрегации, поэтому адсорбция МО на образцах МchSTt, МchSTSt, МcℓSTt и МcℓSTSt становится меньше, чем у образца MST.
Зависимости между сорбционной ёмкостью материалов и их фотокаталитической активностью не обнаружено. В целом заметную фотокаталитическую активность в условиях эксперимента продемонстрировали только образцы, синтезированные на основе лёгкой фракции цитратно-стабилизированного магнетита. Однако эти же образцы более чем на треть уступают образцам с тяжёлой фракцией по магнитной извлекаемости.
Прокаливание материалов повысило их извлекаемость магнитным полем, одновременно с этим существенно понизив их адсорбционную ёмкость и фотокаталитическую активность по отношению к метиловому оранжевому. Предположенная выше агрегация при прокаливании приводит к «схлопыванию» трёхмерной развитой структуры (из-за удаления химически связанной воды и цитратов), что, по-видимому, «запирает» фотокаталитически активные частицы внутри агрегата и делает их менее доступными.
Таблица 1
Сорбционная, фотокаталитическая активность и степень магнитной извлекаемости образцов
|
Образец |
Адсорбция МО (мг/г образца) |
Фотодеструкция МО, % |
Магнитная извлекаемость, % |
|
Холостой опыт |
– |
≈ 0 |
– |
|
MST |
0,41 |
≈ 0 |
≈ 100 |
|
МchST |
0,90 |
≈ 0 |
96 |
|
МchSTS |
0,94 |
≈ 0 |
≈ 100 |
|
МcℓST |
0,78 |
14 |
61 |
|
МcℓSTS |
0,80 |
55 |
67 |
|
МchSTt |
0,32 |
≈ 0 |
≈ 100 |
|
МchSTSt |
0,35 |
≈ 0 |
≈ 100 |
|
МcℓSTt |
0,34 |
4 |
95 |
|
МcℓSTSt |
0,35 |
26 |
≈ 100 |
Исследование методом сканирующей электронной микроскопии показало, что все исследованные образцы представляют собой довольно крупные частицы неправильной формы с большой дисперсией по размерам. При этом непрокалённые образцы, полученные из лёгкой фракции стабилизированного магнетита, в среднем имеют размеры 2…5 мкм, а образцы из тяжёлой фракции, полученные в тех же условиях – 15…20 мкм. Прокаливание при 450 °С привело к увеличению размеров частиц примерно в два раза, что подтверждает ранее выдвинутое предположение об агрегации и соответствующем повышении извлекаемости, а также о снижении фотокаталитической активности прокалённых образцов.
Элементное картирование показало, что во всех исследованных образцах в целом наблюдается довольно равномерное распределение железа, кремния и титана по всему объёму частиц, что указывает на образование композитных материалов. При этом в обоих исследованных образцах, полученных из смешанного кремний-титанового прекурсора, наблюдалась несколько более выраженная сегрегация фаз оксида титана и оксида железа – это может указывать на то, что использование смешанного прекурсора с большей вероятностью ведёт к образованию структур типа «кекс с изюмом» (мелких сегрегированных агломератов магнетита и диоксида титана, распределённых в силикатной матрице), а не «ядро-оболочка». Пример микрофотографии образцов с элементным картированием, полученных при помощи СЭМ, приведён на рис. 1. Прокаливание при 450 °С образца, полученного из прекурсора чистого диоксида титана, не приводит к видимой сегрегации фаз.
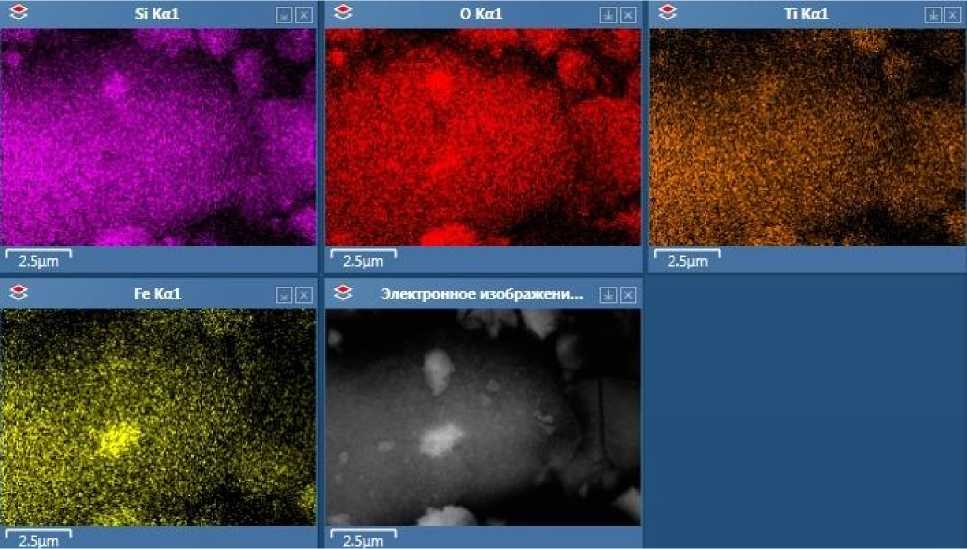
Рис. 1. Микрофотографии и элементное картирование образца МcℓSST
Из результатов энергодисперсионного анализа (табл. 2) следует, что в образцах, полученных на основе тяжёлой фракции стабилизированного магнетита, итоговое мольное соотношение титана к железу оказалось значительно ниже, чем в образцах, полученных по тем же методикам на основе лёгкой фракции стабилизированного магнетита. Скорее всего, именно этим объясняется более высокая фотокаталитическая активность и меньшая магнитная восприимчивость композитов, синтезированных на основе лёгкой фракции.
Таблица 2 Элементный состав образцов (ат. %)
|
Образец |
O |
Si |
Ti |
Fe |
Сумма |
|
МchST |
54,34 |
0,27 |
8,42 |
36,97 |
100,00 |
|
МcℓST |
61,18 |
1,02 |
21,34 |
16,47 |
100,00 |
|
МchSST |
53,28 |
4,48 |
2,07 |
40,17 |
100,00 |
|
МcℓSST |
64,55 |
19,45 |
9,65 |
6,35 |
100,00 |
|
МcℓSTt |
61,37 |
0,99 |
21,75 |
15,89 |
100,00 |
Из результатов видно также, что в образцах, полученных из прекурсора чистого оксида титана, содержание кремния оказалось очень низким в отличие от образцов, полученных из смешанного кремний-титанового прекурсора. Это свидетельствует о том, что внутреннюю защитную оболочку оксида кремния методом гидролиза ТЭОС на частицы магнетита в значительной степени нанести не удалось. Низкие значения мольных долей титана в образцах, полученных на основе тяжёлой фазы стабилизированного магнетита, позволяют утверждать, что в таких образцах наблюдается слишком слабая адгезия между различными оксидными фазами, ведущая к удалению большей части осаждённого оксида титана из материалов в ходе отмывки. В случае же образцов, полученных на основе лёгкой фазы магнетита, фотокаталитически активная фаза закрепляется гораздо лучше, предположительно, за счёт более высокой поверхностной энергии наночастиц [25–27]. Наконец, следует отметить, что материалы, полученные осаждением на частицы носителя фазы смешанного оксида титана-кремния, продемонстрировали более высокую фотокаталити-ческую активность, чем материалы, полученные осаждением фазы чистого оксида титана с более высоким мольным содержанием титана. Это может быть связано со стабилизацией фотокаталитически активных нанокристаллов анатаза в силикатной матрице [28–32].
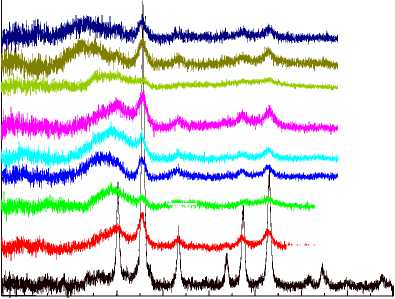
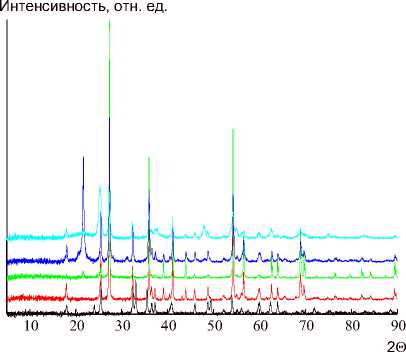
Порошковые рентгенограммы композитных образцов представлены на рис. 2. Все исследованные образцы, за исключением MST, оказались рентгеноаморфными. Рефлексы на дифракто-грамме MST соответствуют магнетиту (интенсивный на 36° и менее выраженные на 31, 43, 54, 57, 63°) [33]. Частицы анатаза, по-видимому, имеют слишком малый размер, а частицы SiO 2 – аморфные. На всех дифрактограммах присутствует широкий интенсивный пик в диапазоне от 23 до 27°, а также ряд менее интенсивных уширенных пиков в интервалах 34–37, 42–45, 56–59 и 61– 65°. Скорее всего, данные пики являются результатом наложения характеристических пиков магнетита и анатаза (интенсивный на 26° и менее выраженные на 38, 47, 54, 55, 63, 70, 75°) [34]. В модифицированных образцах частицы магнетита и анатаза имеют аморфный характер из-за небольших размеров за счёт цитратной обработки и особенностей процедуры получения диоксида титана методом замены растворителя из пероксотитановой кислоты с последующей активацией кипячением в водно-спиртовой смеси [24, 34, 35]. Несколько более высокая кристалличность образцов, полученных на основе лёгкой фракции ядер магнетита, коррелирует с более высоким содержанием в них диоксида титана. Термическая обработка при 450 °C почти не повысила кристалличность прокалённого образца, что свидетельствует о высокой термической стабильности кристаллитов в составе композитов. Прокаливание при температуре 1000 °C вызвало кристаллизацию образцов (рис. 2б). Особенно заметно кристалличность выросла у образцов из тяжёлой фракции ввиду того, что они изначально содержали частицы большего размера.
Интенсивность, отн. ед.
W*w
** --- MchSSTt ww ---- MclSTt
*** ---- MclSST
I****** ---- MclSSTt
MchSTt
10 20 30 40 50 60 70 80 90
а)
iHwwN***
MST
2Θ
MchST
MclST
MchSST
б)
Рис. 2. Рентгеновские дифрактограммы композитных исходных образцов (а) и прокалённых при 1000 °С (б)
Кривые термического анализа композитных образцов имеют довольно сложный профиль из-за наложения эндотермических эффектов удаления воды и адсорбированного углекислого газа и ряда экзотермических эффектов: сгорания цитратов (и, возможно, адсорбированных в порах н-пропанола, используемого в качестве среды в процедуре синтеза диоксида титана, и этанола, образующегося при гидролизе ТЭОС), разложения магнетита на оксид железа(II) и оксид желе-за(III) [36], окисления двухвалентного железе до трёхвалентного состояния, перехода анатаз– рутил. Заметного влияния процедуры фракционирования ядер магнетита, а также состава внешнего слоя композитных частиц на протекающие с композитами термические процессы не зафиксировано. На рис. 3 показан пример кривых ТГ-ДТГ-ДСК-МС.
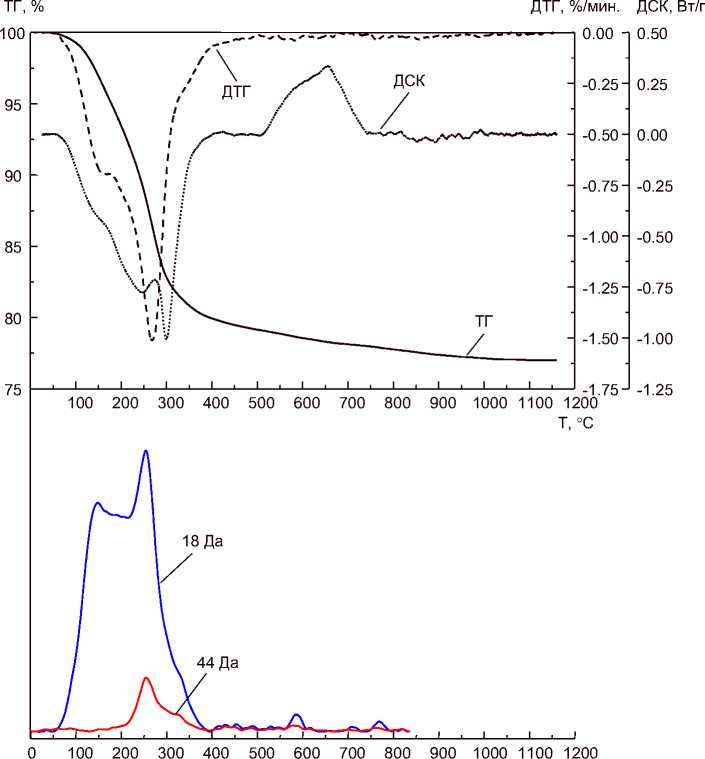
Т, ° С
Рис. 3. Кривые ТГ-ДТГ-ДСК-МС для образца МcℓSST
Масс-спектры, записанные в режиме мониторинга массовых чисел 18 и 44 Да, показывают, что дегидратация в основном заканчивается при температуре 400 °С, хотя незначительные количества воды выделяются и при более высоких температурах, соответствующих фазовым превращениям. По-видимому, это вода, находящаяся внутри структурных образований, при перестройке которых происходит дегидратация. МС-кривая ионного тока 18 Да содержит несколько максимумов, соответствующих не только удалению поровой, гидратной и химически связанной воды в металлоксидных структурах (то есть воды, отщепляющейся от ОН-групп), но и воды, образующейся при сгорании цитратов. Последнее обстоятельство подтверждается совпадением температур максимумов на МС-кривых ионных токов 18, 44 Да и максимума экзоэффекта на ДСК около 275 °С.
Углекислый газ при термолизе образуется за счёт окисления цитратов и, очевидно, как примесь к металлоксидным материалам в виде карбонатов и гидрокарбонатов, что подтверждается максимумами на кривой ионного тока 44 Да в интервале 500…800 °С. Сводные данные по удалению углекислого газа и воды представлены в табл. 3. Относительные количества Н2О и СО2 представлены площадями под МС-кривыми ионных токов с нормировкой на 1 мг навески. Сопоставление суммы этих данных по этим двум компонентам (SMS(H2O+CO2)) с общей потерей массы по кривой ТГ показывает их высокую корреляцию друг с другом. Это свидетельствует о том, что удаляемая при термолизе часть образцов почти полностью представлена Н2О и СО2.
Количество удаляемых воды и углекислого газа после прокаливания при 450 °С уменьшается в среднем в четыре раза, но всё-таки остаётся на уровне 7 % (суммарно). Следовательно, вода и углекислый газ после прокаливания при 450 ° С вновь адсорбируются в порах и на поверхности частиц.
Таблица 3
Количество удалённых веществ по данным ТГ–МС
|
Образец |
S 18 Д а / mнав., мг |
S 44 Д а / mнав., мг |
A m TG, % |
S ms (H 2 O+CO 2 ) / A m TG |
|
MST |
168 |
45,9 |
11,17 |
19,1 |
|
McℓST |
494 |
54,5 |
25,31 |
21,7 |
|
MchST |
507 |
57,2 |
27,52 |
20,5 |
|
McℓSST |
477 |
52,8 |
22,99 |
23,0 |
|
MchSST |
468 |
62,5 |
23,06 |
23,0 |
|
McℓSTt |
153 |
46,7 |
8,00 |
25,0 |
|
MchSTt |
96 |
55 |
6,80 |
22,2 |
|
McℓSSTt |
151 |
21,3 |
6,99 |
24,6 |
|
MchSSTt |
128 |
5,3 |
7,21 |
18,5 |
Таким образом, оптимальная температура постсинтетической термической обработки композита составляет 400 °С. Такая обработка позволяет удалить из композита всю связанную органику и предотвратить разложение частиц магнетита.
Заключение
Разработана трёхступенчатая методика синтеза, приводящая к образованию трёхкомпонентных композитных материалов состава Fe3O4/SiO2/TiO2, обладающих удовлетворительными магнитными свойствами и однородным распределением атомов железа, кремния и титана. Цитратная стабилизация частиц магнетита на стадии их получения приводит к разделению частиц на «лёгкую» и «тяжёлую» магнитные фракции. Установлено, что композиты, синтезированные на основе «лёгкой» фракции, имеют более высокое мольное содержание фазы оксида титана и вследствие этого – более высокую фотокаталитическую активность. Обнаружено, что композиты на основе смешанного оксида титана-кремния имеют более высокую фотокаталитическую активность, чем получаемые по аналогичной методике композиты на основе чистого диоксида титана. Прокаливание композитов при температуре до 400 ° С стабилизирует образцы, удаляет органическую составляющую и повышает магнитную извлекаемость частиц.
Список литературы Композитные магнитовосприимчивые фотокатализаторы на основе оксидов Fe3O4/SiO2/TiO2
- Lelieveld J., Evans J.S., Fnais M., Giannadaki D., Pozzer A. The contribution of outdoor air pollution sources to premature mortality on a global scale. Nature. 2015;525:367-371. DOI: 10.1038/nature15371.
- ZMiga-Benitez H., Sanchez-Monsalve R., Penuela G.A. Benzophenone-3 removal using heterogeneous photocatalysis at pilot scale. Water Air Soil. Pollut. 2018;229:332. DOI: 10.1007/s11270-018-3960-5.
- Mamaghani A.H., Haghighat F., Lee C.-S. Photocatalytic oxidation technology for indoor environment air purification: The state-of-the-art. Appl. Catal. B Environ. 2017;203:247-269.
- Fujishima A., Rao T.N., Tryk D.A. Titanium dioxide photocatalysis. Journal of Photochemistry andPhotobiology C: Photochemistry Reviews. 2000; 1:1-21.
- Lee H.-G., Sai-Anand G., Komathi S., Gopalan A.-I., Kang S.W. and Lee K.P. Efficient visible-light-driven photocatalytic degradation of nitrophenol by using graphene-encapsulated TiO2 nanowires. J. Hazard. Mater. 2015;283:400-409. DOI: 10.1016/j.jhazmat.2014.09.014.
- Lee J.-C., Gopalan A.-I., Saianand G., Lee K.-P. Manganese and graphene included titanium dioxide composite nanowires: fabrication, charerization and enhanced photocatalytic ivities. Nanomate-rials. 2020;10:456. DOI: 10.3390/nano10030456.
- Haider A.J., Jameel Z.N., Al-Hussaini I.H.M. Review on: titanium dioxide applications. Energy Procedia. 2019;157:17-29. DOI: 10.1016/j.egypro.2018.11.159._
- Sirirerkratana K., Kemacheevakul P., Chuangchote S. Color removal from wastewater by photocatalytic process using titanium dioxide-coated glass, ceramic tile, and stainless steel sheets. J. Clean. Prod. 2019;215:123-130. DOI: 10.1016/j.jclepro.2019.01.037.
- Mahmoud W., Rastogi T., Kümmerer K. Application of titanium dioxide nanoparticles as a pho-tocatalyst for the removal of micropollutants such as pharmaceuticals from water. Current Opinion in Green and Sustainable Chemistry. 2017;6:1-10. DOI: 10.1016/j.cogsc.2017.04.001
- You J., Guo Y., Guo R., Liu X. A review of visible light-ive photocatalysts for water disinfection: features and prospects. Chem. Eng. J. 2019;373:624-641. DOI: 10.1016/j.cej.2019.05.071.
- Debnath D., Gupta A.K., Ghosal P.S. Recent advances in the development of tailored functional materials for the treatment of pesticides in aqueous media: a review. J. Ind. Eng. Chem. 2019;70:51-69. DOI: 10.1016/j .jiec.2018.10.014.
- Du Z., Cheng C., Tan L. et al. Enhanced photocatalytic ivity of Bi2WO6/TiO2 composite coated polyester fabric under visible light irradiation. Appl. Surf. Sci. 2018;435:626-634. DOI: 10.1016/j.apsusc.2017.11.136.
- Hakki H.K., Allahyari S., Rahemi N., Tasbihi M. Surface properties, adherence, and photocatalytic ivity of sol-gel dip-coated TiO2- ZnO films on glass plates. Comptes. Rendus. Chim. 2019;22:393-405. DOI: 10.1016/j.crci.2019.05.007
- Song X.M., Wu J.M., Yan M. Photocatalytic degradation of selected dyes by titania thin films with various nanostructures. Thin Solid Films. 2009. V. 517. P. 4341-4347. DOI: 10.1016/j.tsf.2009.02.132.
- Li C.J., Wang J.N., Wang B., Gong J.R., Lin Z. A novel magnetically separable TiO2/CoFe2O4 nanofiber with high photocatalytic ivity under UV-vis light. Mater. Res. Bull. 2012;47:333-337. DOI: 10.1016/j.materresbull.2011.11.012.
- Li Y., Zhang M., Guo M., Wang X. Preparation and properties of a nano TiO2/Fe3O4 composite superparamagnetic photocatalyst. Rare Met. 2009;28:423-427. DOI: 10.1007/s12598-009-0082-7.
- Galbavy E.S., Ram K., Anastasio C. 2-Nitrobenzaldehyde as a chemical actinometer for solution and ice photochemis-try. J. Photochem. Photobiol. 2010;209:186-192. DOI: 10.1016/j.jphotochem.2009.11.013.
- Willett K.L., Hites R.A. Chemical actinometry: using o-nitrobenzaldehyde to measure lamp intensity in photochemical experiments. Journal of Chemical Education. 2000;77(7):900. DOI: 10.1021/ed077p900.
- Kuwakara Y., Miyazaki T., Shirosaki Y., Kawashita M. Effects of organic polymer addition in magnetite synthesis on the crystalline structure. RSC Adv. 2014;4:23359-23363. DOI: 10.1039/C4RA02073A.
- Brazovskaya E.Yu. Razrabotka magnitovospriimchivykh sorbentov na osnove tseolita beta dlya resheniya zadach meditsiny i ekologii. Diss. kand. khim. nauk. [Development of magnetically responsive sorbents based on beta zeolite for solving medical and environmental problems. Cand. sci. dis.] St. Petersburg, 2020. 137 p.
- Stöber W., Fink A., Bohn E. Controlled growth of monodisperse silica spheres in the micron size range. Journal of Colloid and Interface Science. 1968;26(1):62-69.
- Deng, Yo., Qi D., Deng C., Zhang Xi., Zhao D. Superparamagnetic high-magnetization microspheres with an Fe3O4@SiO2 core and perpendicularly aligned mesoporous SiO2 shell for removal of microcystins. Journal of the American Chemical Society. 2008;130(1):28-29. DOI: 10.1021/ja0777584.
- Zaytseva M.P., Muradova A.G., Yurtov E.V. Investigation of the effect of the teos quantity of the structure Fe3O4@SiO2 formation. Uspekhi v khimii i khimicheskoy tekhnologii [Advances in chemistry and chemical technology. 2017;13(194):8-9 (In Russ.)].
- Morozov R., Krivtsov I., Avdin V., Amghouz Z., Gorshkov A., Pushkova E., Bol'shakov O., Bulanova A., Ilkaeva M. Microporous composite SiO2-TiO2 spheres prepared via the peroxo route: Lead(II) removal in aqueous media. Journal of Non-Crystalline Solids. 2018;497:71-81. DOI: 10.1016/j .jnoncrysol.2017.11.031.
- Larson I., Drummond C.J., Chan D.Y.C., Grieser F. Direct force measurements between titanium dioxide surfaces. Journal of the American Chemical Society. 1993;115(25): 11885-11890. DOI: 10.1021/ja00078a029.
- Ashraf M.A., Peng W., Zare Y., Rhee K.Y. Effects of size and aggregation/agglomeration of nanoparticles on the interfacial/interphase properties and tensile strength of polymer nanocomposites. Nanoscale Res Lett. 2018;13:214. DOI: 10.1186/s11671-018-2624-0.
- Carrillo J.M., Raphael E., Dobrynin A.V. Adhesion of nanoparticles. Langmuir. 2010;26(15): 12973-12979. DOI: 10.1021/la101977c.
- Kibombo H.S., Peng R., Rasalingam S., Koodali R.T. Versatility of heterogeneous photocatalysis: synthetic methodologies epitomizing the role of silica support in TiO2 based mixed oxides. Catalysis Science & Technology. 2012;2:1737-1766. DOI: 10.1039/C2CY20247F.
- Seriani N., Pinilla C., Cereda S., De Vita A., Scandolo S. Titania-silica interfaces. J. Physical Chemistry C. 2012;116:11062-11067. DOI: 10.1021/jp301584h.
- Hay J.N., Raval H.M. Synthesis of organic-inorganic hybrids via the non-hydrolytic sol-gel process. Chemistry ofMaterials. 2001;13:3396-3403. DOI: 10.1021/cm011024n.
- Lafond V., Mutin P.H., Vioux A. Non-hydrolytic sol-gel routes based on alkyl halide elimination: toward better mixed oxide catalysts and new supports: application to the preparation of a SiO2-TiO2 epoxidation catalyst. Journal of Molecular Catalysis A: Chemical. 2002;182-183:81-88.
- Kibombo H.S., Zhao D., Gonshorowski A., Budhi S., Koppang M.D., & Koodali R.T. Cosol-vent-induced gelation and the hydrothermal enhancement of the crystallinity of titania-silica mixed oxides for the photocatalytic remediation of organic pollutants. J. Physical Chemistry C. 2011;115:6126-6135. DOI: 10.1021/jp110988j.
- Compean M., Ruiz F., Martinez J.R., Herrera-Gomez A. Magnetic properties of magnetite nanoparticles synthesized by forced hydrolysis. Mater. Lett. 2008;62(27):4248-4250. DOI: 10.1016/j.matlet.2008.06.053.
- Praveen P., Viruthagiri G., Mugundan S., Shanmugam N. Structural, optical and morphological analyses of pristine titanium dioxide nanoparticles synthesized via sol-gel route. Spectrochim. Acta, Part A. 2013;117:622-629. DOI: 10.1016/j.saa.2013.09.037.
- Zelepukin I.V., Shipunova V.O., Mirkasymov A., Nikitin P., Nikitin M.P., Deyev S.M. Synthesis and characterization of hybrid core-shell Fe3O4/SiO2 nanoparticles for biomedical applications. Acta Naturae. 2017;9(4):58-65. DOI: 10.32607/20758251-2017-9-4-58-65.
- Ene V.L., Neacsu I.A., Oprea O., Surdu V.-A. Single step synthesis of glutamic/tartaric acid-stabilised Fe3O4 nanoparticles for targeted delivery systems. Rev. Chim. 2020;71:230-238. DOI: 10.37358/RC.20.2.7920.


