Конформационный анализ катионов семисолей гетероароматических N-оксидов
Автор: Романов Владимир Владимирович, Нижник Яков Петрович, Фофанов Анатолий Дмитриевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-математические науки
Статья в выпуске: 8 (145) т.1, 2014 года.
Бесплатный доступ
В зависимости от строения гетероароматических N-оксидов группа N-O может проявлять как электронодонорные, так и электроноакцепторные свойства. Было высказано предположение, что атом кислорода в комплексах данных соединений может находиться либо в состоянии sp-гибридизации, либо в состоянии sp 2-гибридизации. Для проверки этой гипотезы нами был проведен конформационный анализ четырех семисолей гетероароматических N-оксидов: бис (пиридин-N-оксид) водорода, бис (2-метилпиридин-N-оксид) водорода, бис (2,6-диметилпиридин-N-оксид) водорода и бис (4- хлорхинолин-N-оксид) водорода. Поскольку значения энергий конформаций, соответствующие sp 2- гибридному атому кислорода, соответствуют максимумам на энергетической поверхности, то существование прочных аддуктов N-оксидов с sp 2-гибридизованным атомом кислорода в твердой фазе можно поставить под сомнение.
Конформация, конформационный анализ, гетероароматические n-оксиды, гибридизация, энергетическая поверхность
Короткий адрес: https://sciup.org/14750773
IDR: 14750773 | УДК: 539.192+547.821.2+547.821.411.2+547.821.412.6
Текст научной статьи Конформационный анализ катионов семисолей гетероароматических N-оксидов
Гетероароматические N-оксиды содержат атом кислорода, связанный семиполярной связью с эндоциклическим атомом азота ароматического гетероцикла. В силу особенностей электронного строения таких молекул, группа N–O может проявлять как электронодонорные, так и электроноакцепторные свойства в зависимости от строения N-оксида [8], [11], [12]. Такой двойственный характер N-оксидной группы обуславливает своеобразные химические свойства гетероаромати-ческих N-оксидов, что проявляется в легкости осуществления как реакций SN, так и SE. Недавно было показано, что скорости реакций SN в ряду гетероароматических N-оксидов значительно ускоряются при комплексообразовании N-оксидов с кислотами Льюиса и Брёнстеда-Лоури [3], [4], [6], [7], при этом, как правило, атом кислорода N-оксидной группы служит донорным центром. Было высказано предположение [1], [2], что в различных молекулярных комплексах гетеро-ароматических N-оксидов атом кислорода может находиться либо в состоянии sp 3-гибридизации (рис. 1 А ), либо в состоянии sp 2-гибридизации (рис. 1 Б ).
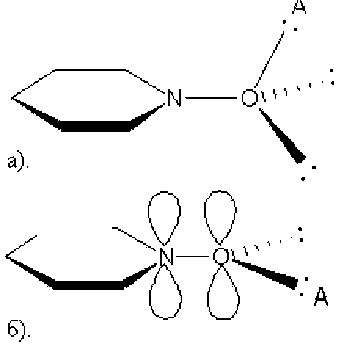
Рис. 1. Структура аддуктов N-оксида пиридина с атомом кислорода в состоянии sp 3- (А) и sp 2-гибридизации (Б)
Для проверки этой гипотезы необходимо провести детальное квантовомеханическое описание молекулярных комплексов N-оксидов, в частности, необходимо проанализировать энергии различных конформаций этих аддуктов с точки зрения конформационного анализа, поскольку то или иное строение аддукта может быть связано исключительно со стерическими фактора- ми, а не с типом гибридизации атома кислорода (sp 2 и sp 3). Для этого необходимо рассчитать энергии двух крайних конформаций c разной гибридизацией атома кислорода (А и Б). Учитывая возможность свободного вращения относительно одинарной связи N–O в структуре с sp 3-гибриди-зованным атомом кислорода, для оценки энергии структуры Б с точки зрения стерических факторов возможно использовать структуру А, которая наиболее часто встречается в этих аддуктах в твердом виде: для этого необходимо построить зависимость энергии аддукта от двугранного угла между плоскостью ароматического кольца и плоскостью N–O–A (A – кислота Льюиса или Брёнстеда-Лоури). Если энергия структуры, соответствующей структуре Б, будет очень значительной, то возможность существования комплексов N-оксидов с sp 2-гибридизованным атомом кислорода можно поставить под сомнение.
ЭКСПЕРИМЕНТ
Для нахождения энергетической поверхности нами были выбраны семисоли (основные соли) нескольких N-оксидов, поскольку, согласно [1], именно слабое взаимодействие между атомом кислорода в N-оксидах и кислотным центром должно благоприятствовать sp2-гибридизованно-му атому кислорода. Кроме того, симметричная структура лиганд...H+...лиганд значительно облегчает расчет конформационных зависимостей.
Структурные данные для тетрахлороаурата бис (пиридин-N-оксид) водорода, (PyNO)2H+... AuCl4– , хлорида бис (2-метилпиридин N-оксид) водорода, (2-MePyNO)2H+...Cl– , тетрахлоро-аурата бис (2,6-диметилпиридин) водорода, (2,6-Me2PyNO)2H+...AuCl4– были взяты из КСБД (коды BALGUQ10 [10], BOJBUX [13] и ZUB-DEF [9] соответственно), а для трибромида бис (4-хлорхинолин-N-оксид) водорода нами был проведен РСА [5].
Нами была написана утилита, позволяющая изменять конформацию заданной молекулы по некоторому заданному набору правил, сохраняя при этом промежуточные конформации в формате, предназначенном для программы ABINIT. Изменение конформации может представлять собой изменение длин связей, углов между связями, торсионных углов (в заданных пределах и с заданным шагом). Возможно совместное либо независимое варьирование нескольких конформационных параметров.
Мы промоделировали возможные конформационные переходы в катионах следующим образом: ароматический фрагмент вращали против часовой стрелки (глаз: O–N) вокруг соответствующей связи N–O с шагом 1o, используя написанную нами утилиту. Для каждой полученной конформации рассчитывали энергию из первых принципов при помощи программы ABINIT, и таким образом получали зависимость энергии от угла поворота. Угол в 0o соответствует конформации, структура которой была определена методом РСА. Полученная зависимость энергии от угла была переведена из ед. Хартри на молекулу в кДж/моль, а за нулевой уровень энергии был принят абсолютный минимум на каждой конкретной зависимости.
Для расчета энергий была использована программа ABINIT, реализующая метод функционала плотности. Расчеты выполнены в приближении локальной плотности с использованием TM псевдопотенциалов (Trouller, Martins) и базиса плоских волн.
РЕЗУЛЬТАТЫ
В случае катиона бис (пиридин-N-оксид) водорода (рис. 2) на энергетической поверхности наблюдаются два энергетических максимума (~ 20 кДж/моль), обусловленные некоторым сближением атома водорода при а -углеродном атоме пиридинового кольца и атома водорода O ...H+...O группы. В случае катиона бис (2-ме-тилпиридин-N-оксид) водорода (рис. 3) также наблюдается два основных максимума – 14 и 315 кДж/моль; первый максимум обусловлен сближением атома водорода при а -углеродном атоме пиридинового кольца и атома водорода O ...H+105...O группы, второй – сближением объемной метильной группы с атомами кислорода (второго лиганда) и водорода O...H+...O группы. Энергетическая зависимость для катиона бис (2,6-диметилпиридин-N-оксид) водорода (рис. 4) также имеет два значительных максимума (96 и 72 кДж/моль), появление которых обусловлено теми же факторами. Меньшие значения энергии в последнем случае по сравнению с катионом бис (2-метилпиридин-N-оксид) водорода, возможно, обусловлены снятием стерического напряжения между сближенными метильными группами в исходном катионе при вращении одного из лигандов.
Аналогичная картина наблюдается и для катиона бис (4-хлорхинолин N-оксид) водорода [5] (рис. 5).
Очевидно, что во всех приведенных случаях атом кислорода в лигандах находится в состоянии sp 3-гибридизации, поскольку экспериментально и расчетно найденный двугранный угол между плоскостями, проведенными через атомы хинолинового кольца и через атомы N–O ...H...O –N, составляет около 90o (соответствует 0o на рисунках). В случае sp 2-гибридного атома кислорода данный двугранный угол должен быть равным 0o (соответствует 90o и 270o на рисунках), что, однако, не исключает и sp 3-гиб-ридного состояния атома кислорода вследствие свободного вращения вокруг одинарной связи N–O. Однако если предположить возможность реализации sp 2-гибридного состояния атома кислорода в данном комплексе, то очевидно, что гео-
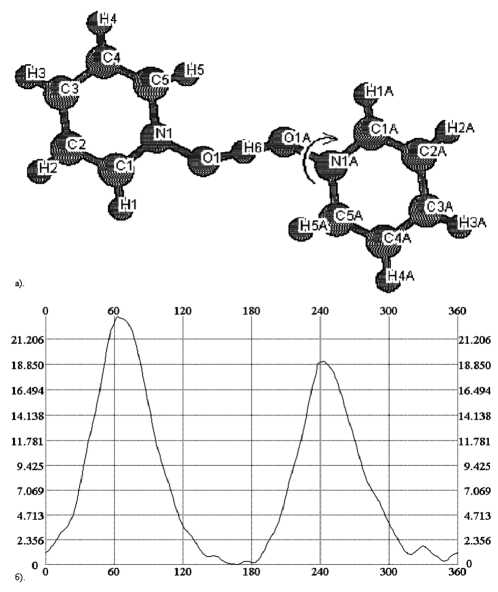
Рис. 2. Катион (PyNO)2H+: А – структура катиона и направление выполняемого в эксперименте поворота, Б – полученная зависимость энергии от угла поворота
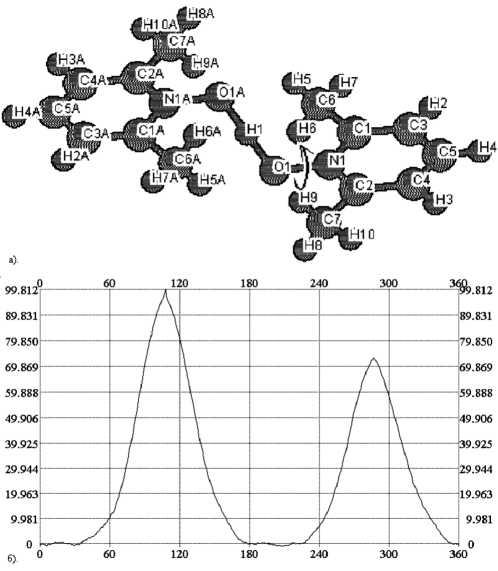
Риc. 4. Катион (2,6-Me2PyNO)2H+: А – структура катиона и направление выполняемого в эксперименте поворота, Б – полученная зависимость энергии от угла поворота
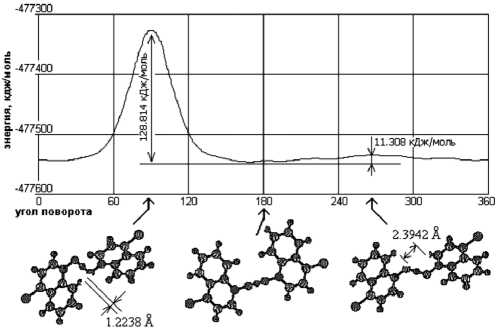
Рис. 5. Зависимость энергии иона (4-ClQO) H+ от угла поворота одной из хинолинных плоскостей вокруг соответствующей связи N–O
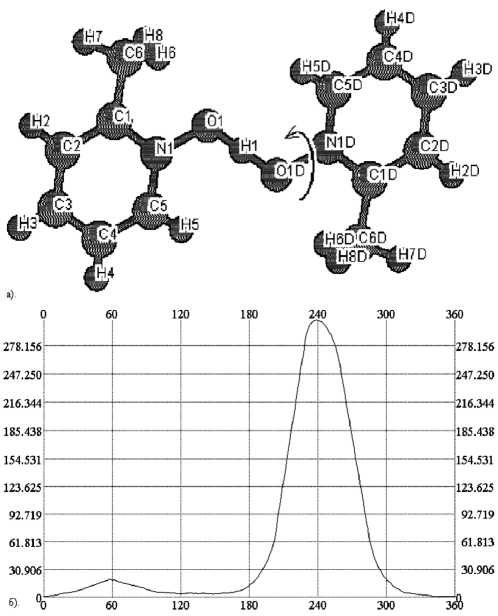
Рис. 3. Катион (2-MePyNO)2H+: А – структура катиона и направление выполняемого в эксперименте поворота, Б – полученная зависимость энергии от угла поворота
метрические параметры такого комплекса будут соответствовать максимумам на энергетической зависимости. Поэтому мы не исключаем того, что sp 2-гибридное состояние атома кислорода группы N–O в достаточно прочных комплексах вообще не встречается, а «O sp 2»-геометрия таких комплексов (двугранный угол пиридин – N–O–A = 0o; A – кислотный центр кислоты Брёнстеда-Лоури или Льюса [8]) может быть характерна только для комплексов с очень слабым орбитальным взаимодействием.
* Исследования проведены в рамках реализации Программы стратегического развития на 2012–2016 годы «Университетский комплекс ПетрГУ в научно-образовательном пространстве Европейского Севера: стратегия инновационного развития».
Список литературы Конформационный анализ катионов семисолей гетероароматических N-оксидов
- Андреев В. П., Вапиров В. В., Нижник Я. П., Алешина Л. Л., Семенова Т. А. Изменение гибридизации атома кислорода группы N-O при комплексообразовании N-оксидов пиридинов и хинолинов с v-акцепторами//Журнал общей химии. 2008. Т. 78. Вып. 5. С. 830-840.
- Андреев В. П., Нижник Я. П. Исследование комплексообразования N-оксидов пиридинов и хинолинов с трифторидом бора методом протонного магнитного резонанса//Координационная химия. 2007. Т. 33. № 9. С. 703-708.
- Андреев В. П., Нижник Я. П. Реакция N-оксида 4-нитрохинолина с хлоридом алюминия//Журнал органической химии. 2001. Т. 37. Вып. 1. С. 148-150.
- Андреев В. П., Рыжаков А. В. Активация v-акцепторами реакций нуклеофильного замещения в N-оксиде 4-нитрохинолина//Химия гетероциклических соединений. 1999. № 11. C. 1443-1461.
- Романов В. В., Нижник Я. П., Фофанов А. Д. Конформационный и структурный анализ трибромида бис (4-хлорхинолин-Ы-оксид) водорода//Журнал структурной химии (в печати).
- Рыжаков А. В., Вапиров В. В., Родина Л. Л. Молекулярные комплексы как промежуточные продукты в реакциях нуклеофильного замещения в ряду ароматических гетероциклов//Журнал органической химии. 1991. Т. 27. Вып. 5. C. 955-959.
- Рыжаков А. В., Родина Л. Л. Активация тетрацианоэтиленом реакций нуклеофильного замещения в гетероароматическом ряду//Журнал органической химии. 1994. Т. 30. Вып. 9. C. 1417-1420.
- Albini A., Pietra S. Heterocyclic N-Oxides. Boca Raton, Ann Arbor, Boston: CRC Press, 1991. 312 p.
- Hussain M. S. Intramolecular short hydrogen bonding. Synthesis and spectroscopic studies of pyridine N-oxide diadducts: X-ray structure of //Polyhedron. 1996. 15 (4). P. 645-649.
- Hussain M. S., Schlemper E. O. Crystal structure of hydrogenbis (pyridine N-oxide) tetrachloroaurate (III), revealing a short hydrogen bond//Journal of the Chemical Society, Dalton Trans., 1982. P. 751-755.
- Katritzky A. R., Lagowski J. M. Chemistry of the Heterocyclic N-oxides. London; N. Y.: Acad. Press, 1971. 587 p.
- Ochiai E. Aromatic Amine Oxides. Amsterdam: Elsevier, 1967. 444 p.
- Speakman J. C., Muir K. W.//Croatica chemica acta. 1982. Vol. 55. P. 233.


