Консенсус по лечению больных псевдомиксомой брюшины
Автор: Калинин А.Е., Гущин В., Доманский А.А., Кузнецова О.А., Шаленков В.А., Абудеев С.А., Козлов Н.А., Колышкин В.А., Привалов А.В., Рыбаков Е.Г., Абгарян М.Г., Сушков О.И.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.14, 2024 года.
Бесплатный доступ
Введение: Лечение больных псевдомиксомой брюшины — одна из сложных и нерешенных проблем в онкологии. В отечественной медицинской литературе тема псевдомиксомы брюшины представлена единичными разрозненными публикациями. В основных зарубежных национальных клинических руководствах данная тема также не освещена. Основными документами, определяющими подходы к лечению псевдомиксомы брюшины, являются национальные консенсусы. Настоящий Консенсус является первой попыткой предложить стандартизованные подходы к проблеме псевдомиксомы брюшины в России. Методы: Настоящий Консенсус принят на основании анализа литературных данных, анализа известных зарубежных консенсусов, а также в результате серии обсуждений с участием специалистов, имеющих значительный личный опыт в диагностике и лечении псевдомиксомы брюшины. Результаты: Итоговый документ Консенсуса представлен в формате расширенных клинических рекомендаций, освещающих все аспекты данной патологии — эпидемиологию, патогенез, классификацию, клиническую картину, диагностику, и возможные варианты лечения, наблюдение после лечения и организационные вопросы. Заключение: Настоящий Консенсус создан с целью предложить практикующим врачам оптимальную стратегию лечения псевдомиксомы брюшины, а также информировать врачей (как онкологов, так и общего профиля) об особенностях данной редкой патологии.
Псевдомиксома брюшины, муцинозная опухоль аппендикса, циторедукция, гипертермическая внутрибрюшинная химиотерапия, HIPEC
Короткий адрес: https://sciup.org/140307162
IDR: 140307162 | DOI: 10.18027/2224-5057-2024-14-3s1-4-13
Текст научной статьи Консенсус по лечению больных псевдомиксомой брюшины
Введение: Лечение больных псевдомиксомой брюшины — одна из сложных и нерешенных проблем в онкологии. В отечественной медицинской литературе тема псевдомиксомы брюшины представлена единичными разрозненными публикациями. В основных зарубежных национальных клинических руководствах данная тема также не освещена. Основными документами, определяющими подходы к лечению псевдомиксомы брюшины, являются национальные консенсусы. Настоящий Консенсус является первой попыткой предложить стандартизованные подходы к проблеме псевдомиксомы брюшины в России.
Методы: Настоящий Консенсус принят на основании анализа литературных данных, анализа известных зарубежных консенсусов, а также в результате серии обсуждений с участием специалистов, имеющих значительный личный опыт в диагностике и лечении псевдомиксомы брюшины.
Результаты: Итоговый документ Консенсуса представлен в формате расширенных клинических рекомендаций, освещающих все аспекты данной патологии — эпидемиологию, патогенез, классификацию, клиническую картину, диагностику, и возможные варианты лечения, наблюдение после лечения и организационные вопросы.
Заключение: Настоящий Консенсус создан с целью предложить практикующим врачам оптимальную стратегию лечения псевдомиксомы брюшины, а также информировать врачей (как онкологов, так и общего профиля) об особенностях данной редкой патологии.
Псевдомиксома брюшины (ПМБ) — это вторичное поражение брюшины, источником которого в большинстве случаев является муцинозная опухоль аппендикса. Значительно реже ПМБ развивается из первичной муцинозной опухоли урахуса, поджелудочной железы, яичников. ПМБ характеризуется скоплением в брюшной полости муцинозных масс, продуцируемых опухолевыми клетками, попадающих на поверхность брюшины в результате разрыва стенки червеобразного отростка. Муцин не всасывается с поверхности брюшины, вызывает воспалительную реакцию окружающих тканей, что приводит к нарушению кишечной проходимости и гибели пациентов несмотря на отсутствии инвазивного роста ПМБ и отдалённых ме- тастазов. Эта особенность ПМБ послужила основанием для международного консенсуса признать это заболевание злокачественным [1–3].
Заболеваемость
Заболеваемость ПМБ оценивают на уровне 3–4 операбельных случаев на миллион населения в год. В силу редкости, эффективное лечение требует концентрации больных в референсных центрах, обладающих соответствующим опытом и компетентностью. Основное внимание онкологического сообщества следует сосредоточить на осведомленности об оптимальных подходах к лечению больных ПМБ, предотвращении применения неэффективных методов и оптимальной маршрутизации пациентов [2–5].
Особенности патогенеза
ПМБ возникает в результате разрыва псевдокапсулы опухоли/стенки пораженного органа, в результате перфорации или неинвазивного (расслаивающего) роста муцинозных новообразований различного биологического потенциала, и попаданием в брюшную полость муцин-продуцирующих опухолевых клеток, которые имплантируются на поверхность брюшины и, в последующем, формируют типичную макроскопическую картину интраперитонеального скопления слизи, т. н. «желеобразный живот».
Формирование канцероматоза при ПМБ происходит в результате «феномена перераспределения» — перемещения муцин-продуцирующих эпителиальных клеток, вместе с перитонеальной жидкостью в результате перистальтики и под действием силы тяжести по брюшной полости. Основными местами всасывания жидкости из брюшины являются большой и малый сальники, брюшина диафрагмы, особенно правого купола, зона связки Трейца, илеоцекального перехода, полости таза. В этих областях происходит пролиферация опухолевых клеток и секреция муцина. Другой механизм перераспределения — гравитационный, при котором опухолевые скопления чаще образуются в нижних отделах брюшной полости.
Еще одной особенностью ПМБ является высокая склонность к распространению на поверхности брюшины муцинозных масс, при этом практически отсутствует лимфогенный и гематогенный пути метастазирования. Воспалительная реакция брюшины на муцин может быть настолько выраженной, что создаёт впечатление инвазивного роста опухоли, приводит к трудностям, а иногда и невозможности удаления муцинозных масс [2–4].
Клиническая картина
Клинические проявления ПМБ связанны с накоплением в брюшной полости муцина и характеризуется следующими основными симптомами: увеличение размера живота 19%, увеличение яичников по УЗИ/КТ 39%, грыжа 25%–40%, клиническая картина острого аппендицита 20%, асцит 4%, другие симптомы 13%.
Многие пациенты проходят долгий путь диагностики и попыток лечения до того, как попадут в референсные центры. Нередко подвергаются необоснованным операциям: например, правосторонней гемиколэктомии или овариоэктомии с сохранением опухоли аппендикса, что ухудшает результаты последующей циторедуктивной операции. Иногда пациентам проводят множество циклов неэффективной полихимиотерапии в надежде «уменьшить опухоль и улучшить «резектабельность» [1–6].
1. КЛАССИФИКАЦИЯ, СТАДИРОВАНИЕ
ПМБ — термин, обобщающий все случаи опухолей брюшины, характеризующиеся выраженной продукцией внеклеточной слизи. Эта гетерогенная группа опухолей включает как новообразования с пограничным, так и со злокачественным биологическим потенциалом (карциномы). Наиболее частым источником данных новообразования являются органы пищеварительной системы, доминирующее положение среди которых занимает червеобразный отросток. Исторически, источником ПМБ у женщин считались муцинозные опухоли яичника, и только в 1990-х годах было установлено, что подавляющее большинство ПМБ происходит из первичных опухолей желудочно-кишечного тракта (ЖКТ). На практике это означает, что при выявлении «желеобразного живота» при лапароскопии или лапаротомии гинекологам следует тщательно осматривать аппендикс и другие органы ЖКТ. Более того, если аппендектомия не представляет сложности, ее следует выполнить как эксцизионную биопсию, тотально исследовать удаленный отросток, что во многих случаях может способствовать установлению диагноза.
Среди новообразований червеобразного отростка (табл. 1) наиболее часто встречается аппендикулярная муцинозная опухоль низкой степени злокачественности (low grade appendiceal mucinous neoplasm/LAMN), заметно реже в стенке органа могут развиться аппендикулярная муцинозная опухоль высокой степени злокачественности (high grade appendiceal mucinous neoplasm/HAMN), муцинозная аденокарцинома с/без перстневидноклеточным компонентом [7,8].
Таблица 1. Классификация ВОЗ (2019). Эпителиальные новообразования и предопухолевые процессы червеобразного отростка
|
Нозологическая единица |
Код МКБ-О |
|
Аппендикулярная муцинозная опухоль низкой степени злокачественности |
8480/1 |
|
Аппендикулярная муцинозная опухоль высокой степени злокачественности |
8480/2 |
|
Аденокарцинома БДУ |
8140/3 |
|
• Слизистая аденокарцинома |
8480/3 |
|
• Перстневидноклеточная аденокарцинома |
8490/3 |
|
• Бокаловидноклеточная аденокарцинома |
8243/3 |
|
Недифференцированный рак |
8020/3 |
Аппендикулярная муцинозная опухоль, независимо от степени злокачественности (low grade, high grade), не относится к истинным карциномам и не подлежит гистологической градации, характерной для аденокарцином других отделов пищеварительной системы. Напротив, все аденокарциномы, включая перстневидноклеточный рак, возникшие в стенке червеобразного отростка, подлежат гистологической градации в соответствии с действующими критериями Классификации ВОЗ (2019). Для того, чтобы подчеркнуть серьезность прогноза неинвазивных муцинозных опухолей аппендикса (табл. 2), консенсус специалистов по лечению перитонеального карциноматоза рекомендует считать ПМБ раком [7–8].
Таблица 2. Градация псевдомиксомы брюшины в зависимости от вида опухоли-источника
|
Нозологическая единица (ВОЗ 2019) |
Гистологическая градация перитонеальной диссеминации (псевдомиксомы) |
|
Аппендикулярная муцинозная опухоль низкой степени злокачественности (LAMN) |
Псевдомиксома брюшины низкой степени злокачественности/low grade (устаревший синоним — диссеминированный аденомуци-ноз брюшины/DPAM) |
|
Аппендикулярная муцинозная опухоль высокой степени злокачественности (HAMN) |
Псевдомиксома брюшины высокой степени злокачественности/high grade (устар. син. — диссеминированный аденомуциноз брюшины/DPAM) |
|
Инвазивная муцинозная аденокарцинома без перстневидноклеточного компонента |
Псевдомиксома брюшины высокой степени злокачественности/high grade (устар. син. — муцинозный перитонеальный карцинома-тоз/PMCA) |
|
Муцинозная аденокарцинома с перстневидноклеточным компонентом |
Псевдомиксома брюшины высокой степени злокачественности/high grade (устар. син. — муцинозный перитонеальный карцинома-тоз/PMCA) |
Стадирование
Гистологический диагноз ПМБ может быть сложным (табл. 3), поэтому целесообразно получить второе мнение и консультации у патологов центров с опытом лечения таких пациентов.
В случае роста муцинозной опухоли низкой/высо-кой степени злокачественности в пределах мышечного слоя аппендикса, она стадируется как pTis. Градации pT1-T2 отсутствуют. При распространении в субсерозный слой — как pT3, при выходе на поверхность серозной оболочки отростка — pT4a. Наличие бесклеточного муцина на поверхности брюшины классифицируется как pM1a (при наличии клеток в скоплениях слизи — pM1b) [9–11].
1.1. Особенности формулировки диагноза
В настоящее время правило формирования диагноза складывается следующим образом — при морфологически подтвержденной связи опухоли червеобразного отростка и псевдомиксомы брюшины диагноз классифицируется кодом С18.1, или указывается другой морфологически идентифицированный источник (яичники, толстая кишка). В случае если источник возникновения ПМБ не идентифицирован код заболевания выставляется С48.2 [7].
2. ДИАГНОСТИКА
Анамнез, клинический осмотр, пальпация живота, ректальное (и вагинальное) обследование, а также МРТ малого таза и КТ грудной клетки, живота и малого таза с двойным контрастированием позволяют оценить вопрос об операбельности пациентов с ПМБ. Хороший функциональный статус и отсутствие симптомов непроходимости ЖКТ при наличии больших опухолевых масс в животе обычно говорит о неинвазивном характере роста опухоли, возможности полной циторедукции (особенно у пациентов без предварительных хирургических попыток удалить опухоль) и аппендикулярном происхождении карциноматоза.
Диагноз ПМБ уточняется патоморфологическим исследованием, а также результатами инструментальных методов обследования. Забор материала для исследования может быть сделан чрескожно под УЗИ или КТ наведением, или при лапароскопии. В обоих случаях проколы брюшной стенки, которые следует выполнять по средней линии, что не всегда удобно для лапароскопии. Это позволит в дальнейшем иссечь имплантационные метастазы при срединной лапаротомии и предотвращает обширные резекции брюшной стенки.
Первичное обследование должно быть проведено до начала любого вида лечения и включает в себя:
Таблица 3. Классификация муцинозных опухолей аппендикса низкой степени злокачественности AJCC1 8-я редакция и критерии установления стадии2
|
Стадия |
Определение |
Критерии |
|
pTis |
Опухоль ограничена мышечной оболочкой аппендикса |
|
|
pT3 |
Опухоль или бесклеточный муцин присутствуют под серозной оболочкой, но не перфорируют последнюю |
• Фокусы опухоли или муцина, пенетрирующие мышечную оболочку в субсерозу, следует оценивать как рТ3 |
|
рТ4а |
Опухоль или бесклеточный муцин присутствуют на серозной оболочке |
|
|
М1а |
Бесклеточный муцин в брюшной полости |
• Отсутствие эпителия при тщательном исследовании |
|
М1b |
Муцин в брюшной полости с опухолевыми депозитами |
• Тщательное исследование опухолевых депозитов должно быть проведено с целью установления степени злокачественности G1, G2 и G3 |
• СКТ органов грудной клетки, брюшной полости с внутривенным и пероральным контрастированием;
• СКТ малого таза и\ или МРТ с внутривенным контрастированием;
• тотальная колоноскопия;
• ЭГДС;
• Определение уровня онкомаркеров: РЭА, CA19-9, СА 125.
3. ЛЕЧЕНИЕ
3.1. Хирургическое лечение ± внутрибрюшиннаягипертермичеcкая химиотерапия
Выполнение позитронно-эмиссионной томографии с ПЭТ-КТ не рекомендуется.
Если диагноз ПМБ установлен, пациентам показано лечение с циторедуктивной целью: в результате полного удаления всей видимой опухоли, т. е. выполнения полной циторедукции СС0-СС1 (CC0-отсутствие визуализируемой опухоли, CC1-присутствуют опухолевые узлы до 0,25 см; нет понятия невовлечённого края резекции) ожидается значительная безрецидивная выживаемость: дольше 10–20 лет [13]. Выбор лечебной тактики осуществляется на мультидисциплинарном консилиуме с участием хирурга, химиотерапевта, патолога и рентгенолога, на основании результатов дооперационного обследования и функционального состояния больного, при необходимости могут быть привлечены другие специалисты. Лечебная тактика определяется степенью распространенности опухолевого процесса, функциональным состоянием пациента и возможностями и опытом референсного центра. Основным методом радикального лечения псевдомиксомы брюшины является хирургический.
Основным методом лечения ПМБ является хирургический. У пациентов с ПМБ низкой степени злокачественности, после полной циторедукции в сочетании с гипертермической внутрибрюшинной химиотерапией, 10-летняя выживаемость достигает 80%, при инвазивном муцинозном раке — 45%.
При выполнении циторедуктивной операции необходимо начинать операцию с широкой лапаротомии от мечевидного отростка до лона для тщательной ревизии брюшины.
Возможны два варианта доступов для выполнения циторедуктивных операций: чрезбрюшинный и внебрю-шинный. Во втором случае окончательная ревизия проводится после мобилизации большей части париетальной брюшины. При ревизии следует обратить особое внимание на следующие зоны брюшной полости: между селезенкой и диафрагмой, между диафрагмой и правой долей печени, область нижней полой вены со стороны малого сальника, капсула SI печени, область венозной связки печени, круглая связка печени на всем протяжении до уровня гепато-дуоденальной связки (при необходимости, рассечь паренхиму вокруг круглой связки печени), передняя и задняя поверхности гепато-дуоденальной связки, брюшина желчного пузыря, область связки Трейца (после ее рассечения), брюшина малого таза (особо обращая внимание на брюшину ректо-вагинального/ректо-везикального пространств).
На основании данных ревизии, необходимо интраоперационно рассчитать индекс перитониального канцеро-матоза (ИПК) (рис. 1). Индекс перитонеального карциноматоза представляет собой сумму значений, присвоенных каждому из отделов брюшной полости, амплитуда значении составляет 0–39.
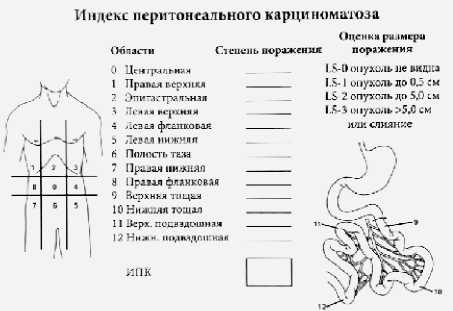
Рисунок 1. Индекс перитонеального канцероматоза
Целесообразно иссекать послеоперационные рубцы (рубец кожи, подкожной клетчатки, апоневроза или мышцы с брюшиной) после предшествующих операций, выполненных по поводу муцинозной опухоли аппендикса и/или псевдомиксомы брюшины.
Не следует резецировать органы или участки брюшины, если на них не обнаружено видимой опухоли.
При ПМБ низкой степени злокачественности опухоль часто не является инвазивной и может быть удалена различными способами (марлей или иным механическим путем) с прилежащей париетальной или висцеральной брюшины.
Основным лимитирующим фактором, ограничивающим выполнение полной циторедукции, является тотальное поражение тонкой кишки метастазами. Минимальная длина оставшейся части тонкой кишки должна быть более 90 см.
Выполнение неполного удаления опухоли (СС2–3) не улучшает отдаленные результаты и не должно быть целью циторедуктивного лечения. Однако, в сложных случаях бывает невозможно оценить выполнимость полной циторедукции за первые несколько часов операции. Тем не менее, частота незапланированных неполных циторедукций в референсном центре не должна превышать 10–15%. Паллиативная циторедукция, с цельюустранения конкретного симптома опухоли — допустимый и часто единственно возможный вид оперативного лечения ПМБ, когда полная циторедукция невозможна.
Циторедуктивные операции могут длиться более 10 часов и сопровождаться дистрибутивным шоком (с низким периферическим сопротивлением сосудов) в ответ на обширную хирургическую травму и геморрагическим шоком даже при контролируемой хирургом кровопотере, которая, однако, может длиться долго. Поэтому, объём операции должен коррелировать с опытом хирургической и анестезиологической бригады, а также вспомогательных служб в послеоперационном периоде. Некоторые центры ограничивают объемы операции и не рассматривают возможность циторедукции у пациентов с высоким индексом канцероматоза (ИПК, см. далее) [11,13–17].
3.2 Внутрибрюшинная гипертермичеcкая химиотерапия
При достижении полной циторедукции целесообразно дополнить ее гипертермической внутрибрюшинной химиотерапией (HIPEC). Несмотря на то, что роль последней остается неясной, ретроспективные исследования указывают на эффективность выполнения полной циторедукции в комбинации с HIPEC. Так, проведение HIPEC предотвращает накопление асцита в 90% случаев. Проспективное рандомизированное исследование для ответа на этот вопрос в настоящее время невыполнимо, однако имеется широкий консенсус среди цитоторедуктивных хирургов и пациентов о необходимости HIPEC.
Схемы, применяемые для гипертермической внутрибрюшинной химиотерапии приведены в таблице 4.
Процедура HIPEC может быть выполнена по методике открытого и закрытого контуров. При наиболее часто применяемом закрытом контуре одну или две дренажные трубки для введения химиопрепаратов в брюшную полость следует установить в малый таз, два дренажа над левой долей печени для эвакуации химиопрепарата, температура удаляемой жидкости из брюшной полости должна контролироваться с помощью датчика температуры и быть равной 42°С. При вскрытии плевральной полости во время удаления брюшины с диафрагмы, возможна химиоперфузия плевральной полости [4,6].
Формирование анастомозов (восстановление непрерывности желудочно-кишечного тракта) после резекций может выполняться как до, так и после процедуры HIPEC. При этом частота несостоятельности анастомозов сопоставима при обоих подходах. Однако техническое удобство формирования анастомозов перед HIPEC является значимым при использовании закрытого контура [18].
Таблица 5. Рекомендуемые режимы лекарственной терапии ПМБ high grade
|
FOLFOX-6 |
Оксалиплатин 85 мг/м 2 2-часовая инфузия в 1-й день, кальция фолинат 400 мг/м 2 в/в в течение 2 часов с последующим болюсом 5-фторурацила 400 мг/м 2 в/в струйно и 46-часовой инфузией 5-фторурацила 2400 мг/м 2 (по 1200 мг/м 2 /сут.). Начало очередного курса — на 15-й день |
|
XELOX |
Оксалиплатин 130 мг/м 2 в 1-й день, капецитабин 2000 мг/м 2 в сутки 1–14 дни. Начало очередного курса — на 22-й день |
|
Бевацизумаб |
7,5 мг/кг в виде 90–60–30-минутной инфузии каждые 3 недели или 5 мг/кг каждые 2 недели (в зависимости от применяемого режима химиотерапии может применяться с любой комбинацией (FOLFOX/FOLFIRI/ XELOX/XELIRI или монохимиотерапией (капецитабин, de Gramont, бевацизумаб) |
|
FOLFIRI |
Иринотекан 180 мг/м 2 в виде 90-минутной инфузии в 1-й день, кальция фолинат 400 мг/м 2 в/в в течение 2 ч с последующим болюсным введением 5-фторура-цила 400 мг/м 2 в/в струйно и 46-часовой инфузией 5-фторурацила 2400 мг/м 2 (по 1200 мг/м 2 в сутки). Начало очередного курса на 15-й день |
|
XELIRI |
Иринотекан 180–200 мг/м 2 90-минутная инфузия в 1-й день, капецитабин 1600–1800 мг/м 2 в сутки 1–14 дни. Начало очередного курса — на 22-й день |
|
Иринотекан |
250–300 мг/м 2 в 1-й день. Начало очередного курса на 22-й день или 180 мг/м 2 в 1 день. Начало курса на 15 день. |
|
Капецитабин |
Капецитабин 1600–2500 мг/м 2 /сут. внутрь в 1–14-й дни. Начало очередного курса — на 22-й день. Доза может быть снижена до 1250–2000 мг/м 2 /сут. внутрь в 1–14-й дни для улучшения переносимости лечения и приверженности терапии |
|
De Gramont |
Кальция фолинат 400 мг/м 2 в/в в течение 2 часов с последующим болюсом 5-фторурацила 400 мг/м 2 и с последующей 46-часовой инфузией 5-фтор-урацила 2400 мг/м 2 (по 1200 мг/м 2 /сут.). Начало очередного курса — на 15-й день |
3.3. Особенности интраоперационного ведения пациентов
Предоперационная подготовка проводится согласно протоколам ERAS (Guidelines for Perioperative Care in Cytoreductive Surgery (CRS) with or without hyperthermic IntraPEritoneal chemotherapy: Enhanced recovery after surgery (ERAS®) Society Recommendations).
Индукция в анестезию при циторедуктивной операции с HIPEC проводят с использованием анестетиков короткого действия (пропофол 1,5–2,5 мкг/кг) и миорелаксантов (рокуроний 0,6 мг/кг). Поддержание анестезии может быть достигнуто либо с помощью ингаляционных ане- стетиков (севофлуран, десфлуран) с поддержанием МАК около 1,0, либо с использованием тотальной внутривенной анестезии (пропофол, фентанил) под контролем глубины анестезии (BIS-мониторинг). Из-за большой длительности циторедуктивных операций обезболивание должно быть мультимодальным.
Мультимодальная анестезия включает в себя применение дексмедетомидина, лидокаина, кетамина, сульфата магния, а также применение блокаторов NMDA-рецепторов (прегабалин, габапентин). Дополнительное использование вышеперечисленных адьювантов входит в алгоритм опиат-сберегающей методики ведения анестезии, что снижает риск респираторных осложнений и обеспечивает более быстрое восстановление функции желудочно-кишечного тракта. Эпидуральная анестезия при обширных лапаротомиях также снижает количество респираторных осложнений. Представляет интерес эпидуральная анестезия на уровне грудных позвонков продолжительностью более 72 часов, поскольку она способствует ранней активизации и лучшему восстановлению в раннем послеоперационном периоде, а также в целом высокой выживаемости пациентов.
У данной категории пациентов может наблюдаться широкий спектр проблем со стороны дыхательной, сердечнососудистой, мочевыделительной и свертывающей систем во время операции и раннем послеоперационном периоде.
Мониторинг и оценка интраоперационного волемического статуса пациента играет немаловажную роль во время проведения циторедуктивной операции с HIPEC. Массивная потеря жидкости за счет большой раневой поверхности, кровопотери и острой хирургической травмы в течение достаточно продолжительного времени, а также внутрибрюшная гипертермия 42°С в течение 30–90 мин, дополнительно приводят к снижению общего периферического сопротивления, усугубляя гиповолемию. Гиповолемия приводит к гипотензии и тахикардии и требует активной волемической поддержки из расчета 9–12 мл/кг/ч на протяжении всего хирургического этапа с поддержанием адекватного темпа диуреза из расчета 1 мл/кг/ч. Некоторые используемые химиопрепараты оказывает нефротоксическое действие, что потенциально может привести к развитию почечной недостаточности. Согласно данным литературы в первые 24 часа после операции пациенты теряют до 10 л жидкости через установленные дренажи.
Волемический статус необходимо восполнять растворами кристаллоидов, а также раствором альбумина из расчета 700 г/сут. Оценку волемического статуса следует проводить под контролем центрального венозного давления, в отдельных случаях использовать инвазивный мониторинг гемодинамики с оценкой внутрисосудистой воды в легких, ОПСС и сердечного выброса, что актуально в условиях быстро меняющейся гемодинамической картины.
Развитие внутрибрюшной гипертензии на фоне асцита, является еще одним неблагоприятным фактором, который приводит к снижению остаточной функциональной способности легких, и развитию гипоксемии вследствие снижения индекса оксигенации PaO/FiO. Кроме того, по- вышенное внутрибрюшное давление может приводить к аспирации во время индукции. Снижение оксигенации может наблюдаться и во время проведения процедуры HIPEC, так как раствор, циркулирующий в брюшной полости под давлением, способствует усугублению внутри-брюшной гипертензии и нарушению вентиляционно-перфузионных отношений с последующим формированием ателектазов в легких. Способами решения данной проблемы, является проведение протективной искусственной вентиляции легких с применением низких дыхательных объемов (< 8 мл/кг) и использование положительного давления в конце выдоха (PEEP) на уровне 9–11 см H2O, что практически не отражается на гемодинамике.
Интраоперационный контроль температуры тела входит в протоколы FastTrack при циторедуктивной хирургии. Гипотермия (< 36°C), во время циторедуктивного этапа сопровождается выраженными метаболическими нарушениями и способствует развитию гипокоагуляции, что создает проблемы с хирургическим гемостазом, усугубляя интраоперационную кровопотерю. Поддержание нормо-термии в основном достигается физическими методами согревания (подогревание инфузионных и ирригационных растворов, тепловой фен).
Во время процедуры HIPEC, наоборот, необходимо проводить коррекцию гипертермии. Диапазон безопасной для пациента температуры составляет 36–41°С. Мониторинг температуры тела осуществляется установкой чрез-пищеводного датчика, а также расположением датчиков в брюшной полости поддиафрагмально и области малого таза. Коррекция гипертермии проводится также физическими методами охлаждения (охлаждающий матрас, конвекция, пакеты со льдом).
Склонность к диффузным кровотечениям может наблюдаться особенно к концу операции. Основные причины этого осложнения: гипотермия, гипокальциемия и коагулопатия потребления. В большинстве случаев коагулопатия — это клинический диагноз, который устанавливается анестезиологом вместе с хирургом по результатам наблюдения за раневыми поверхностями. Лечение диффузных кровотечений направлено на коррекцию гипотермии, гипокальциемии, переливании компонентов плазмы, особенно при трансфузии значительных объемов эритроцитарной массы [19–21].
3.3. Рецидивы псевдомиксомы
Как при ранних, так и при поздних рецидивах ПМБ показано выполнение повторной циторедуктивной операции. Медиана ОВ после повторных полных циторедукций составляет 80,2 мес.: при ПМБ низкой степени злокачественности — 174,1 мес., при псевдомиксоме высокой степени злокачественности — 42 мес. Также целесообразно выполнить повторную гипертермическую внутрибрюшинную химиотерапию HIPEC после выполнения полной циторедукции, с применением химиопрепарата, отличного от того, который был использован ранее [22,23].
4. СИСТЕМНАЯ ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
Системная лекарственная терапия при ПМБ имеет ограниченные показания к применению. Учитывая, что в большинстве случаев изначальным субстратом ПМБ являются опухоли аппендикса различного потенциала злокачественности, наиболее применимыми схемами являются режимы, применяемые в лечении КРР (содержащие фтор-пиримидины, оксалиплатин, иринотекан, анти-VEGF препарат бевацизумаб).
4.1. ПМБ низкой степени злокачественности (low grade)
Проведение системной лекарственной терапии (неоадъювантной, адъювантной, паллиативной) не улучшает отдаленные результаты лечения пациентов (ВБП, ОВ) и не рекомендована.
По данным трех ретроспективных исследований неоадъювантная химиотерапия не улучшила ВБП и ОВ. При подгрупповом анализе назначение неоадъювантной химиотерапии при ПМБ низкой степени злокачественности являлось негативным прогностическим фактором.
В адъювантном режиме системная химиотерапия также не улучшила результаты у пациентов с ПМБ низкой степени злокачественности. Более того, назначение системной лекарственной терапии при нерезектабельной ПМБ низкой степени злокачественности несет больше токсичности, нежели потенциальной пользы, в связи с чем в случае отсутствия выраженных симптомов пациентам может быть предложено динамическое наблюдение. Целями такого наблюдения являются определение необходимости для паллиативной операции или другого лечения (парентеральное питание, чрезкожное дренирование почек, пункционная гастростома, направление в хоспис) при развитии симптомов опухоли.
4.2. ПМБ высокой степени злокачественности (high grade)
При ПМБ высокой степени злокачественности системная терапия может быть назначена в адъювантном режиме, а также как паллиативная опция.
Назначение химиотерапии в неоадъювантном режиме при ПМБ высокой степени злокачественности не улучшило ВБП и ОВ. Напротив, адъювантная химиотерапии после проведения циторедуктивных операций была связана с увеличением ОВ в случае низкой степени дифференцировки аденокарциномы аппендикса. Другие работы демонстрируют противоречивые результаты в группе пациентов ПМБ высокой степени злокачественности: увеличение ВБП без влияния на ОВ или же даже достоверное снижение ОВ при добавлении адъювантной ХТ. При прямом сравнении 180 пациентов с ПМБ высокой степени злокачественности после полной циторедукции СС0–1 добавление адъювант- ной ХТ (капецитабин/5ФУ/FOLFIRI/FOLFOX/FOLFIRINOX) не отразилось на увеличении ОВ (медиана группы адъювантной ХТ 53 против 75 месяцев при наблюдении, p = 0,56) вне зависимости от факторов риска (наличие перстневидных клеток, пораженные лимфоузлы, PCI ≥ 20). В случае же проведения неполной циторедукции (CC2–3) пациентам с ПМБ высокой степени злокачественности было получено улучшение показателей ОВ (медиана 12 против 26 месяцев) в случае добавления адъювантной ХТ (в 65% случаев — ок-салиплатин-содержащей). Изучение роли системной лекарственной терапии в рамках паллиативного лечения нере-зектабельных форм псевдомиксомы ограничено сериями клинических случаев. При применении режима системной терапии (в большинстве случаев режимы FOLFOX/XELOX, реже капецитабин/5ФУ или FOLFIRI) медиана ВБП и ОВ составили 6–8 и 26–61 месяца, соответственно. Очевидно, наиболее оправданным назначение лекарственной терапии в стандартных режимах является при нерезектабельной ПМБ высокой степени злокачественности. Добавление к стандартным режимам паллиативной терапии анти-VEGF препарата бевацизумаба позволило увеличить ВБП (медиана 4 против 9 месяцев) и ОВ (медиана 42 против 76 месяцев) пациентов с нерезектабельной ПМБ высокой степени злокачественности. Применяемые в описанных работах режимы химиотерапии представлены в табл. 5 [24–32].
5. НАБЛЮДЕНИЕ ПОСЛЕ ПЕРВИЧНОГО ЛЕЧЕНИЯ
Большинство рецидивов псевдомиксомы низкой степени злокачественности выявляются в срок от 3 до 7 лет после операции.
Под наблюдением подразумевают регулярный сбор жалоб и физикальный осмотр больных, выполнение спиральной компьютерной томографии грудной клетки, СКТ с двойным контрастированием, брюшной полости и малого таза, а также исследование маркеров крови: РЭА, CA19-9, СА 125, по определенному графику: первое (референсное) исследование рекомендуется сделать через 3 месяца после операции, когда послеоперационные изменения (например, скопление жидкости) минимальны, как минимален и риск рецидива, в последующем каждые 6 мес. — в течение первых 5 лет, далее ежегодно до 10 лет. Цель наблюдения — диагностика рецидива, оценка возможности повторной циторедукции, паллиативной химиотерапии, симптоматических манипуляций, лекарственного симптоматического лечения.
Выполнение ПЭТ-КТ в качестве метода мониторинга не целесообразно.
6. ПРОГНОЗ
Прогноз аппендикулярной муцинозной опухоли определяется стадией заболевания: опухоли, растущие в пределах аппендикса, отличаются очень хорошим прогнозом, тогда как выживаемость больных снижается при перитонеальной диссеминации. В свою очередь, прогноз диссеминированных аппендикулярных муцинозных опухолей определяется степенью злокачественности эпителиального компонента, распространенностью опухоли по брюшине, возможностью достижения максимальной видимой циторедукции при операции.
7. ТРЕБОВАНИЯК ЦИТОРЕДУКТИВНЫМ ЦЕНТРАМ
Следуя примеру международных консенсусов специалистов по лечению перитонеального карциноматоза, референсные центры по лечению ПМБ должны иметь необходимые службы для безопасного лечения пациентов после циторедуктивных операций: реанимацию, круглосуточную возможность выполнения компьютерной томографии с внутривенным контрастированием, дежурных интервенционных радиологов (для дренирования интра-абдоминальных патологических образования), дежурных хирургов с опытом лечения пациентов после циторедукций. Ожидается, что референсные центры регулярно публикуют данные об осложнениях и постоперационной смертности (90 дней), частоте неполных (CC2–3) циторедукций, выживаемости пациентов по гистологическим подтипам и полноте циторедукций. Это позволит принимать решения о балансе рисков и преимуществ оперативного лечения с учетом конкретных данных.
8. ПАЦИЕНТЫ
Пациенты с ПМБ имеют ряд особенностей по сравнению с другими онкологическими больными. Во время первичного обследования и установления диагноза они чувствуют себя одинокими, жертвами «плохой медицины». Малодоступная и разноречивая информация и значительный спектр онкологических исходов ПМБ путают самых образованных и осведомленных пациентов. Восстановление после циторедуктивных операций требует значительных временных, материальных и социальных ресурсов. Однако, долгосрочные результаты с возможностью вести обычный образ жизни без продолженного системного лечения пациенту с IV стадией опухоли превращают безнадежного больного в пациента с одним из самых благоприятных исходов, которые только встречаются в онкологии. Сообщества таких пациентов исторически имеют большое влияние на развитие онкологии перитонеального карциноматоза.
8.1. Паллиативная помощь пациентам с ПМБ
Список литературы Консенсус по лечению больных псевдомиксомой брюшины
- Sugarbaker P.H. Are there curative options to peritoneal carcinomatosis?. Ann Surg 2005;242(5):748-751. https://doi.org/10.1097/00000658-200511000-00023
- Smeenk R.M., van Velthuysen M.L., Verwaal V.J., Zoetmulder F.A. Appendiceal neoplasms and pseudomyxoma peritonei: a population based study. Eur J Surg Oncol. 2008;34(2):196-201. https://doi.org/10.1016/j.ejso.2007.04.002
- Sugarbaker P.H. New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome? Lancet Oncol 2006;7(1):69-76. https://doi.org/10.1016/S1470-2045(05)70539-8
- Циторедуктивная хирургия и периоперационная химиотерапия для лечения опухолей с перитонеальной диссеминаций. Руководство и видеоатлас. Второе издание. Под редакцией Пол Шугабейкер, главный редактор русскоязычного издания Вадим Гущин 2019.
- Govaerts K., Lurvink R.J., De Hingh IHJ.T., et al. Appendiceal tumours and pseudomyxoma peritonei: Literature review with PSOGI/EURACAN clinical practice guidelines for diagnosis and treatment. Eur J Surg Oncol 2021;47(1):11-35. https://doi.org/10.1016/j.ejso.2020.02.012
- Chicago Consensus Working Group. The Chicago Consensus on Peritoneal Surface Malignancies: Management of Colorectal Metastases. Ann Surg Oncol 2020;27(6):1761-1767. https://doi.org/10.1245/s10434-020-08315-x
- WHO Classification of Tumours Editorial Board. Digestive system tumours (5th edition). - IARC; Lyon, 2019:35-155.
- Carr N.J., Cecil T.D., Mohamed F., et al. A Consensus for Classification and Pathologic Reporting of Pseudomyxoma Peritonei and Associated Appendiceal Neoplasia: The Results of the Peritoneal Surface Oncology Group International (PSOGI) Modified Delphi Process. Am J Surg Pathol 2016;40(1):14-26.9. https://doi.org/10.1097/PAS.0000000000000535
- AJCC Staging https://www.facs.org/quality-programs/cancer-programs/american-joint-committee-on-cancer/ajcc-staging-online
- Umetsu S.E., Kakar S. Staging of appendiceal mucinous neoplasms: challenges and recent updates. Hum Pathol 2023;132:65-76. https://doi.org/10.1016/j.humpath.2022.07.004
- National Comprehensive Cancer Network v.5.2024 https://www.nccn.org/guidelines/guidelines-detail?category = 1&id = 1428
- Carmignani C.P., Hampton R., Sugarbaker C.E., et al. Utility of CEA and CA 19-9 tumor markers in diagnosis and prognostic assessment of mucinous epithelial cancers of the appendix. J Surg Oncol 2004;87(4):162-166. https://doi.org/10.1002/jso.20107
- Munoz-Zuluaga C.A., King M.C., Diaz-Sarmiento V.S., et al. Defining “Complete Cytoreduction» After Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy (CRS/HIPEC) for the Histopathologic Spectrum of Appendiceal Carcinomatosis. Ann Surg Oncol 2020 Dec;27(13):5026-5036. https://doi.org/10.1245/s10434-020-08844-5, PMID: 32705513.
- Chua TC, Moran BJ, Sugarbaker PH, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol. 2012;30(20):2449-2456. https://doi.org/10.1200/JCO.2011.39.7166
- Nikiforchin A., Sardi A., King MC., et al. Safety of Nephrectomy Performed During CRS/HIPEC: A Propensity Score-Matched Study. Ann Surg Oncol 2023;30(4):2520-2528. https://doi.org/10.1245/s10434-022-12862-w
- Glehen O., Mohamed F., Sugarbaker P.H. Incomplete cytoreduction in 174 patients with peritoneal carcinomatosis from appendiceal malignancy. Ann Surg 2004 Aug;240(2):278-85. https://doi.org/10.1097/01.sla.0000133183.15705.71
- Baratti D., Kusamura S., Nonaka D., et al. Pseudomyxoma peritonei: biological features are the dominant prognostic determinants after complete cytoreduction and hyperthermic intraperitoneal chemotherapy. Ann Surg. 2009;249(2):243-249. https://doi.org/10.1097/SLA.0b013e31818eec64
- Somashekhar S.P., Rohit K.C., Ramya Y., et al. Bowel Anastomosis After or Before HIPEC: A Comparative Study in Patients Undergoing CRS + HIPEC for Peritoneal Surface Malignancy. Ann Surg Oncol 2022 Jan;29(1):214-223. https://doi.org/10.1245/s10434-021-10661-3
- Hübner M., Kusamura S., Villeneuve L., et al. Guidelines for Perioperative Care in Cytoreductive Surgery (CRS) with or without hyperthermic IntraPEritoneal chemotherapy (HIPEC): Enhanced recovery after surgery (ERAS®) Society Recommendations - Part I: Preoperative and intraoperative management. Eur J Surg Oncol 2020;46(12):2292-2310. https://doi.org/10.1016/j.ejso.2020.07.041
- Hübner M., Kusamura S., Villeneuve L., et al. Guidelines for Perioperative Care in Cytoreductive Surgery (CRS) with or without hyperthermic IntraPEritoneal chemotherapy (HIPEC): Enhanced recovery after surgery (ERAS®) Society Recommendations - Part II: Preoperative and intraoperative management. Eur J Surg Oncol 2020;46(12):2311-2323. https://doi.org/10.1016/j.ejso.2020.08.006
- Solanki S.L., Mukherjee S., Agarwal V., et al. Society of Onco-Anaesthesia and Perioperative Care consensus guidelines for perioperative management of patients for cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (CRS-HIPEC). Indian J Anaesth 2019;63(12):972-987. https://doi.org/10.4103/ija.IJA_765_19
- Lopez-Ramirez F., Gushchin V., Sittig M., et al. Iterative Cytoreduction and Hyperthermic Intraperitoneal Chemotherapy for Recurrent Mucinous Adenocarcinoma of the Appendix. Ann Surg Oncol 2022;29(6):3390-3401. https://doi.org/10.1245/s10434-021-11233-1
- Bhutiani N., Grotz T.E., Concors S.J., et al. Repeat Cytoreduction and Hyperthermic Intraperitoneal Chemotherapy for Recurrent Mucinous Appendiceal Adenocarcinoma: A Viable Treatment Strategy with Demonstrable Benefit. Ann Surg Oncol 2024;31(1):614-621. https://doi.org/1010.1245/s10434-023-14422-2
- Blackham A.U., Swett K., Eng C., et al. Perioperative systemic chemotherapy for appendiceal mucinous carcinoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Surg Oncol 2014;109(7):740-745. https://doi.org/10.1002/jso.23547
- Asare E.A., Compton C.C., Hanna N.N., et al. The impact of stage, grade, and mucinous histology on the efficacy of systemic chemotherapy in adenocarcinomas of the appendix: Analysis of the National Cancer Data Base. Cancer 2016;122(2):213-221. https://doi.org/10.1002/cncr.29744
- Milovanov V., Sardi A., Ledakis P., et al. Systemic chemotherapy (SC) before cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (CRS/HIPEC) in patients with peritoneal mucinous carcinomatosis of appendiceal origin (PMCA). Eur J Surg Oncol 2015;41(5):707-712. https://doi.org/10.1016/j.ejso.2015.01.005
- Pietrantonio F., Maggi C., Fanetti G., et al. FOLFOX-4 chemotherapy for patients with unresectable or relapsed peritoneal pseudomyxoma. Oncologist 2014;19(8):845-850. https://doi.org/10.1634/theoncologist.2014-0106
- Baron E., Sardi A., King M.C., et al. Adjuvant chemotherapy for high-grade appendiceal cancer after cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. Eur J Surg Oncol 2023;49(1):179-187. https://doi.org/10.1016/j.ejso.2022.08.022
- Tejani M.A., ter Veer A., Milne D., et al. Systemic therapy for advanced appendiceal adenocarcinoma: an analysis from the NCCN Oncology Outcomes Database for colorectal cancer. J Natl Compr Canc Netw 2014;12(8):1123-1130. https://doi.org/10.6004/jnccn.2014.0109
- Baron E., King M.C., Gushchin V., et al. ASO Author Reflections: CRS/HIPEC Cannot be Done-Now what? Systemic Chemotherapy in Mucinous Appendiceal Cancer. Ann Surg Oncol 2022;29(11):6590-6591. https://doi.org/10.1245/s10434-022-11925-2
- Logan-Collins J.M., Lowy A.M., Robinson-Smith T.M., et al. VEGF expression predicts survival in patients with peritoneal surface metastases from mucinous adenocarcinoma of the appendix and colon. Ann Surg Oncol 2008;15(3):738-744. https://doi.org/10.1245/s10434-007-9699-7
- Choe J.H., Overman M.J., Fournier K.F., et al. Improved Survival with Anti-VEGF Therapy in the Treatment of Unresectable Appendiceal Epithelial Neoplasms. Ann Surg Oncol 2015;22(8):2578-2584. https://doi.org/10.1245/s10434-014-4335-9
- Franke A.J., Iqbal A., Starr J., et al. Management of malignant bowel obstruction associated with gi cancers. J Oncol Pract 2017;13(7):426-434. https://doi.org/10.1200/jop.2017.022210.


