Константы диссоциации димеров 2-(N-аллилоксифенил) и 2-(N-пропаргилоксифенил)-4,5-дифенилимидазолилов
Автор: Буртасов Алексей Анатольевич, Пряничникова Маргарита Константиновна, Безрукова Елена Вячеславовна, Тихонова Людмила Григорьевна, Танасейчук Борис Сергеевич
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Химия
Статья в выпуске: 1-2, 2014 года.
Бесплатный доступ
Определены константы диссоциации димеров 2- (п-аллилоксифенил) - и 2- (п-пропаргилоксифенил) -4,5-дифенилимидазолилов. Было показано, что равновесие процесса диссоциации во многом определяется степенным фактором.
Имидазол, димер, диссоциация, химическое равновесие
Короткий адрес: https://sciup.org/14720301
IDR: 14720301 | УДК: 547.569.1
Текст научной статьи Константы диссоциации димеров 2-(N-аллилоксифенил) и 2-(N-пропаргилоксифенил)-4,5-дифенилимидазолилов
Исследование влияния заместителей на относительную стабильность триарилимидазолильных радикалов, обладающее термодинамическими характеристиками (энтальпия, энтропия и изменение свободных энергий), показало, что наличие электронодонорных заместителей в фенильных кольцах триарилими-дазолилов увеличивает относительную стабильность радикалов [1; 4–5].
Нам представилось интересным исследовать роль и влияние заместителей, содержащих алкенильный или алкиниль-ный фрагмент, таких как – ОСН2СН=СН2 и – ОСН2С≡СН, на стабильность имидазолильных радикалов. В этом случае ненасыщенная связь не вступает в пря- мое сопряжение с фенильным кольцом, проявляет только электроноакцепторные свойства и должна, по сравнению с метоксигруппой, затруднять диссоциацию димеров на радикалы. Кроме того, такие радикалы могут представлять интерес, в связи с наличием у них двойной или тройной связи, в качестве строительных блоков при синтезе органических магнитоактивных материалов [3; 7].
Синтез необходимых для данного исследования имидазолов (I а–б) был осуществлен взаимодействием соответствующих п -гидроксибензальдегидов (II а–б) с бензилом и ацетатом аммония в уксусной кислоте при нагревании по методу Давидсона [6].
Схема 1
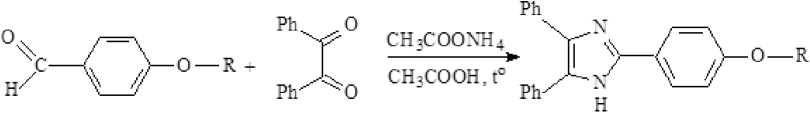
II а, б где R: –ОСН2СН=СН2 (а); –ОСН2С≡СН (б).
I а, б
Димеры радикалов (IV а–б) были получены окислением соответствующих имидазолов (III а–б) феррициани- дом (III) калия в щелочной среде в двухфазной системе бензол/вода и выделены в кристаллическом виде.
Серия «Естественные и технические науки»
Схема 2
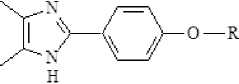
Kj [Fe(CN)6]
NaCE T36AX
----------:------------sr- вода йен зол, t
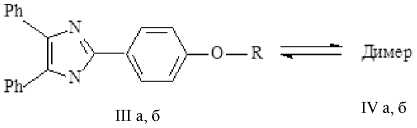
и радикалы (III а–б) устойчивы по отноше-
I а, б
При растворении димеров (IV а–б) бензол приобретает зеленую окраску.
Это свидетельствует об их легкой диссоциации на радикалы (III а–б), что является характерным для большинства имидазолильных радикалов.
Спектр ЭПР радикалов (III а–б) представляет собой синглет, что указывает на четко центрированный на атоме углерода С2 радикальный центр.
Зеленая окраска растворов (III а–б) сохраняется на воздухе в течение длительного времени и усиливается при освещении. Это свидетельствует о том, что димеры (IV а–б) проявляют фотохромные свойства нию к кислороду воздуха.
Для оценки роли заместителей и их влияния на константу диссоциации димеров радикалов (IV а–б) спектрофотометрически в бензоле на максимуме поглощения соответствующего радикала были изучены равновесия димер радикал и рассчитаны термодинамические параметры этого процесса для 70 °С.
Полученные результаты приведены в таблице, наряду с аналогичными величинами, рассчитанными как для димера 2,4,6-трифенилимидазолила (V), так и для димера 4,5-дифенил-2-( п -метоксифенил) имидазолила (VI) [2].
Т а б л и ц а
Термодинамические параметры для диссоциации димеров радикалов (IVа) и (IVб) в бензоле (70 оС)
|
Название димера |
λ, нм |
ΔН≠, кДж/моль |
ΔS≠, Дж/(моль·К) |
ΔG≠, кДж/моль |
|
Димер 2-( п -аллилоксифенил)- 4,5-дифенилимидазолила (IVа) |
455 |
62,3 |
87,4 |
32,3 |
|
Димер 2-( п -пропаргилоксифенил)-4,5-дифенилимидазолила (IVб) |
430 |
71,9 |
138,1 |
24,5 |
|
Димер 2,4,5-трифенилимидазолила (V) |
440 |
64,9 |
95,9 |
32,0 |
|
Димер 2-( п -метоксиксифенил)-4,5-дифенилимидазолила (VI) |
440 |
53,6 |
72,4 |
28,8 |
ВЕСТНИК Мордовского университета | 2014 | № 1-2
Согласно полученным результатам, значение энтальпии процесса диссоциации димеров (IV а–б, V, VI) является наименьшим в случае наличия в качестве заместителя в положении 2 имидазольного цикла метокси- (VI), а наибольшим – пропаргилоксигруппы (IV б). Это может быть объяснено только тем, что как тройная, так и двойная связь проявляют акцепторные свойства.
Изменение свободной энергии для всех исследованных димеров (IV а–б. V, VI) существенно только для пропаргильного производного (IV б), где оно является наименьшим. В то же время значение энтропии процесса диссоциации возрастает от метоксипроизводного (VI) до пропаргильного производного (IV б) в порядке (VI) < (IV а) < (V) < (IV б).
Скорее всего, возрастание энтропии процесса диссоциации в случае димера (IV б) может быть связано с тем, что даже в п -положении фенильного кольца алкинильный фрагмент препятствует процессу димеризации радикалов (III б).
Значения активационного барьера для диссоциации димеров (IV а–б) на радикалы (III а–б) значительно ниже такового для димера 2,4,5-трифенили-мидазолила (V). При чем значения ΔS≠ свидетельствуют об определяющем влиянии на скорость диссоциации димеров (IV а–б) стерического фактора: для димера (IV а) он более значим, чем для димера (IV б).
Экспериментальная часть
Анализ продуктов проводился методом ТСХ на пластинках Silufol UV-254 (элюенты – петролейный эфир, ацетон, дихлорметан), проявился в парах иода и при УФ-облучении. ИK-спектры (таблетки KBr) регистрировались с помощью Фурье-спектрометра «Инфра-Люм ФТ-02». Спектры ЯМР 1Н и 13С – прибор Jeol «ECX 400(А) T» в ДМСО-d6 ; в качестве реперной точки использовался остаточный сигнал протона в дейтерированном растворе. Электронные спектры видимой области (бензол) регистрировались на приборах «Simadzu UV 2600 VIS» и
«СФ-16», ЭПР спектры – с помощью ЭПР спектрометра «ESR 70-03 XD/2».
Синтез 2-( п -пропаргилоксифенил)-4,5-дифенилимидазолила (IVа) и его димера был осуществлен по литературным методикам [2].
п -Аллилоксибензальбегид (II а). В круглодонную колбу емкостью 50 мл, снабженную обратным холодильником с хлоркальциевой трубкой, поместили 15 мл ацетона, 0,0213 моль (2 г) п -гидроксибензальдегида, 0,0213 моль (1,845 см3) бромистого аллила и 0,0213 моль (2,936 г) карбоната калия. Реакционную смесь нагревали в течение 8 ч. По истечении времени реакционную смесь охладили до комнатной температуры и вылили в 80 мл воды. Продукт экстрагировали эфиром. Эфирный экстракт промыли раствором едкого натра и сушили над безводным карбонатом натрия. Эфир отогнали при атмосферном давление, а остаток перегнали в вакууме, собирая фракцию в интервале 115–116 °С/18 мм. рт. ст (лит 115 °С/18 мм. рт. ст). Получили 2,6 г (75 %) п -ал-лилоксибензальбегида. Продукт представляет собой маслянистую жидкость с серовато-зеленоватым оттенком, кристаллизующуюся при комнатной температуре в низкоплавкие кристаллы.
ИК спектр (см-1): 829 (ср), 1 022 (ср), 1 111 (ср) 1 172 (ср), 1 215 (с), 1 250 (ср), 1 381 (ср), 1 454 (ср), 1 508 (оч. с), 1 554 (ср), 1 578 (с), 1 604 (с), 1 678 (с), 1 685 (с), 2 835 (ср), 3 071 (ср), 3 210 (ср).
2-(4-Аллилоксифенил)-4,5-дифе-нилимидазол (I а). В круглодонную колбу емкостью 100 мл, снабженную обратным холодильником, поместили 0,0031 моль (0,5 г) п -аллилоксибензаль-бегида (II а), 0,0031 моль (0,65 г) бензила, 0,061 моль (4,67 г) безводного ацетата аммония и 30 мл ледяной уксусной кислоты. Реакционную смесь кипятили в течение 1,5 ч, затем охладили до комнатной температуры и вылили в 50 мл водного раствора аммиака. Выпавший осадок отфильтровали на воронке Бюхнера, промыли на фильтре водой (30 мл х 3) и сушили на воздухе. Очищали перекристаллизацией из этанола.
Получили 0,725 г (66 %) бесцветных со слегка желтоватым оттенком игольчатых кристаллов (Iа); t пл. – 112–113 °С.
ИК спектр (см-1): 521 (ср), 675 (ср), 698 (оч. с), 733 (с), 773 (ср), 833 (ср), 1 026 (с), 1 073 (ср) 1 130 (ср), 1 180 (с), 1 227 (с), 1 451 (с), 1 493 (оч. с), 1 504 (с), 1 582 (ср), 1 613 (с), 2 863 (ср), 2 924 (ср), 2 963 (ср), 3 295 (ср), 3 445 (ср), 3 476 (ср).
Спектр ЯМР 13С δ, м, д: 68,80, 115,35, 118,03, 123,85, 126,92, 127,26, 127,61, 128,11, 128,67, 128,89, 129,13, 131,80, 134,16, 135,90, 137,35, 146,15, 158,90,
Спектр ЯМР 1Н (м, д): 4,58 д (2H, 3 Гц), 5,23 д (J3 10 Гц, 1H), 5,26 д (J3 17 Гц, 1H), 6,00–6,07 м (1Н), 7,04 д (2H, 9 Гц), 7,01–7,54 м (10Н), 7,98 д (2H, 9 Гц), 8,00 д (2H, 10 Гц), 9,33 с (1Н).
Димер 2-(п-аллилоксифенил)-4,5-дифенилимидазол-2-ила (IV а), В плоскодонную колбу емкостью 100 мл, снабженную магнитной мешалкой, помещали 0,96 ммоль (0,315 г) гексацианоферрата (III) калия, 0,46 ммоль (0,162 г) 2-(4-аллилоксифенил)-4,5-дифенилимидазола (I а), 10 мл воды, 3,5 мл бензола, 5,3 ммоль (0,211 г) гидроксида натрия и 0,117 г триэтилбен-зиламмония хлорида (катализатор межфазного переноса). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. В результате реак- ции органический бензольный слой окрасился в желто-зеленый цвет. Выпавший в ходе реакции осадок отфильтровали на воронке Бюхнера и промыли на фильтре водой до нейтральной реакции промывных вод и отрицательной реакции на ионы Fe2+ и Fe3+. Сушили на воздухе, получили 0,21 ммоль (0,15 г, 93 %) бесцветных со слегка желтоватым оттенком кристаллов димера (IV а); t пл. – 221–222 °С.
ИК спектр (см-1): 482 (сл), 552 (ср), 694 (оч, с,), 721 (с), 767 (с), 799 (ср), 837(ср), 1 073 (ср), 1 134 (с), 1 204 (с), 1 273 (ср), 1 447 (с), 1 489 (с), 1 524 (ср), 1 601 (с), 1 647 (оч, с), 1 655 (оч, с), 1 663 (оч, с), 1 671 (оч, с), 3 032 (ср), 3 059 (ср).
Спектр ЯМР 13С δ, м, д: 68,79, 113,86, 115,00, 117,77, 127,12, 127,25, 127,98, 128,43, 129,42, 131,51, 132,00, 133,29, 158,52, 159,20, 166,31.
Спектр ЯМР 1Н δ, м, д: 4,39 – 4,69 м (4Н), 5,24 – 5,43 м (4Н), 5,97 – 6,03 м (2Н), 6,45 д (2Н, 15 Гц), 6,90 д (2Н, 15 Гц), 7,07 – 7,49 м (10Н), 7,77 д (2Н, 7 Гц), 7,82 д (2Н, 7 Гц).
п -Пропаргилоксибензальбегид (II б), 2-(4-пропаргилоксифенил)-4,5-дифенилимидазол (I б), димер 2-( п -аллилоксифенил)-4,5-дифенилимидазол-2-ила (IV б) были получены по литературным методикам [2].
Серия «Естественные и технические науки»
Список литературы Константы диссоциации димеров 2-(N-аллилоксифенил) и 2-(N-пропаргилоксифенил)-4,5-дифенилимидазолилов
- Исследования в области химии азотсодержащих гетероциклических свободных радикалов: XXI: Константы диссоциации димеров триарилимидазолилов/Б. С. Танасейчук [и др.]//Журнал органической химии. -1978. -Т. 14. -№ 10. -С. 2029-2035.
- Пряничникова, М. К. Стабильные радикалы XXV: Триарилимидазолилы с тройными связями в боковой цепи/М К. Пряничникова, Л. Г Тихонова, Б. С. Танасейчук//Журнал органической химии. -1997. -Вып. 9. -С. 1386-1389.
- Allinson, G. Organic molecular magnets -the search for stable building blocks/G. Allinson, R. J. Bushby, J.-L. Paillaud//Journal Materials Sciense: Materials in Electronics. -1994. -Vol. 5. -Р. 67-74.
- Baumgartel, H. 1,1'-Bis-imidazolyl und ihre dissoziation in radikale/H Baumgartel., H. Zimmermann//Z. Naturforsch. -1963. -Vol. 186. -№ 5. -Р. 406-412.
- Baumgartel, H. Uber triarylimidazolyl und triarylimidazol -Farbstoffe/H Baumgartel., H. Zimmermann//Chem. Ber. -1966. -Vol. 99. -№ 3. -Р. 843-849.
- Davidson, D. The action of animonia on benzyl/D. Davidson, M. Weiss, Jelling.//J. Org. Chem. -1977. -Vol. 42. -№ 4. -P. 319-324.
- Magnetism in organic radical ion salts based on imidazolyl and benzimidazolyl nitronyl nitroxide/T. Sugano [et al.]//J. Phys. IV (France). -2004. -Vol. 114. -P. 651-653.


