Конституциональные особенности больных узловой и отечной формами рака молочной железы
Автор: Пак Д.Д., Сарибекян Э.К., Ермощенкова М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (46), 2011 года.
Бесплатный доступ
Показано, что более 75 % больных раком молочной железы страдают избыточным весом и ожирением различной степени. Средний индекс массы тела выше у больных с агрессивными отечными формами рака по сравнению с более благоприятными по прогнозу узловыми формами. Имеются различия в возрастной структуре. У больных отечным раком молочной железы по сравнению с узловым средний возраст меньше и преобладает группа с перименопаузальным возрастом.
Рак молочной железы, отечная, узловая форма рака молочной железы, индекс массы тела, избыточный вес, ожирение, возраст
Короткий адрес: https://sciup.org/14055922
IDR: 14055922 | УДК: 618.19-006.6:616-056.5
Текст научной статьи Конституциональные особенности больных узловой и отечной формами рака молочной железы
Заболеваемость раком молочной железы (РМЖ) в связи с неуклонным ростом занимает лидирующие позиции. Ежегодно в мире регистрируют более 1 млн новых случаев РМЖ. В 1997 г. абсолютное число больных с впервые в жизни установленным диагнозом РМЖ в России составило 40360, в 2009 г. – уже 52157 [3]. Средний возраст больных – 60 лет. Кумулятивный риск развития РМЖ в течение жизни у женщин занимает первое место среди всех нозологий и в 2007 г. достиг 4,81 %. В структуре смертности женщин в России злокачественные новообразования молочной железы имеют наибольший удельный вес – 17,3 %. Риск умереть от РМЖ у женщин в 2008 г. составил 2 %. В большинстве стран мира РМЖ является одной из важнейших проблем современной онкологии.
Рак молочной железы – гетерогенное заболевание, патогенез которого основан на комплексном взаимодействии генетических, гормональных, метаболических, экзогенных и других факторов. Главным направлением в поиске причин развития рака молочной железы в настоящее время является изучение молекулярно-биологических процессов, обусловливающих неконтролируемый инвазивный рост и метастазирование опухоли с развитием ее гормонорезистентности. В комплексе причин эстрогенам принадлежит заметная и, возможно, решающая роль [4]. Увеличение концентрации эстрогенов повышает пролиферативную активность клеток тканей-мишеней (молочной железы, матки и пр.), приводя к возрастанию риска развития в них злокачественных новообразований.
Выделяют два основных типа гормонального канцерогенеза: промоторный, при котором под влиянием гормонов создаются условия для увеличения числа опухолевых клеток, и генотоксический [1]. Две основные эстрогенные фракции (эстрадиол и эстрон) образуются под влиянием фермента ароматазы из андрогенных предшественников тестостерона и андро-стендиола. Взаимопревращения эстрадиола и эстрона осуществляются при участии фермента 17ß-гидроксистероиддегидрогеназы [10]. Ряд исследователей считают, что метаболиты, образующиеся при внутритканевом образовании гидроксипроизводных эстрогенов, обладают канцерогенным и генотоксическим действием [13]. Также установлено, что в гормональном канцерогенезе важную роль имеют так называемые катехолэстрогены, то есть метаболиты эстрогенов, образующихся в результате внедрения гидроксильной группы во 2-е или в 4-е положение молекулы [7]. Один из важных вариантов влияния эстрогенов на клеточный аппарат может быть связан с угнетением репарации ДНК. Было установлено, что под влиянием некоторых агентов (радиация, курение, алкоголизация, избыточное употребление насыщенных/твердых жиров) развивается фазное изменение эффекта эстрогенов в виде ослабления его гормональной составляющей (индукция рецепторов прогестерона) и увеличения степени повреждения ДНК [1]. Эстрогены, обнаруживаемые в циркуляторном русле, попадают в него из разных источников, наиболее важным из которых у женщин репродуктивного возраста являются яичники. Биосинтез эстрогенов в менопаузе совершается внегонадно – в жировой мышечной ткани, ЦНС и др. В гонадах и внегонадно эстрогены образуются из андрогенных предшественников, на основе одних и тех же биохимических реакций под действием фермента ароматазы. Периферическая ароматизация андрогенов в жировой ткани у женщин с избыточной массой тела и ожирением в постменопаузе, приводящая к повышенной концентрации циркулирующих эстрогенов, является одной из причин связи между ожирением в постменопаузе и раком молочной железы. Ожирение – накопление жира в организме, приводящее к увеличению избыточной массы тела на 20 % и более от средних нормальных величин, характеризуется избыточным отложением жира в жировых депо организма и представляет не только медицинскую, но и социальную проблему. В промышленно развитых странах лица, страдающие различными формами ожирения, составляют 20–30 % от общего числа популяции, а 40–50 % имеют избыточную массу тела. Согласно эпидемиологическим прогнозам, предполагается, что к 2025 г. ожирением будет страдать около 40 % мужчин и 50 % женщин. Для определения степени ожирения учитывается избыток массы тела по сравнению с «идеальной» или «теоретической» массой тела. В зависимости от массы тела различают ожирение I степени (увеличение массы по сравнению с «идеальной» более чем на 29 %), II степени (избыток массы тела составляет 30–49 %), III степени (избыток массы тела равен 50–99 %) и IV степени (избыток массы тела 100 % и более). В настоящее время наибольшее распространение получил так называемый индекс массы тела (ИМТ), который наилучшим образом коррелирует с массой жировой ткани в организме (Герроу Д., 1981). Показатель индекса массы тела был разработан бельгийским социологом и статистиком А. Кетеле в 1869 г. При ожирении у женщин изменяется функция гипоталамо-гипофизарной системы, нарушается гипоталамический контроль за продукцией фолликулостимулирующего и лютеинизирующего гормонов яичников. Могут иметь место аменорея, меноррагия или удлинение менструального цикла. Повышается уровень ФСГ в крови в преовуляторный период, интегрированная же секреция ЛГ снижена. Отмечается незначительная недостаточность желтого тела, проявляющаяся снижением уровня прогестерона в крови. В настоящее время установлено, что у больных с ожирением наблюдается относительный иммунодефицит, преимущественно связанный с нарушением Т-клеточных функций и фагоцитоза. Наблюдается достоверное повышение секреции кортикотропина и нарушение его суточного ритма параллельно увеличению степени ожирения. Избыточная секреция кортикотропина стимулирует продукцию андрогенов надпочечниками, что сопровождается симптомами маскулинизации у женщин. Существует связь между антропометрическими данными и риском РМЖ. По данным P.A. Van den Brandt [8], рост является независимым фактором риска для постменопаузального РМЖ, тогда как у женщин до менопаузы эта связь менее отчетлива. В исследовательской программе EPIC с участием 9 европейских стран изучены данные о 73542 женщинах до менопаузы и 103355 женщинах после менопаузы, рассчитаны показатели относительного риска развития РМЖ в зависимости от роста, веса, ИМТ, окружности талии и бедра. У женщин после менопаузы использование заместительной гормонотерапии (ЗГТ) влияло на связь между размером тела и развитием РМЖ. У женщин, не использующих ЗГТ, страдающих ожирением (ИМТ более 30), риск РМЖ был на 31 % выше, чем у женщин с ИМТ менее 25. Повышенный риск РМЖ среди использующих ЗГТ был выявлен у худощавых женщин. У женщин после менопаузы, не принимающих экзогенные гормоны, общее ожирение являлось существенным прогностическим фактором для РМЖ, тогда как избыток абдоминального жира (отношение окружности талии к окружности бедра) не был связан с РМЖ. Среди женщин после менопаузы имелись недостоверные положительные связи РМЖ с весом и ИМТ [5, 11].
Все вышеперечисленные факторы патогенеза ожирения играют прямую или опосредованную роль в развитии гиперэстрогенемии – одного из самых существенных факторов риска рака молочной железы. В МНИОИ им. П.А. Герцена изучены конституциональные особенности больных РМЖ и проведен анализ влияния избыточной массы тела и ожирения женщин различных возрастных категорий на развитие той или иной формы рака молочной железы.
В настоящее время в клинической практике выделяют две основные формы РМЖ: узловую и отечную. Узловая форма рака составляет около 75 % и представлена при всех стадиях. Отечные формы (синонимы: инфильтративно-отечный рак, отечный рак) составляют около 15 % и относятся к особым формам, отличающимся неблагоприятным прогнозом и крайне агрессивным течением с быстрым локорегионарным и отдаленным метастазированием. Основным клиническим признаком данной формы является наличие отека железы [14]. Причем достаточно только данного признака, чтобы поставить IIIB или IV (при наличии отдаленных метастазов) стадии независимо от других факторов – размера опухоли, наличия и количества метастатических лимфатических узлов и др. F. Nakhlis et al. [12] указывают, что диффузное утолщение кожи и аномальные изменения сосудов выявляются до подтверждения клинического диагноза отечный РМЖ. В соответствии с международной классификацией TNM под инфильтративно-отечным раком понимают сочетание симптомов: наличие диффузного утолщения кожи в виде симптома «лимонной корки», отсутствие четко пальпируемого узла опухоли, увеличение железы в размере и уплотнение ткани, гиперемия кожи. В случае морфологического подтверждения наличия клеток рака в коже железы ставят индекс T4d (carcinoma inflammatory) и называют воспалительным раком. При отсутствии клеток рака в коже – T4b. Патогенез появления отека полностью не изучен. Большая часть исследователей считают, что развитие отека молочной железы связано с биологическими свойствами опухоли, высокими темпами удвоения, с продукцией ею вазоактивных и других факторов, удерживающих жидкость в молочной железе [6]. Учитывая взаимосвязь системы опухоль–организм в появлении отека, можно говорить и о гормональных предикторах развития отека, и, следовательно, о возможных конституциональных особенностях пациенток с инфильтративно-отечным раком. Косвенным подтверждением вышеуказанного являются данные некоторых авторов о существенном уменьшении отека при применении пролактинблокирующих препаратов (перлодел и др.) и выключении функции яичников вне зависимости от уровня гормональных рецепторов опухоли [2].
Вопрос о конституциональных особенностях женщин при инфильтративно-отечном РМЖ мало изучен и относительно скудно представлен в литературе. S. Chang et al. [9] обратили внимание на более высокий ИМТ (26,65 кг/м2) у 68 женщин с инфильтративно-отечным раком по сравнению с 143 больными неотечным раком (22,27 кг/м2). Средний вес соответственно составил 77,6 и 68,0 кг. Различий в росте не выявлено. Группы мало отличались по статусу менопаузы, хотя имелась тенденция к превалированию пре-менопаузальных больных. По данным А.А. Дорофеева [2], при инфильтративно-отечном раке, по сравнению с узловыми формами, отмечаются плавный подъем заболеваемости с 40 до 55 лет и более поздние сроки наступления менопаузы.
Цель исследования – установить влияние некоторых антропометрических показателей у больных раком молочной железы на развитие узловой и отечной форм данного заболевания.
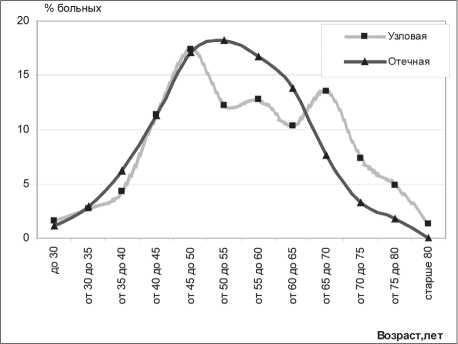
Рис. 1. Распределение больных по возрасту в зависимости от формы рака молочной железы
Материал и методы
Объектом исследования явились 668 больных раком молочной железы, госпитализированных в отделение общей онкологии МНИОИ им. П.А. Герцена с 2000 по 2010 г. Из них больных с узловой формой рака (I, IIA, B, IIIA стадии) – 680, отечной формой (IIIB T4bd стадии) – 300. Средний возраст пациенток сост, авил 55,16 года. Средние показатели роста – 162,28 см, веса – 74,29 кг, ИМТ – 28,23.
Индекс массы тела (ИМТ) определяли по формуле: ИМТ = m (кг) / h2 (м), где m – масса тела больного (кг), h – рост больного (м). Значения ИМТ определялись соответственно общепринятой градации: 18,5–25 кг/м2 – нормальный ИМТ, от 25 кг/м2 до 29,9 кг/м2 – избыточный вес; от 30 кг/м2 до 34,9 кг/м2 – I степень ожирения; от 35 кг/м2 до 39,9 кг/м2 – II степень ожирения; более 40 кг/м2 – III степень ожирения.
Результаты и обсуждение
Сравнение больных с двумя основными формами рака молочной железы (отечной и узловой) по некоторым конституциональным особенностям выявило определенные отличия, что косвенно свидетельствует об их различном патогенезе. При изучении возрастных показателей обращает внимание большой процент пациенток в возрасте от 53 до 68 лет. Это наиболее многочисленная группа больных РМЖ, причем ее доля при отечном РМЖ составляет почти половину и статистически значимо выше, чем при узловой форме. Данная возрастная группа относится к категории повышенного риска развития рака молочной железы. Этот факт косвенно подтверждает мнение о значении гормонального фактора в патогенезе отечного рака. Средний возраст больных отечным раком несколько ниже по сравнению с узловым раком – 53,0 и 56,2 соответственно (р≤0,005) (рис. 1).
Всем больным в нашем исследовании при поступлении были измерены рост и вес с целью вычисления индекса массы тела. По росту отличий не выявлено, средний рост составил 162,36 при отечном раке и 162,2 – при узловом. Выявлена существенная разница в весе (табл. 1).
Распределение больных с отечными и узловыми формами рака молочной железы в зависимости от индекса массы тела представлено в табл. 2, 3. Обращает внимание наличие избыточного веса у большинства больных в обеих исследуемых группах. Причем статистически значимый больший показатель избыточного веса имеется у больных с наиболее прогностически неблагоприятной формой рака – инфильтративно-отечной.
Таким образом, избыточная масса тела и ожирение являются факторами риска развития рака молочной железы. Отечная форма рака молочной железы приобретает большую вероятность у больных с избыточной массой тела и ожирением, по сравнению с риском развития узловой формы.
Борьба с избыточной массой тела и ожирением у женщин должна быть социальной программой, направленной на профилактику рака молочной железы.
Таблица 1
Распределение больных раком молочной железы в зависимости от веса тела
|
Вес |
Минимальный |
Максимальный |
Средний |
|
Отечные формы РМЖ (n=300) |
46 |
153 |
76,96 |
|
Узловые формы РМЖ (n=366) |
38 |
120 |
72,7 |
Распределение больных с диагнозом отечная и узловая формы рака молочной железы в зависимости от индекса массы тела
Таблица 2
|
Индекс массы тела |
Отечные формы РМЖ (n=300) |
Узловые формы РМЖ (n=366) |
|
Дефицит массы тела (15–19,9) |
5 (1,67 %) |
17 (4,62 %) |
|
Норма (20–24,9) |
65 (21,7 %) |
108 (29,35 %) |
|
Избыточная масса тела (25–29,9) |
118 (39,3 %) |
139 (37,77 %) |
|
Ожирение I ст. (30–34,9) |
67 (22,33 %) |
72 (19,57 %) |
|
Ожирение II ст. (35–39,9) |
35 (11,66 %) |
26 (7,07 %) |
|
Ожирение III ст. (40 и более) |
10 (3,33 %) |
6 (1,63 %) |
Выборка больных раком молочной железы по особенностям веса
Таблица 3
|
ИМТ |
Минимальный ИМТ |
Максимальный ИМТ |
Средний ИМТ |
|
Отечные формы РМЖ (n=300) |
18,57 |
62,07 |
29,2 |
|
Узловые формы РМЖ (n=366) |
16,4 |
44,1 |
27,7 |


