Контроль концентрации метотрексата методом ВЭЖХ на коротких колонках при химиотерапевтическом лечении
Автор: Федорова Г.А., Грачев М.А., Подольская Е.П., Краснов Н.В., Гимбицкая Е.К., Урсуленко Е.В., Ованесян С.В., Толмачева О.П.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Интерпретация данных, методология, применение
Статья в выпуске: 3 т.16, 2006 года.
Бесплатный доступ
Предложена методика определения метотрексата в сыворотке крови, пригодная для контроля его концентрации при проведении химиотерапевтического лечения. Подготовка пробы заключается в предварительной экстракции липидов гексаном, осаждении белков в присутствии перхлората лития, уксусной кислоты и ацетонитрила. Супернатант инжектируется в хроматограф, и компоненты пробы разделяются на колонке 2 x 75 мм с обращенной фазой С 18 в режиме градиентного элюирования. В качестве подвижных фаз использованы водный раствор 0.2 М перхлората лития (рН 3) и ацетонитрил. Для идентификации пика метотрексата на хроматограмме и подтверждения его гомогенности использовали спектральные отношения и сочетание ЖХ-МС в режиме прямой стыковки. Методика была апробирована для коррекции схемы лечения при проведении химиотерапии у детей с острым лимфобластным лейкозом.
Короткий адрес: https://sciup.org/14264441
IDR: 14264441 | УДК: 543.544.5.068.7:
Текст научной статьи Контроль концентрации метотрексата методом ВЭЖХ на коротких колонках при химиотерапевтическом лечении
Метотрексат (МТХ) (рис. 1) — противоопухолевое средство, которое используют при проведении химиотерапевтического лечения детей с острым лимфобластным лейкозом. МТХ является сильнейшим системным ядом, поэтому лечение высокими дозами МТХ проводится в сочетании с лейковорином, доза которого зависит от результатов определения концентрации МТХ в крови.
Метод ВЭЖХ широко используется для терапевтического лекарственного мониторинга МТХ. Как правило, для рутинного серийного анализа используется изократическое элюирование в бинарных системах МеCN—буфер (рН 2.6–6.0) [1– 3] или режим ион-парной хроматографии [4, 5] на стандартной аналитической колонке 4.6 × 250 мм.
При высоком содержании МТХ подготовка пробы может заключаться в предварительном осаждении белков ацетонитрилом и центрифугировании с последующим удалением ацетонитрила органическим растворителем [1, 6]. При низких концентрациях МТХ подготовка пробы включает стадию концентрирования [2, 5, 7, 8].
В нашу задачу входила оптимизация подготовки пробы и условий хроматографического определения МТХ в сыворотке крови.
муравьиная и уксусная кислоты — квалификация не ниже х.ч.
В работе использовали жидкостный хроматограф "Милихром А-02" (ЗАО "ЭкоНова", Новосибирск, Россия). Колонка 2 × 75 мм с Nucleosil 100-5 C18 (Macherey-Nagel, Duren, Germany). Температура колонки 35 ° С. Подвижные фазы: А — 0.2 M LiClO4 (pH 2), В — ацетонитрил. Градиентное элюирование: от 5 до 20 % В за 1500 мкл. Скорость потока 150 мкл/мин. Длины волн детектирования 290, 300, 310 и 330 нм.
Масс-спектрометрический анализ проводили на приборе МХ 5303, оборудованном электрораспы-лительным источником ионизации (electrospray ionization, ESI) с ортогональным вводом ионов и времяпролетным масс-анализатором (TOF) (ESI-o-TOF), разработанном в Лаборатории экологической и биомедицинской масс-спектрометрии ИАнП РАН. Спектр получали в режиме съемки положительных ионов. При проведении хроматомасс-спектрометрического анализа в качестве подвижных фаз использовали: А — 0.5% НСООН в воде (pH 2.5), В — 0.5% НСООН в ацетонитриле. Скорость потока 150 мкл/мин. Градиент линейный, от 5 до 20 % В за 1500 мкл.
МАТЕРИАЛЫ И МЕТОДЫ
Метотрексат в виде субстанции с содержанием основного вещества > 98 % ("Sigma"), ацетонитрил для ВЭЖХ ("Криохром", Санкт-Петербург, Россия), гексан, перхлорат лития, ортофосфорная,
H 2 N

CH 3 O
CH 2 N C NH CH COOH
CH2
CH COOH
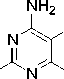
Рис. 1. Структурная формула метотрексата
Пробы крови из вены центрифугировали и отделяли сыворотку, которую хранили при –20°С до анализа. Для проведения анализа к 60 мкл сыворотки крови добавляли 0.5 мл гексана, встряхивали в течение 5 мин и центрифугировали для разделения слоев. Гексановый слой, содержащий липиды, отбрасывали. Аликвоту сыворотки объемом 50 мкл помещали в чистую пробирку, добавляли 50 мкл 0.6 М раствора перхлората лития в ацетонитриле, содержащего 1% уксусной кислоты, встряхивали и центрифугировали. Супернатант (5–20 мкл) хроматографировали.
Идентификацию пика метотрексата на хроматограмме выполняли по времени удерживания, спектральным отношениям и данным МС. Концентрацию метотрексата в исходной сыворотке рассчитывали по градуировочной зависимости, полученной на основе градуировочных растворов. Градуировочные растворы готовили путем добавления стандартного раствора метотрексата к донорской сыворотке. Далее пробы обрабатывались в соответствии с прописью методики. Градуировочная зависимость для метотрексата получена для 5 концентраций ( n = 5).
Воспроизводимость методики рассчитывали по архивным данным лаборатории. Значение относительного стандартного отклонения в каждом интервале концентраций рассчитывали для группы из 18–20 проб, каждую из которых анализировали дважды.
Оценку правильности выполняли методом добавок. Каждая величина представляет собой среднее значение из восьми независимых определений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для терапевтического лекарственного мониторинга обычно используется стандартная хроматографическая колонка 4.6×250 мм. В последние несколько лет благодаря появлению более совершенного хроматографического оборудования чаще стали применять колонки длиной 100–150 мм и в настоящее время на таких колонках выполняется около 50 % разделений. Применение коротких колонок — один из возможных путей снижения стоимости анализа, т. к. это позволяет сократить длительность анализа и уменьшить расход дорогостоящих растворителей.
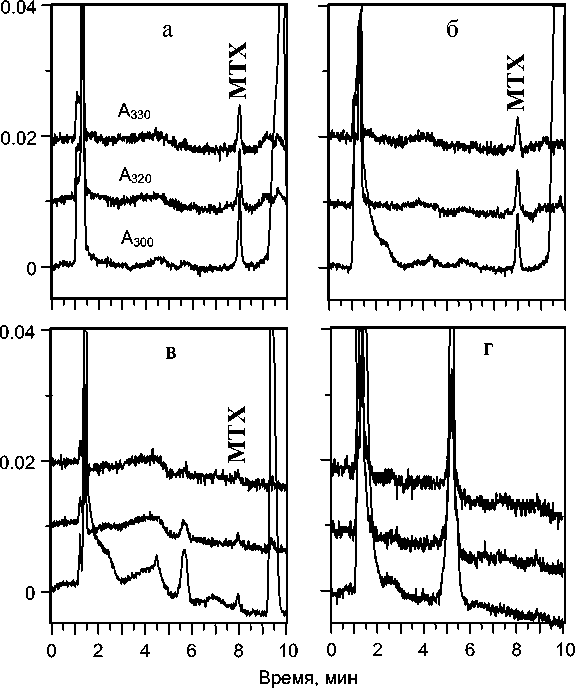
Рис. 2. Хроматограммы обработанной сыворотки крови пациента, проходящего лечение высокими дозами метотрексата (МТХ).
Объем пробы 20 мкл. Пробы отобраны в процессе инфузии: а — 1.2 мкмоль/л, б — 0.7 мкмоль/л; через 2 часа после окончания инфузии — в (0.2 мкмоль/л) и через 18 часов — г (< 0.01 мкмоль/л)
В настоящей работе предложен экономичный короткоколоночный вариант ВЭЖХ (2 × 75 мм), который позволяет в 10–20 раз снизить расход растворителей и во столько же раз повысить чувствительность определения по сравнению с хроматографической колонкой стандартных размеров. Выбор градиентного режима элюирования позволяет дополнительно увеличить чувствительность определения МТХ без существенного увеличения длительности анализа. На рис. 2 приведены хроматограммы обработанной сыворотки крови пациента, проходящего лечение метотрексатом. На всех хроматограммах пики МТХ симметричны и полностью отделены от эндогенных соединений сыворотки крови. Детектирование на длине волны 300 нм (второй максимум) значительно снижает число УФ-поглощающих (мешающих) компонентов сыворотки при достаточной чувствительности по определяемому компоненту.
На стадии разработки методики идентификацию пика метотрексата на хроматограмме обработанной сыворотки крови проводили с использованием масс-спектрометрического детектирования методом ESI-MS-TOF в режиме "on-line" (рис. 3).
Разработанная методика апробирована в клинической практике онкогематологического отделения Иркутской государственной областной детской клинической больницы. Методика использована для определения концентрации МТХ в сыворотке крови детей, получающих лечение высокими дозами МТХ (Международный протокол ALL-BFM-90 "Лечение острых лимфобластных лейко-
4 600
4 400
4 200
4 000
3 800
3 600
3 400
3 200
3 000
2 800
2 600
2 400
2 200
2 000
1 800
1 600
1 400
1 200
1 000

455 456 457
m / z
Рис. 3. Масс-спектр стандартного раствора метотрексата (MH+ = 455.17 а.е.м.)
зов у детей", протокол М). Лечение проводится в четыре приема с перерывами в две недели и заключается во внутривенном введении раствора МТХ в течение 36 часов. Так как МТХ является сильнейшим системным ядом, то через 6, 12, а при необходимости еще через 18 и 24 часа после окончания инфузии МТХ ребенку вводится противоядие — лейковорин. Число введений лейковорина зависит от концентрации МТХ в крови ребенка.
Мониторинг концентрации МТХ в сыворотке крови выполнялся при проведении первой (из четырех) инфузии, для которой доза МТХ определялась из расчета 1000 мг/м2 поверхности тела ребенка. Для проведения мониторинга пробы крови из вены отбирали по схеме: 9 проб в течение инфузии МТХ, 9–11 проб — после ее окончания.
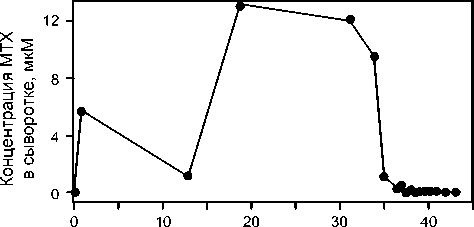
На рис. 4 приведена зависимость концентрации МТХ от времени в образцах крови пациента, проходящего лечение МТХ по стандартной схеме (1000 мг/м2). Результаты ВЭЖХ-анализа в сочетании с клиническими данными использованы для изменения схемы дальнейшего лечения: для пациентов, имеющих высокие содержания МТХ в образцах крови в процессе инфузии, рекомендовано уменьшить дозу вводимого препарата на 5–10%; при низкой скорости выведения МТХ после окончания инфузии рекомендовано трижды вводить лейковорин, через каждые 6 часов. Отмечено, что при дальнейшем лечении по измененной схеме осложнений не было.
По разработанной методике был проведен мониторинг 30 пациентов онкогематологического отделения Областной государственной детской клинической больницы г. Иркутска, проходящих лечение высокими дозами МТХ. Отмечено, что около 75 % пациентов нуждаются в изменении "стандартной" схемы лечения.
Время, ч
Рис. 4. Изменение концентрации МТХ в сыворотке крови пациента в процессе лечения высокими дозами МТХ


