Коронавирусная болезнь-2019 (COVID-19): течение и отдаленные последствия
Автор: Муркамилов И. Т., Айтбаев К. А., Муркамилова Ж. А., Кудайбергенова И. О., Маанаев Т. И., Сабиров И. С., Юсупов Ф. А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 9 т.7, 2021 года.
Бесплатный доступ
Новый штамм коронавируса — SARS-CoV-2 (Severe Acute Respiratory Syndrome CorOnaVirus-2) послужил причиной роста числа заболевших и высокой смертности во всем мире. У пациентов с коронавирусной болезнью 2019 (COVID-19, Corona Virus Disease 19) помимо поражения легких, имеется высокий риск развития полиорганной недостаточности. Сопутствующие сердечно-сосудистые заболевания служат независимыми факторами риска развития тяжелых форм COVID-19. Острый COVID-19 проявляется полисегментарной пневмонией, отеком легких, сепсисом, фибрилляцией предсердий или желудочков, острым миокардиальным повреждением, миокардитом, выпотным перикардитом, тампонадой сердца, различными тромбоэмболическими нарушениями. COVID-19 может провоцировать хроническое поражение сердечно-сосудистой, нефро- и цереброваскулярной системы, ухудшающих прогноз жизни больного. У лиц, перенесших COVID-19, в будущем можно ожидать роста различных сердечно-сосудистых осложнений, нарушений углеводного и пуринового обмена. В статье, на основе представленной серии конкретных клинических случаев, обсуждаются течение и долговременные последствия коронавирусной болезни 2019 (COVID-19). Приведенные наблюдения случаев коронавирусной болезни (COVID-19) демонстрируют разнообразие ее клинических проявлений и исходов, при которых, наряду с поражением легких, отмечаются также поражения сердечно-сосудистой, эндокринной и мочевыделительной систем. На основании накопленного опыта по ведению пациентов предлагается в течении COVID-19 различать острую (от 1-го до 4-х недель), подострую (от 4-х до 12-ти недель) и хроническую (от 12-ти недель и более) формы. Использование такого подхода в реальной клинической практике облегчает работу врачей по амбулаторно-поликлиническому этапу наблюдения, снижению социального бремени заболевания, маршрутизации пациентов, а также стратификации лиц, страдающих COVID-19 на предмет развития легочного фиброза.
COVID-19, прогноз, хроническое течение, артериальная гипертензия, инфекционный миокардит, гипергликемия, интерстициальная пневмония, легочный фиброз
Короткий адрес: https://sciup.org/14119614
IDR: 14119614 | УДК: 616-002; 616-002.2 | DOI: 10.33619/2414-2948/70/24
Текст научной статьи Коронавирусная болезнь-2019 (COVID-19): течение и отдаленные последствия
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-002;616-002.2
Коронавирусная инфекция, унесшая к настоящему времени более 4,31 млн. человеческих жизней, стала одной из основных глобальных проблем общественного здравоохранения. По состоянию на конец июля 2021 года в мире число зараженных превысило 204 млн. человек. Лавинообразное течение пандемии коронавирусной инфекции и, как следствие, введение режима самоизоляции, а также карантинных мер значительно повлияло на психосоматический статус людей в обществе. Очевидно, что борьба с пандемией новой коронавирусной инфекции на сегодняшний день является одним из самых злободневных социальных вопросов глобального масштаба. Накопленные сведения по новой коронавирусной болезни — 2019 (COVID-19, CoronaVirus Disease 2019) дают основание полагать, что течение COVID-19 является сложным и порой непредсказуемым [1–8] с возможными долгосрочными осложнениями, называемыми «постковидным синдромом». На наш взгляд, использование в клинической практике термина «постковидный синдром» не совсем правильно, поскольку сохраняющиеся симптомы COVID-19 могут свидетельствовать о хроническом течении патологического процесса. Как показывает реальная клиническая практика, именно в отдаленном периоде формируются разнообразные осложнения. В публикации М. Г. Бубновой и Д. М. Аронова подчеркнуто, что острая коронавирусная болезнь 2019, ассоциированная с сердечно-сосудистым синдромом, проявляется в виде фибрилляции предсердий или желудочков, острым миокардитом, выпотным перикардитом, тампонадой сердца, а также различными тромбоэмболическими нарушениями [9]. Появились сообщения, что у лиц с COVID-19 выявляются осложнения в отдаленном периоде заболевания [10, 11]. Симптомы и/или признаки поражения сердечно-сосудистой, нефро- и цереброваскулярной систем регистрируются в любой период госпитализации пациента. Многочисленные исследования демонстрируют, что риск полиорганной дисфункции возрастает с 15-го дня от начала лихорадки [8, 12–14]. Развитие тех или иных органных осложнений нередко развивается после стабилизации либо улучшения респираторного статуса пациента [15].
Уже известно, что тяжесть патологических изменений, клинические проявления и течение COVID-19 варьируют от бессимптомной инфекции – до тяжелой пневмонии, сепсиса, полиорганной дисфункции и острого респираторного дистресс-синдрома (ОРДС) [16–20]. Вместе с тем течение COVID-19 может отличаться в зависимости от климатогеографических особенностей региона проживания пациента, его возраста, пола и этнической принадлежности.
Более полное исследование структуры вирусных частиц и механизмов патологического процесса показало, что коронавирус для проникновения в клетки хозяина использует рецептор ангиотензинпревращающего фермента 2 (АПФ2). В работе M. Hoffmann с соавторами отмечено, что коронавирус для входа в клетки хозяина использует трансмембранный гликопротеин CD147, который выступает в роли кофактора активации S-белка для эффективной клеточной инвазии вируса [21]. Следовательно, исходный уровень гликопротеина CD147 в организме человека определяет степень вирусной нагрузки. Повышенная экспрессия гликопротеина CD147 не только определяет тяжесть заболевания, но, возможно, и отдаленные исходы COVID-19.
Биологическая роль АПФ2 в организме человека хорошо изложена О. М. Драпкиной и Л. Э. Васильевой в 3-м номере журнала «Кардиоваскулярная терапия и профилактика» за 2020 год. Так, АПФ2 представляет собой мембранный фермент, и впервые был идентифицирован как гомолог АПФ1 в 2000 году [4]. По данным M. Donoghue и соавторов, АПФ2 превращает ангиотензин II в ангиотензин 1-7 и ангиотензин I в ангиотензин 1-9 [22]. Последующие исследования показали, что АПФ2 как мембранный белок, закреплен на апикальной поверхности клеток [23]. Исследователи подчеркивают, что АПФ1 и АПФ2 различаются по функциям, хотя они как трансмембранные ферменты, имеют схожую структуру. Важно помнить, что наибольшее количество АПФ2 сосредоточено в слюнных железах, дыхательных путях, эпителии альвеол легких, тонкой кишки и почек, эндотелии артерий и вен, гладкомышечном слое артерий [24]. Предполагается, что АПФ2 обеспечивает ингибирующий контроль над ангиотензином II. АПФ2 катализирует деградацию ангиотензина I и ангиотензина II, снижая их уровни [25]. Кроме того, продукты распада ангиотензина I и ангиотензина II сами по себе являются биологически активными пептидами, участвующими в ингибировании активности ангиотензина II [25, 26]. Ранее продемонстрировано, что снижение образования ангиотензина I на фоне избыточного накопления ангиотензина II содействует повреждению внутренних органов и легких, в том числе [27]. По другим данным, отмечалась прямая корреляционная зависимость между уровнем ангиотензина II в крови, вирусной нагрузкой и тяжестью поражения легких [28]. Анализ данных литературы, касающихся роли АПФ2 при коронавирусной инфекции, позволяет сделать вывод о том, что продукция АПФ2 снижается с возрастом. Содержание АПФ2 у молодых людей выше, чем у пожилых, а у женщин выше, чем у мужчин [26]. Между тем, у людей старших возрастных групп COVID-19 протекает намного тяжелее. Прогноз COVID-19 у лиц старшего возраста коррелирует с числом сопутствующих заболеваний и степенью вирусной нагрузки [29–31].
Течение и прогноз COVID-19. Непосредственной целью лечения COVID-19, осложненной органной дисфункцией, является сохранение жизни человека, в то время как промежуточная и конечная цели — профилактика всевозможных осложнений. С самого начала возникновения пандемии COVID-19 усилия исследователей были направлены на поиск эффективных вариантов терапии органных дисфункций, регистрируемых в начальном периоде заболевания. Тогда как изучению развития возможных отдаленных последствий COVID-19 уделялось мало внимания. Точный механизм развития хронического повреждения различных органов при COVID-19 требует всестороннего исследования. Между тем в реальной клинической практике у многих пациентов с COVID-19 в отдаленном периоде отмечаются различные органные дисфункции, среди которых поражения сердечнососудистой, нефро- и цереброваскулярной систем являются жизнеугрожающими. С другой стороны, сохраняющиеся интерстициальные изменения легких на компьютерной томографии, повышенные уровни С-реактивного белка и ферритина крови при наличии респираторных симптомов в отдаленные периоды COVID-19 оставляют много вопросов. Кроме того, определенные трудности у клиницистов вызывают формулировки клинического диагноза при так называемом «постковидном периоде» заболевания.
Как показывает практика, многие пациенты в отдаленном периоде COVID-19 отмечают усиленное потоотделение, головные боли, снижение работоспособности, похудание, сердцебиение, различные вегетативные расстройства и нарушения менструального цикла, в том числе. Недавно И. А. Козлов и И. Н. Тюрин на основании литературных данных предоставили сведения о частоте, основных вариантах и прогностическом значении сердечнососудистых осложнений коронавирусной инфекции. Так, факторами риска возникновения сердечно-сосудистых осложнений у пациентов с СOVID-19 явились сахарный диабет, пожилой и старческий возраст, хроническая обструктивная болезнь легких, хроническая болезнь почек, системное воспаление, иммунные реакции, коагулопатия и метаболические нарушения, полиорганная дисфункция, длительная иммобилизация, а также неблагоприятные кардиотропные эффекты лекарственных средств [7]. В публикации исследователей во главе с В. Ю. Мареевым отмечено, что нарастающее аутоиммунное воспаление и коагулопатия с риском повышенного тромбообразования после 12-14-го дня болезни определяют прогрессирование COVID-19 и дальнейший прогноз пациентов [8].
Выявленные системные изменения у пациентов с COVID-19 в стационарном периоде лечения, такие как: повышение уровня креатинкиназы, лактатдегидрогеназы, цистатина С, NT-proBNP (N-terminal pro-brain natriuretic peptide, pro-B-type natriuretic peptide), тропонина I, Д-димера, могут провоцировать различные органные дисфункции в будущем. Как сказано в публикации О. Л. Барбараш с соавторами, более поздние сердечно-сосудистые проявления крайне важны, так как они могут существенно влиять на долгосрочный прогноз. Так, авторами предполагается ассоциация инфицирования SARS-CoV-2 с нарушениями регуляции липидного и углеводного обмена, а также хроническое повреждающее действие этого вирусного агента на сердечно-сосудистую систему [1]. Исследователи утверждают, что нарушения функциональных свойств миокарда и развитие сердечной недостаточности при COVID-19 индуцируются гипоксическим повреждением кардиомиоцитов на фоне гипериммунного воспаления, системного ацидоза, лизиса митохондрий. В отдаленном периоде COVID-19 микроциркуляторные нарушения развиваются на фоне гиперкоагуляции и дезагрегации тромбоцитов, а также вазоспазма [8, 9]. По отдельным данным, миокардит и сердечная недостаточность составляют до 7% в общей структуре смертности от COVID-19 [32]. Развитие тяжелой сердечной недостаточности сопровождается повышением содержания NT-proBNP в крови [33]. Как показали исследования, особенностями миокардита при COVID-19 являются наличие коронариита и возможность сочетания миокардита с лимфоцитарным эндо- и перикардитом [6].
На кафедре факультетской терапии КГМА им. И. К. Ахунбаева наблюдаются свыше 300 пациентов, перенесших новую коронавирусную инфекцию с различными органными осложнениями. Часть этих пациентов послужила материалом для наших ранее проведенных исследований [13, 14, 18, 20]. В данной работе представляем клинические случаи, иллюстрирующие возникновение сердечно-сосудистых и других осложнений в отдаленном периоде коронавирусной инфекции.
Клинический случай №1. Пациентка — М., 55 лет. В анамнезе: страдает артериальной гипертензией (АГ) в течение трех лет (подъемы артериального давления (АД) до 150-160/90100 мм рт. ст.), нерегулярно принимает антигипертензивные препараты. С 12.10.2020 по 21.10.2020 гг. получала стационарное лечение по месту жительства с клиническим диагнозом: U07 1. Коронавирусная инфекция, осложненная пневмонией. ОРДС. Дыхательная недостаточность II степени. При обследовании: гемоглобин 86 г/л, эритроциты 3,84×109/л, тромбоциты 186×109/л, лимфоциты 23%, гематокрит 23%, скорость оседания эритроцитов (СОЭ) 34 мм/час. В биохимическом анализе крови: глюкоза венозной крови натощак 6,6 ммоль/л, креатинин 52,3 мкмоль/л, фосфор 0,8 ммоль/л, магний 0,7 ммоль/л, кальций 2,2 ммоль/л, С-реактивный белок 96 мг/л, железо сыворотки крови 16,2 мкмоль/л. Проведена антибактериальная, антиагрегантная и антикоагулянтная терапия с положительным эффектом. В конце декабря месяца 2020 года начала отмечать появление одышки и мышечной слабости. Госпитализирована в отделение реанимации с клиникой сердечной недостаточности. При обследовании: гемоглобин 103 г/л, эритроциты 4,95×1012/л, тромбоциты 103×109/л, лимфоциты 29%, гематокрит 31%, СОЭ 18 мм/час. При биохимическом анализе крови были получены следующие результаты: глюкоза венозной крови натощак 7,8 ммоль/л, креатинин 58,3 мкмоль/л, фибриноген 3,4 г/л. В начале февраля 2021 года обратилась в клиническую базу кафедры факультетской терапии КГМА имени И. К. Ахунбаева. Жалобы: одышка и сердцебиение при малейшей физической нагрузке, отеки на голенях, стопах и передней брюшной стенке, уменьшение количества выделяемой мочи. При поступлении показатель SaО 2 в покое, без кислородной терапии равнялся 86%.
Объективно: набухание шейных вен, частота дыханий 24 в минуту в покое. При аускультации: над легкими жесткое дыхание, единичные сухие хрипы при форсированном выдохе. Частота сердечных сокращений (ЧСС) — 110 уд/мин, пульс ритмичный, АД 140/90 мм рт. ст. Печень увеличена, нижний край закругленный, консистенция эластичная, гладкий и болезненный при пальпации. Живот увеличен в объеме за счет асцита, селезенка не пальпируется. Отеки голеней и стоп.
Таблица 1
ДАННЫЕ ЭХОКАРДИОГРАФИЧЕСКИХ ИССЛЕДОВАНИЙ (ПАЦИЕНТКА М., 55 ЛЕТ)
|
Показатель |
25.02.2021 |
27.03.2021 |
Референсные значения |
|
Аорта в восходящем отделе, см |
3,4 |
3,6 |
2,0-4,0 |
|
Конечный диастолический размер ЛЖ, см |
6,9 |
5,8 |
4,0-5,5 |
|
Конечный систолический размер ЛЖ, см |
5,7 |
4,7 |
2,5-3,8 |
|
Конечный диастолический объем ЛЖ, мл |
244 |
169 |
59-157 |
|
Конечный систолический объем ЛЖ, мл |
160 |
107 |
18-68 |
|
Ударный объем ЛЖ, мл |
85 |
62 |
44-100 |
|
Толщина задней стенки ЛЖ, см |
0,9 |
1,2 |
0,6-1,0 |
|
Толщина межжелудочковой перегородки, см |
0,9 |
1,2 |
0,6-1,0 |
|
Фракция выброса ЛЖ, % (Simpson) |
27 |
37 |
>52 |
|
Продольный размер правого желудочка, см |
2,6 |
2,3 |
<3,0 |
|
Размер левого предсердия, см |
4,5 |
4,3 |
1,9-4,0 |
|
Диаметр легочной артерии, см |
2,5 |
2,2 |
<2,8 |
|
Систолическая экскурсия плоскости |
2,5 |
2,6 |
>1,7 |
|
трикуспидального кольца в M режиме, см |
|||
|
Толщина передней стенки ПЖ, см |
0,5 |
0,4 |
<0,5 |
Примечание. ЛЖ — левый желудочек; ПЖ — правый желудочек
По данным суточного мониторирования электрокардиограммы (на фоне терапии 1,25 мг бисопролола) всего было зарегистрировано 98386 комплексов QRS. Средняя ЧСС — 71 уд/мин, минимальная ЧСС — 42 уд/мин в 06:46. Максимальная ЧСС — 130 уд/мин в 22:10. Были обнаружены 64 изолированных политопных желудочковых экстрасистол (преимущественно в дневные часы), из них 5 – желудочковые экстрасистолы по типу бигеминий. В течение всего периода записи суточного мониторирования электрокардиограммы (22 ч 52 мин) регистрировалось нарушение процессов реполяризации левых отделов сердца: косонисходящая депрессия сегмента ST с переходом в горизонтальную депрессию на 0,5–1,0 мм во II, III, aVF, V4-V6 отведениях. Вместе с тем, у нашей пациентки во время суточного мониторирования электрокардиограммы выявлялись: A-V блокада I степени (интервал PQ = 0,24–0,36 сек); 3385 эпизодов A-V блокады II степени Мобитц I; 16 эпизодов высокостепенной A-V блокады 2:1 (преимущественно в утренние часы).
Таблица 2
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (ПАЦИЕНТКА М., 55 ЛЕТ)
|
Показатель |
5.02.2021 |
16.03.2021 |
Референсные значения |
|
Глюкоза, ммоль/л |
7,09 |
6,58 |
3,8–5,82 |
|
Мочевая кислота, мг/дл |
- |
5,3 |
3,5 – 7,2 |
Бюллетень науки и практики / Bulletin of Science and Practice Т. 7. №9. 2021
|
Показатель |
5.02.2021 |
16.03.2021 |
Референсные значения |
|
Магний, ммоль/л |
0,68 |
0,82 |
0,73 – 1,06 |
|
Калий, ммоль/л |
4,3 |
4,6 |
3,4 – 5,5 |
|
Кальций, ммоль/л |
2,12 |
2,61 |
2,11 – 2,55 |
|
Натрий, ммоль/л |
139 |
136 |
136 – 145 |
|
Неорганический фосфор, ммоль/л |
1,01 |
1,44 |
0,87 – 1,45 |
|
С-реактивный белок количественный, мг/л |
96 |
5,09 |
до 5 |
|
Лактатдегидрогеназа, МЕ/л |
- |
177 |
125 – 220 |
|
Фолиевая кислота, нг/мл |
6,2 |
- |
3,1 – 20,5 |
|
Креатинкиназа, Ед/л |
- |
18 |
29 – 168 |
|
Аланинаминотрансфераза, Ед/л |
42,2 |
- |
0 – 20 |
|
Аспартатаминотрансфераза, Ед/л |
44 |
- |
0 – 20 |
|
Липидный профиль |
|||
|
Общий холестерин (ХС), ммоль/л |
- |
5,90 |
до 5,17 |
|
ХС липопротеинов высокой плотности, ммоль/л |
- |
0,83 |
от 1,2 |
|
ХС липопротеинов низкой плотности, ммоль/л |
- |
3,82 |
2,6 – 3,34 |
|
Триглицериды, ммоль/л |
- |
2,11 |
до 1,7 |
|
Маркеры воспаления/Гемостазиограмма |
|||
|
Фибриноген, г/л |
3,4 |
2,9 |
1,8–3,5 |
|
Д-димер, мг FEU/л |
5,34 |
0,652 |
0 – 0,55 |
|
Ферритин, нг/мл |
- |
53,81 |
5 – 148 |
|
Цитокиновый профиль |
|||
|
Интерлейкин-10, пг/мл |
14,798 |
2,143 |
до 30 |
|
Интерлейкин-6, пг/мл |
30,671 |
3,941 |
до 10 |
|
Фактор некроза опухоли-альфа (TNF-α), пг/мл |
1,607 |
0,294 |
до 6 |
|
Фактор роста эндотелия сосудов (VEGF), пг/мл |
445,62 |
451,80 |
10 – 700 |
|
Функциональное состояние почек |
|||
|
Креатинин, мкмоль/л |
58,2 |
55,5 |
62 – 115 |
|
Цистатин С, мг/л |
1,05 |
1,23 |
0,31 – 0,79 |
|
Гомоцистеин, мкмоль/л |
10,91 |
8,18 |
5,46 – 16,2 |
|
Расчетная СКФ мл/мин/1,73м2, по креатинину |
100 |
101 |
|
|
Расчетная СКФ мл/мин/1,73м2, по цистатину С |
72,20 |
61,00 |
|
|
Клиренс креатинина по формуле Кокрофта-Голта, |
107 |
111 |
|
|
мл/мин/1,73м2 |
|||
|
Примечание. СКФ — скорость клубочковой фильтрации. |
|||
Учитывая перенесенную новую коронавирусную инфекцию в октябре 2020 года и тяжесть общего состояния, пациентка в конце декабря 2020 года была вновь госпитализирована в стационар Национального госпиталя (г. Бишкек) с клиническим диагнозом: Коронавирусная болезнь 2019 (COVID-19), подострое течение, с преимущественным поражением сердца (инфекционный миокардит с нарушением A-V проводимости и снижением сократимости левого желудочка /сердечная недостаточность), почек (тубулоинтерстициальный нефрит), печени (гепатит с минимальной степенью активности). Была проведена терапия с включением сердечных гликозидов, бета-блокаторов, ингибиторов ангиотензинпревращающего фермента, нитратов, диуретиков, антикоагулянтов, антибактериальных препаратов, корректоров метаболизма. На фоне приема указанных фармакологических препаратов в амбулаторно-поликлинических условиях самочувствие пациента улучшилось: одышку в покое не отмечает, расширился двигательный режим, исчезли отеки на нижних конечностях, живот уменьшился в объеме. АД снизилось до целевого уровня. В настоящее время пациентка продолжает наблюдаться в амбулаторнополиклинических условиях. Цель представления данного клинического случая заключается в том, чтобы на его примере продемонстрировать возникновение сердечно-сосудистых осложнений через 1 месяц после коронавирусной инфекции.
Клинический случай №2. Пациентка А., 48 лет, в июле 2020 г. перенесла новую коронавирусную инфекцию, лечилась стационарно по месту жительства. В конце марта 2021 г. обратилась в клиническую базу кафедры факультетской терапии КГМА им. И. К. Ахунбаева. Жалобы: одышка при небольшой физической нагрузке, кашель с трудноотделяемой мокротой, головные боли. SaО 2 92% в покое на атмосферном воздухе. Частота дыханий 23 в минуту в покое. При аускультации: над легкими дыхание жесткое, влажные хрипы в нижних отделах легких с обеих сторон. ЧСС 93 уд/мин, ритм правильный, АД 120/80 мм рт. ст. Печень увеличена, нижний край закругленный, консистенция эластичная, характер гладкий и болезненный. Живот увеличен в объеме за счет толщины подкожно-жирового слоя, селезенка не пальпируется.
Таблица 3
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (ПАЦИЕНТКА А., 48 ЛЕТ)
|
Показатель |
02.04.2021 |
Референсные значения |
|
Глюкоза, ммоль/л |
8,45 |
3,8–5,82 |
|
С-реактивный белок количественный, мг/л |
2,3 |
до 5 |
|
Лактатдегидрогеназа, МЕ/л |
151 |
125–220 |
|
Ферритин, нг/мл |
255,4 |
5–148 |
|
Креатинкиназа, Ед/л |
37 |
29–168 |
|
Аланинаминотрансфераза, Ед/л |
31 |
0–20 |
|
Аспартатаминотрансфераза, Ед/л |
19 |
0–20 |
|
ГГТ, гамма глутамин транспептидаза, Ед/л |
45 |
9–36 |
|
Фибриноген, г/л |
3,4 |
2–4 |
|
Д-димер, мг FEU/л |
0,348 |
0–0,55 |
|
Прокальцитонин, нг/мл |
0,029 |
0–0,1 |
|
Цистатин С, мг/л |
0,73 |
0,31–0,79 |
|
Креатинин, мкмоль/л |
58,1 |
53–97 |
|
Общий холестерин, ммоль/л |
6,80 |
до 5,17 |
|
Холестерин липопротеинов высокой плотности, ммоль/л |
0,98 |
от 1,2 |
|
Холестерин липопротеинов низкой плотности, ммоль/л |
5,28 |
2,6–3,34 |
|
Триглицериды, ммоль/л |
1,72 |
до 1,7 |
|
Т3, трийодтиронин, нмоль/л |
1,62 |
0,89–2,44 |
|
Т4, тироксин, нмоль/л |
113,45 |
62,67–150,8 |
|
ТТГ, тиреотропный гормон, мМЕ/мл |
1,3886 |
0,35–4,94 |
|
Антитела к тиреоидной пероксидазе (АТ-ТПО), МЕ/мл |
0,07 |
до 5,61 |
|
Интерлейкин-10, пг/мл |
2,273 |
до 30 |
|
Интерлейкин-6, пг/мл |
27,790 |
до 10 |
|
Фактор некроза опухоли-альфа (TNF-α), пг/мл |
1,875 |
до 6 |
|
Фактор роста эндотелия сосудов (VEGF), пг/мл |
274,30 |
10–700 |
|
Антитела к коронавирусу SARS-CoV-2/ IgG, |
8,67 |
<0,8 |
|
Антитела к коронавирусу SARS-CoV-2/ IgМ, |
0,51 |
<0,8 |
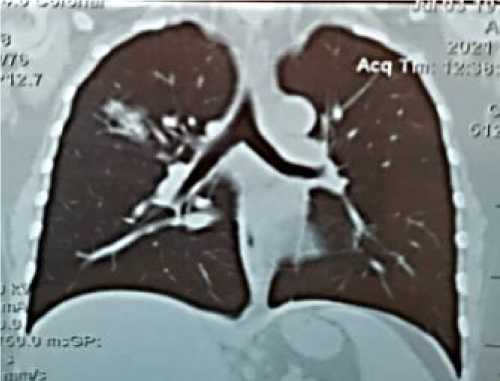
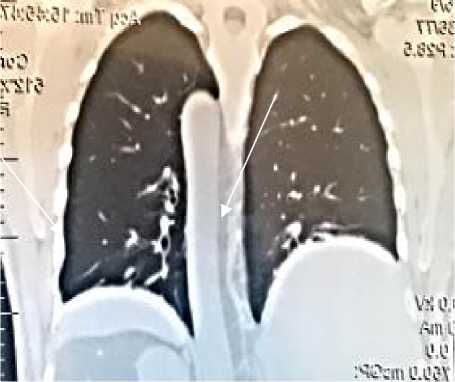
Периферический анализ крови: лейкоцитоз (лейкоциты = 11,73×109/л), нейтрофилез (нейтрофилы = 7,568×109/л), тромбоцитоз (тромбоциты = 422,9×109/л), а также ускоренное СОЭ (по Вестергрену) = 20 мм/час. На компьютерной томографии легких (Рисунок 1, А, Б, В) выявлены участки уплотнений легочной ткани по типу «матового стекла». Необходимо подчеркнуть, что пациентка А., 48 лет, до коронавирусной инфекции сахарным диабетом 2-го типа не страдала, наследственной отягощенности по нарушениям углеводного обмена не отмечает. Ранее, при плановом профилактическом осмотре, глюкоза венозной крови не превышала референсных значений. На фоне пероральной сахароснижающей терапии уровень глюкозы крови натощак показал 8,45 ммоль/л.
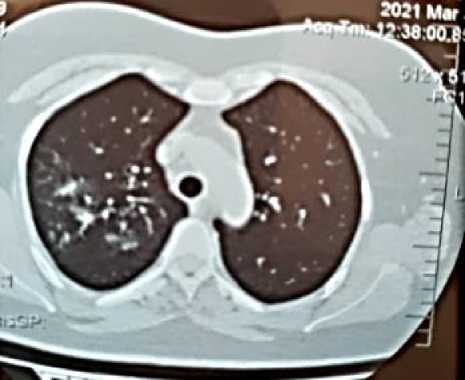
А
Б
Р исунок 1 (А, Б). Компьютерная томография легких пациентки А., 48 лет: видны светлые участки/уплотнения легочной ткани
В
Рисунок 1 (В). Компьютерная томография легких пациентки А., 48 лет: видны светлые участки/уплотнения легочной ткани
Клинический диагноз: Коронавирусная болезнь 2019 (COVID-19), хроническое течение, с преимущественным поражением легких (интерстициальная пневмония/дыхательная недостаточность) и поджелудочной железы (гипергликемия).
Цель представления данного клинического случая – продемонстрировать возникновение сахарного диабета и легочных осложнений в марте 2021 года после перенесенной новой коронавирусной инфекции в июле 2020 года, то есть через 8 месяцев. Пациентке были рекомендованы низкопоточная кислородотерапия, антибактериальные препараты, антиагреганты и метформин, а также контроль за уровнем сахара крови.
Клинический случай №3. Пациент Д., 55 лет, в июле 2020 г. перенес новую коронавирусную инфекцию, лечился в амбулаторно-поликлинических условиях по месту жительства. В конце марта 2021 г. обратился в клиническую базу кафедры факультетской терапии КГМА им. И. К. Ахунбаева. Жалобы: одышка при небольшой физической нагрузке, кашель с трудноотделяемой мокротой без примеси крови. SaО 2 93% в покое, без кислородной терапии. Частота дыханий - 22 в минуту в покое. При аускультации: над легкими дыхание жесткое, влажные хрипы в нижних отделах с обеих сторон. Частота сердечных сокращений 86 уд/мин, ритм правильный. АД 160/90 мм рт. ст. Печень увеличена в размере, нижний край закругленный, консистенция эластичная, характер гладкий и болезненный. Живот не увеличен в объеме, селезенка не пальпируется. Из анамнеза заболевания: в течение 13 лет состоит на диспансерном учете по поводу сахарного диабета 2-го типа. Регулярно принимает сахароснижающие препараты. Артериальная гипертензия с 2019 года. Принимал противовирусный препарат (энтекавир) по поводу вирусного гепатита В. Курение отрицает, вредных привычек не имеет.
Таблица 4.
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (ПАЦИЕНТ Д., 55 ЛЕТ)
|
Показатель |
25.03.2021 |
Референсные значения |
|
Гликированный гемоглобин, % |
6,7 |
4,5–6,3 |
|
Аланинаминотрансфераза, Ед/л |
15,9 |
0–20 |
|
Аспартатаминотрансфераза, Ед/л |
30,3 |
0–20 |
|
Калий, ммоль/л |
4,1 |
3,4–5,5 |
|
Натрий, ммоль/л |
130 |
136–145 |
|
Кальций, ммоль/л |
2,24 |
2,11–2,55 |
|
Креатинин, мкмоль/л |
130 |
53–97 |
|
Гомоцистеин, мкмоль/л |
16,09 |
5,46–16,2 |
|
Общий холестерин, ммоль/л |
5,76 |
до 5,17 |
|
Холестерин липопротеинов высокой плотности, ммоль/л |
0,96 |
от 1,2 |
|
Холестерин липопротеинов низкой плотности, ммоль/л |
4,70 |
2,6–3,34 |
|
Триглицериды, ммоль/л |
1,50 |
до 1,7 |
|
Интерлейкин-10, пг/мл |
5,221 |
до 30 |
|
Интерлейкин-6, пг/мл |
2,644 |
до 10 |
|
Фактор некроза опухоли-альфа (TNF-α), пг/мл |
3,452 |
до 6 |
|
Фактор роста эндотелия сосудов (VEGF), пг/мл |
1181,96 |
10–700 |
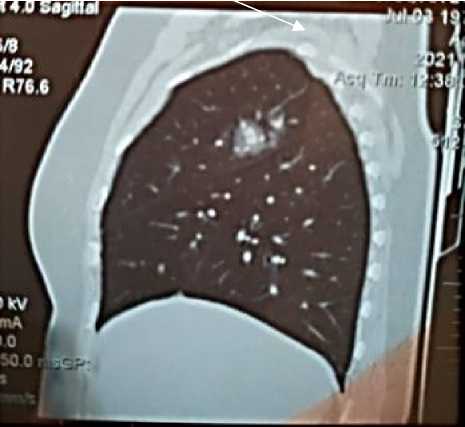
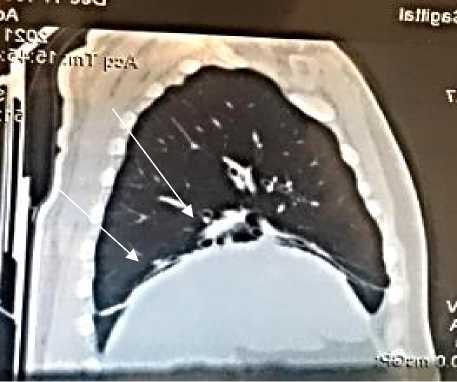
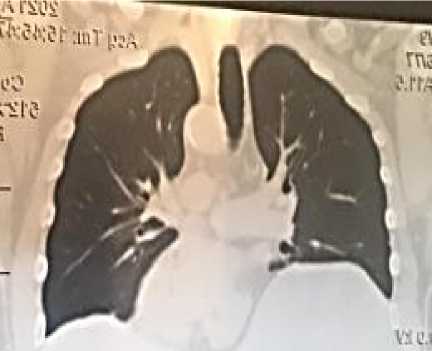
Результаты анализа периферический крови: лейкоциты = 6,90×109/л, нейтрофилы = 3,97×109/л, тромбоциты = 268×109/л, СОЭ (по Вестергрену) = 24 мм/час. В клиническом анализе мочи: протеинурия – белок 1 г/л. На компьютерной томографии легких (Рисунок 2 Г,
Д, Е) отмечаются перибронхиальные утолщения, сливающиеся между собой очаговые тени и сравнительно светлые участки, а также неровность контуров нижнего края легких (Рисунок 2
Ж).
Г
Д
Ain С c.e.
Е
Ж
Рисунок 2 (Г, Д). Компьютерная томография легких пациента Д., 55 лет: видны светлые участки/уплотнения легочной ткани
По данным эластографии печени (фиброскан) по шкале METAVIR (META-ANALYSIS OF HISOLOGICAL DATA IN VIRAL HEPATITIS) были выявлены признаки фиброза с множественными септами без цирроза, то есть картина F3.
Клинический диагноз: Коронавирусная болезнь 2019 (COVID-19), хроническое течение с преимущественным поражением легких (интерстициальная пневмония/дыхательная недостаточность). Сахарный диабет 2-го типа, целевой уровень HbA1c <7,5%. Артериальная гипертензия высокого риска, I стадия. Хроническая болезнь почек С1, А1. Хронический вирусный гепатит «В» минимальной степени активности.
Цель представления данного клинического случая заключается в том, чтобы на его примере продемонстрировать существование признаком интерстициальной пневмонии через 8 месяцев (март 2021 г.) у пациента перенесшего новую коронавирусную инфекцию в июле 2020 года на фоне сахарного диабета 2-го типа и хронического заболевания печени. Спектр иммунопатологических изменений у пациента, имеющего вирус гепатита В (ДНК содержащий вирус) при наличии коронавирусной инфекции (РНК содержащий вирус) во многом определяется компенсацией углеводного обмена в будущем.
Клинический случай №4. Пациент К., 38 лет, в октябре 2020 г. перенес новую коронавирусную инфекцию, лечился по месту жительства. В анамнезе проявлений сердечнососудистых заболеваний отрицает, не курит. В декабре 2020 года стал ощущать чувство дискомфорта за грудиной и мышечную слабость. Был осмотрен кардиологом, проведены электро- и эхокардиографическое исследования, суточное мониторирование ЭКГ, по результатам которых каких-либо патологий со стороны сердечно-сосудистой системы выявлено не было. Повышение АД до 160/100 мм рт. ст. начал отмечать с конца февраля 2021 года. Периодически принимал каптоприл 25 мг под язык. При поступлении в стационар: жалобы на чувство дискомфорта за грудиной и мышечную слабость. SaО2 94% в покое, без кислородной поддержки. Частота дыханий 22 в минуту в покое. При аускультации: над легкими дыхание жесткое, сухие хрипы в нижних отделах легких с обеих сторон на высоте вдоха. ЧСС 46 уд/мин, ритм правильный. АД 160/100 мм рт. ст. Печень увеличена, нижний край закругленный, консистенция эластичная, поверхность печени гладкая и болезненная при пальпации. Живот не увеличен в объеме. Селезенка и лимфатические узлы не пальпируются. Видимых отеков нет. В клиническом анализе мочи — протеинурия и гематурия.
Таблица 5
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (ПАЦИЕНТ К., 38 ЛЕТ)
|
Показатель |
02.04.2021 |
Референсные значения |
|
Глюкоза, ммоль/л |
4,05 |
3,8–5,82 |
|
С-реактивный белок количественный, мг/л |
0,63 |
до 5 |
|
Лактатдегидрогеназа, МЕ/л |
142 |
125 - 220 |
|
Креатинкиназа, Ед/л |
61 |
29 - 168 |
|
Аланинаминотрансфераза, Ед/л |
43 |
0 – 20 |
|
Аспартатаминотрансфераза, Ед/л |
49 |
0 – 20 |
|
Д-димер, мг FEU/л |
0,112 |
0 – 0,55 |
|
Цистатин С, мг/л |
0,99 |
0,31 – 0,79 |
|
Креатинин, мкмоль/л |
67,9 |
53 – 97 |
|
Гомоцистеин, мкмоль/л |
11,98 |
5,46 – 16,2 |
|
Т3, трийодтиронин, нмоль/л |
1,00 |
0,89 – 2,44 |
|
Т4, тироксин, нмоль/л |
67,30 |
62,67 – 150,8 |
|
ТТГ, тиреотропный гормон, мМЕ/мл |
3,2661 |
0,35 – 4,94 |
|
Антитела к тиреоидной пероксидазе (АТ-ТПО), МЕ/мл |
488,90 |
до 5,61 |
|
Паратиреоидный гормон, пг/мл |
60,6 |
9,5 – 75 |
|
Интерлейкин-10, пг/мл |
0,357 |
до 30 |
|
Интерлейкин-6, пг/мл |
0,247 |
до 10 |
|
Фактор некроза опухоли-альфа (TNF-α), пг/мл |
2,262 |
до 6 |
|
Фактор роста эндотелия сосудов (VEGF), пг/мл |
225,30 |
10 – 700 |
При проведении ультразвукового исследования внутренних органов обнаружены изменения эхогенности паренхимы печени и почек, а также атрофические изменения в структуре щитовидной железы. На электрокардиографии — картина синусовой брадикардии. Нарушения в глобальной функции желудочков и другие изменения при эхокардиографии не отмечались. По данным суточного мониторирования ЭКГ всего было зарегистрировано
88427 комплексов QRS. Средняя ЧСС 69 уд/мин, минимальная ЧСС 47 уд/мин в 06:12. Максимальная ЧСС 107 уд/мин в 15:37. Были обнаружены: 1 изолированная наджелудочковая экстрасистола; эпизоды нарушений процессов реполяризации в нижней и передне-боковой стенке левого желудочка; эпизоды A-V блокады I степени (интервал PQ = 0,24 сек) в ночное время; преходящий синдром ранней реполяризации желудочков. Клинический диагноз: Коронавирусная болезнь 2019 (COVID-19), хроническое течение, с преимущественным поражением сердца (миокардит с нарушением A-V проводимости), почек (тубулоинтерстициальный нефрит/артериальная гипертензия), печени (гепатит минимальной степени активности).
Клинический случай №5. Пациентка К., 61 лет, в июле 2020 года перенесла коронавирусную инфекцию, осложненную двусторонней полисегментарной пневмонией. В анамнезе: временами отмечает повышение АД (до 150/90 мм рт. ст.), регулярно принимает антигипертензивные препараты. С марта 2021 года появился кашель с трудноотделяемой мокротой, субфебрильное повышение температуры тела. При поступлении в стационар жалобы на чувство дискомфорта за грудиной, одышку и мышечную слабость. SaО 2 — 90% в покое, без кислородной поддержки. Частота дыханий 22 в минуту в покое. При аускультации: над легкими дыхание жесткое, сухие хрипы в нижних отделах легких с обеих сторон. ЧСС 78 уд/мин, ритм правильный, АД 120/80 мм рт. ст.
|
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ ( |
ПАЦИЕНТКА К., 6 |
Таблица 6 ЛЕТ) |
|
Показатель |
10.04.2021 |
Референсные значения |
|
Глюкоза, ммоль/л |
5,5 |
3,8–5,82 |
|
Гликированный гемоглобин, % |
5,8 |
4,5–6,3 |
|
С-реактивный белок количественный, мг/л |
10,6 |
до 5 |
|
Лактатдегидрогеназа, МЕ/л |
202 |
125–220 |
|
Ферритин, нг/мл |
227,1 |
5–148 |
|
Креатинкиназа, Ед/л |
157 |
29–168 |
|
Аланинаминотрансфераза, Ед/л |
35 |
0–20 |
|
Аспартатаминотрансфераза, Ед/л |
28 |
0–20 |
|
Калий, ммоль/л |
3,4 |
3,4–5,5 |
|
Натрий, ммоль/л |
142 |
136–145 |
|
Кальций, ммоль/л |
2,35 |
2,11–2,55 |
|
Магний, ммоль/л |
0,84 |
0,77–1,03 |
|
Фибриноген, г/л |
3,1 |
2–4 |
|
Д-димер, мг FEU/л |
1,064 |
0–0,55 |
|
Прокальцитонин, нг/мл |
0,028 |
0–0,1 |
|
Цистатин С, мг/л |
0,94 |
0,31–0,79 |
|
Креатинин, мкмоль/л |
57,0 |
53–97 |
|
Общий холестерин, ммоль/л |
5,70 |
до 5,17 |
|
Холестерин липопротеинов высокой плотности, ммоль/л |
1,08 |
от 1,2 |
|
Холестерин липопротеинов низкой плотности, ммоль/л |
2,45 |
2,6–3,34 |
|
Триглицериды, ммоль/л |
1,50 |
до 1,7 |
|
Иммуноглобулин Е, МЕ/мл |
50,9 |
<87 |
|
Гомоцистеин, мкмоль/л |
12,81 |
4,44–13,56 |
По поводу респираторных жалоб пациентке выполнена рентгенография органов грудной клетки, где выявлены изменения легочной ткани в виде мелкосетчатой (мелкоячеистой) деформации легочного рисунка за счет интерстициального компонента, больше справа.
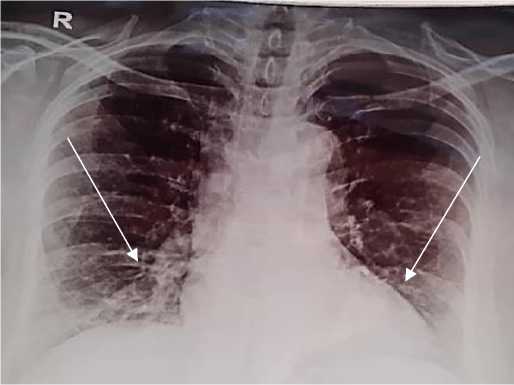
Рисунок 3. Рентгенография органов грудной клетки пациентки К., 61 лет. Хорошо видна деформация легочного рисунка, больше справа. Мелкосетчатые изменения легочной ткани
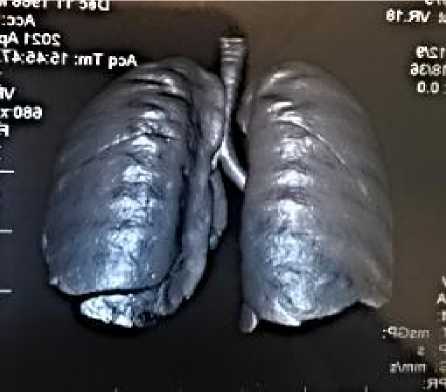
Учитывая наличие респираторных жалоб и изменений на рентгенографии легких, было решено провести компьютерную томографию легких, где полученные данные характеризовались картиной интерстициальной пневмонии (Рисунок 4).
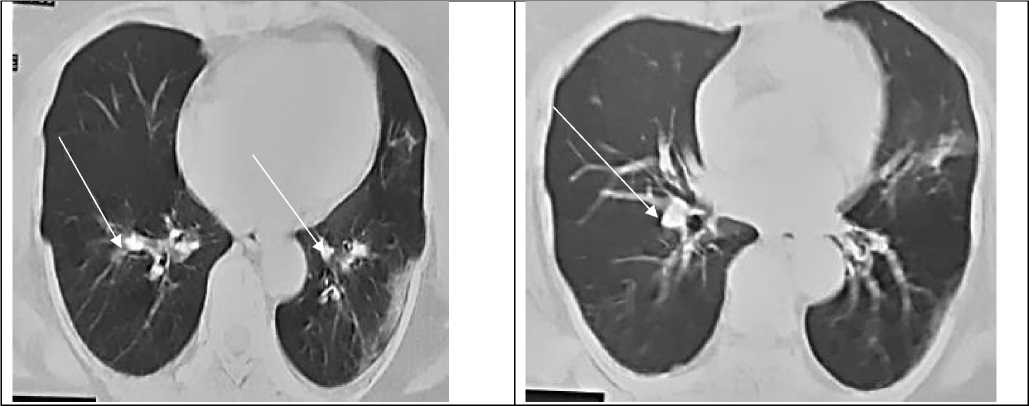
Рисунок 4. Компьютерная томография легких пациентки К., 61 лет: видны (очаговые) светлые участки/уплотнения легочной ткани, а также ретикулярные изменения
В клиническом анализе мочи: относительная плотность мочи 1033 кг/л, реакция мочи 5,5, эритроциты (измененные и неизмененные) 7,7 клеток в 1 мкл, общее количество солей 77,8 клеток в 1 мкл мочи. Макроскопически собранная моча имела ярко-желтый цвет с хлопьевидными элементами за счет большого количества эпителия в мочевом осадке (Рисунок 5). При анализе периферической крови были обнаружены признаки лимфоцитоза (52,15%) и ускорения СОЭ (35 мм/час).
При проведении электро- и эхокардиографии каких-либо патологических изменений выявлено не было.
Клинический диагноз: Коронавирусная болезнь 2019 (COVID-19), хроническое течение с преимущественным поражением легких по типу интерстициальной пневмонии. Дыхательная недостаточность. Хронический тубулоинтерстициальный нефрит.

Рисунок 5. Внешний вид собранной мочи у пациентки К., 61 лет. Моча имела ярко-желтый цвет с хлопьевидными элементами за счет большого количества эпителия в мочевом осадке
Учитывая вышеизложенное, а также накопленный клинический опыт по ведению пациентов с COVID-19 в отдаленном периоде сотрудников отделения пульмонологии Национального Госпиталя МЗ КР, кафедры факультетской терапии КГМА им. И. К. Ахунбаева, кафедры терапии №2 КРСУ, а также кафедры неврологии, нейрохирургии и психиатрии ОшГУ, предлагается следующая клиническая классификация коронавирусной болезни 2019 по течению (Рисунок 6).
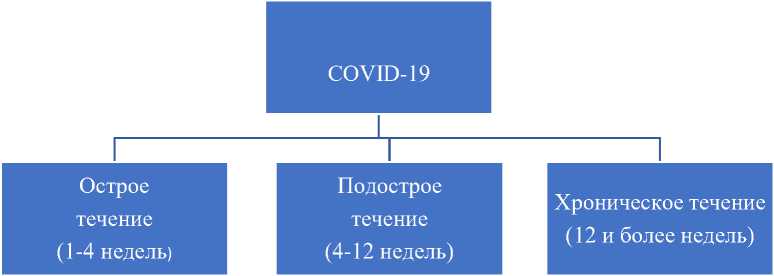
Рисунок 6. Возможные варианты течения коронавирусной болезни 2019 (COVID-19)
Как показано на Рисунке 6, предлагается в течении коронавирусной болезни 2019 (COVID-19) выделить острую, подострую и хроническую формы. Это может значительно облегчить работу врачей на амбулаторно-поликлиническом этапе реабилитации пациентов, перенесших COVID-19. Кроме того, важным моментом в отдаленном периоде после инфицирования SARS-COV-2 является исследование уровней интерлейкина-6, ферритина, Д-димера, цистатина С, бета-2-микроглобулина, гомоцистеина и CYFRA-21-1, особенно при наличии респираторных жалоб у пациента, что возможно потребует проведения компьютерной томографии легких, а в некоторых случаях, при поражении сердечнососудистой системы, также и суточного мониторирования электрокардиографии.
Список литературы Коронавирусная болезнь-2019 (COVID-19): течение и отдаленные последствия
- Барбараш О. Л., Каретникова В. Н., Кашталап В. В., Зверева Т. Н., Кочергина А. М. Новая коронавирусная болезнь (COVID 19) и сердечно сосудистые заболевания // Комплексные проблемы сердечно сосудистых заболеваний. 2020. Т. 9. №2. C. 17 28. https://doi.org/10.17802/2306 1278 2020 9 2 17 28
- Глыбочко П. В., Фомин В. В., Моисеев С. В., Авдеев С. Н., Яворовский А. Г., Бровко М. Ю., Яковлева А. А. Исходы у больных с тяжелым течением COVID 19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии // Клиническая фармакология и терапия. 2020. Т. 29. №3. С. 25 36. https://doi.org/10.32756/0869 5490 2020 3 25 36
- Глыбочко П. В., Свистунов А. А., Фомин В. В., Волкова О. С., Бутнару Д. В., Роюк В. В., Мунблит Д. Б. Роль клиник Сеченовского Университета в оказании помощи пациентам с новой коронавирусной инфекцией (COVID 19) // Национальное здравоохранение. 2020. Т. 1. №1. C. 23 27.
- Драпкина О. М., Васильева Л. Э. Спорные вопросы применения ингибиторов ангиотензинпревращающего фермента и антагонистов рецепторов ангиотензина у пациентов с COVID 19 // Кардиоваскулярная терапия и профилактика. 2020. Т. 19. №3. 2580. https://doi.org/10.15829/1728 8800 2020 2580
- Драпкина О. М., Самородская И. В., Сивцева М. Г., Какорина Е. П., Брико Н. И., Черкасов С. Н., Мальков П. Г. COVID 19: неотложные вопросы оценки заболеваемости, распространенности, летальности и смертности // Профилактическая медицина. 2020. Т. 23. №1. С. 7 13. https://doi.org/10.17116/profmed2020230117
- Коган Е. А., Березовский Ю. С., Благова О. В., Куклева А. Д., Богачева Г. А., Курилина Э. В., Фомин В. В. Миокардит у пациентов с COVID 19, подтвержденный результатами иммуногистохимического исследования // Кардиология. 2020. Т. 60. №7. С. 4 10. https://doi.org/10.18087/cardio.2020.7.n1209
- Козлов И. А., Тюрин И. Н. Сердечно сосудистые осложнения COVID 19 // Вестник анестезиологии и реаниматологии. 2020. Т. 17. №4. C. 14 22. https://doi.org/10.21292/20785658 2020 17 4 14 22
- Мареев В. Ю., Орлова Я. А., Павликова Е. П., Мацкеплишвили С. Т., Акопян Ж. А., Плисюк А. Г., Камалов А. А. Возможности комбинированной терапии на раннем этапе течения новой коронавирусной инфекции (COVID 19). Разбор клинических случаев и дизайн исследования: Бромгексин И Спиронолактон для лечения КоронаВирусной Инфекции, Требующей госпитализации (БИСКВИТ) // Кардиология. 2020. Т. 60. №8. С. 4 15. https://doi.org/10.18087/cardio.2020.8.n1307
- Бубнова М. Г., Аронов Д. М. COVID 19 и сердечно сосудистые заболевания: от эпидемиологии до реабилитации // Пульмонология. 2020. Т. 30. №5. С. 688 699. https://doi.org/10.18093/0869 0189 2020 30 5 688 699
- Barh D., Tiwari S., Andrade B. S., Weener M. E., Góes Neto A., Azevedo V., Ganguly N. K. A novel multi omics based highly accurate prediction of symptoms, comorbid conditions, and possible long term complications of COVID 19 // Molecular Omics. 2021. V. 17. №2. P. 317 337. https://doi.org/10.1039/D0MO00189A
- Raveendran A. V. Long COVID 19: Challenges in the diagnosis and proposed diagnostic criteria // Diabetes & Metabolic Syndrome. 2021. V. 15. №1. P. 145. https://doi.org/10.1016/j.dsx.2020.12.025
- Моисеев С. В., Авдеев С. Н., Тао Е. А., Бровко М. Ю., Яворовский А. Г., Умбетова К. Т., Фомин В. В. Эффективность тоцилизумаба у пациентов с COVID 19, госпитализированных в ОРИТ: ретроспективное когортное исследование // Клиническая фармакология и терапия. 2020. V. 29. №4. P. 17 25. https://doi.org/10.32756/ 0869 5490 2020 417 25
- Муркамилов И. Т. Цитокиновый статус при новой коронавирусной болезни (COVID 19) // Вестник Кыргызско Российского Славянского университета. 2020. Т. 20. №. 9. С. 55 65.
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Кудайбергенова И. О., Муркамилова, Ж. А., Юсупов Ф. А. Функция почек и изменения цитокинового профиля при COVID 19 // Клиническая нефрология. 2020. Т. 12. №3. С. 22 30. https://doi.org/10.18565/nephrology.2020.3.22 30
- Hendren N. S., Grodin J. L., Drazner M. H. Unique patterns of cardiovascular involvement in coronavirus disease 2019 // Journal of cardiac failure. 2020. Т. 26. №6. С. 466 469. https://doi.org/10.1016/j.cardfail.2020.05.006
- Хирманов В. Н. COVID 19 как системное заболевание // Клиническая фармакология и терапия. 2021. Т. 30. №1. С. 5 15.
- Чеботарева Н. В., Бернс С. А., Мясников А. Л. Частота, факторы риска и прогностическое значение острого повреждения почек у больных c COVID19: ретроспективное когортное исследование // Клиническая фармакология и терапия. 2021. 2021. Т. 30. №1. С. 30 35.
- Муркамилов И. Т., Айтбаев К. А., Кудайбергенова И. О., Фомин В. В., Муркамилова Ж. А., Юсупов Ф. А. Поражение мышечной системы при COVID 19 //Архивъ внутренней медицины. 2021. Т. 11. №2(58). С. 146 153. https://doi.org/10.20514/2226 6704 2021 11 2 146 153
- Петриков С. С., Иванников А. А., Васильченко М. К., Эсауленко А. Н., Алиджанова Х. Г. COVID 19 и сердечно сосудистая система. Часть 1. Патофизиология, патоморфология, осложнения, долгосрочный прогноз // Журнал им. НВ Склифосовского Неотложная медицинская помощь. 2021. Т. 10. №1. С. 14 26. https://doi.org/10.23934/2223 9022 2021 10 114 26
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Кудайбергенова И. О., Маанаев Т. И., Муркамилова Ж. А., Юсупов Ф. А. Функциональное состояние почек, уровни Д димера и прокальцитонина крови при COVID 19 // Клиническая нефрология. 2020. Т. 12. №4. С. 43 50. https://doi.org/10.18565/nephrology.2020.4.43 50
- Hoffmann M., Kleine Weber H., Schroeder S., Krüger N., Herrler T., Erichsen S., Pöhlmann S. SARS CoV 2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor //cell. 2020. V. 181. №2. P. 271 280. e8. https://doi.org/10.1016/j.cell.2020.02.052
- Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N., Acton S. A novel angiotensin converting enzyme related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1 9 // Circulation research. 2000. V. 87. №5. P. e1 e9. https://doi.org/10.1161/01.RES.87.5.e1
- Xu J., Sriramula S., Xia H., Moreno Walton L., Culicchia F., Domenig O., Lazartigues E. Clinical relevance and role of neuronal AT1 receptors in ADAM17 mediated ACE2 shedding in neurogenic hypertension // Circulation research. 2017. V. 121. №1. P. 43 55. https://doi.org/10.1161/CIRCRESAHA.116.310509
- ACC. COVID 19 Clinical Guidance for The Cardiovascular Care Team. https://www.acc.org/~/media/665AFA1E710B4B3293138 D14BE8D1213.pdf
- Patel V. B., Zhong J. C., Grant M. B., Oudit G. Y. Role of the ACE2/angiotensin 1 7 axis of the renin angiotensin system in heart failure // Circulation research. 2016. V. 118. №8. P. 1313 1326. https://doi.org/10.1161/CIRCRESAHA.116.307708
- Soro Paavonen A., Gordin D., Forsblom C., Rosengard Barlund M., Waden J., Thorn L., Circulating ACE2 activity is increased in patients with type 1 diabetes and vascular complications // Journal of hypertension. 2012. V. 30. №2. P. 375 383. https://doi.org/10.1097/HJH.0b013e32834f04b6
- Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B., Penninger J. M. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus induced lung injury // Nature medicine. 2005. V. 11. №8. P. 875 879. https://doi.org/10.1038/nm1267
- Liu Y., Yang Y., Zhang C., Huang F., Wang F., Yuan J., Liu L. Clinical and biochemical indexes from 2019 nCoV infected patients linked to viral loads and lung injury // Science China Life Sciences. 2020. V. 63. №3. P. 364 374. https://doi.org/10.1007/s11427 020 1643 8
- Муркамилов И. Т., Сабиров И. С., Фомин В. В., и др. Фактор роста эндотелия сосудов при новой коронавирусной болезни 2019 (COVID 19), осложненной пневмонией // Вопросы биологической, медицинской и фармацевтической химии. 2021. Т. 24. №6. С. 3 10.
- Shah A. S., Wong A. W., Hague C. J., Murphy D. T., Johnston J. C., Ryerson C. J., Carlsten C. A prospective study of 12 week respiratory outcomes in COVID 19 related hospitalisations // Thorax. 2021. V. 76. №4. P. 402 404. http://dx.doi.org/10.1136/thoraxjnl 2020 216308
- Муркамилов И.Т., Айтбаев К.А., Фомин В.В., и др. Клинико функциональные проявления COVID 19 у лиц пожилого возраста: в фокусе поражение сердечно сосудистой системы // The scientific heritage.2021;71:48 60.
- Ruan Q., Yang K., Wang W. et al. Correction to: Clinical predictors of mortality due to COVID 19 based on an analysis of data of 150 patients from Wuhan, China // Intens. Care Med. 2020. V. 6. P. 1 4. https://doi.org/10.1007/s00134 020 06028 z
- Inciardi R. M., Lupi L., Zaccone G. et al. Cardiac involvement in a patient with coronavirus disease 2019 (COVID 19) // JAMA Cardiol., 2020. https://doi.org/10.1001/jamacardio.2020.1096


