Коррекция лекарственно-индуцированной гепатотоксичности новыми тритерпеновыми производными (экспериментальные исследования)
Автор: Бессергенева Е.П., Жукова Н.А., Толстикова Т.Г., Сорокина И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (48), 2011 года.
Бесплатный доступ
Проведено морфологическое исследование влияния новых тритерпеновых производных - 3β,28-ди-О-никотинат бетулина (of 3) и метилового эфира 3,20-диоксимино-29-норлуп-28-овой кислоты (of 15) на печень мышей СВА/Lac с перевитой лимфомой RLS на фоне и без полихимиотерапии. Установлено, что введение агентов of 3 и of 15 животным-опухоленосителям на фоне по- лихимиотерапии уменьшает объем и степень токсического поражения печени, митотическую активность опухолевых клеток в первичном узле как на фоне полихимиотерапии, так и без нее и оказывает умеренное противоопухолевое действие. Эти свойства наиболее выражены у агента of 15. Введение агентов of 3 и of 15 животным с перевитой лимфомой RLS уменьшает выраженность альтеративных изменений, связанных с общим и местным влиянием неопластического процесса.
Метастазирование в печень мышей лимфомы rls, полихимиотерапия, гепатопротективный эффект, 28-ди-о-никотинат бетулина (of 3), метиловый эфир 3, 20-диоксимино-29-норлуп-28-овой кислоты (of 15)
Короткий адрес: https://sciup.org/14055964
IDR: 14055964 | УДК: 616.36-099:615.244]-092.9
Текст научной статьи Коррекция лекарственно-индуцированной гепатотоксичности новыми тритерпеновыми производными (экспериментальные исследования)
Гепатотоксичность является одним из серьезных осложнений интенсивной лекарственной терапии многих заболеваний, в том числе и злокачественных новообразований. Известно, что токсические реакции при проведении химиотерапии реализуются через химические и иммунологические механизмы, нередко носят кумулятивный характер, препятствуют проведению курсового лечения в установленные сроки, сопровождаются снижением эффективности цитостатической терапии и требуют постоянной коррекции гепатотропными средствами в межкурсовой период [2]. В связи с этим поиск новых эффективных и экономически доступных веществ, обладающих протективными свойствами, по–прежнему является актуальным. В последние годы внимание фармакологов и специалистов в области меди- цинской химии привлекают природные тритерпеноиды лупанового ряда, сочетающие широкий спектр биологической активности c экономической доступностью. Так, у производных бетулиновой и бетулоновой кислот выявлены противоопухолевая, противовирусная, бактериостатическая, антиоксидантная, гепатопротекторная и противовоспалительная активности [9–13].
Цель работы – изучение протективных свойств новых производных бетулина у животных с перевитой лимфомой RLS на фоне и без полихимиотерапии.
Материал и методы
Для исследования взяты новые производные бетулина: 3β,28-ди-О-никотинат бетулина (of 3) и метиловый эфир 3,20-диоксимино-29-норлуп-28-овой кислоты (of 15), синтезированные в Институте органической химии
УНЦ РАН (проф. О.Б. Казакова). Эксперименты проведены на 60 мышах-самцах линии СВА/Lac с исходной массой тела 22–25 г, содержавшихся в условиях стандартного вивария. Всем животным перевивали внутримышечно в бедро задней лапы мышиную лимфому RLS в виде суспензии опухолевых клеток в физиологическом растворе (0,1 мл, 2×105 клеток/мл). Перевивочный материал был получен из банка опухолей лаборатории регуляции экспрессии генов Института цитологии и генетики СО РАН (к.б.н. В.И. Каледин, к.м.н. В.П. Николин, к.б.н. Н.А. Попова).
На 5-й день после перевивки опухоли мышей делили на 6 групп (по 10 особей в каждой). Всем животным, за исключением I, IV и VI группы, вводили однократно внутрибрюшинно комплекс цитостатических препаратов, моделирующих полихимиотерапию (ПХТ) [3]: доксорубицин («Лэнс-Фарм», Москва) – 4 мг/кг, цикло-фосфан («Биохимик», Саранск) – 50 мг/кг, винкристин («Гедеон Рихтер», Венгрия) – 0,1 мг/кг и преднизолон («Гедеон Рихтер», Венгрия) – 5 мг/кг массы тела. В последующие 7 дней двум группам мышей (III и IV) вводили внутрижелудочно через зонд of 3, а V и VI группам – of 15, трижды через день в дозе 100 мг/кг в водно-твиновом растворе из расчета по 0,2 мл/10 г массы. Группа сравнения (II) и контроль (I группа) получали водно-твиновую смесь.
На 2, 4, 6-е сут после введения of 3 и of 15 на фоне и без ПХТ определяли объём опухоли путём измерений первичного узла по трём взаимоперпендикулярным направлениям. На 7-е сут после введения ПХТ животных выводили из опыта декапитацией под эфирным наркозом и определяли массу тела, массу опухоли (по разнице в массе лапы с опухолью и здоровой коллатеральной лапы). Подсчитывали индекс торможения роста опухоли (ТРО %): отношение разности массы опухоли в контрольной (mk) и опытных (mo) группах к массе опухоли в контроле: mk – mo/mk.
Печень, первичный опухолевый узел фиксировали в 10 % параформальдегиде на 0,1 М фосфатном буфере Зёренсена (pH 7,4) в течение 4 сут с последующей стандартной обработкой на гистологическом комплексе MICROM («Карл Цейс» Германия). Срезы толщиной 4 мкм окрашивали гематоксилином и эозином, ставили ШИК-реакцию с докраской гематоксилином и оранжевым G. Препараты исследовали методом световой микроскопии в проходящем свете на микроскопе Axioskop 40.
Морфометрический анализ срезов проводили с использованием окулярной сетки на 289 точек [1]. В печени подсчитывали объемную плотность гепатоцитов с дистрофическими и некротическими повреждениями, объемную плотность синусоидов со свободным просветом, с фибрином и метастазами. В первичном опухолевом узле подсчитывали количество митозов на 1000 клеток с расчетом митотического индекса: МИ = Nm./N; где Nm – число митозов, N – общее количество клеток. Изменение данных параметров в группах подопытных животных выражали в процентах относительно контроля (I) и референс–группы с ПХТ (II), показатели которых приняты за 100 %. Статистическую обработку данных проводили методами параметрической статистики с использованием пакета программ «Microsoft Excel». Результаты считали достоверными при значении критерия Стьюдента p<0,05.
Результаты и обсуждение
Лимфома RLS, резистентная к циклофосфану, получена путем многократных перевивок из лимфомы LS, растет в виде солидного узла, метастазирует гематогенно в печень, почки, селезенку [4, 5]. Противоопухолевое действие агентов оценивалось по средним размерам опухоли. Показано, что на 2-е сут в опытных группах размеры опухоли не отличались от контроля. При применении агентов of 3 и of 15 на фоне ПХТ на 4-е и 6-е сут отмечалось выраженное уменьшение средних размеров опухоли (табл. 1). Так, после введения of 15 ингибирование роста опухоли на 4-е и 6-е сут составило 31 % и 47 % соответственно, а введение of 3 приводило к торможению роста опухоли на 35 % на 6-е сут. В группе животных на фоне ПХТ индекс ТРО составил лишь 27 % (табл. 1). На 7-е сут тенденция к уменьшению роста опухоли сохранялась только у животных, получавших of 15 на фоне ПХТ. При подсчете митозов в первичном узле опухоли было установлено, что торможение роста опухоли происходит за счет угнетения митотической активности. Наибольший положительный эффект отмечается в группе животных, получавших of 15. Как на фоне ПХТ, так и при индивидуальном введении агента of 15 митотический индекс уменьшается на 28 % и 40 % соответственно. Введение агента of 3 в сочетании с ПХТ приводит к снижению митотического индекса на 32 %, а при индивидуальном введении митотическая активность так же, как и в группе с ПХТ, повышается на 32 % (табл.2). В референсной группе (ПХТ) митотический индекс увеличился на 33 % по сравнению с контролем, что связано с устойчивостью данного штамма опухоли к циклофосфану. Таким образом, агент of 15 проявляет умеренно выраженное противоопухолевое действие при индивидуальном применении и обладает способностью усиливать
Таблица 1
Средние размеры и индекс торможения роста опухоли в период введения агентов
Митозы в первичном узле перевитой опухоли RLS
|
Группы |
2-е сут |
4-е сут |
6-е сут |
7-е сут |
||||
|
Размеры опухоли, см3 |
ТРО |
Размеры опухоли, см3 |
ТРО |
Размеры опухоли, см3 |
ТРО |
Размеры опухоли, см3 |
ТРО |
|
|
I (контроль) |
0,14 ± 0,02 |
0,55 ± 0,05 |
1,42 ± 0,18 |
2,39 ± 0,25 |
||||
|
II (ПХТ) |
0,14 ± 0,01 |
0 |
0,49 ± 0,04 |
10 |
1,03 ± 0,08 |
27 % |
2,12 ± 0,16 |
11,3 % |
|
III (ПХТ + of 3) |
0,13 ± 0,01 |
7,4 % |
0,47 ± 0,05 |
14,5 % |
0,92 ± 0,09* |
35 % |
2,27 ± 0,28 |
5 % |
|
IV (of 3) |
0,14 ± 0,01 |
0 |
0,53 ± 0,07 |
3,6 % |
0,98 ± 0,16 |
31 % |
1,79 ± 0,35 |
25 % |
|
V (ПХТ + of 15) |
0,14 ± 0,01 |
0 |
0,38 ± 0,05* |
31 % |
0,75 ± 0,07** |
47 % |
1,84 ± 0,19 |
23 % |
|
VI (of 15) |
0,13 ± 0,01 |
7,4 % |
0,53 ± 0,05 |
3,6 % |
1,04 ± 0,10 |
28 % |
2,12 ± 0,29 |
11 % |
Примечание: * – различия, статистически значимые по сравнению с I группой (р<0,05); ** – различия, статистически значимые по сравнению с I группой (р<0,01).
Таблица 2
|
Группы |
Кол-во митозов |
Митотический индекс |
Эффективность |
|
I (контроль) |
34,5 ± 2,71 |
0,0345 (3,45 %) |
100 % |
|
II (ПХТ) |
45,89 ± 1,36 ** |
0,0489 (4,89 %) |
141 % |
|
III (ПХТ + of 3) |
34,9 ± 1,13 ### |
0,0349 (3,49 %) |
71 % |
|
IV (of 3) |
45,63 ± 1,15 ** |
0,0456 (4,57 %) |
132 % |
|
V (ПХТ + of 15) |
25,13 ± 1,16 ### |
0,0251(2,51%) |
51 % |
|
VI (of 15) |
21 ± 0,91 *** |
0,021 (2,1 %) |
60 % |
Примечание: ** – различия, статистически значимые по сравнению с контрольной группой (p≤0,01); *** – различия, статистически значимые по сравнению с контрольной группой (p≤0,001); ###– различия, статистически значимые по сравнению с группой с ПХТ (p≤0,001).
цитостатическое действие полихимиотерапии.
В ходе микроскопического анализа печени были выявлены типичные морфологические изменения, связанные с общим и местным влиянием опухоли. Установлено, что у мышей всех групп типичные изменения наблюдались в виде обширных перипортальных и диффузных клеточных метастазов в просвете сину-соидов с активным делением в них опухолевых клеток, развитием внутрипеченочного холестаза с локальной перестройкой печеночных балок. У животных контрольной группы ведущим признаком поражения гепатоцитов были мелковезикулярная липидная инфильтрация, гидропическая дистрофия, мелкоочаговые некрозы гепатоцитов с признаками поражения синусоидального русла (утолщение стенок синусоидов и заполнение их просветов фибрином).
Показано, что однократное введение животным ПХТ приводит к развитию токсического повреждения печени. Альтеративные изменения в ткани печени проявляются выраженным синдромом регенераторно-пластического дефицита (дистрофия, атрофия и некроз). Так, в парен- химе выявлялись множественные фокальные сливные и мелкоочаговые некрозы печеночных клеток. В гепатоцитах преобладает гидропическая и баллонная дистрофия. Мелковезикулярная липидная инфильтрация выявляется лишь в виде мелких очагов в центролобулярных зонах. В синусоидальном русле преобладает диффузная опухолевая инфильтрация (рис. 1).
Морфометрический анализ подтвердил, что введение комплекса цитостатиков сопровождается увеличением доли некробиотических процессов над дистрофическими. На 500 % увеличился объем некрозов (табл. 3). Объемная плотность гепатоцитов с тяжелыми видами дистрофий увеличилась на 81 %, а доля гепатоцитов с липидной инфильтрацией уменьшилась на 37 %. Рост объемной плотности метастазов в просвете синусоидов составил 200 %. Таким образом, у животных с лимфомой RLS, после введения ПХТ развился тяжелый лекарственный гепатит, сопровождающийся увеличением доли деструктивно-некротических поражений гепатоцитов.
Введение производных бетулина of 3 и of 15 на фоне химиотерапии приводит к уменьшению объёмной
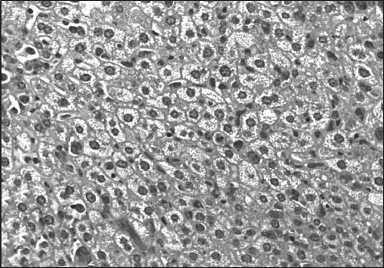
Рис. 1. Микрофото. Печень мыши с перевитой лимфомой RLS на фоне полихимиотерапии. Тотальная жировая инфильтрация гепатоцитов, в синусоидах – метастазы опухоли.
Окраска гематоксилином и эозином. ×400
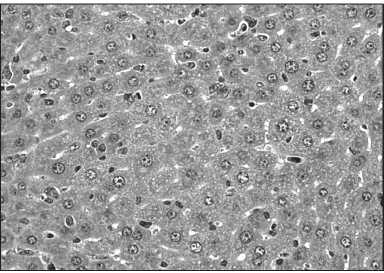
Рис. 2. Микрофото. Печень мыши с перевитой лимфомой RLS после введения агента of 15 на фоне полихимиотерапии. Очаговая мелковезикулярная липидная инфильтрация гепатоцитов, в синусоидах – метастазы опухоли. Окраска гематоксилином и эозином. ×400
плотности некрозов в паренхиме печени, способствует появлению двуядерных гепатоцитов и частичному купированию признаков холестаза. В гепатоцитах выявляется мелковезикулярная липидная инфильтрация и очаговая гидропическая дистрофия (рис. 2). Морфометрический анализ подтвердил, что введение тестируемых агентов привело к уменьшению доли некробиотических поражений в печени. Под влиянием агентов of 3 и of 15 объем некрозов уменьшился в среднем на 80 % по сравнению с референсной группой. Однако введение агента of 3 привело к уменьшению доли гепатоцитов с мелковезикулярной липидной инфильтрацией на 33 % и не оказало положительного влияния на состояние синусоидального русла: доля синусоидов с фибрином и метастазами увеличилась на 78 % и, напротив, введение агента of 15 привело к уменьшению этого показателя на 40 % (табл. 3).
При введении агентов of 3 и of 15 животным без полихимиотерапии в гепатоцитах выявляются признаки как тяжелых деструктивных изменений (в виде гидропической, баллонной дистрофии), так и менее выраженных (в виде мелковезикулярной липидной инфильтрации). В просвете синусоидов видны нити фибрина, увеличенные синусоидальные клетки. Признаки внутрипеченочного холестаза менее выражены, чем у контрольных животных. При морфометрическом анализе выявлено, что введение агентов of 3 и of 15 сопровождается уменьшением объемной плотности некрозов на 83 % и доли синусоидов с фибрином на 20 % (табл. 4). Таким образом, введение исследуемых агентов уменьшает выраженность типичных морфологических изменений, связанных с общим и местным влиянием неопластического процесса.
Полученные результаты коррелируют с данными, полученными ранее у мышей с перевитой лимфомой RLS после введения бетулоновой кислоты и ее аланинамидного производного на фоне и без ПХТ [5]. Обращает внимание точная воспроизводимость типичных патологических процессов после введения производных бетулина и бетулоновой кислоты, сопровождающихся
Таблица 3
Показатели морфометрического исследования печени животных с перевитой лимфомой RLS на фоне ПХТс введением агентов of 3 и of 15
|
Группы |
Дистрофия гепатоцитов |
Некрозы гепатоцитов |
Просвет синусоидов |
|||
|
Мелковезикулярная жировая |
Гидропическая баллонная |
Свободный |
Фибрин |
Метастазы |
||
|
I (контроль) |
0,49 ± 0,038 |
0,11 ± 0,015 |
0,018 ± 0,005 |
0,06 ± 0,001 |
0,24 ± 0,03 |
0,08 ± 0,023 |
|
II (ПХТ) |
0,31 ± 0,013** |
0,20 ± 0,025* |
0,11 ± 0,02** |
0,053 ± 0,004 |
0,18 ± 0,01 |
0,16 ± 0,01* |
|
III (ПХТ + of 3) |
0,24 ± 0,01# |
0,21 ± 0,015 |
0,014 ± 0,005# |
0,06 ± 0,009 |
0,31 ± 0,02# |
0,16 ± 0,02 |
|
V (ПХТ + of 15) |
0,47 ± 0,08 |
0,19 ± 0,07 |
0,01 ± 0,001# |
0,06 ± 0,008 |
0,11 ± 0,024# |
0,15 ± 0,01 |
Примечание: ** – различия, статистически значимые по сравнению с контрольной группой (p≤0,01); # – различия, статистически значимые по сравнению с группой с ПХТ (p≤0,01).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №6 (48)
Таблица 4
|
Группы |
Дистрофия гепатоцитов |
Некрозы гепатоцитов |
Просвет синусоидов |
|||
|
Мелковезикулярная жировая |
Гидропическая баллонная |
Свободный |
Фибрин |
Метастазы |
||
|
I (контроль) |
0,49 ± 0,038 |
0,11 ± 0,015 |
0,018 ± 0,005 |
0,06 ± 0,001 |
0,24 ± 0,03 |
0,08 ± 0,023 |
|
IV (of 3) |
0,46 ± 0,05 |
0,14 ± 0,035 |
0,003 ± 0,002* |
0,07 ± 0,008 |
0,19 ± 0,02 |
0,13 ± 0,019 |
|
VI (of 15) |
0,46 ± 0,05 |
0,14 ± 0,035 |
0,003 ± 0,002* |
0,07 ± 0,008 |
0,19 ± 0,02** |
0,13 ± 0,02 |
Показатели морфометрического исследования печени животных с перевитой лимфомой RLS после введения агентов of 3 и of 15
Примечание: * – различия, статистически значимые по сравнению с контрольной группой (p≤0,05); ** – различия, статистически значимые по сравнению с контрольной группой (p≤0,01).
улучшением структуры печени. Выявленное положительное влияние агентов of 3 и of 15 на состояние синусоидального русла приводит к улучшению процессов транссинусоидального обмена [6–8]. На основании этих фактов можно предположить, что выявленное гепато-протективное действие новых производных бетулина также реализуется посредством стабилизации клеточных мембран.
Выводы
-
1. Проведение полихимиотерапии животным с перевитой лимфомой RLS приводит к развитию токсического повреждения печени.
-
2. Введение 3β,28-ди-О-никотината бетулина (of 3) и метилового эфира 3,20-диоксимино-29-норлуп-28-овой кислоты (of 15) животным-опухоленосителям на фоне полихимиотерапии уменьшает объем и степень токсического поражения печени. Эти свойства наиболее выражены у метилового эфира 3,20-диоксимино-29-норлуп-28-овой кислоты (of 15).
-
3. Введение агентов of 3 и of 15 животным с перевитой лимфомой RLS уменьшает выраженность альте-ративных изменений, связанных с общим и местным влиянием неопластического процесса.
-
4. Метиловый эфир 3,20-диоксимино-29-норлуп-28-овой кислоты (of 15) в сочетании с полихимиотерапией и без нее уменьшает митотическую активность опухолевых клеток в первичном узле и вызывает задержку роста опухоли.
-
5. Сочетание выявленных свойств у 3β,28-ди-О-никотината бетулина (of 3) и метилового эфира 3,20-диоксимино-29-норлуп-28-овой кислоты (of 15) позволяет рекомендовать их для дальнейшего изучения в качестве высокоэффективных корректоров гепатоток-сического действия цитостатиков.
Работа выполнена в рамках Интеграционной программы СО РАН (N 93) «Развитие исследований в области медицинской химии и фармакологии как научной основы разработки отечественных лекарственных препаратов».


