Коррекция психовегетативного синдрома у пациентов с ишемической болезнью сердца в раннем послеоперационном периоде
Автор: Шерман М.А., Мирзоев Р.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Физиология
Статья в выпуске: 1 т.15, 2019 года.
Бесплатный доступ
Цель: изучение роли тревоги послеоперационного периода в развитии психовегетативного синдрома у пациентов после коронарного шунтирования (КШ), характера и направленности сформировавшейся вегетативной дисфункции, а также эффективности коррекции алимемазином регистрируемых нарушений. Материал и методы. Обследованы 15 пациентов (3 женщины, 12 мужчин) после КШ, имевшие умеренный и высокий уровень тревоги по шкале Спилбергера - Ханина, без признаков депрессии. Выполнялась балльная оценка эмоциональной и вегетативной сфер, а также дневной сонливости и нарушения качества сна пациентов. Изучены показатели вегетативного тонуса и вегетативной регуляции больных, в частности анализировались временные и спектральные показатели вариабельности сердечного ритма. Результаты. Большинство пациентов в раннем восстановительном периоде после КШ имели умеренную ситуативную и личностную тревогу и нарушение качества сна. Выявлены признаки психовегетативного синдрома в виде сочетания тревоги и вегетативных дисбаланса и дисрегуляции с преобладанием влияний симпатического отдела вегетативной нервной системы (ВНС). Подключение к базисной терапии этих больных препарата «алимемазин» в виде инъекций позволило в течение двух недель значимо снизить уровень тревоги и симпатической активности ВНС. Заключение. Использование алимемазина в качестве корректора тревоги позволяет уменьшить выраженность психовегетативной дисфункции у пациентов после КШ и, вероятно, снизить риск неблагоприятных послеоперационных исходов и прогрессирования ишемической болезни сердца.
Алимемазин, вариабельность сердечного ритма, коронарное шунтирование, психовегетативный синдром, тревога
Короткий адрес: https://sciup.org/149135254
IDR: 149135254 | УДК: 616.8-085.2/3
Текст научной статьи Коррекция психовегетативного синдрома у пациентов с ишемической болезнью сердца в раннем послеоперационном периоде
-
1 Вв едение. К серьезным нежелательным проявлениям послеоперационного периода коронарного шунтирования (КШ), способным повлиять как на успешность реабилитации больных, так и на отдаленные результаты операции, а также на дальнейшее течение ИБС, относятся характерные для пациентов этой группы психовегетативные нарушения [1, 2]. При этом ведущим фактором, определяющим выраженность и направленность вегетативной дисрегу-ляции, являются расстройства тревожно-депрессивного ряда. Повышенный уровень тревоги вызывает активацию симпатического отдела ВНС и гипотала-мо-гипофизарно-надпочечниковой системы, что способствует, в частности, усугублению дисфункции эндотелия, спазму коронарных артерий и снижению порога фибрилляции желудочков [3]. Перечисленные нарушения могут приводить к усилению прогрессирования атеросклероза, ухудшению коронарного кровотока, склонности к тромбообразованию и утяжелению течения ИБС [1, 4]. Показано, что тревога является независимым предиктором неблагоприятного клинического прогноза КШ, повышения риска смертности даже в ситуации успешного технического осуществления оперативного вмешательства [5]. Кроме того, известно негативное влияние высокого уровня тревожности на структуру сна [6], что, в свою очередь, позволяет рассматривать диссомнию в качестве фактора риска развития кардиометаболиче-ских нарушений [7].
Изучению места психовегетативного синдрома в развитии коронарных нарушений при ИБС посвящены многочисленные работы [8–11], однако, несмотря на это, ряд вопросов требует более детального рассмотрения. В частности, представляет интерес своевременная коррекция имеющихся у пациентов
после КШ нарушений в виде повышенной тревоги и вегетативной дисфункции с целью обеспечения успешной послеоперационной реабилитации и ограничения процесса прогрессирования ИБС.
Цель: изучение роли тревоги послеоперационного периода в развитии психовегетативного синдрома у пациентов после коронарного шунтирования (КШ), характера и направленности сформировавшейся вегетативной дисфункции, а также эффективности коррекции алимемазином регистрируемых нарушений.
Материал и методы. Основную исследуемую группу составили 15 пациентов (3 женщины, 12 мужчин) с ИБС в возрасте 51–68 лет (средний возраст 60,0 (57,0; 63,0) лет) после впервые перенесенного оперативного вмешательства (КШ), в среднем 13,0 (10,0; 14,0) дней назад, находившиеся в стационаре на реабилитации. Пациенты не имели иных соматических, а также психических заболеваний в стадии декомпенсации, неврологической патологии с нарушением мышления, зрения, среднетяжелых и тяжелых ЧМТ и онкологической патологии в анамнезе. Все входившие в основную группу, помимо базисной терапии основного заболевания, включавшей, в частности, β-адреноблокаторы, с целью коррекции выявленного психовегетативного синдрома получали препарат «алимемазин» в виде инъекций в суточной дозе 5–10 мг. Данное лекарственное средство относится к группе малых нейролептиков, имеет множественный механизм действия, противотревожный и вегетостабилизирующий эффекты и характеризуется благоприятным профилем безопасности [12]. Титрация вводимой дозы препарата начиналась в день госпитализации больного, первое введение лекарственного средства производилось перед сном.
Контрольная группа включала 8 человек сопоставимого возраста (55,5 года (47,5; 60)), страдавших ИБС и перенесших КШ, в среднем 11,0 (9,5; 15,0) дней назад, но не подвергшихся терапии алимема-зином. Лица группы контроля также не имели невро- логических и/или значимых когнитивных нарушений, верифицированных онкологических заболеваний и получали сопоставимую с основной группой базисную терапию ИБС.
Оценка состояния эмоциональной сферы пациентов осуществлялась с помощью шкал, используемых для нейропсихологической диагностики. С целью выявления уровня личностной и ситуативной тревоги использовался опросник самооценки тревожности Спилбергера — Ханина [13], а для исключения клинических признаков депрессии — госпитальная шкала тревоги и депрессии (HADS) [14]. В исследуемые группы включались пациенты с умеренным и высоким уровнем тревоги по шкале Спилберге-ра — Ханина, но не имевшие клинически значимой депрессии — превышения верхней границы нормы (7 баллов) по шкале HADS.
Изучение качества сна проводилась при помощи Питтсбургского опросника для определения индекса качества сна (PSQI) [15], а также Эпвортской шкалы дневной сонливости (Epworth Sleepiness Scale (ESS)) [16].
Для оценки функционального состояния ВНС использовались опросник для выявления признаков вегетативных изменений, интегративный показатель вегетативного тонуса индекс Кердо (ИК) и индекс МОК (минутный объем кровообращения), а также коэффициент Хильдебрандта (Q), характеризующий межсистемные (кардиореспираторные) отношения [17]. Изучалась вариабельность сердечного ритма. Временные и спектральные показатели ВСР, характеризующие соотношение активности симпатического и парасимпатического отделов ВНС и уровень напряженности регулирующих вегетативных влияний на сердце, регистрировались посредством выполнения суточного холтеровского мониторирования (ХМ) ЭКГ на аппаратно-программном комплексе «Кардиотехника-06» (Инкарт, Санкт-Петербург).
Все исследования в группах проводились в фиксированные сроки: при госпитализации, на 5–6-й и 12–14-й дни наблюдения.
Статистическая обработка результатов исследования выполнялась с использованием пакета для статистического анализа Statistica 10.0. Оценка характера распределения проводилась по критерию Шапиро — Уилка. Величины, имевшие распределения, отличные от нормальных, представлены медианой Me (Q1; Q3). Статистическая значимость различий выборочных данных с отличным от нормального распределением оценивалась с помощью непараметрических критериев сравнения двух независимых групп Манна — Уитни. Оценка двух зависимых переменных внутри групп оценивалась с помощью непараметрического критерия Вилкоксона. В качестве критического уровня статистической значимости различия (p) выбрано значение p<0,05.
Результаты. В основной группе при поступлении в стационар преобладали лица с умеренным уровнем ситуативной и личностной тревоги, соответственно 73% (n=11) и 67% (n=10). В группе контроля умеренные ситуативная и личностная тревоги представлены в 87% (n=7) и 75% (n=6) случаев соответственно. При этом средние показатели ситуативной тревожности в основной группе были несколько выше: 42,0 (35,0; 45,0) против 35,0 (33,0; 37,0). Величины личностной тревожности в группах оказались практически равны: 41,0 (35,0; 45,0) и 41,5 (36,5; 44,5).
Результаты изучения качества сна в основной группе свидетельствовали о наличии инсомнии: по данным ESS, 5,0 (2,0; 6,0) и плохого качества сна: согласно показателям PSQI, 11,0 (8,0; 12,0). Аналогичные нарушения выявлены в группе сравнения.
С помощью опросника для выявления признаков вегетативных изменений верифицирована вегетативная дисфункция как у пациентов основной группы: 24,0 (10,0; 44,0), так и группы сравнения: 28,5 (11,5; 34,5).
При первичном осмотре показатели вегетативного тонуса пациентов основной группы демонстрировали незначительную парасимпатическую направленность (ИК=–7,1 (–12,5; 5,4)), равно как и, в еще меньшей степени, испытуемые группы сравнения (ИК=–4,1 (–13,1; 16,3)). Очень легкая тенденция к симпатикотонии индекса минутного объема крови (ИМОК) прослеживалась и в основной группе: 1,1 (0,9; 1,2), и в группе сравнения: 1,1 (1,0; 1,3). Величины Q обеих групп демонстрировали отсутствие рассогласования межсистемных взаимоотношений в кардиореспираторной сфере.
Анализ ВСР свидетельствовал о вегетативном дисбалансе и функционировании ВНС в режиме напряжения, что объективизировалось снижением следующих показателей: стандартное отклонение среднего интервала R-R в течение суток (SDNN) 62,0 (35,0; 81,0) мс, среднее значение стандартных отклонений всех пятиминутных интервалов в течение суток (SDNNidx) 28,0 (14,0; 40,0) мс, стандартное отклонение средних значений интервала R-R за пятиминутные отрезки времени в течение суток (SDАNN) 48,0 (32,0; 71,0) мс, стандартное отклонение разницы последовательных интервалов R-R (rMSSD) 15,0 (11,0; 18,0) мс, процентная представленность эпизодов различия последовательных интервалов RR более чем на 50 мс (pNN 50,0%) 0,0 (0,0; 1,0)
Среди пациентов основной группы после подключения к базисной терапии реабилитационного периода инъекций алимемазина стало меньше лиц с ситуативной умеренной (60% (n=9)) и выраженной (13% (n=2)) тревогой. Статистически значимо снизились показатели ситуативной (p=0,01) и личностной (p=0,04) тревожности на 12-й день терапии. Значимо (p=0,04) уменьшилась и дневная сонливость (по шкале ESS), а по результатам PSQI улучшилось (p=0,01) качество сна (рис. 1).
По результатам опросника для выявления признаков вегетативных изменений на 14-й день терапии значимо (p=0,001) уменьшилась выраженность проявлений вегетативной дисфункции. В этот же период приобрели отчетливую парасимпатическую направленность параметры вегетативного фона, в частности ИК (p=0,02) и ИМОК (p=0,01), а также, согласно динамике коэффициента Q, более сбалансированными (p=0,002) стали межсистемные кардио-респираторные соотношения (рис. 2).
Динамика временных показателей ВСР к 14-му дню терапии продемонстрировала значимое (p=0,04) нарастание величин SDNN и SDNNidx (рис. 3), а также показателя pNN 50 до 2,0 (0,0;6,0) (p=0,01), свидетельствующее об уменьшении симпатических вегетативных влияний и снижении риска развития кардиологических осложнений. При этом отмечались положительные изменения величин еще одного показателя ВСР — rMSSD, отражающего активность парасимпатического компонента вегетативной регуляции сердечного ритма (см. рис. 3).
Одновременно с этим в группе сравнения за период двухнедельного наблюдения не было отмечено статистически значимой динамики показателей. Исследуемые величины преимущественно либо оста-
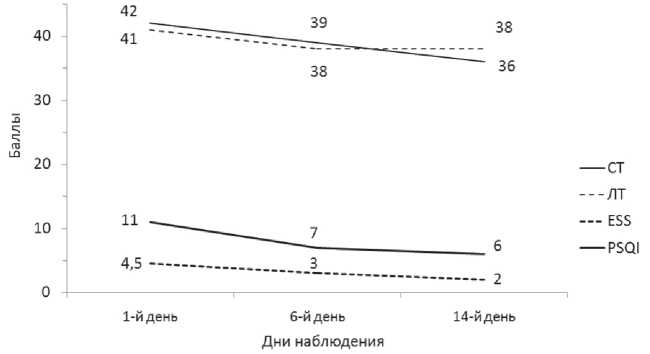
Рис. 1. Динамика психометрических показателей и показателей качества сна у пациентов основной группы: СТ — ситуативная тревога, ЛТ — личностная тревога, ESS — Эпвортский опросник, PSQI — Питтсбургский опросник;
* — значимое различие между показателями в 1-й и 14-й дни терапии
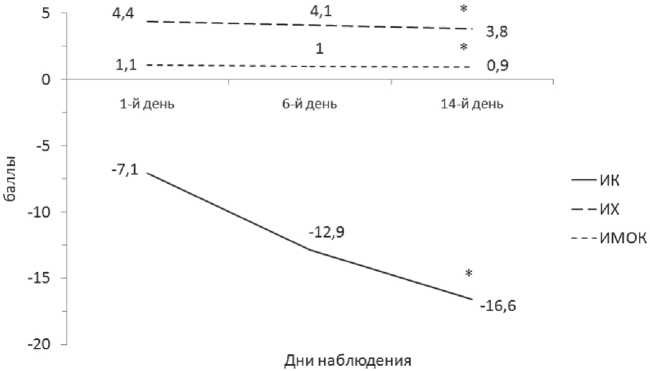
Рис. 2. Динамика показателей вегетативной регуляции у пациентов основной группы: ИК — индекс Кердо, ИМОК — индекс минутного объема кровообращения, ИХ — индекс Хильдебрандта; * — значимое различие между показателями в 1-й и 14-й дни терапии
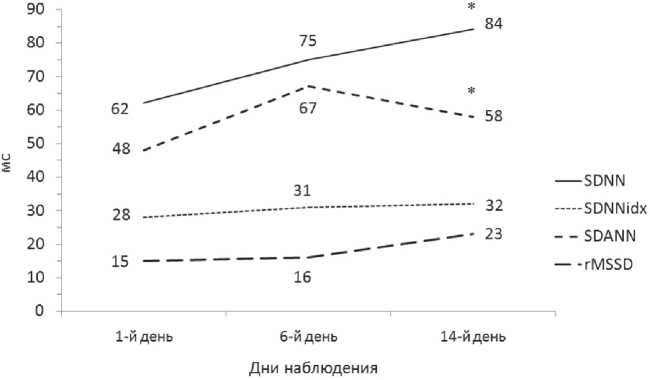
Рис. 3. Динамика показателей вариабельности сердечного ритма ВСР у пациентов основной группы: * — значимое различие между показателями в 1-й и 14-й дни терапии вались на прежнем уровне, либо изменялись в сторону утяжеления нарушений. Так, несколько усилились ситуативная тревожность: с 35,0 (33,0; 37,0) до 37,0 (33,0; 39,5) баллов и дневная сонливость (по шкале ESS): с 3,0 (2,5; 7,0) до 4,0 (3,5; 5,0); вырос симпатический тонус (в соответствии с ИК): с 4,1 (–13,1; 16,3) до 9,1 (–10,2; 14,6). Величины показателей ВСР в целом имели слабую тенденцию к увеличению, но rMSSD показал снижение: с 15,0 (9,0; 20,5) до 13,0 (8,0; 22,0), что также отражало превалирование регуляторных симпатических влияний.
Сравнение обеих групп пациентов в основном не показало статистически значимого отличия исследуемых параметров. Исключение составили показатели состояния вегетативного тонуса ИК, который в основной группе по истечении 14 дней наблюдения имел отчетливую (p=0,04) парасимпатическую направленность: — 16,6 (–33,3; 5,4), а в группе сравнения прогрессирующую симпатическую: 9,1 (–10,2; 14,6) и ИМОК: 0,9 (0,9; 1,1) и 1,2 (1,0; 1,3) соответственно.
Обсуждение. Полученные в проведенном исследовании результаты свидетельствовали о наличии у перенесших коронарное шунтирование и имеющих повышенный уровень тревоги пациентов значимой вегетативной дисфункции. Анализ параметров ВСР демонстрировал снижение ключевых показателей регуляции ритма сердца, что согласовывалось с представленными ранее данными [18]. В соответствии с классической интерпретацией полученных результатов можно говорить об активации симпатического тонуса ВНС, что является неблагоприятным фактором в отношении развития и усугубления ИБС [19].
В соответствии с современными представлениями повышенный риск развития и прогрессирования сосудистой кардиологической патологии как в раннем, так и в позднем послеоперационном периоде коронарного шунтирования обусловил необходимость проведения психотропной терапии прежде всего препаратами группы антидепрессантов, продемонстрировавших эффективную коррекцию тревожных и вегетативных нарушений [20]. В отличие от антидепрессантов, оказывающих терапевтический эффект не ранее чем через две недели, использованный в представленной нами работе в качестве варианта психотропной коррекции психовегетативного синдрома препарат «алимемазин» продемонстрировал положительную динамику анализируемых параметров в течение уже первой недели, достигнув в результате статистически значимого улучшения к завершению второй недели терапии.
Заключение. Для большинства пациентов в раннем восстановительном периоде после КШ оказались характерными умеренная ситуативная и личностная тревога и инсомния с нарушением качества сна. Выявлены признаки психовегетативного синдрома в виде сочетания тревоги и вегетативных дисбаланса и дисрегуляции с преобладанием влияний симпатического отдела ВНС. Подключение к базисной терапии больных препарата «алимемазин» в виде инъекций позволило в течение двух недель значимо снизить уровни тревоги и симпатической активности ВНС, повышающих риск неблагоприятных послеоперационных исходов КШ и прогрессирования ИБС. Объем проведенного исследования на текущий момент недостаточен, но, вероятно, использование инъекционного алимемазина с целью коррекции психовегетативного дисбаланса может стать фактором, способствующим успешной реабилитации пациентов после КШ.
Список литературы Коррекция психовегетативного синдрома у пациентов с ишемической болезнью сердца в раннем послеоперационном периоде
- Швалев B.H. Патоморфологические изменения симпатического отдела вегетативной нервной системы и сердечно-сосудистая патология. Архив патологии 1999; (3): 50-2
- Tully PJ, Baker RA. Depression, anxiety, and cardiac morbidity outcomes after coronary artery bypass surgery: a contemporary and practical review. Journal of Geriatric Cardiology 2012; (9): 197-208
- Kubzansky LD, Kawachi I, Weiss ST, et al. Anxiety and coronary heart disease: a synthesis of epidemiological,psychological, and experimental evidence. Ann Behav Med 1998; 20 (2): 47-58
- Kubzansky LD, Kawachi I. Going to the heart of the matter: do negative emotions cause coronary heart disease? J Psychosom Res 2000; 48 (4-5): 323-37
- Бурлаков А. В., Бочарова M.B. Психические расстройства в предоперационном периоде аортокоронарного шунтирования. Психиатрия и психотерапия 2003; 5 (6): 12-5
- Вербицкий E.B. Взаимоотношения тревоги и сна в эксперименте и клинике. Журнал неврологии и психиатрии им. С. С. Корсакова 2017; 117 (4): 12-8
- Tobaldini Е. Short sleep duration and cardiometabolic risk: from pathophysiology to clinical evidence. Nat Rev Cardiol 2019; 16 (4): 213-24
- Минакова И.В., Минакова Н.Э., Дубачев А.А. Показатели спектрального анализа и традиционных параметров ВРС у больных после реконструктивных кардиовмешательств. Вестник новых медицинских технологий 2010; 17 (2): 133-6
- Kishi Т. Heart failure as an autonomic nervous system dysfunction. Journal of Cardiology 2012; (59): 117-22
- Kupper N. Cardiovascular reactivity to mental stress and mortality in patients with heart failure. JACC Heart Fail 2015; 3 (5): 373-82
- Акулова А.С., Федотов А. А., Колмакова K.M. и др. Параметры дисфункции автономной нервной системы у пациентов кардиологического профиля с острой и хронической формами ишемической болезни сердца. Современные технологии в медицине 2017; (2): 162-9
- Джонс П. Б., Бакли П.Ф. Шизофрения: клиническое руководство. М.: МЕДпресс-информ, 2008; 192 с.
- Ханин Ю.Л. Краткое руководство к применению шкал реактивной тревоги и личностной тревожности. Л.: ЛНИИТЕК, 1976
- Базовые психологические свойства и самоопределение личности. В кн: Практическое руководство по психологической диагностике. СПб.: Речь, 2005; с. 44-9
- Buysse DJ, Reynolds CF, Monk TH, et al. The Pittsburgh Sleep Quality Index (PSQI): a new instrument for psychiatric research and practice. Psychiatry Res 1989; 28 (2): 193-213
- Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness Scale. sleep 1991; 14 (6): 540-5
- Вейн A.M., Вознесенская Т.Г., Голубев В. Л. и др. Заболевания вегетативной нервной системы. М.: Медицина, 1991; 624 с.
- Киселев A.P, Вульф K.A., Шварц В.A. и др. Сравнительная оценка вегетативной регуляции кровообращения у пациентов, перенесших аортокоронарное шунтирование или коррекцию приобретенных пороков сердца. Саратовский научно-медицинский журнал 2018; 14 (1):45-9
- Макаров Л.М. Особенности использования анализа вариабельности ритма сердца у больных с болезнями сердца. Физиология человека 2003; 28 (3): 65-8
- Ойноткинова О.Ш., Спасский А. А., Баранов А. П. и др. Психотропная и антиоксидантная терапия в реабилитации кардиохирургических больных. Архивъ внутренней медицины 2013; (2): 65-70.


