Коррекция стрессовых состояний с помощью рецептур антиконвульсанта и пептидных веществ
Автор: Сунчаляев Ренат Нариманович, Баулин Сергей Иванович, Рогачева Светлана Михайловна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Коррекция экологического неблагополучия
Статья в выпуске: 5-3 т.14, 2012 года.
Бесплатный доступ
Исследовано противосудорожное действие композиций окскарбазепина с пептидными ноотропами: L-пироглутаминглицинамидом (pGlu-Gly a) и L-пироглутаминаспарагинамидом (pGlu-Asp a). В экспериментах на белых беспородных крысах использованы модели острого конвульсивного припадка, вызванного введением коразола и никотина. Установлено, что антиконвульсант в комбинации с пептидами оказывает более выраженный и длительный эффект по сравнению с чистым препаратом, что выражается в подавлении и устранении конвульсий.
Пептиды, антиконвульсант, противосудорожный эффект, лабораторные крысы
Короткий адрес: https://sciup.org/148201599
IDR: 148201599 | УДК: 574.24
Текст научной статьи Коррекция стрессовых состояний с помощью рецептур антиконвульсанта и пептидных веществ
Одним из проявлений урбанистического стресса у людей, чья профессия предполагает напряженный, монотонный труд или чрезмерные психоэмоциональные нагрузки, является возникновение конвульсий [1]. Для снятия судорожных эффектов в настоящее время обычно применяются препараты группы карбамазепина, например окскарбазепин, которые наряду с высокой активностью обладают рядом побочных эффектов [2]. Наиболее опасным и частым при постоянном приеме данного препарата является поражение нейронов и ухудшение когнитивных навыков [3]. Для компенсации негативных проявлений противосудорожные препараты рекомендовано сочетать с веществами, оказывающими протекторный эффект. В качестве протекторов используются ноотропы, а также их аналоги пептидной природы, которые проявляют высокую активность в низких концентрациях и способны проникать через гематоэнцефалический барьер. Ранее была выявлена высокая ноотропная активность амидов дипептидов – L-пироглутаминглицинамида (pGlu-Gly a ) и L-пироглутаминаспарагинамида (pGlu-Asp a ), обусловленная влиянием метаболитов: гамма-аминомасляной кислоты (ГАМК) и глицина [4].
Возможно, что протекторный эффект пептидов связан с коррекцией функционирования ГАМК-эргической системы мозга и глутаматных
рецепторов, антиоксидантным и антитоксическим действием глицина [5]. Таким образом, выдвинуто предположение, что использование ноотропов пептидной природы совместно с противосудорожными средствами группы карбамазепина позволит в значительной степени купировать судорожные припадки, кроме того, указанное позволит снизить фармакологическую нагрузку на организм.
Цель работы: исследование противосудорожного действия рецептур окскарбазепина с амидами дипептидов pGlu-Gly a и pGlu-Asp a .
Материалы и методы. Эксперименты были выполнены на 200 белых беспородных половозрелых крысах массой тела 180-200 г. Дозовые характеристики препаратов представлены в табл. 1.
Таблица 1. Дозовые характеристики препаратов и рецептур
|
Препарат |
Доза, мг/кг |
|
окскарбазепин |
1 |
|
pGlu-Gly a |
0,5 |
|
pGlu-Asp a |
0,5 |
|
окскарбазепин/ pGlu-Gly a |
0,5/0,5 |
|
Окскарбазепин/ pGlu-Asp a . |
0,5/0,5 |
Растворы препаратов в физиологическом растворе вводили животным внутрибрюшинно в объеме 0,5 мл/кг. Контрольные животные получали физиологический раствор в эквивалентном объеме. Для изучения противосудорожной активности использовали модели коразоловых и никотиновых судорог [6]. В модели коразоло-вых судорог исследуемые препараты вводили внутрибрюшинно однократно за 30 минут до введения 80 мг/кг коразола. В условиях хронического эксперимента испытуемые вещества вводили внутрибрюшинно в течение 14 дней. Введение коразола осуществляли однократно через 30 минут после последней инъекции препаратов. В случае развития стабильных судорог у животных контрольной группы проводили дальнейшее исследование судорожной активности у крыс опытных групп. Наблюдение за подопытными животными осуществлялось в течение 30 минут. Регистрировали продолжительность латентного периода, частоту возникновения клонико-тонических судорог, летальность в процентах от общего количества животных в группе. Отсутствие судорог свидетельствовало о противосудорожном действии исследуемого вещества.
В модели никотиновых судорог исследуемые препараты вводили внутрибрюшинно однократно за 30 минут до введения судорожной дозы никотина 12 мг/кг. При хроническом введении животные получали испытуемые вещества в течение 14 дней, а никотин вводили однократно через 30 минут после последней инъекции препаратов. Наблюдение за подопытными животными осуществлялось в течение 30 минут. В каждой группе регистрировали частоту возникновения тонического компонента судорожного синдрома («хвост Штрауба»), судорог, а также летальность в процентах от общего количества животных в группе. Активность веществ оценивали по отсутствию судорожного эффекта. Статистическая обработка полученных данных проводилась с применением интегрированного пакета статистических программ SPSS 9.0 (StatSoft, Inc).
Результаты и обсуждение. На модели никотиновых судорог были выявлены достоверные изменения судорожной активности животных при однократном и хроническом введении комбинированных препаратов относительно действия окскарбазепина (рис. 1). Как следует из данных рис. 1А, при однократном введении комбинаций pGlu-Asp a /окскарбазепин и pGlu-Gly a /окскарбазепин происходит существенное снижение частоты возникновения судорог – в 2,7 и 2 раза, соответственно. При этом летальные исходы на пике судорожного синдрома не отмечены. В условиях хронического введения рецептур pGlu-Asp a и pGlu-Gly a с окскарбазепином (рис. 1Б) на фоне введения никотина количество погибших животных достигает лишь 3%. Исследованные пептидные препараты не обладают выраженным противосудорожным эффектом, т.е. комбинированное действие рецептур, возможно, обусловлено эффектом потенцирования пептидами действия окскарбазепина.
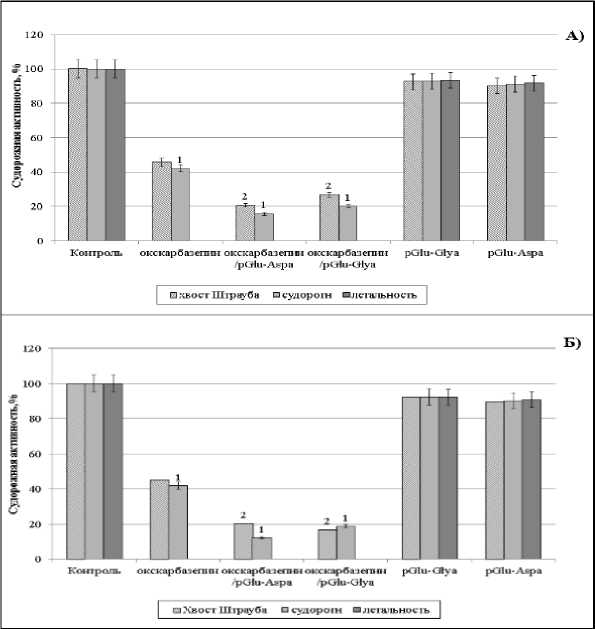
Рис. 1. Влияние чистых препаратов и комбинаций веществ на развитие судорог, вызванных никотином:
А – при однократном введении, Б – при хроническом введении. Примечание: 1 – различия достоверны при P≤0,05 относительно контроля; 2 – различия достоверны при р≤0,05 относительно крыс, получавших окскарбазепин. За 100% принято проявление судорог у контрольных животных
На модели коразоловых судорог также установлены некоторые отличия в судорожной активности животных при введении рецептур препаратов и чистого окскарбазепина (рис. 2). При однократном введении комбинации pGlu-Aspa с окскарбазепином достоверно увеличивается латентный период развития судорожного синдрома, в среднем в 1,5 раза, но частота возникновения судорог не меняется. В условиях хронического введения комбинаций обоих пептидов с окскарбазепином отмечается снижение латентного периода возникновения судорог, вызванных введением коразола, но уменьшение частоты их возникновения. Поскольку модель кора-золовых судорог основана на блокировании дофаминовых рецепторов, мы предполагаем, что развитие судорожного синдрома с более коротким латентным периодом связано с их неполной разблокировкой. Явление потенцирования пептидами действия окскарбамазепина, скорее всего, связано со специфическим взаимодействием пептидов с рецепторным комплексом холеци-стокина (ССК) за счет аспарагина и глутамина на свободных концах их молекул [7]. Указанный тип рецепторов опосредованно и эффективно влияет на функционирование различных синаптических систем мозга, в том числе и на дофа-минэргическую систему и никотиновые рецепторы [8], что было продемонстрировано на использованных нами моделях.
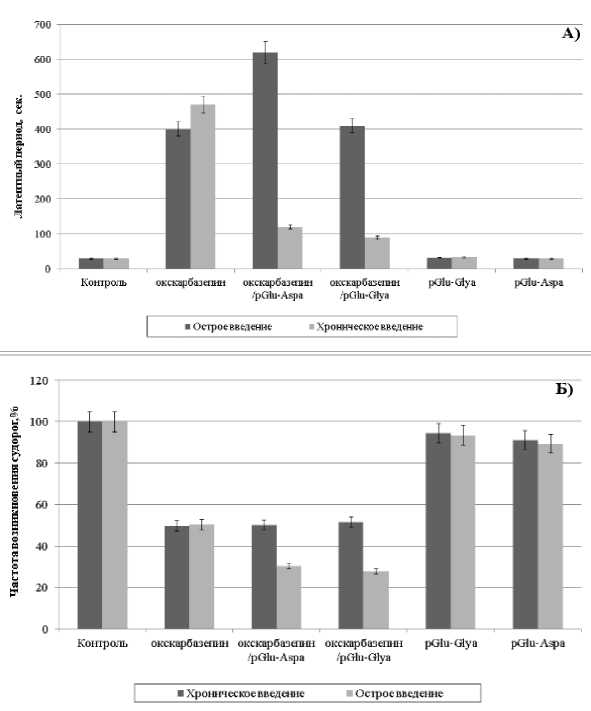
Рис. 2. Влияние однократного и хронического введения чистых препаратов и комбинаций веществ на: А – латентный период судорог, Б – частоту возникновения судорог, вызванных введением коразола. За 100% приняты контрольные животные
Выводы: установлено, что комбинированное действие пептидов pGlu-Asp a и pGlu-Gly a с окскарбазепином приводит к усилению противосудорожного действия препарата, при этом эффективность рецептуры превышает активность лекарственного средства как минимум в 1,5 раза при снижении дозы последнего в 2 раза.
Список литературы Коррекция стрессовых состояний с помощью рецептур антиконвульсанта и пептидных веществ
- URL: http://apps.who.int/classifications/apps/icd/icd10online/gf40.htm
- Rovira, C. Developmental study of miniature IPSCs of CA3 hippocampal cells: modulation by midazolam/C. Rovira, Y. Ben-Ari//Developmental Brain Research. 1999. Vol. 114. P. 79-88.
- Ушкалова, А.В. Влияние противосудорожных препаратов на когнитивные и поведенческие функции/А.В. Ушкалова, Е.А. Ушкалова//Фарматека. 2009. № 7. С. 13-18.
- Гудашева, Т.А. Синтез амида пироглутамиласпарагина -дипептидного фрагмента вазопрессина и стереоселективность его мнестического эффекта/Т.А. Гудашева, Г.Г. Розанцев, Р.У. Островская и др.//ХФЖ. 1995. Т. 29, № 1. С. 15-18.
- Гудашева, Т.А. Пептидные аналоги пирацетама как лиганды предполагаемых ноотропных рецепторов/Т.А. Гудашева, Р.У. Островская, С.С. Трофимов//ХФЖ. 1985. Т. 19, №11. С. 1322-1329.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/под общ. ред. чл.-кор. РАМН, профессора Р.У. Хабриева. 2-изд., перераб. и доп. -М.: Медицина, 2005. 832 c.
- Durieux, C. Occurrence of two cholecystokinin binding sites in guinea pig cortex/C. Durieux, M. Coppey, J.M. Zajac, B.P. Roques//Biochem. Biophys. Res. Commun. 1986. Vol. 137. P. 1167-1173.
- Léna, I. Dual modulation of dopamine release from anterior nucleus accumbens through cholescystokinin-B/I. Léna, B.P. Roques, C. Durieux//J. Neurochem. 1997. Vol. 68. P. 162-168.


