Коррекция трофологической недостаточности у больных с синдромом компрессионной миелопатии различной этиологии на уровне верхнешейного отдела позвоночника
Автор: Бажанов С.П., Ульянов В.Ю., Островский В.В., Щуковский В.В., Макаркина Е.В., Ульянова Е.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 3 т.8, 2012 года.
Бесплатный доступ
Цель: улучшение результатов лечения больных с травматическими повреждениями и опухолевыми поражениями верхнешейного отдела позвоночника на основании применения дифференцированного алгоритма нутритивно-метаболической терапии. Материал и методы. На основании клинико-инструментальных методов обследования изучены типичные метаболические характеристики у 21 больного с компрессионными ми-елопатиями на уровне верхнешейного отдела позвоночника. Результаты. На основании полученных данных разработан дифференцированный алгоритм нутритивно-метаболической терапии. Заключение. Применение нутритивно-метаболической терапии у больных с компрессионными миелопатиями на уровне верхнешейного отдела позвоночника позволяет улучшить результаты лечения данных пациентов.
Компрессионная миелопатия, лечение, трофологическая недостаточность
Короткий адрес: https://sciup.org/14917631
IDR: 14917631
Текст научной статьи Коррекция трофологической недостаточности у больных с синдромом компрессионной миелопатии различной этиологии на уровне верхнешейного отдела позвоночника
Адрес: 410002, г. Саратов, ул. Чернышевского, 148.
Тел.: 8 (8452) — 39-31-91.
практически все эфферентные и афферентные пути. Одним из проявлений неврологического дефицита при данных формах патологии верхнешейного отдела позвоночника и спинного мозга является нарушение моторно-эвакуаторной функции верхних отделов желудочно-кишечного тракта. В его основе лежит разобщение центров пищеварения, расположенных на уровне продолговатого мозга и проводящих путей, соединяющих центры управления со спинным мозгом, а также периферические отделы нервной системы, иннервирующие диафрагму и мышцы передней брюшной стенки. Существенную роль в патогенезе центральных нарушений при поражении спинного мозга на верхнешейном уровне, приводящих к развитию синдрома острой энтеральной недостаточности, играет нарушение кровообращения в верте-бро-базилярном сосудистом бассейне, что приводит к дисгемическим расстройствам в продолговатом мозге, где сосредоточены ядра черепных нервов, осуществляющих парасимпатическую иннервацию органов желудочно-кишечного тракта. Патогенез периферической формы нарушений функции желудочно-кишечного тракта связан как с сегментарным, так и с проводниковым повреждением центров симпатической иннервации в боковых рогах спинного мозга, двигательных нейронов, корешков, периферических нервов, нервно-мышечных окончаний. Общий сим-птомокомплекс острой энтеральной недостаточности при компрессионных миелопатиях на верхнешейном уровне является не только следствием неврологического дефицита, но и результатом выполняемых по поводу этой патологии оперативных вмешательств. В связи с этим концепция активной хирургической тактики при травматической и опухолевой патологии верхнешейного отдела позвоночника существенным образом обостряет проблему поддержания не только адекватной функции желудочно-кишечного тракта, но и гомеостаза в целом [1-5].
Интенсивная терапия травматических повреждений и опухолевых поражений спинного мозга предполагает использование единой лечебной доктрины, основанной на представлении о единстве патофизиологических процессов, возникающих при указанной патологии. Травматические повреждения и опухолевые поражения спинного мозга на верхнешейном уровне характеризуются стрессорным гиперкатаболизмом, который сопровождается увеличением мышечного протеолиза, ускоренным распадом белков, увеличением печеночного глюконеогенеза и синтеза острофазовых белков, глюкозы и мобилизацией жира. Возросший катаболизм мышечных и висцеральных белков проявляется прогрессирующей потерей тощей массы тела, что оказывает отрицательное влияние на функциональное состояние органов и систем организма, повышает вероятность вторичных осложнений и летального исхода у больных. Процессы катаболизма, развивающиеся в постагрессивном периоде, диктуют необходимость быстрой доставки в ткани энергетических и пластических ресурсов в условиях их повышенной потребности. Исходя из этого, современная концепция комплексного интенсивного лечения при компрессионных миелопатиях предполагает осуществление нутритивно-метаболической терапии [6-10].
Целью настоящего исследования является улучшение результатов лечения больных с травматическими повреждениями и опухолевыми поражениями верхнешейного отдела позвоночника на основании применения дифференцированного алгоритма нутритивно-метаболической терапии.
Методы. Объектом исследования явились 21 больной с осложненными травматическими повреждениями и опухолевыми поражениями на уровне верхнешейного отдела позвоночника, находившиеся на лечении в ФГБУ «СарНИИТО» Минздравсоцразвития РФ в период с 2010 по 2012 г. Исследование проводилось в однородной группе пациентов, сопоставимых по полу, возрасту, характеру повреждения, вызвавшего синдром поражения верхнешейного отдела спинного мозга. Структуру больных с синдромом компрессионной миелопатии травматической этиологии составляли пациенты с отрывным переломом корней дуг и травматическим спондилолистезом С2 позвонка (n=11). В группу больных с синдромом верхнешейной миелопатии опухолевой этиологии вошли пациенты с доброкачественными интрадуральными экстрамедуллярными образованиями (менингиомы), локализующимися на уровне краниовертебрального перехода и верхнешейного отдела позвоночника (n=10).
При поступлении все больные были подвергнуты комплексному обследованию: детально исследовались соматический и неврологический статусы, проводилось интраскопическое обследование, применялись клинико-лабораторные методы исследования. С целью максимальной стандартизации результатов неврологического осмотра использовали шкалу АSIA / NASCIS, которая имеет цифровое выражение и позволяет оценить степень функциональных нарушений спинного мозга с учетом мышечной силы, тактильной и болевой чувствительности. Осложненный характер повреждений был отмечен у всех (n=21) больных (классы А, В, С, D по Frankel).
Рентгенологическое исследование шейного отдела позвоночника в прямой и боковой проекциях проводили всем больным с травматическими повреждениями (n=11) при фокусном расстоянии 0,5 м.
При травме всем больным выполняли рентгенографию в трех проекциях (переднезадней, боковой и трансоральной), что позволяло выявить изменения оси позвоночника, смещения и вывихи позвонков, патологию краниовертебрального перехода и С2 позвонка, наличие костной деформации, а в некоторых случаях изменение тени паравертебральных мягких тканей. При оценке рентгенограмм измеряли снижение высоты тела позвонка (на 1/2, 2/3 и т.д.), определяли степень деформации позвоночного столба в градусах.
Компьютерная томография также была выполнена во всех случаях у больных с синдромом верхнешейной миелопатии травматической этиологии (n=11). Характер изменений в позвоночном канале оценивали по следующим параметрам: плотность и объем патологического содержимого позвоночного канала; локализация компремирующего агента.
Магнитно-резонансная томография выполнялась во всех случаях (n=21) для выявления состояния содержимого позвоночного канала. У больных с опухолевым поражением верхнешейного отдела спинного мозга (n=10) использовалось контрастное вещество Гадовист.
Оценку неврологического статуса, послеоперационный интраскопический контроль всем пациентам проводили в динамике.
Всем пациентам были выполнены хирургические вмешательства, которые в случае травматических повреждений (n=21) заключались в дискэктомии С2-С3 позвонков, передней декомпрессии дурального мешка, вентральном моносегментарном спондилодезе сетчатым эндофиксатором Mesh, накостной мо-носегментарной эндофиксации шейной пластиной. Больным с опухолевыми поражениями (n=10) выполнялись ламинэктомии на уровне С1-С2 позвонков, микрохирургическое удаление опухоли.
Согласно принятому в клинике протоколу у всех больных в пред- и послеоперационном периодах оценивали следующие параметры:
-
1) критерии недостаточности питания (фактическая масса тела от расчетной массы тела, %; индекс массы тела, кг/м2; окружность плеча, см; толщина кожно-жировой складки над трицепсом, мм; окруж-
- ность мышц плеча, см; общий белок, г/л; трансферрин, г/л; лимфоциты, тыс);
-
2) прогностический индекс риска (%) =100-1,5 х альбумин, (г/л) — окружность плеча, (см);
-
3) нутриционный риск, баллы (индекс массы тела; непроизвольная потеря веса за последние 3 месяца; снижение за последний месяц перед госпитализацией приема пищи; стрессовый фактор / тяжесть заболевания);
Кроме того, осуществляли обязательный мониторинг уровней содержания лактата, мочевины, натрия 1 раз в неделю.
Лечением больных занималась группа нутритивной поддержки, включающая врачей анестезиолога-реаниматолога, диетолога, оперирующего хирурга, эндоскописта, которыми обеспечивался мониторинг трофологического статуса, расчет потребности в основных макро- и микронутриентах и калорийности питательных смесей, выбор способа нутритивной поддержки и осуществление доступа для введения смесей.
Результаты. В соответствии с критериями оценки трофологического статуса и диагностики нарушений питания в предоперационном периоде обследуемые пациенты распределились следующим образом: 14 (66,6%) — в состоянии эйтрофии (более 27 баллов), 5 (23,8%) — с признаками легкой недостаточности питания (27-20 баллов), 2 (9,6%) — с признаками средней недостаточности питания (18-14 баллов). Прогностический индекс риска у всех 14 пациентов в состоянии эйтрофии составил 15±3%, у остальных семи пациентов, имеющих признаки недостаточности питания, — 24±2%. Расчетный показатель оценки нутриционного риска у больных в эйтрофии составил 1±1 балл, у пяти больных с легкой недостаточностью питания — 3±1 балл, у двух больных со средней недостаточностью питания — 5±1 балл. Согласно полученным данным в предоперационном периоде пациенты, находящиеся в эйтрофическом состоянии или имеющие признаки легкой трофологической недостаточности, не требовали никаких дополнительных действий, за исключением динамического наблюдения. Двое больных с признаками средней степени недостаточности питания были консультированы врачом-диетологом группы нутритивной поддержки, которым в качестве дополнения к обычной диете был назначен прием нутридринков по 200 мл 3 раза в сутки в течение 5-7 дней с целью восполнения повышенной потребности в белке, энергии и витаминах. Среди всех наблюдаемых в предоперационном периоде пациентов новых случаев возникновения или прогрессирования недостаточности питания отмечено не было, что подтверждено расчетными параметрами и данными биохимических исследований.
После всестороннего клинического, лабораторного и инструментального обследования всем пациентам при стабильном состоянии были выполнены декомпрессивно-стабилизирующие или микрохирургические вмешательства.
Также в соответствии с критериями оценки трофологического статуса и диагностики нарушений питания в раннем послеоперационном периоде обследуемые пациенты распределились следующим образом: 13 (61,9%) — в состоянии эйтрофии (более 27 баллов), 6 (28,5%) — с признаками легкой недостаточности питания (27-18 баллов), 2 (9,5%) — с признаками средней недостаточности питания (14 и 10 баллов). Прогностический индекс риска у всех 13 пациентов в состоянии эйтрофии также находился в пределах 15±3%, у остальных 8 пациентов, имеющих признаки легкой и средней недостаточности питания, он составил 25±3%. Расчетный показатель оценки нутриционного риска у больных в эйтрофии составил 1±1 балл, у шести больных с легкой недостаточностью питания — 3±1 балл, у двух больных со средней недостаточностью питания — 6±1 балл. Согласно полученным данным, в послеоперационном периоде пациенты, находящиеся в эйтрофическом состоянии, не требовали никаких дополнительных действий. Остальные шесть больных с признаками легкой трофологической недостаточности получали также в качестве дополнения к обычной диете нутри-дринки в объеме 200 мл 3 раза в сутки до нормализации расчетных и биохимических показателей. Двум больным с признаками средней тяжести трофологической недостаточности, уже начиная с первых суток, проводили нутритивно-метаболическую терапию путем парентерального введения глюкозо-электролитных растворов, а со вторых суток путем энтерального введения нутризон по 1000 мл/сут в течение последующих двух-трех дней. Затем осуществляли плавный переход к обычному рациону с дополнительным назначением нутридринков в объеме 200 мл 3 раза в сутки до нормализации расчетных и биохимических параметров.
В качестве иллюстрации полученных данных приводим два клинических наблюдения.
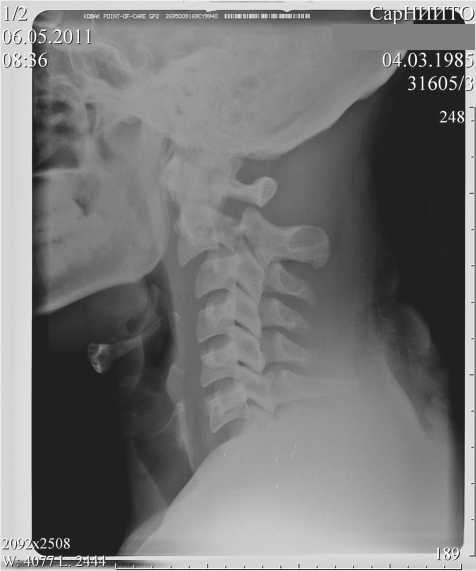
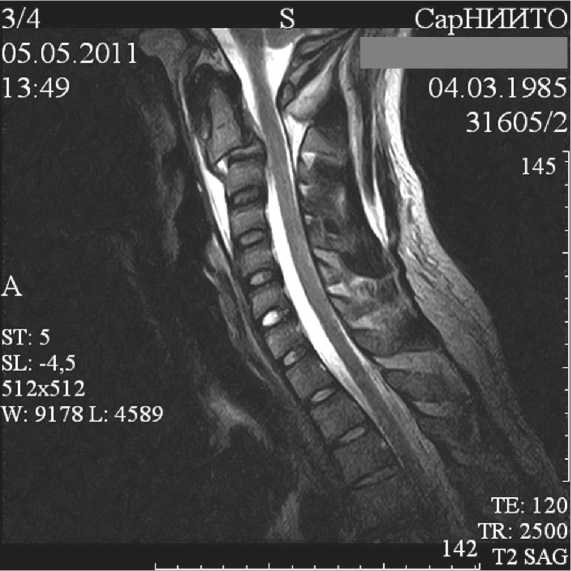
Больной Б., 27 лет, получил травму во время дорожно-транспортного происшествия (флексион-но-экстензионный механизм травмы). Сразу же почувствовал боль в шейно-затылочной области, ограничение движений в шейном отделе позвоночника, отсутствие движений в обеих кистях, слабость в нижних конечностях. Поступил в отделение нейрохирургии ФГБУ «СарНИИТО» через 6 часов с момента получения травмы. В неврологическом статусе выявлен центромедуллярный синдром, сегментарно-диссоциированные расстройства чувствительности с уровня С2 сегмента с обеих сторон (тип С по Frankel). При клинико-интраскопическом обследовании (рис. 1 а, б) выявлена закрытая осложненная травма верхнешейного отдела позвоночника, отрывной перелом корней дуг С2 позвонка c отрывом краниовентрального угла и травматическим спондилолистезом тела С2 позвонка до 0,5 см (II тип по классификации B. Effendi в дополнении A. M. Levine и C. C. Edwards).
При оценке нутриционного статуса в предоперационном периоде признаков трофологической недостаточности не выявлено: критерии оценки недостаточности питания (27 баллов), прогностический индекс риска (17%), нутриционный риск (1 балл).
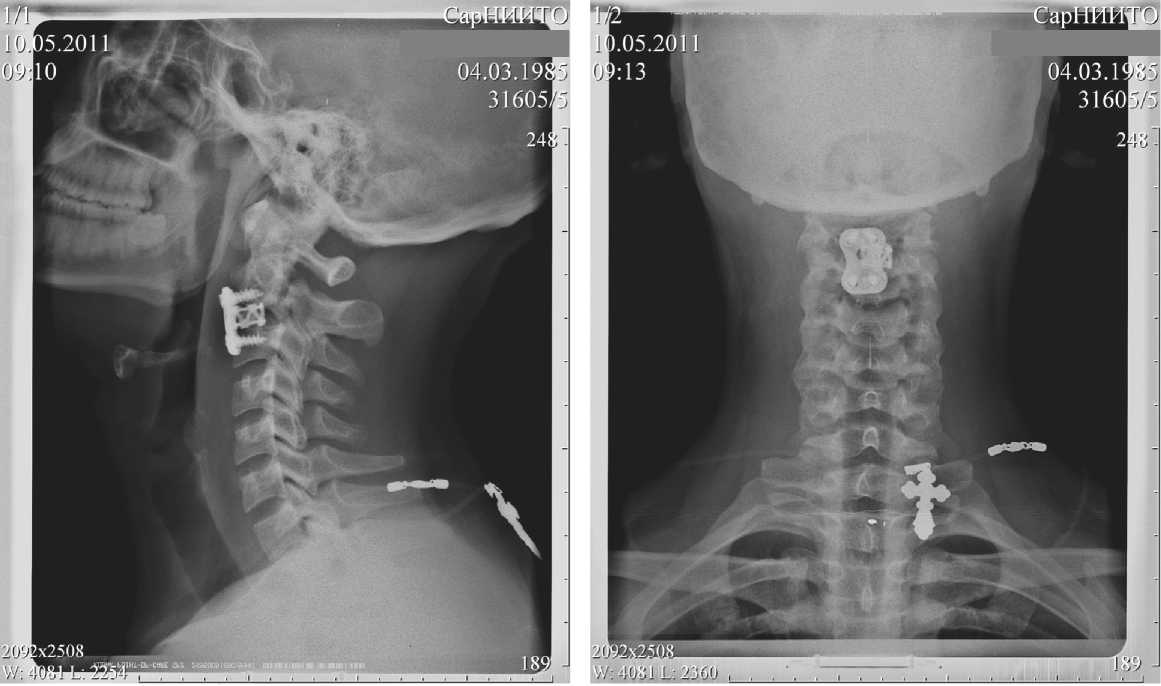
Больному было выполнено оперативное вмешательство: микрохирургическая дискэктомия С2-С3, устранение вывиха С2 позвонка, коррекция сегментарного кифоза, межтеловая стабилизация костным аутоимплантом, фиксация С2-С3 позвонков моносегментарной пластиной фирмы Atlantis., передняя декомпрессия дурального мешка, восстановление формы позвоночного канала и анатомической оси позвоночника на уровне повреждения (рис. 2 а, б).
В раннем послеоперационном периоде отмечено нарастание неврологической симптоматики в виде усугубления степени выраженности пареза в кистях, появления легкого пареза в нижних конечностях и признаков трофологической недостаточности легкой степени: критерии оценки недостаточности питания (24 балла), прогностический индекс риска (24%), нутриционный риск (3 балла). Данная клини-
а
Рис. 1. Боковая рентгенограмма: а — выявляется отрывной перелом корней дуг С2 позвонка c травматическим спондилолистезом тела С2 позвонка и сагиттальной трансляцией тела С2 позвонка кпереди на 0,5 см; б — на боковой МР-томограмме определяется компрессия переднего субарахноидального пространства на уровне С2-С3 позвонков
б
б
Рис. 2. Боковая рентгенограмма: а — состояние после оперативного вмешательства, устранения вывиха С2 позвонка, моно-сегментарный С2-С3 спондилодез; вентральный моносегментарный корриргирующий спондилодез сетчатым эндокфиксато-ром Mesh; б — фиксация С2-С3 позвонков моносегментарной пластиной фирмы Atlantis, восстановление анатомической оси позвоночника
ческая ситуация потребовала усиления проводимого противоотечного лечения в режиме пульс-терапии глюкокортикоидными препаратами до 1000 мг/сут и осуществления нутритивно-метаболической терапии, включающей парентеральное введение глюкозо-электролитных растворов и энтеральное введение питательных смесей.
На фоне проведенного курса реабилитационновосстановительного лечения отмечен регресс неврологической симптоматики в виде восстановления чувствительности в С2-дерматомах с обеих сторон, увеличения силы и объема движений в обеих кистях (тип D по Frankel) и нормализация показателей трофологического статуса.
Больная Б., 53 лет поступила в отделение нейрохирургии ФГБУ «СарНИИТО» с жалобами на боль оболочечно-сосудистого характера в шейно-затылочной области, несистемное головокружение, слабость в верхних и нижних конечностях, шаткость при ходьбе, нарушение функций тазовых органов по типу задержки.
Из анамнеза известно, что перечисленные жалобы стала отмечать в течение последних 11 месяцев, которые с течением времени стали приобретать прогредиентный характер.
В неврологическом статусе выявлен синдром поражения шейного отдела спинного мозга выше уровня шейного утолщения, в виде центрального спастического тетрапареза до 3 баллов, нарушения чувствительности по спинально-проводниковому типу с уровня С2 с двух сторон (тип В по Frankel); наличие синдрома поражения вентрального и дорзального спинно-мозжечковых путей, синдром Броун — Секара.
При интраскопическом обследовании выявлена интрадуральная экстрамедуллярная опухоль на уровне С1-С2 позвонков, располагающаяся по левой заднебоковой поверхности позвоночного канала, грубо компремирующая вещество спинного мозга (рис. 3 а, б)
При оценке нутриционного статуса в предоперационном периоде у больной были выявлены признаки трофологической недостаточности легкой степени: критерии оценки недостаточности питания (22 балла), прогностический индекс риска (25%), нутри-ционный риск (3 балла). Мероприятия по нутрицион-ной поддержке не осуществляли.
Больной было выполнено оперативное вмешательство: ламинэктомия на уровне С1-С2 позвонков, микрохирургическое тотальное удаление опухоли, степень радикальности Simpson II. Гистологическое заключение: менинготелиоматозная менингиома (Grade I).
В раннем послеоперационном периоде отмечено нарастание пареза в левой кисти до двух баллов, усугубление пареза в правой нижней конечности, что расценено как проявление круциатного синдрома (синдрома перекреста пирамид), по-видимому, как вследствие прямого воздействия на нервные структуры, так и опосредованного вследствие дисгеми-ческих расстройств и появления восходящего отека вещества спинного мозга.
В раннем послеоперационном периоде нарастания признаков трофологической недостаточности не отмечали: критерии оценки недостаточности питания (24 балла), прогностический индекс риска (25%), нутриционный риск (3 балла). Нутритивно-метаболическая терапия в данном случае осуществлялась в виде парентерального введения глюкозо-электролитных растворов, смеси для энтерального питания не вводились.
На фоне комплексного лечения отмечалась положительная динамика в виде постепенного регресса тетрапареза, чувствительных нарушений (тип С по Frankel), расстройств функций тазовых органов и нормализация трофологического статуса.
Обсуждение. В предоперационном периоде среди всех пациентов с компрессионными миелопатиями травматической этиологии признаков трофологической недостаточности выявлено не было. Согласно имеющимся литературным данным это может быть связано с внезапностью травмирующего агрессивного воздействия извне на фоне отсутствия дефицита макро- и микронутриентов, нормальным уровнем метаболической активности и отсутствием тяжелых сопутствующих заболеваний [1-3]. Ухудшение показателей трофологического статуса у больных с компрессионными миелопатиями опухолевой этиологии обусловлено прогрессирующим снижением реактивности и пластических свойств макроорганизма в результате преобладания процессов катаболизма [4, 5].
Таким образом, в раннем послеоперационном периоде вне зависимости от этиологии компреми-рующего воздействия в ряде случаев происходит прогрессирование признаков острой энтеральной недостаточности, что связано с объемом оператив-
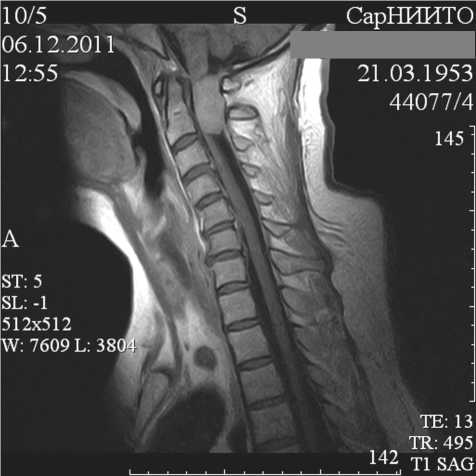
Рис. 3. На боковой МР-томограмме (а) определяется интрадуральная экстрамедуллярная опухоль на уровне С1-С2 позвонков, интенсивно и равномерно накапливающая контрастное вещество; на корональной МР-томограмме (б) отмечена грубая компрессия и дислокация вправо вещества верхнешейного отдела спинного мозга.
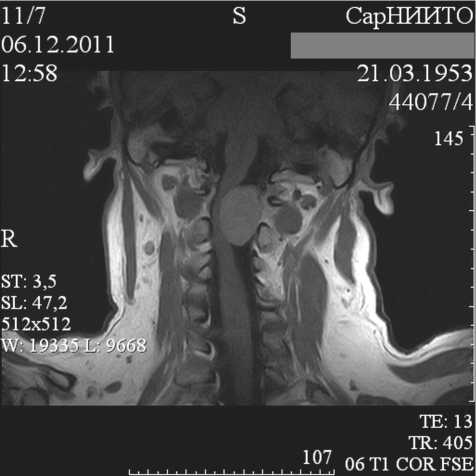
б
ного вмешательства, усилением аутоканнибализма, сниженной мышечной активностью, ограничением поступления макро- и микронутриентов.
Заключение. У больных с синдромом компрессионной миелопатии различной этиологии, особенно на уровне верхнешейного отдела спинного мозга и уровня краниовертебрального перехода, несмотря на проведение адекватного по объему оперативного вмешательства (декомпрессия и стабилизация) в послеоперационном периоде отмечается нарастание неврологической симптоматики, что связано как с прямыми альтерирующими влияниями в ходе хирургического вмешательства, так и опосредованными в результате развития дисгемических расстройств в компремированном веществе спинного мозга. Указанные факторы приводят к усилению степени выраженности отека вещества спинного мозга и нарушению восходящих и нисходящих неспецифических связей, оказывающих влияние на регуляцию деятельности внутренних органов, в том числе желудочно-кишечного тракта, что приводит к развитию и прогрессированию острой энтеральной недостаточности, требующей осуществления нутритивно-метаболической терапии. Адекватно проводимая нутритивно-метаболическая терапия в комплексе с хирургическим вмешательством и другими методами интенсивного воздействия позволяет улучшить результаты лечения больных с компрессионными миелопатиями.
Список литературы Коррекция трофологической недостаточности у больных с синдромом компрессионной миелопатии различной этиологии на уровне верхнешейного отдела позвоночника
- Ермолов А. С. Искусственное питание в неотложной хирургии и травматологии/под ред. А. С. Ермолова, М.М. Абакумова. М.: НИИ СП им. Н. В. Склифосовского, 2001. 388 с.
- Костюченко А. Л., Костин Э.Д., Курыгин А. А. Энтераль-ное искусственное питание в интенсивной медицине. СПб.: СпецЛит, 1996. 304 с.
- Попова Т. С. Нутритивная поддержка больных в критических состояниях. М.: М-Вести, 2002. 319 с.
- Ульянов В.Ю., Бажанов С. П., Щуковский В. В., Макар-кина Е. В. Эндоскопическая назоинтестинальная интубация у пациентов с травмой шейного отдела позвоночника и спинного мозга//Альманах Института хирургии им. А. В. Вишневского. 2012. Т. 7, № 1. С. 279-280
- Лященко Ю. Н., Петухов А. Б. Основы энтерального питания. М.: Вега Интел, 2001. 343 с.
- Луфт В.М., Костюченко А. Л., Лейдерман И. Н. Руководство по клиническому питанию больных в интенсивной медицине. СПб. Екатеринбург: УГМА, 2003. 325 с.
- Хорошилов И. Е., Панов П. Б. Клиническая нутрициоло-гия. СПб.: ЭЛБИ, 2009. 284 с.
- Тутельян В. А., Самсонов М.А. Справочник по диетологии. М.: Медицина, 2002. 345 с.
- Бахман А. Л. Искусственное питание. М. СПб.: Бином -Невский диалект, 2001. 190 с.
- Гальперин Ю.М., Лазарев П. И. Пищеварение и гомеостаз. М.: Наука, 1986. 304 с.


