Ковалентное допирование нитрида углерода карбазолом и бензохалькодиазолами: моделирование электронных свойств в альтернативных приближениях
Автор: Григорьева Е.А., Матвейчук Ю.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
Представлены результаты теоретического анализа электронных свойств соединений на основе фрагментов нитрида углерода, состоящих из трех гептазиновых колец (мелона), ковалентно связанных с гетероциклическими заместителями: электрон-акцепторными 2,1,3-бензохалькодиазолами и электрон-донорным карбазолом. Моделирование выполнено на двух альтернативных уровнях: молекулярная газофазная модель и модель одномерного полимера с периодическими граничными условиями. Эти уровни позволили сравнить разность энергий граничных орбиталей молекулярной модели и ширину запрещенной зоны цепочечного полимера одного и того же соединения. Обнаружено, что, с одной стороны, селенсодержащие гетероциклы значительно больше, чем другие ковалентно связанные допанты рассмотренной серии, уменьшают разность энергий граничных орбиталей, а с другой стороны, допирование мелона только карбазолом максимально уменьшает ширину запрещённой зоны. При эффективном допировании, максимально уменьшающем разность граничных орбиталей, высшая занятая орбиталь локализована на электрон-донорном фрагменте молекулы, а низшая свободная - на электрон-акцепторном фрагменте молекулы. Также показано, что допированные мелоны формируют комплексы с бензиловым спиртом, образованные за счёт появления между ними нековалентных связей. При этом меньшая прочность таких связей в комплексах с мелоном, замещённым электрон-акцепторными селенсодержащими фрагментами, предполагает более эффективное окисление спирта в таких системах. Результаты моделирования адекватно соответствуют имеющимся экспериментальным данным по ширине запрещённой зоны мелона, допированного электрон-акцепторными молекулами. Быстрые газофазные расчёты подходят для качественной оценки зависимостей разности энергий граничных орбиталей от вида и количества вводимого допанта, а более затратные расчёты полимерных структур позволяют провести корректную оценку самих значений ширины запрещённой зоны полимеров нитрида углерода при введении различных допантов.
Нитрид углерода, мелон, электрон-донорные и электрон-акцепторные гетероароматические допанты, разность граничных орбиталей, ширина запрещённой зоны
Короткий адрес: https://sciup.org/147243265
IDR: 147243265 | УДК: 544.169 | DOI: 10.14529/chem240110
Текст научной статьи Ковалентное допирование нитрида углерода карбазолом и бензохалькодиазолами: моделирование электронных свойств в альтернативных приближениях
Нитрид углерода вызывает широкий интерес исследовательского сообщества благодаря простоте получения, привлекательной для многих практических целей электронной структуре, высокой физико-химической стабильности и доступности [1–3]. Графитоподобный нитрид углерода g-C 3 N 4 (ГНУ) в целом представляет собой плоскую двумерную структуру, которая в стабильной кристаллической форме не зафиксирована [4]. Разновидности ГНУ образованы триазиновыми или гептазиновыми звеньями. Наиболее энергетически выгодную структуру имеет мелем, представляющий собой гептазиновое звено. Мономеры мелема, связываясь между собой через атомы азота, образуют мелон [5], который является важным промежуточным продуктом при конденсации меламиновых колец до нитрида углерода [6].
Особый интерес представляет дальнейшая модификация сопряженной π-системы полигептазиновых цепей. Исследование органических полупроводниковых полимеров получило развитие в течение последних двух десятилетий, что привело к возникновению новой отрасли электронных устройств на основе органических светоизлучающих диодов, OLED, полевых транзисторов, OFET и органических фотогальванических элементов, OPV [7, 8]. Это развитие основано на модификации электронной структуры высокосопряженных органических полимеров. Основным подходом к этой модификации является введение донорных и акцепторных заместителей в полимерные цепи, которые нагнетают или отнимают электронную плотность в сопряженной системе, тем самым влияя на энергетические уровни и ширину запрещенной зоны полимера.
Хотя этот подход оказался эффективным при создании органической электроники, он мало применяется в синтезе фотокатализаторов для расщепления воды, окисления или разложения загрязняющих веществ из-за низкой стабильности и фотокоррозии [9, 10] Мы предлагаем применить донорно-акцепторный подход к ГНУ, который оправдан из-за его более высокой стабильности и надежности. Более того, убедительное количество публикаций однозначно указывает на положительное влияние молекулярного допирования и сополимеризации с g-C3N4 на фотокаталитическую активность. Исследована сополимеризация с производными бензола: п-фенилендиамин [11], тригидроксибензол [12], терефталевая кислота [13, 14], пиромеллитовый ангидрид [15–17], аминобензойная кислота [18], пиридины [19, 20], пиримидины [21–24], триазол [25], 3-аминотиофен-2-кабонитрил [9, 26, 27], фенилмочевина [28] и бензотиадиазол [29, 30].
Однако в большинстве этих публикаций изучается влияние одного допанта на активность ГНУ, что затрудняет полное понимание преобразования электронной структуры. Хотя в некоторых отчетах [31, 32] и показано влияние ряда допантов на фотокаталитическую активность по отношению к выделению водорода, сложно сделать вывод о природе возникающей эффективности катализа.
Полупроводниковые свойства ГНУ обусловлены делокализованной π-электронной структурой мелемовых или триазиновых субструктур, состоящих из атомов углерода и азота в sp2-гибридизации. С одной стороны, ароматическая π-система ГНУ в чистом виде содержит внутренние недостатки, с практической точки зрения, такие как быстрое рекомбинирование разделённых зарядов, неполное поглощение видимой части спектра, существенным образом сдерживающие её фотохимический потенциал [33, 34]. С другой стороны, на большом числе примеров было показано, что внедрение малых ароматических и гетероароматических молекул в полимерную структуру ГНУ способствует оптимизации запрещённой зоны полупроводниковых материалов, настройке уровней ВЗМО и НСМО, улучшению светочувствительности и фоторазделению зарядов [35].
Важным сдерживающим фактором для понимания особенностей взаимодействия ГНУ с допантами и механизмов его каталитической активности является недостаточность данных о структуре объектов исследований [36]. Первыми приближениями на пути к моделированию ГНУ являются его структурные звенья – меламин, мелем, димелем, мелон [37]. Такие звенья возможно успешно смоделировать в газофазном кластерном приближении с помощью различных методов и подходов, учитывая известный опыт [38–40]. Несмотря на невозможность учёта межзвенных взаимодействий, слоевых эффектов, на этом уровне моделирования удаётся корректно описать особенности, связанные со свойствами ковалентных связей, и в первом приближении учесть влияние атомных и молекулярных допантов типа пиридина на электронные характеристики [41]. Однако прогностические модели, позволяющие предсказать каталитическую активность ГНУ как его главное целевое свойство, требуют прямого учёта ближнего порядка и симметрии. Это становится возможным только при переходе к моделям с периодическими граничными условиями, позволяющим учесть двумерную или трёхмерную периодичность [42]. Рассмотрение таких моделей в литературе встречается намного реже, однако в числе наиболее выдающихся стоит отметить модели, в рамках ТФП, периодических расчётов с использованием локализованных атомных базисных наборов в CRYSTAL [43], а также сравнение различных подходов к вычислению ШЗЗ [44].
Все вышеперечисленные модели затрагивают вопросы построения двух- и трёхмерной структуры без точно известной геометрии взаимного расположения звеньев, а также позволяют получить ряд сопоставимых с расчётом электронных характеристик.
В представленном исследовании мы поставили следующие цели:
-
• моделирование молекул мелона, допированных рядом гетероциклов с выраженными электрон-донорными и электрон-акцепторными свойствами в 2 приближениях: кластерном и с периодическими граничными условиями;
-
• расчет электронных характеристик полученных систем, анализ взаимосвязи рассчитанных характеристик и имеющихся экспериментальных данных;
-
• определение влияния допантов на энергию связывания замещённого мелона с молекулой бензилового спирта;
-
• анализ результатов расчетов в 2 приближениях и разработка рекомендации по возможности использования методик расчетов для модификации свойств допированного мелона.
В работе представлены результаты моделирования структуры и свойств рассматриваемых π-электронных систем с экспериментальными данными на двух уровнях моделирования, а именно: 1) оптимизированные структуры и энергия граничных орбиталей для изолированных молекул мелона, состоящих из трех и девяти гептазиновых звеньев, полученные путем кластерного расчета молекулы в газофазном состоянии; 2) рассчитанная ширина запрещенной зоны для полимерных цепей мелона, смоделированных из девяти гептазиновых звеньев как мономеров, с периодическими граничными условиями. В обоих случаях одна молекула легирующей примеси соответствовала одной молекуле мелона или полимерному звену.
Экспериментальная часть
Серия анализируемых молекулярных структур мелона ( Tm_M ), ковалентно-связанного с замещенными гетероциклами на основе карбазола и 2,1,3-бензохалькодиазола ( 1–20 ), формировалась путем замещения атомов водорода и чередования молекулярных допантов, представленных молекулами с выраженными как электрон-донорными, так и электрон-акцепторными свойствами (табл. 1). Кластерные квантово-химические расчеты, включающие локализацию равновесной геометрии допированных структур мелона, были выполнены с использованием ТФП, в программе Gaussian 16 [45]. Были использованы функционалы с базисными наборами B3LYP/6-311+G(d,p) и HSE06/DZVP. Учет эффектов сольватации произведен методом поляризационного континуума То-маси, PCM [46]. Критерий сходимости по энергии 10–8 ат. ед. и параметры по умолчанию уровня точности Tight. Выполнен расчет энергий граничных молекулярных орбиталей: высшей занятой (ВЗМО) и низшей свободной (НСМО), и разности граничных орбиталей, ΔE MO = Е НСМО – Е ВЗМО .
Таблица 1
Состав молекулярно-допированных структур мелона и энергии граничных орбиталей в кластерных расчётах, уровень расчета HSE06/DZVP
|
№ |
Обозначение |
Электрон-акцепторный допант |
Электрон-донорный допант |
E ВЗМО , эВ |
Е НСМО , эВ |
ΔE MO , эВ |
|
0 |
Tm_M |
– |
– |
–6,32 |
–2,75 |
3,57 |
|
1 |
Tm_O |
1,2,5-оксадиазол |
– |
–6,56 |
–3,09 |
3,46 |
|
2 |
Tm_S |
1,2,5-тиадиазол |
– |
–6,49 |
–3,01 |
3,48 |
|
3 |
Tm_Se |
1,2,5-селенадиазол |
– |
–6,47 |
–3,00 |
3,48 |
|
4 |
Tm_B_O |
2,1,3-бензоксадиазол |
– |
–6,40 |
–3,16 |
3,23 |
|
5 |
Tm_B_S |
2,1,3-бензотиадиазол |
– |
–6,23 |
–3,10 |
3,13 |
|
6 |
Tm_B_Se |
2,1,3-бензоселенадиазол |
– |
–6,13 |
–3,20 |
2,93 |
|
7 |
Tm_D |
– |
карбазол |
–5,64 |
–2,66 |
2,98 |
|
8 |
Tm_D_S |
– |
дибензотиофен |
–5,90 |
–2,74 |
3,16 |
|
9 |
Tm_O_D |
1,2,5-оксадиазол |
карбазол |
–5,75 |
–2,95 |
2,80 |
|
10 |
Tm_S_D |
1,2,5-тиадиазол |
карбазол |
–5,72 |
–2,88 |
2,84 |
|
11 |
Tm_Se_D |
1,2,5-селенадиазол |
карбазол |
–5,71 |
–2,87 |
2,85 |
|
12 |
Tm_B_O_D |
2,1,3-бензоксадиазол |
карбазол |
–5,72 |
–3,08 |
2,64 |
|
13 |
Tm_B_S_D |
2,1,3-бензотиадиазол |
карбазол |
–5,69 |
–3,03 |
2,65 |
|
14 |
Tm_B_Se_D |
2,1,3-бензоселенадиазол |
карбазол |
–5,68 |
–3,14 |
2,53 |
|
15 |
Tm_O_D_S |
1,2,5-оксадиазол |
дибензотиофен |
–6,00 |
–3,02 |
2,99 |
|
16 |
Tm_S_D_S |
1,2,5-тиадиазол |
дибензотиофен |
–5,97 |
–2,94 |
3,03 |
|
17 |
Tm_Se_D_S |
1,2,5-селенадиазол |
дибензотиофен |
–5,96 |
–2,93 |
3,04 |
|
18 |
Tm_B_O_D_S |
2,1,3-бензоксадиазол |
дибензотиофен |
–5,97 |
–3,12 |
2,85 |
|
19 |
Tm_B_S_D_S |
2,1,3-бензотиадиазол |
дибензотиофен |
–5,94 |
–3,07 |
2,87 |
|
20 |
Tm_B_Se_D_S |
2,1,3-бензоселенадиазол |
дибензотиофен |
–5,93 |
–3,18 |
2,75 |
Локализация равновесной геометрии одномерных полимерных структур 8 исследуемых образцов производилась с помощью программного пакета CRYSTAL17 [47] методом ТФП с периодическими граничными условиями следующим образом. В качестве мономерного звена взята молекула, состоящая из трёх параллельных трёхзвенных молекул мелона, соединённых между собой в шахматном порядке. То есть одно звено моделируемого полимера состояло из 9 соединённых между собой в три ряда молекул мелема. Затем один или два атома водорода на краях мономерного звена замещались на молекулярные фрагменты допантов в нескольких сочетаниях. Информация о мономерных звеньях, использованных для моделирования соответствующих полимеров, приведена в табл. 2. Было установлено, что применение к моделированию того же уровня расчёта, что и для молекулярных структур, а именно B3LYP/6-311+G(d,p), даёт завышенные и далёкие от экспериментальных [48] значения ШЗЗ. Поэтому для локализации равновесной геометрии полимеров был использован уровень расчёта HSE06/pob-DZVP_rev2 [49, 50], давший более близкие к эксперименту значения ШЗЗ для незамещённого полимера. Для релаксации как исходной структуры мелона, так и замещённых полимеров использована опция POLYMER программного пакета CRYSTAL17 и следующие значения параметров программы: TOLDEG 0.00001, TOLDEX 0.00003, TOLDEE 10, TOLINTEG 14 14 14 14 24. Полученные значения ШЗЗ приведены в табл. 2.
Таблица 2
Состав молекулярно-допированных структур мелона в расчётах полимеров, значения ШЗЗ и разности энергий граничных орбиталей для соответствующих молекул
|
№ |
Обозначение |
Допанты |
Структура |
ШЗЗ, эВ |
ΔEMO, эВ |
|
1 |
Tm_M |
– |
2,91 (2,56)*, (2,70)** |
3,57 |
|
|
2 |
Tm_B_Se |
2,1,3-бензоселенадиазол |
2,72 (1,88)* |
2,93 |
|
|
3 |
Tm_D |
карбазол |
2,26 |
2,98 |
|
|
4 |
Tm_B_Se_D |
2,1,3-бензоселенадиазол, карбазол |
2,49 |
2,53 |
|
|
5 |
Tm_B_O |
2,1,3-бензоксадиазол |
2,92 (2,41)* |
3,23 |
|
|
6 |
Tm_B_S |
2,1,3-бензотиадиазол |
2,69 (2,00)* |
3,13 |
|
|
7 |
Tm_B_S_D |
2,1,3-бензотиадиазол, карбазол |
2,45 |
2,65 |
|
|
8 |
Tm_B_O_D |
2,1,3-бензоксадиазол, карбазол |
2,60 |
2,64 |
Экспериментальное значение ШЗЗ [36]; ** Экспериментальное значение ШЗЗ [54].
Ан а л и з хара к тера в за и мод ействия в комплексах из молекулы ГНУ и б е н зи лов ого спирта п рои зв од и лся при п омощи ра счё т ов э н е рги и в з аимоде й с тв ия (E int ) молекул бензилового спирта и терм и н а л и з ов а н н ого фр агме н та н и три да у гле р од а. Р а сче т E int произведен методом противовеса, с у че том оши б к и с у п е рп ози ци и ба зи с н ого наб о ра п о фо рм у л е : E int = E AB – (E A + E B ) – E BSSE , где E AB – эн ергия м ол е к у лярн ого комплекса бензилового спирта и фрагмента н и три д а у глерод а, E A – эн ергия мол е к у лы бе н зил ов ого с п ирта , E B – энергия фрагмента нитрида углерода, E BSSE – п оп ра в к а н а ош и бк у с у перп оз и ц и и б а зи с н о го н а бора [ 51]. Расчет энергии нековалентных взаимодействий E HB п рои зве де н по уравнению Эспиноза с соавторами [ 52]: E HB = ΣE i,HB , E i,HB = 0,5υ(r b ), где E i,HB – эн ерги я отдельно взятого нековалентного взаимоде й с тв и я в к омп л е к се, υ(rb) – п л отн ос ть п оте н ц и альн ой э н е рги и в связевой критической точке (3,–1) этого взаимодейст в и я. Р а с чет вы п олн е н в програ мме Gaussian 16 [45], критерий сходимости по э нерги и 10–8 ат. ед. и п а раме тры п о у м ол ча ни ю у ро вня точности Tight. Визуализация и анализ ра сс чи та н н ых с т руктур молекул, пол и м еров, к омпл ексов и их молекулярных орбиталей выполнены п ри п омощ и п рограммы ChemCraft 1.8 [53].
Обсуждение результатов
Моле ку ля р ный дизай н к ов але нтн о -допированных соединений мелона
Для мод е ли р ов а н и я и золи рованных молекул мелона и их допированных п ро изводных были в ы б ра н ы ф ра гм е н ты, с остоящ и е из трех и девяти гептазиновых звеньев, из н а ча льн о и ме ющ ие п л ос к у ю с тру к ту ру. Рас п олож е н ие донорных и акцепторных гетероциклов в Г НУ в ыб ра н о с у ч е том и ме ющ и хс я э кс п е риме н та л ьн ых данных [36]. Разности энергий граничных молекулярных орбиталей ( ΔE MO ) д ля и золи рованных молекул мелона, замещенных од н и м и з бе н-зо[c ][1, 2, 5]ха л ьк о ге н ад и азолов , и оценки ШЗЗ для полимерных цепей тех ж е фрагме н тов , п олу ч е н ны е с п е ри о д и че ск и м и гра н и чными условиями, приведены в табл. 2. Также м ож но отметить, ч т о м ол ьн ое с оотн оше н и е молекулы допанта и мелона (в пересчете на мела ми н) в п оли ме рн о м зв е н е при ме рн о соответс т в уе т 5%-ному допированию в эксперименте. Этот факт позволяет срав н и ть э к с п е ри м е н та льные и ра с че тные э ле к трон ные харак те рис ти к и д оп и рованной молекулы ме- л он а , и х те нд е н ц и и и оц ени ть в озможные структурные особенности допирова н н ого мелон а .
С п е ц и фи че ск ое ра с поло же н ие допирующих заместителей повлияло на п рос транственн у ю структуру смоделированных сое д и не н и й ( ри с . 1 ) . Э лек трон-акцепторные допанты на основе 2,1,3- б е н зоха льк о д и а золо в могу т замещать атом Н первичной аминогруппы, т. е. располагаться в о д н ой из в е ршин гептаз и н ов ого к ольца Tm_M, находясь при этом в одной плоскости со связан н ы м ге п та зи нов ы м фрагментом ме л он а . Пл а н а рн ое ра с п оло же н и е этих фрагментов связано с эф ф е к т а ми с оп ря же н и я межд у д опантами и гептазиновым кольцом, которое по д к ре пле н о в озмо ж н ы м об ра зов а н и е м в о д ор од н ых с в язе й N…H–C. Электрон-донорные гетероциклы, замещающие по з ици и пр и вт о рич но м ат о м е азо т а м еж д у дв умя гепт аз ино вы ми кольцами, как правило, разверну т ы о р т о г о нал ь но по о т ношению к плоскости мелона. Молекулы мелона, допир о ванны е т ол ь ко электрон-акцепт о р ны ми зам ест ителями, содержащими в своей структуре хал ь ко г ены (O, S, Se), более планарны в случае Se как г ет ер о ат о м а в до пантах. Степень планарности мы определяли, как м аксим ал ь но е о т кл о нение ат о м о в, вх о д я щих в сост а в м ел о на, по ко о рдинат е Z от плоскости XY.
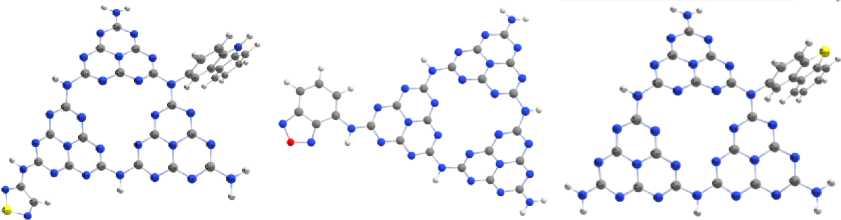
а) б) в)
Рис. 1. Примеры оптимизированных допированных структур мелона: а) Tm_S_D: акцептор – 1,2,5-тиадиазол, донор – карбазол, б) Tm_B_О: акцептор – 2,1,3-бензоксадиазол, в) Tm_D_S: донор – дибензотиофен
Например, для чистого Tm_M степень планарности составляет 2 , 37 Å. Молекулярное допирование чаще всего приводит к увеличению степени планарности в интервале 0 , 1–1 , 9 Å. Модели допированного мелона, построенные с учетом влияния растворителя, имеют более плоскую структуру, степень планарности уменьшается в среднем на 0 , 08 Å.
Рассмотрим изменение энергетических уровней ВЗМО и НСМО (рис. 2 и табл. 1) при модификации структуры мелона ковалентно-связанными допантами, а также разность граничных орбиталей (ΔE MO = Е НСМО – Е ВЗМО ). На рис. 2 видно, что модификация структуры любыми допантами закономерно влияет на изменение Е ВЗМО . Все значения энергий далее приведены относительно Е ВЗМО недопированного мелона, равной –6,32 эВ. Введение только электрон-донорных молекул повышает Е ВЗМО на 0,43…0,68 эВ, в среднем на 0,55 эВ. Одновременное присоединение к мелону электрон-донорных и электрон-акцепторных молекул приводит к повышению Е ВЗМО в среднем на 0,48 эВ. При введении только акцепторных молекул, больший вклад в изменение Е ВЗМО вносит атомная орбиталь более электроотрицательного атома. Поэтому для допантов, содержащих атом О, наблюдаемое изменение уровня ВЗМО сильнее, чем для соединений, содержащих атомы S и Se. Введение электрон-акцепторных молекул, представленных серией 1,2,5-халькогендиазолов, понижает значение Е ВЗМО на 0,15…0,24 эВ.
Рис. 2. Распределение значений энергий граничных орбиталей Е ВЗМО , Е НСМО в зависимости от состава и характера замещения атомов H в мелоне
Простой количественной зависимости изменения энергии НСМО от состава, положения и количества вводимых допантов не обнаружено (см. рис. 2). Максимальное понижение Е НСМО наблюдается для структуры, допированной только одним электрон-акцепторным допантом – 2,1,3-бензоселенадиазолом. Для структур, допированных дибензотиофеном и карбазолом, наблюдается незначительное повышение Е НСМО , на 0,05 эВ.
Анализ разности энергий граничных орбиталей ΔE MO показывает зависимость её значений от вида и количества вводимых допантов (рис. 3). Расчетное значение ΔEMO для мелона Tm_M составляет 3,57 эВ. Отметим, что близкий результат (3,88 эВ) был получен в теоретических расчетах, опубликованных ранее [48]. В целом величина разности энергий ВЗМО и НСМО уменьшалась при введении любых исследованных допантов. Максимальное уменьшение ΔEMO отмечается для структур, допированных одновременно и электрон-донорными, и электрон-акцепторными молекулами. Так, присутствие фрагментов 2,1,3-бензоселенадиазола и карбазола уменьшает ΔE MO на 1,04 эВ по сравнению с Tm_M. Введение только одного из этих допантов уменьшает ΔE MO максимально на 0,6 эВ.
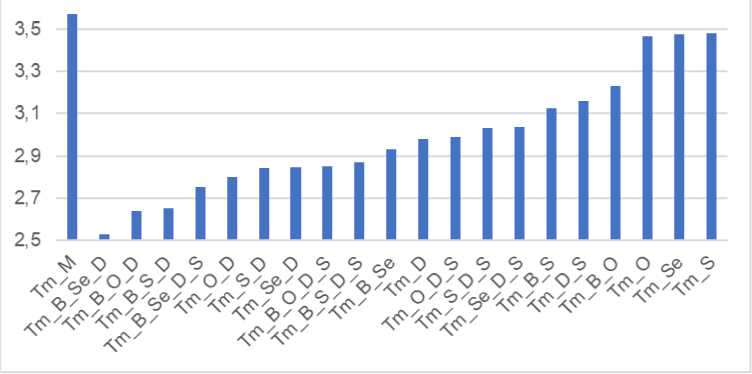
Рис. 3. Разность энергии граничных орбиталей ΔE MO , для структур с разными видами и количеством допантов
Анализ распределения электр онной плотности по молекулярным орбитал ям
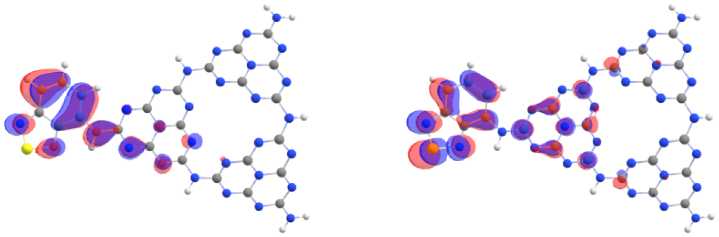
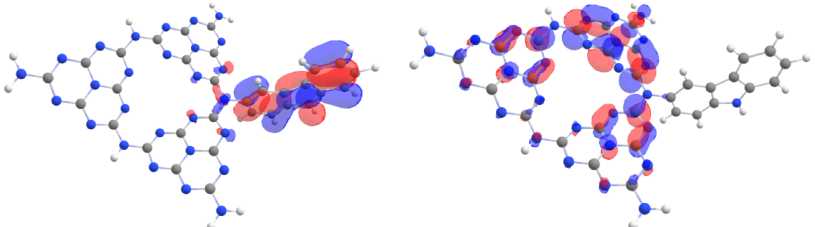
Ковалентное допирование м елона только акцептирующими электронну ю плотность бенз о- халькодиазолами приводит к смещению локализации ВЗМО в основном на акцептор (рис. 4). НСМО имеет большую площадь распределения, локализуясь одновременно и на фрагменте а к цептора, и на связанном с акцеп тором гептазиновом кольце. Допирование к арбазолом как эле к-трон- донорной молекулой приводит к локализации ВЗМ О на донорном фрагменте молекулы, при этом НСМО локализована на мелоне (рис. 5).
а)
б)
Рис. 4. Локализация ВЗМО (а) и НСМО (б) на молекуле мелона, допированной 2,1,3-бензотиадиазолом
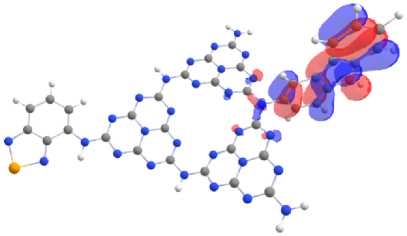
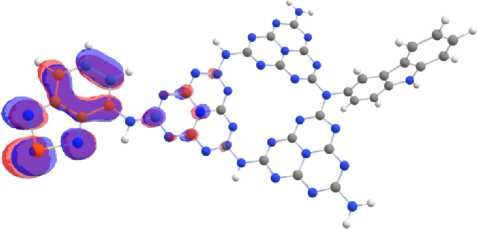
Одновременное допирование донорными и акцепторными молекулами, наиболее эффектив но уменьшающее разность грани чных молекулярных орбиталей, приводит к одинаковой закон омерности: ВЗМО оста ется локализованной на электрон -донорном фрагменте, а НСМО локализуется на электрон- акцепторном фрагменте и связанном с ним гептазиновом кольце (рис. 6). Говоря более конкретно, показано, что ВЗМО допированного мелона преимущест венно локализована на атоме N и распределена на связях С –С молекулы карбазола, а НСМО локализована на атомах N халькогенсодержащих эле ктрон -акцепторных допантов, связанных с гептазиновым фрагментом.
а)
б)
Рис. 5. Локализация ВЗМО (а) и НСМО (б) на молекуле мелона, допированной карбазолом
а) б)
Рис. 6. Локализация ВЗМО (а) и НСМО (б) на молекуле мелона, допированной молекулами 2,1,3-бензоселенадиазола и карбазола
В целом стоит отметить, что введение допантов в структуру мелона приводит не только к уменьшению ΔEMO, но и к изменению локализации ВЗМО и НСМО в структуре молекулы. Это может способствовать образованию сайтов связывания на поверхности допированной молекулы по отношению к наиболее способным к сорбции модельным молекулам. Так, были исследованы взаимодействия в комплексах, состоящих из бензилового спирта и мелона, которые являются переходными в реакциях окисления бензиловых спиртов до альдегидов с использованием фотокатализатора.
Нековалентные взаимодействия в комплексах ГНУ с молекулой бензилового спирта
Рассмотрим нековалентные взаимодействия в комплексах, образованных молекулами допи-рованного мелона и бензилового спирта ( табл . 3), и оценим прочность связывания в комплексе, используя топологические характеристики электронной плотности [55] в критических точках связи в зависимости от вида допанта. При моделировании наблюдается, что молекула бензилового спирта, как правило, ориентируется практически параллельно псевдоплоскости допированного мелона и формирует несколько связевых путей, определяемых нековалентными взаимодействиями (рис. 7). Значения электронной плотности в критических точках нековалентных связей показывают, что наиболее сильное взаимодействие наблюдается для водородной связи О–H…N–C, образованной атомом Н в молекуле спирта и вторичным атомом N в гептазиновом фрагменте.
Таблица 3
Смоделированные комплексы молекулярно-допированных структур мелона с бензиловым спиртом, энергии взаимодействия молекул E int и энергии водородных связей E НВ в соответствующих комплексах
|
№ |
Обозначение |
Структура |
Eint, ккал/моль |
EНВ, ккал/моль |
|
1 |
Tm_M |
–7,32 |
–3,92 |
|
|
2 |
Tm_B_Se |
–7,22 |
–3,84 |
|
|
3 |
Tm_D |
^^^^? |
–7,44 |
–3,94 |
Окончание табл. 3
|
№ |
Обозначение |
Структура |
E int , ккал/моль |
E НВ , ккал/моль |
|
4 |
Tm_B_Se_D |
V*frVv5»?r |
–7,22 |
–3,99 |
|
5 |
Tm_B_O |
^^^Vvy*^**^' |
–7,47 |
–3,87 |
|
6 |
Tm_B_S |
–7,37 |
–3,83 |
|
|
7 |
Tm_B_S_D |
^«*v^£у/ V- |
–7,43 |
–3,93 |
|
8 |
Tm_B_O_D |
–7,75 |
–3,98 |
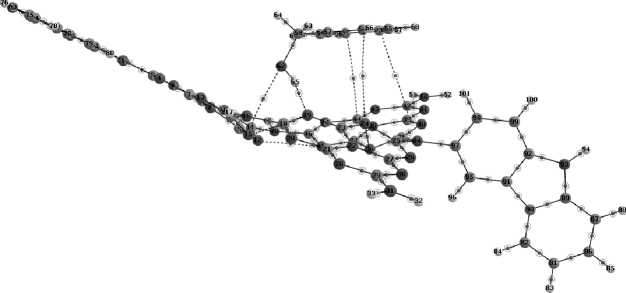
Рис. 7. Формирование связевых путей в комплексе между бензиловым спиртом и молекулой допированного мелона
Энергия взаимодействия молекул в комплексе Eint сравнивалась с энергией водородной связи EНВ, определяемой исходя из корреляции, предложенной Эспиноза с соавт. в работе [52]. Определенное отсутствие количественной корреляции энергии взаимодействия в 8 исследованных комплексах бензилового спирта и допированного мелона с энергией водородной связи говорит о том, что не только одна водородная связь О–H…N–C определяет прочность связывания молекул бензилового спирта на поверхности допированного мелона в молекулярных комплексах. По- этому нами также проведен анализ зависимости энергии взаимодействия от ЕВЗМО допированного мелона. Для комплексов, допированных карбазолом (рис. 8), с ростом ЕВЗМО энергия взаимодействия Eint меняется сильнее по сравнению с комплексами, допированными только акцепторными заместителями. В последних при повышении ЕВЗМО на 0,33 эВ энергия взаимодействия повышается на 0,25 ккал/моль.
При допировании мелона карбазолом наблюдается иная тенденция: при незначительном увеличении Е ВЗМО – на 0,02 эВ – E int увеличивается на 0,53 ккал/моль. Селенсодержащие комплексы имеют меньшие значения E int , чем комплексы с S и O. Установленная зависимость косвенно указывает на то, что нитрид углерода в образуемом комплексе с бензиловым спиртом выступает донором электронной плотности. Отмечено, что формирование более прочных комплексов может препятствовать частичному окислению спиртов. В случае допирования мелона электрон-акцепторными селенсодержащими структурами образуется промежуточный комплекс с менее прочными связями, чем с серой и кислородом, и поэтому окисление проходит более эффективно.
-7,1
-7,2
-7,3
8 -7,4
-7,5
-7,6
-7,7
-7,8
Tm_B_Se Tm_B_Se_D
Tm_M
Tm_B_S
Tm_B_S_D Tm_D
Tm_B_O
Tm_B_O_D
-6,7 -6,6 -6,5 -6,4 -6,3 -6,2 -6,1 -6,0 -5,9 -5,8
ЕВЗМО, эВ
Рис. 8. Зависимость энергии взаимодействия молекул бензилового спирта и ГНУ E int в комплексе от Е ВЗМО мелона и его допированных производных
Характеристики одномерных периодических моделей допированного мелона
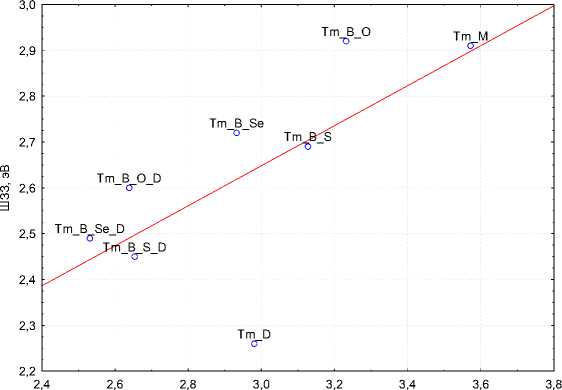
Далее мы рассмотрим 1D-полимерные модели допированного мелона, полученные с использованием периодических граничных условий, и сравним значения ширины запрещенной зоны, рассчитанные для этих полимерных структур, и величины разности энергий граничных орбиталей ΔE MO , полученные для молекулярных моделей (рис. 9, см. табл. 2). Из указанного сравнения можно оценить, насколько может быть корректен переход от газофазного кластерного расчёта к расчёту с периодическими граничными условиями и насколько полученные значения при этом переходе приближаются к экспериментальным. Значение ШЗЗ для немодифицированного полимерного мелона, равное 2,91 эВ, оказывается значительно ближе к экспериментальному (2,7 эВ, [54]), чем ΔE MO , равное 3,57 эВ, которое рассчитано для газофазного состояния. Здесь, однако, следует отметить, что расчёт равновесной геометрии полимерного мелона с необходимыми параметрами требует на порядки б о льших компьютерных ресурсов и времени, чем расчёт фрагмента мелона в газофазном состоянии.
Тем не менее, как видно из обобщающего рис. 9, прослеживается некоторая зависимость между значениями ШЗЗ и ΔE MO . Мелон, допированный кислородсодержащими гетероциклами, имеет большее значение ШЗЗ и ΔE MO . Селенсодержащие допанты, наоборот, максимально уменьшают значения ШЗЗ и ΔEMO. Однако корреляция этих значений в ряду меняющихся в допантах халькогенов (O, S, Se) низкая.
ΔE MO , эΒ
Рис. 9. Зависимость между значениями ШЗЗ и ΔE MO для исследуемых молекул
Из сравнения результатов расчётов в разных приближениях мы не можем сказать однозначно, какое допирование необходимо выполнить для максимального уменьшения ШЗЗ, так как при кластерном расчете наименьшую ΔE MO показывает мелон, допированный карбазолом и 2,1,3-бензоселенадиазолом. При периодических расчетах наименьшая ШЗЗ у мелона, допированного только электрон-донорной молекулой – карбазолом, затем следуют молекулы, допированные карбазолом и 2,1,3-бензотиадиазолом, карбазолом и 2,1,3-бензоселенадиазолом. Причем разница между ШЗЗ в двух последних случаях составляет 0,04 эВ. По рис. 9 также видно, что допирование мелона 2,1,3-бензоксадиазолом, по сравнению с другими допантами этого ряда, увеличивает ШЗЗ, даже по сравнению с недопированным мелоном.
Сравнение экспериментальных значений ШЗЗ и рассчитанных электронных свойств для ряда рассчитанных комплексов (табл. 4) показало следующее. При 5 %-ном допировании нитрида углерода бензо[c][1,2,5]халькогенадиазолами рассчитанные значения ШЗЗ и ΔE MO коррелируют с экспериментально измеренными значениями ШЗЗ 5% с коэффициентами 89 и 84 % соответственно (см. табл. 4). Изменение метода и уровня молекулярного расчета влияет на значения ΔE MO , при этом корреляция уменьшилась на 10 % при использовании метода учёта растворителя PCM и уровня HSE06/DZVP. Значения ШЗЗ и ΔE MO , полученные на уровне B3LYP/6-311+G(d,p), всегда имеют более высокое значение, чем для уровня HSE06/DZVP. Рассчитанное значение ШЗЗ для исходного ГНУ, равное 2,91 эВ, намного ближе к экспериментальным значениям 2,56 эВ [36] и 2,70 эВ [54], чем ΔE MO , рассчитанное для молекулы ГНУ в газофазном состоянии и равное 3,57 эВ.
Таблица 4
Экспериментальные и расчетные значения ШЗЗ и ΔE MO для исследуемых систем с электрон-акцепторными допантами
|
Обозначение |
ΔEMO, эВ |
EВЗМО, эВ |
Е НСМО , эВ |
ШЗЗ, эВ |
E(TVB*), эВ |
E(BVB*), эВ |
ШЗЗ 5% , эВ |
|
Tm_M |
3,57 |
–6,32 |
–2,75 |
2,91 |
–5,72 |
–2,81 |
2,56 (2,70) |
|
Tm_B_O |
3,23 |
–6,40 |
–3,16 |
2,92 |
–5,72 |
–2,80 |
2,41 |
|
Tm_B_S |
3,13 |
–6,23 |
–3,10 |
2,69 |
–5,65 |
–2,96 |
2,00 |
|
Tm_B_Se |
2,93 |
–6,13 |
–3,20 |
2,72 |
–5,65 |
–2,93 |
1,88 |
* – TVB – верхний валентный уровень, BVB – нижний виртуальный уровень.
Учитывая вышеизложенное, мы можем отметить, что результаты, полученные на обоих расчетных уровнях, приемлемо соответствуют экспериментальным данным, а именно тенденциям изменения ширины запрещенной зоны при допировании исходной структуры ГНУ электрон-акцепторными молекулами. В то же время, моделирование полимера с периодическими граничными условиями позволяет рассчитать эти значения и их тренды при допировании различными бензо[c][1,2,5]халькогенадиазолами несколько ближе к самим экспериментальным значениям и, возможно, правильно предсказать их для других электрон-акцепторных заместителей. С другой стороны, расчет равновесной геометрии полимера ГНУ требует на порядки больше компьютерных ресурсов и времени, чем расчет геометрии молекулы ГНУ в газофазном состоянии.
Заключение
Проведено моделирование структур мелона, допированного рядом гетероциклических молекул с выраженными электрон-донорными и электрон-акцепторными свойствами, в 2-х приближениях. Во-первых, мы применили подход, основанный на расчетах изолированных молекул. Во-вторых, мы использовали периодические граничные условия для моделирования 1D полимерных цепей. Сравнивая рассчитанные значения ШЗЗ и ΔEMO с экспериментальными данными для исходного и допированного ГНУ, мы пришли к выводу, что газофазные молекулярные расчеты больше подходят для качественной оценки трендов ΔE MO . Расчеты же полимерных цепей с периодическими граничными условиями дают удовлетворительные количественные зависимости ШЗЗ от вида и количества вводимого допанта. Одновременное допирование мелона электрон-донорными молекулами карбазола и электрон-акцепторными молекулами 2,1,3-бензохалькодиазолов максимально уменьшает разность энергий граничных орбиталей, а допирование только карбазолом максимально снижает ширину запрещенной зоны в рассмотренном ряду соединений.
Анализ распределения молекулярных орбиталей показал, что при эффективном допировании, максимально сужающем ΔE MO, ВЗМО локализовано на электрон-донорном фрагменте молекулы, а НСМО – на электрон-акцепторном фрагменте молекулы, что способствует быстрому рекомбинированию разделенных зарядов.
Допированные структуры ГНУ способны к образованию комплексов с бензиловым спиртом, образуемых за счет разных видов нековалентных взаимодействий. Селенсодержащие допанты ГНУ являются более подходящими молекулами для модификации катализатора в реакциях частичного окисления бензиловых спиртов.
Список литературы Ковалентное допирование нитрида углерода карбазолом и бензохалькодиазолами: моделирование электронных свойств в альтернативных приближениях
- Zou Z., Ye J., Sayama K. et al. // Nature. 2001. V. 414, No. 6864. P. 625. DOI: 10.1038/414625a.
- Kapilashrami M., Zhang Y, Liu Y.S. et al. // Chem. Rev. 2014. V. 114, No. 19. P. 9662. DOI: 10.1021/cr5000893.
- Lan Y, Lu Y, Ren Z. // Nano Energy. 2013. V. 2, No. 5. P. 1031. DOI: 10.1016/j.nanoen.2013.04.002.
- Wang H. Investigations into carbon nitrides and carbon nitride derivatives. Ludwig-MaximiliansUniversität München, 2013. 121 p.
- Keßler F.K. Structure and reactivity of s-triazine-based compounds in C/N/H chemistry. Ludwig-Maximilians-Universität München, 2019. 222 p.
- Jürgens B., Irran E, Senker J. et al. // J. Am. Chem. Soc. 2003. V. 125, No. 34. P. 10288. DOI: 10.1021/ja0357689.
- Y. Wang T.M. // J. Mater. Chem. C. 2016. V. 4. P. 6200. DOI: 10.1039/C6TC01860B.
- Knyazeva E.A., Rakitin O.A. // Russ. Chem. Rev. 2016. V. 85, No. 10. P. 1146. DOI: 10.1070/RCR4649.
- Zhang J., Zhang M., Lin S. et al. // J. Catal. 2014. V. 310. P. 24. DOI: 10.1016/j.jcat.2013.01.008.
- Schwab M.G., Hamburger M., FengX. et al. // Chem. Commun. 2010. V. 46, No. 47. P. 8932. DOI: 10.1039/C0CC04057F.
- Kailasam K., Schmidt J., Bildirir H. et al. // Macromol. Rapid Commun. 2013. V. 34, No. 12. P. 1008. DOI: 10.1002/marc.201300227.
- Yu Y, Yan W., Gao W. et al. // J. Mater. Chem. A. 2017. V. 5, No. 33. P. 17199. DOI: 10.1039/C7TA05744J.
- Zhang J., An X., Lin N. et al. // Carbon. 2016. V. 100. P. 450. DOI: 10.1016/j.carbon.2016.01.027.
- Cao J., Wu Q., Zhao Y. et al. // Appl. Catal., B. 2021. V. 285. P. 119817. DOI: 10.1016/j.apcatb.2020.119817.
- Shiraishi Y., Kanazawa S., Kofuji Y. et al. // Angew. Chem., Int. Ed. Engl. 2014. V. 53, No. 49. P. 13454. DOI: 10.1002/anie.201407938.
- Guo Y., Chu S., Yan S. // Chem. Commun. 2010. V. 46, No. 39. P. 7325. DOI: 10.1039/c0cc02355h.
- Chu S, Wang Y, Guo Y. et al. // ACS Catal. 2013. V. 3, No. 5. P. 912. DOI: 10.1021/cs4000624.
- Liu P., Sun N, Liang Y. et al. // Res. Chem. Interned. 2018. V. 44, No. 2. P. 843. DOI: 10.1007/s11164-017-3139-5.
- Chen Z, Sun P, Fan B. et al. // Appl. Catal., B. 2015. V. 170-171. P. 10. DOI: 10.1016/j.apcatb.2015.01.024.
- Fan X., Zhang L., Cheng R. et al. // ACS Catal. 2015. V. 5, No. 9. P. 5008. DOI: 10.1021/acscatal.5b01155.
- Ho W, Zhang Z., Lin W. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7, No. 9. P. 5497. DOI: 10.1021/am509213x.
- Qin J., Wang S, Ren H. et al. // Appl. Catal., B. 2015. V. 179. P. 1. DOI: 10.1016/j.apcatb.2015.05.005.
- Zhang J., Chen X., Takanabe K. et al. // Angew. Chem., Int. Ed. Engl. 2010. V. 49, No. 2. P. 441. DOI: 10.1002/anie.200903886.
- Zheng Q., Durkin D.P., Elenewski J.E. et al. // Environ. Sci. Technol. 2016. V. 50, No. 23. P. 12938. DOI: 10.1021/acs.est.6b02579.
- Gao B., Wang J., Dou M. et al. // Sep. Purif. Technol. 2020. V. 241. P. 116576. DOI: 10.1016/j.seppur.2020.116576.
- Zheng D., Pang C., Liu Y. // Chem. Commun. 2015. V. 47. P. 9706. DOI: 10.1039/C5CC03143E.
- Chen Y., Zhang J., Zhang M. et al. // Chem. Sci. 2013. V. 4, No. 8. P. 3244. DOI: 10.1039/c3sc51203g.
- Zhang G., WangX. // J. Catal. 2013. V. 307. P. 246. DOI: 10.1016/j.jcat.2013.07.026.
- Kailasam K., Mesch M.B., Mohlmann L. et al. // Energy Technol. 2016. V. 4, No. 6. P. 744. DOI: 10.1002/ente.201500478.
- Li K., Zhang W. // Small. 2018. V. 14, No. 12. P. 1703599. DOI: 10.1002/smll.201703599.
- Fan X., Zhang L., Wang M. et al. // Appl. Catal., B. 2016. V. 182. P. 68. DOI: 10.1016/j.apcatb.2015.09.006.
- Zhang J., Zhang G., Chen X. et al. // Angew. Chem., Int. Ed. Engl. 2012. V. 51, No. 13. P. 3183. DOI: 10.1002/anie.201106656.
- Ye C., Li J.X., Li Z.J. et al. // ACS Catal. 2015. V. 5, No. 11. P. 6973. DOI: 10.1021/acscatal.5b02185.
- Zhang S., Li J., Wang X. et al. // J. Mater. Chem. A. 2015. V. 3, No. 18. P. 10119. DOI: 10.1039/C5TA00635J.
- Ong W.J., Tan L.L., Ng Y.H. et al. // Chem. Rev. 2016. V. 116, No. 12. P. 7159. DOI: 10.1021/acs.chemrev.6b00075.
- Chernukha A., Zirnik G., Mustafina K. et al. // Bulletin of the South Ural State University. Ser. Chemistry. 2022. V. 14, No. 4. P. 96. DOI: 10.14529/chem220410.
- Tyborski T., Merschjann C., Orthmann S. et al. // J. Phys.: Condens. Matter. 2013. V. 25, No. 39. P. 395402. DOI: 10.1088/0953-8984/25/39/395402.
- Thomas A., Fischer A., Goettmann F. et al. // J. Mater. Chem. 2008. V. 18, No. 41. P. 4893. DOI: 10.1039/b800274f.
- Zambon A., Mouesca J.M., Gheorghiu C. et al. // Chem. Sci. 2016. V. 7, No. 2. P. 945. DOI: 10.1039/C5SC02992A.
- Melissen S., Steinmann S.N., Le Bahers T. et al. // J. Phys. Chem. C. 2016. V. 120, No. 43. P. 24542. DOI: 10.1021/acs.jpcc.6b06335.
- Chen Z, Sun P, Fan B. et al. // Appl. Catal., B. 2015. V. 170-171. P. 10. DOI: 10.1016/j.apcatb.2015.01.024.
- Silva A.M., Rojas M.I. // Comput. Theor. Chem. 2016. V. 1098. P. 41. DOI: 10.1016/j.comptc.2016.11.004.
- Melissen S., Le Bahers T., Steinmann S.N. et al. // J. Phys. Chem. C. 2015. V. 119, No. 45. P. 25188. DOI: 10.1021/acs.jpcc.5b07059.
- Steinmann S.N., Melissen S.TAG, Le Bahers T. et al. // J. Mater. Chem. A. 2017. V. 5, No. 10. P. 5115. DOI: 10.1039/C6TA08939A.
- Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 16 Revision C.01. 2016.
- Tomasi J, Mennucci B, Cammi R. // Chem. Rev. 2005. V. 105, No. 8. P. 2999. DOI: 10.1021/cr9904009.
- Dovesi R., Erba A, Orlando R. et al. // Wiley Interdiscip. Rev.: Comput. Mol. Sci. 2018. V. 8, No. 4. P. 1360. DOI: 10.1002/wcms.1360.
- Li K., Zhang W.D. // Small. 2018. V. 14, No. 12. P. 1703599. DOI: 10.1002/smll.201703599.
- Krukau A.V., Vydrov O.A., Izmaylov A.F. et al. // J. Chem. Phys. 2006. V. 125, No. 22. P. 224106. DOI: 10.1063/1.2404663.
- Vilela Oliveira D., Laun J., Peintinger M.F. et al. // J. Comput. Chem. 2019. V. 40, No. 27. P. 2364. DOI: 10.1002/jcc.26013.
- Balabin R.M. // J. Chem. Phys. 2008. V. 129, No. 16. P. 164101. DOI: 10.1063/1.2997349.
- Espinosa E, Molins E, Lecomte C. // Chem. Phys. Lett. 1998. V. 285, No. 3-4. P. 170. DOI: 10.1016/S0009-2614(98)00036-0.
- Chemcraft - graphical software for visualization of quantum chemistry computations. Version 1.8, build 654. https://www.chemcraftprog.com.
- Wang X., Maeda K., Thomas A. et al. // Nat. Mater. 2009. V. 8, No. 1. P. 76. DOI: 10.1038/nmat2317.
- Bader R.F.W. Atoms in Molecules: A Quantum Theory. Clarendon Press; 1990. 438 p.


