Краткосрочные результаты химиолучевой терапии больных раком слизистой оболочки ротоглотки с использованием ускоренного гипофракционирования дозы облучения
Автор: Раджапова Мария Уруновна, Гулидов Игорь Александрович, Севрюков Феликс Евгеньевич, Гордон Константин Борисович, Семенов Алексей Владимирович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.16, 2017 года.
Бесплатный доступ
Цель исследования - оценка острой токсичности и эффективности методики ускоренного гипофракционирования химиолучевой терапии больных раком ротоглотки. Материал и методы. Клинические наблюдения представлены 54 пациентами с морфологически подтвержденным диагнозом первичного рака слизистой оболочки органов ротоглотки II-IV стадии. Всем пациентам проводилась неоадъювантная полихимиотерапия по схеме PF с последующей самостоятельной лучевой терапией. Использована методика облучения 2,4 Гр за фракцию пять раз в неделю до 62,4 Гр на зоны высокого риска и до 45,6-48 Гр на зоны низкого риска. Результаты. Ответ на неоадъювантную химиотерапию получен в 75,9 % случаев. Стабилизация процесса достигнута у 24,1 % больных. После ускоренной гипофракционированной лучевой терапии ответ опухоли отмечен у 50 (92,6 %), стабилизация - у 4 (7,4 %) пациентов. Полная регрессия выявлена у 38 (76,0 %), частичная - у 12 (24,0 %) больных с объективным ответом. Общая однолетняя выживаемость составила 83,8 %. Частота мукозитов III степени выявлена в 38 (70,4 %), II степени - в 16 (29,6 %) случаях. Вынужденный перерыв в лечении осуществлен у 33 (61,1 %) пациентов. В среднем длительность перерыва равнялась 14,2 ± 2,4 сут. Различия выживаемости у больных, пролеченных с перерывом и при непрерывном лучевом лечении, статистически незначимы (р=0,418). Общая однолетняя выживаемость составила 88,9 и 70,0 % соответственно. Заключение. Оценка краткосрочных результатов и первый опыт изучения методики ускоренного гипофракционирования 2,4 Гр для лечения рака ротоглотки не позволяет нам сделать однозначных выводов. Необходимо динамическое наблюдение за пациентами на предмет оценки поздней токсичности и долгосрочных результатов эффективности терапии.
Ускоренное гипофракционирование, рак ротоглотки, острая токсичность, химиолучевая терапия, ускоренная репопуляция
Короткий адрес: https://sciup.org/140254148
IDR: 140254148 | УДК: 616.31+616.321]-006.6-08:615.849.1:615.28 | DOI: 10.21294/1814-4861-2017-16-6-18-24
Текст научной статьи Краткосрочные результаты химиолучевой терапии больных раком слизистой оболочки ротоглотки с использованием ускоренного гипофракционирования дозы облучения
Ротоглотка является одной из наиболее частых локализаций плоскоклеточного рака органов головы и шеи (ПРГШ). Причем на фоне снижения общей частоты ПРГШ в мире частота развития рака ротоглотки растет преимущественно за счет опухоли, ассоциированной с вирусом папилломы человека [1, 2]. С 2002 по 2012 г. в базе данных SEER зарегистрирован 149 301 случай рака головы и шеи. Отмечено снижение данного заболевания в целом на 0,22 % в год (р=0,0549), уменьшение числа рака гортани на 1,9 % в год (р<0,0001) и увеличение частоты развития рака ротоглотки на 2,5 % в год (р<0,0001) [3].
Несмотря на определенные успехи, проблема достижения локального контроля при раке ротоглотки остается актуальной. В 2015 г. в России в поздних стадиях (III–IV) выявлены 80,5 % новообразований фарингеальной области. При этом удельный вес больных с запущенным опухолевым процессом (IV стадия) от числа больных с впервые установленным диагнозом злокачественного новообразования составил 43,2 %. Настораживает высокая одногодичная летальность, составляющая для данной патологии 40,7 % [4].
Существующие подходы к лечению рака ротоглотки основаны на выборе оптимального метода,
направленного на достижение онкологического результата при сохранении функции органа и без ухудшения качества жизни пациента. Хирургическое лечение и лучевая терапия в различной последовательности с добавлением системной терапии являются основными методами лечения данного заболевания [5].
При лучевой терапии выбор оптимального фракционирования определяется биологическим статусом опухоли [6]. Для ПРГШ характерно наличие ускоренной репопуляции опухолевых клеток в процессе традиционной фракционированной лучевой терапии в среднем на 4 ± 1 нед [7]. Это отрицательно сказывается на локальном контроле. Поэтому возникает необходимость в дозно-временной оптимизации лучевого лечения. С точки зрения радиобиологии перспективны в этом плане режимы ускоренного гипофракционирования дозы облучения, позволяющие сократить время облучения и преодолеть негативное влияние ускоренной репопуляции опухоли на локальный контроль [7–9].
Доказаны преимущества ускоренных режимов гипофракционирования для лечения начальных стадий рака гортани по сравнению с традиционным фракционированием без увеличения токсичности [10–12]. Имеются сообщения об улучшении локального контроля и выживаемости при ускоренном гипофракционировании химиолучевой терапии рака органов фарингеальной области, полости рта с токсичностью, сопоставимой или превышающей таковую при традиционном фракционировании [13–16]. Анализ данных литературы свидетельствует о терапевтической перспективности методик ускоренного гипофракционирования в современных протоколах лечения ПРГШ, и, следовательно, изучение данной проблемы представляется актуальным.
Целью исследования является оценка острой токсичности и краткосрочных результатов эффективности методики ускоренного гипофракционирования химиолучевой терапии больных раком ротоглотки.
Материал и методы
Работа выполнена в соответствии со стандартами надлежащей клинической практики и соблюдением этических принципов проведения научных медицинских исследований. Обязательным условием включения в исследование являлось наличие оформленного информированного согласия. Клинические наблюдения представлены 54 пациентами с морфологически подтвержденным диагнозом первичного рака слизистой оболочки органов ротоглотки (таблица). Средний возраст больных составил 57,7 ± 4,5 года. У всех больных диагностирован плоскоклеточный рак различной степени дифференцировки. Степень распространенности злокачественного процесса и определение стадийности опухолевого поражения проводили согласно Международной классификации опухолей по системе TNM (AJCC 7-е изд., 2010). Оценка общего состояния проводилась по шкале Карновского.
Всем пациентам проводилась неоадъювантная системная полихимиотерапия (2 цикла) по схеме PF (цисплатин – 100 мг/м2, 5-фторурацил – 1000 мг/м2) с интервалом 3 нед. Дистанционная лучевая терапия (ДЛТ) начиналась через 3 нед после второго курса химиотерапии на облучательных установках «Терабалт» с использованием объемного планирования (3D). Топометрическая подготовка пациентов для планирования ДЛТ проводилась на спиральном компьютерном томографе с шагом исследования 5 мм с использованием иммобилизирующих приспособлений (подголовник, термомаска).
В качестве методики облучения применили ускоренное гипофракционирование 2,4 Гр за фракцию 5 раз в неделю до суммарной очаговой дозы (СОД) 62,4 Гр на зоны высокого риска (EQD2=67,4 Гр). При расчете биологически эквивалентной дозы (BED) принимали значение коэффициента α/β для поздно реагирующих тканей, равное 3,0 Гр [17]. При этом BED для позднего эффекта составила 112,3 Гр, что несколько меньше по сравнению с традиционным фракционированием (2 Гр за фракцию до 70 Гр), где BED равнялась 116,7 Гр. Превентивное облучение регионарных лимфоколлекторов проводили до СОД 45,6–48 Гр (EQD2=49,4–51,6 Гр). Пациентам с неполной регрессией регионарных метастазов выполнялось плановое иссечение лимфатических узлов через 4–6 нед после завершения лучевой терапии. В случае выявления остаточной опухоли либо локального и/или регионарного рецидива больным выполнялось органосохраняющее
Таблица
Характеристика пациентов по TNM и локализации опухоли
Показатели Частота
Распределение больных по TNM
Лучевая терапия проводилась на фоне сопроводительной терапии, включая нутритивную поддержку с первых дней лечения. Вынужденный перерыв в лечении допускался при возникновении тяжелых острых лучевых реакций со стороны слизистой оболочки, препятствующих проведению непрерывного курса ДЛТ. Длительность перерыва и величина СОД, подведенная к опухоли до перерыва, фиксировались. После завершения лечения все больные находились под динамическим наблюдением. Апробация методики проводится в рамках проспективного контролируемого исследования (2015–17 гг.). Оценка острой токсичности проводимой терапии была дана в соответствии со шкалой EORTC/RTOG. Общий ответ на лечение оценивали согласно критериям RECIST (версия 1.1. 2009).
Статистический анализ данных проводили с использованием программы Statistica 10. При анализе количественных показателей рассчитывались среднее значение и стандартное отклонение (М±SD). Качественные показатели представлены частотами в процентах. Анализ выживаемости проводился по методу Каплана – Мейера. Сравнение кривых выживаемости выполняли с помощью логрангового критерия. Критическим уровнем статистической значимости принималось значение менее 0,05.
Результаты
Острые лучевые реакции
Наиболее частым и ранним токсическим осложнением химиолучевого лечения ПРГШ, ограничивающим его радикальность, являются тяжелые мукозиты III–IV степени, частота развития которых достигает 70 % и более [18]. В связи с этим оценка состояния слизистой оболочки ротоглотки при апробации методики ускоренного гипофракционирования являлась определяющей и проведена у всех 54 пациентов.
В процессе лучевой терапии ускоренным гипофракционированием дозы облучения 2,4 Гр частота развития тяжелых мукозитов III степени составила 70,4 % (n=38). Мукозиты II степени имели место в 16 (29,6 %) наблюдениях. Время стихания симптоматики острой токсичности после лечения равнялось 3–4 нед. Следует отметить, что у 33 (61,1 %) пациентов с выраженной симптоматикой мукозитов III степени, несмотря на интенсивную терапию сопровождения, в лечении был вынужденный перерыв (в среднем – 14,2 ± 2,4 сут).
Краткосрочные результаты эффективности
Мы получили ответ на неоадъювантную химиотерапию в 75,9 % случаев. У 24,1 % больных была отмечена стабилизация процесса. Индекс Карновского после неоадъювантной химиотерапии в среднем составил 80 баллов. После лучевой терапии ускоренным гипофракционированием 2,4 Гр ответ опухоли получен у 50 (92,6 %), стабилизация – у 4 (7,4 %) пациентов. Полная регрессия выявлена – у 38 (76,0 %), частичная – у 12 (24,0 %) больных с объективным ответом.
Анализ общей выживаемости
Медиана наблюдения за пациентами равнялась 12 мес. На графике кривой выживаемости видно, что большинство больных доживает до одного года наблюдения (рис. 1). Общая однолетняя выживаемость составила в целом по группе 83,8 %. У 7 (12,9 %) пациентов в течение одного года возникли рецидивы опухоли, у 1 (1,9 %) больного диагностированы множественные метастазы в кости скелета. Остаточные регионарные метастазы и их продолженный рост отмечены у 11 (20,4 %) больных. Более детальный анализ показателей
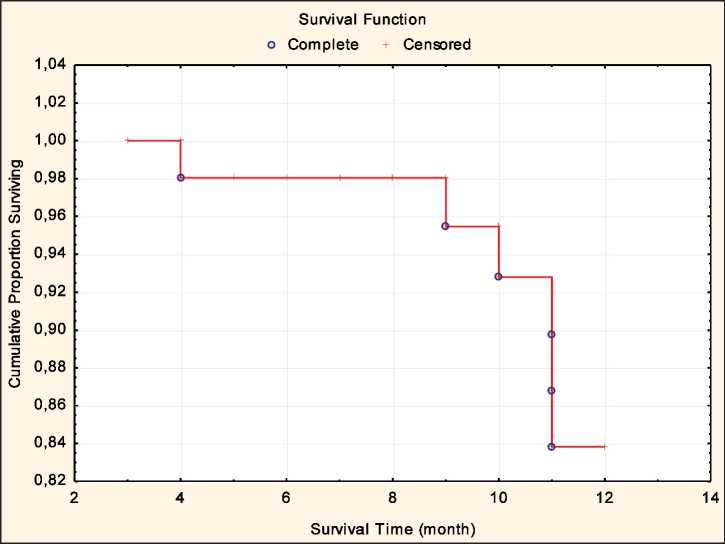
Рис. 1. Показатели общей выживаемости по Каплану – Мейеру после лучевой терапии ускоренным гипофракционированием 2,4 Гр в целом по группе (n=54)
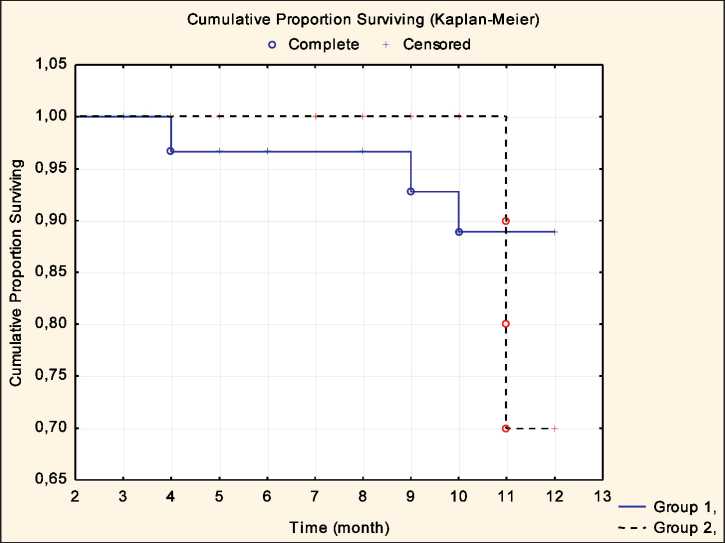
Рис. 2. Показатели общей выживаемости по Каплану – Мейеру у больных с вынужденным перерывом (сплошная линия – группа 1, n=33) и без перерыва в лечении (пунктирная линия – группа 2, n=21). Log Rank=0,418
эффективности лечения будет представлен по результатам дальнейшего наблюдения. Различия выживаемости в течение первого года наблюдения у больных с вынужденным перерывом в лечении и при непрерывной лучевой терапии статистически незначимы (р=0,418) – общая однолетняя выживаемость составила 88,9 и 70,0 % соответственно (рис. 2).
Обсуждение
С учетом радиобиологических характеристик ПРГШ активно исследуются ускоренные режимы фракционирования лучевой терапии. Перспективным является применение ускоренного гипофракционирования с уменьшением общего времени лечения – одного из основных факторов, определяющих эффективность терапии ПРГШ. Доказана корреляция локального контроля с общим временем лечения и продолжительностью перерыва [19]. Показано, что удлинение времени терапии с 46 до 51 дня статистически значимо увеличило частоту локорегионарных рецидивов на 14 % [20]. Отмечено отрицательное влияние продления лучевой терапии и на общую выживаемость [21]. При общем времени лечения ≤51 и >51 дня время жизни пациентов после химио-лучевого лечения составило 52,2 и 41,2 мес соответственно (р<0,041) [22]. В нашем исследовании при ускоренном гипофракционировании 2,4 Гр за фракцию у значительной части больных в лечении был вынужденный перерыв, что, естественно, привело к увеличению времени радикального курса лучевой терапии. Воздействие перерыва за наблюдаемый период не достигло уровня статистической значимости. Однако это не означает, что негативного влияния данного фактора на самом деле нет. Показано, что репопуляция опухолевых клеток происходит быстрее во время перерыва, и для её подавления необходима доза 0,75 Гр/ день. В процессе традиционной лучевой терапии для компенсации данного явления достаточно 0,2 Гр/день [19]. В нашем случае симптоматика острой токсичности со стороны слизистой оболочки ротоглотки препятствовала дальнейшему проведению лучевой терапии. Поэтому мы были вынуждены сделать перерыв. У 14 (42,4 %) пациентов вынужденный перерыв осуществлен на СОД <36 Гр. У 19 (57,6 %) больных большая часть предписанной дозы была подведена до перерыва и равнялась ≥36 Гр. Гипотетически можно предположить, что у части больных с большей дозой облучения до перерыва негативное влияние ускоренной репопуляции опухоли на клинический результат снижается. Однако это лишь предположение, требующее дополнительных исследований.
При ускоренном гипофракционировании 2,4 Гр за фракцию мы получили высокий ответ опухоли с меньшим риском неблагоприятного исхода на протяжении первого года наблюдения. Однако имело место усиление острой токсичности. Это потребовало интенсификации сопроводительной терапии в процессе лечения, что способствовало полному завершению лучевого лечения у всех пациентов. В литературе имеются сообщения об усилении острых лучевых реакций при увеличении дозы за фракцию. Частота тяжелых мукозитов составила 78 % при химиолучевом лечении ПРГШ с использованием дозы 2,5 Гр и 2,75 Гр за фракцию [14, 15]. Таким образом, частота и степень токсичности в нашем исследовании не были экстраординарными при сравнении с данными других авторов.
Краткосрочность результатов и первый опыт изучения методики ускоренного гипофракционирования 2,4 Гр для лечения рака ротоглотки не позволяют нам сделать однозначных выводов. Необходимо динамическое наблюдение за пациентами с целью оценки поздней токсичности и долгосрочных результатов эффективности терапии.
Заключение
Собственные результаты и данные литературы свидетельствуют о перспективности использования ускоренного гипофракционирования дозы облучения в схеме химиолучевого лечения больных раком ротоглотки. Предпочтение следует отдавать
Список литературы Краткосрочные результаты химиолучевой терапии больных раком слизистой оболочки ротоглотки с использованием ускоренного гипофракционирования дозы облучения
- Chaturvedi A.K., Anderson W.F., Lortet-Tieulent J., Curado M.P., Ferlay J., Franceschi S., Rosenberg P.S., Bray F., Gillison M.L. Worldwide trends in incidence rates for oral cavity and oropharyngeal cancers. J Clin Oncol. 2013 Dec 20; 31 (36): 4550-9. DOI: 10.1200/JCO.2013.50.3870
- Gooi Z., Chan J.Y., Fakhry C. The epidemiology of the human papillomavirus related to oropharyngeal head and neck cancer. Laryngoscope. 2016 Apr; 126 (4): 894-900. DOI: 10.1002/lary.25767
- Mourad M., Jetmore T., Jategaonkar A.A., Moubayed S., Moshier E., Urken M.L. Epidemiological Trends of Head and Neck Cancer in the United States: A SEER Population Study. J Oral Maxillofac Surg. 2017 Dec; 75 (12): 2562-72. DOI: 10.1016/j.joms.2017.05.008
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2015 году. М., 2016; 236.
- National Comprehensive Cancer Network Guidelines. URL: http://www.nccn.org/professionals/physician_gls/pdf/cns.pdf (дата обращения: 01.10.2017).


