Кремний и гуминовые кислоты: моделирование взаимодействий в почве
Автор: Офицеров Е.Н., Рябов Г.К., Убаськина Ю.А., Климовский А.Б., Фетюхина Е.Г.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-2 т.13, 2011 года.
Бесплатный доступ
Изучены физико-химические процессы, протекающие при контакте гуминовых кислот с кислородными соединениями кремния, а также описаны свойства образующихся при этом продуктов. Обсуждается роль полученных растворимых и нерастворимых веществ в регуляции агрофизических и агрохимических свойств почв. Показано, что баланс концентраций кремниевых соединений и гуминовых кислот во многом определяет формирование почвы, ее структуру, свойства и влияет на ее функционирование.
Кремний, гуминовые кислоты, агрофизические и агрохимические свойства почв
Короткий адрес: https://sciup.org/148200168
IDR: 148200168 | УДК: 631.41:631.811
Текст научной статьи Кремний и гуминовые кислоты: моделирование взаимодействий в почве
материала, ухудшается минералогический состав почвы.
Тем не менее, мало изученным остается вопрос взаимного влияния всех форм кремниевых соединений и гуминовых кислот в почве, тогда как ответ на него может оказаться актуальным для решения остро стоящей проблемы создания и поддержания почвенного слоя на местах сбора промышленных и бытовых отходов, шлама и переработанной руды.
В связи с этим, целью данного исследования явилось изучение физико-химических процессов, протекающих при контакте кремнекислородных соединений с гуминовыми кислотами, и свойств образующихся при этом продуктов.
Объектами исследования были выбраны: диатомит - кремнистая порода, содержащая значительное количество растворимого кремнезема (Инзенское месторождение, Ульяновская область), кварцевый песок (Кучурский карьер, Ульяновская область), глина (Ляховское месторождение, Ульяновская область), промышленный золь кремнезема, состоящий из моно-, олиго- и поликремниевых кислот с низкой молекулярной массой, стабилизированный органическими веществами (Na2O . 85SiO2, содержание сухого вещества 30%, ρ =1.20 г/см3, рН 11), гуминовые кислоты, выделенные по методике, приведенной в работе [13], из товарного образца почвы, обогащенной компостированным торфом (рН 7.2, содержание органического углерода 19,7 %, потери после прокаливания 29,7%).
Химический состав диатомита и глины определяли рентгеноспектральным методом. При анализе состава полученных нами гуминовых кислот использовали собственные и литературные характеристики ИК-спектроскопии [12], а также данные по элементному составу и моле- кулярные формулы гуминовых кислот, приведенные в работе [11].
Растворимость кремнезема диатомита в воде изучали по методике, изложенной в [1], растворимые формы кремнезема - моно- и олигокрем-ниевые кислоты, определяли методом синего кремнемолибденового комплекса, приведенным в работе [5]. Полученные данные по содержанию кремниевых кислот пересчитывали на концентрацию кремнезема.
Степень перехода кремнезема диатомита в растворы пирокатехина и гуминовых кислот изучали следующим образом. Диатомит предварительно дробили на шаровой мельнице, достигнув при этом максимальной для данного прибора степени измельчения 4.07 (что соответствует размеру частиц в пределах 0.16-6.30 мкм), для увеличения поверхностного контакта кремнезема с раствором органического реагента. Далее использовали методику, приведенную в работе [23], с нашими дополнениями: при гравиметрическом определении кремнезема в насыщенном растворе гуминовых кислот мы учитывали их зольность.
Для изучения влияния гуминовых кислот на стабилизацию растворенных форм кремнезема, была исследована зависимость критического времени гелеобразования в растворе кремнезема от концентрации в нем гуминовых кислот.
Раствор кремнезема готовили путем нейтрализации жидкого стекла, полученного выщелачиванием из диатомита (кремниевый модуль 0.34, содержание сухого вещества 4.13%, ρ =1.06 г/см3), 1н. серной кислотой.
Выделенные ранее гуминовые кислоты высушивали при 25°С.
Гуминовые кислоты в концентрации от 0 до 10 вес. % добавляли к жидкому стеклу до нейтрализации его серной кислотой.
Измеряли кинематическую вязкость растворов кремнезема и гуминовых кислот через определенные промежутки времени, вплоть до начала процесса гелеобразования – то есть до перехода моно-кремниевой кислоты в олигокремниевые, а затем в коллоидные поликремниевые кислоты с высокой молекулярной массой и далее в гель кремнезема, что проявлялось в резком повышении вязкости раствора. По полученным данным строили графики изменения кинематической вязкости растворов во времени для каждой концентрации гуминовых кислот. Графически в точке пересечения касательных к полученным кривым определяли критическое время гелеобразования для каждого значения концентрации гуминовых кислот. Затем, используя полученные значения, строили кривую и проводили регрессионный анализ зависимости критического времени гелеобразования в растворе от концентрации в нем гуминовых кислот.
Синтез аммонийной соли трипирокатехинового эфира монокремниевой кислоты на основе кремнийсодержащего материала вели, опираясь на методику, приведенную в работе [23].
Рассчитывали количество кремнеземсодер-жащего материала в пересчете на его растворимую форму – монокремниевую кислоту Si(OH)4, для синтеза по реакции:
3С6H4(OH)2 + Si(OH)4 + 2NH4OH → (C6H4O2)3Si(NH4)2+ 6H2O
Для получения необходимой концентрации 145 г/л, промышленный золь кремнезема, объемом 8.16 мл разбавляли водой до 20 мл, помещали в трехгорлую 250 мл колбу, добавляли 20 мл воды и 15.5 г пирокатехина. После нагревания на флегме с аргоном в течение 1 ч 30 мин., аммиак пропускали через раствор до обесцвечивания и полного растворения геля (1 ч 20 мин). При охлаждении из раствора выпали кристаллы, которые очищали ацетоном. Полученный продукт (12.18 г) был проанализирован на элементный состав и исследован его ИК-спектр.
При синтезе аммонийной соли трипирокатехинового эфира монокремниевой кислоты из диатомита, 3.21 г диатомита, 15.5 г пирокатехина, 36 мл воды нагревали 4 ч на флегме с аргоном. Затем пропускали аммиак через смесь в течение 1 ч 30 мин. и полученный раствор отфильтровали. Выпавшие из горячего раствора кристаллы очищали ацетоном. Производили анализ элементного состава продукта (5 г) и регистрировали его ИК-спектр.
Синтез аммонийной соли гуминового эфира монокремниевой кислоты вели следующим образом. Кремнеземсодержащее вещество (диатомит, глину и золь кремнезема) добавляли к насыщенному раствору гуминовых кислот в массовом соотношении “кремний : гуминовые кислоты” – 1 : 3. Выделенные сухие гуминовые кислоты измельчали в ступке и 20 г полученного порошка растворяли в 300 мл воды (рН 13, NH3) с образованием насыщенного раствора. Кремнеземсодержащий материал (3 г) помещали в колбу с обратным холодильником и смешивали с 135 мл насыщенного раствора гуминовых кислот. После нагревания на водяной бане в течение 45 мин для увеличения скорости реакции горячую смесь пропускали через бумажный фильтр. Фильтраты высушивали при 25°С. Производили анализ элементного состава и снимали ИК-спектр сухого остатка.
Проведенный нами рентгеноспектральный анализ диатомита показал наличие в нем 90.2% кремнезема, что согласуется с литературными данными по составу и свойствам диатомита Инзенского месторождения [7, 15]. Максимальная величина его растворимости в воде составила
Таблица 1. Изменение степени перехода кремнезема диатомита, %, в насыщенные растворы пирокатехина и гуминовых кислот по времени
|
Органичес кое вещество |
Время опыта, сутки |
||
|
0* |
5 |
10 |
|
|
Пирокатехин |
2.6 |
3.6 |
4.9 |
|
Гуминовые кислоты |
33.8 |
40.7 |
45.6 |
* начало эксперимента
всего 0.00520 ± 0.00022%. Однако, как показывают результаты наших экспериментов, количество кремнезема, переходящее в раствор, может быть существенно увеличено при добавлении к нему органических веществ с вицинальными ОН-группами, в частности пирокатехина и гуминовых кислот. Расчетные данные изменения степени перехода кремнеземадиатомита в насыщенные растворы пирокатехина и гуминовых кислот от времени выдержки кремнезема в растворе приведены в табл 1.
Изучение взаимного влияния кремнезема и гуминовых кислот в растворе показало, что повышение содержания гуминовых кислот в растворе от 0 до 3-3.8%, при постоянной концентрации кремнезема, вызывает увеличение критического времени гелеобразования кремнезема. То есть в данном диапазоне концентраций гуминовые кислоты стабилизируют растворимые формы кремнезема. При концентрации гуминовых кислот более 3.8%, критическое время гелеобразования кремнезема уменьшается из-за совместной коагуляции золя кремнезема и гуминовых кислот. Коагуляция происходит как вследствие повышения содержания гуминовых кислот в растворе, так и из-за увеличения концентрации в нем кремнезема. При этом формируются малорастворимые продукты взаимной поликонденсации.
Регрессионный анализ изменения критического времени гелеобразования монокремниевой кислоты, T, от концентрации гуминовых кислот в растворе, C, показал, что наиболее близко данная зависимость может быть передана полиномиальным уравнением:
T(C) = - 282.5C3+ 1590С2+ 192.5С + 300.
Результаты экспериментов показали, что растворение кремнезема в присутствии органических веществ с вицинальными ОН-группами происходит с образованием устойчивых продуктов.
Выход аммонийной соли трипирокатехинового эфира монокремниевой кислоты на основе промышленного золя кремнезема составил 78%, на основе диатомита – 32% от количества введенного пирокатехина. Элементный анализ и ИК-спектры продуктов соответствуют формуле димера аммонийной соли трипирокатехинового эфира монокремниевой кислоты (C6H4O2)6Si2(NH4)4, чтосогласуется с данными работы [23].
Элементный анализ аммонийной соли гуминового эфира монокремниевой кислоты на основе кремнезема диатомита показал наличие C в количестве 31.59%, Н – 3.85%, N – 8.77%, Si– 4.58%, прочих элементов – 59.98%. В ИК – спектре продукта (рис. 1) замечено уменьшение n OH–групп, n H-O-H (мультиширокий уступ 4000-3600 см-1), смещение электронной плотности с –OH на N (с 3600 на 2850-2350 см-1), усиление пиков сопряженных колец (пик 1585 см-1), появление Si-O-C связей (широкий пик 1112 см-1), образование ароматических эфиров (пик 1277 см-1), уменьшение n P-OH, n -СOOH (уменьшение уступа 2750- 1750 см-1, исчезновение пика 2726 см-1).
Элементный анализ аммонийной соли гуминового эфира монокремниевой кислоты на основе силикатов глины показал наличие C в количестве 40.65%, Н – 4.25%, N – 3.11%, Si– 1.88%, прочих элементов – 50.12%, а в ИК – спектре, приведенном на рис. 2, выявлено увеличение ν OH–групп, -NH, H-O-H (мультиширокий уступ 4000-3600 см-1), уменьшение P-OH, -СOOH (уменьшение уступа 2750-1750 см-1, исчезновение пика 2726 см-1), смещение электронной плотности с –OH на N (с 3600 на 2850-2350 см-1), усиление пиков сопряженных колец (пик 1585 см-1), образование ароматических эфиров (пик 1277 см-1), появление Si-O-C связей (1097 см-1), уменьшение пиков Si-O-Si – связей (исчезновение пиков 873, 581 см-1, уменьшение величины пиков от 1041 до 722 см-1, от 483 до 400 см-1.
Элементный анализ аммонийной соли гуминового эфира монокремниевой кислоты на основе промышленного золя кремнезема обнаружил наличие C – 4.14%, H – 0.56%, N – 0.35%, Si – 35.40%, прочих элементов- 59.55%. В ИК - спектре (рис. 3) подмечено некоторое смещение электронной плотности с –OH на N (с 3600 на 28502350 см-1), вследствие присутствия аммиака в реакционной смеси, в остальном ИК-спектр практически совпал с исходным спектром промышленного золя кремнезема, с небольшим наложением спектра гуминовых кислот.
Почвообразующая порода подвержена постоянному выветриванию. При этом происходит миграция кремниевых соединений – образование подвижных форм в виде моно- и олигокрем-
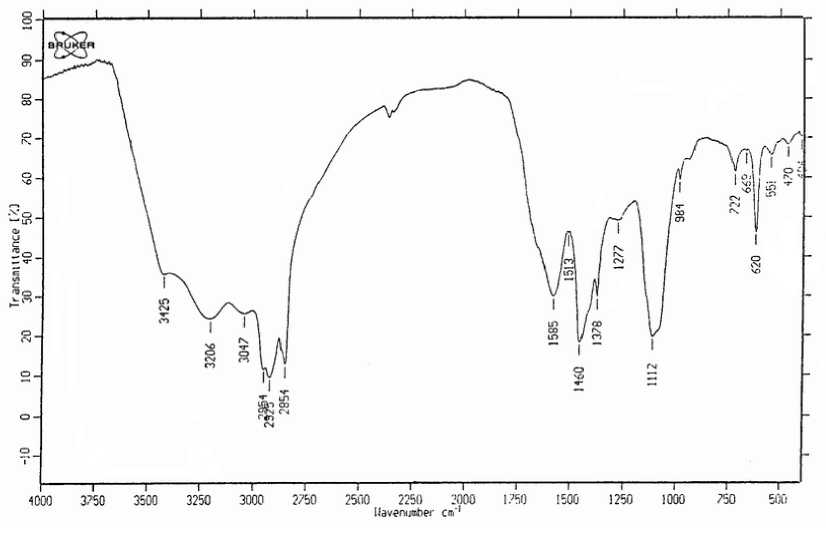
Рис. 1. ИК- Спектр продукта, полученного на основе гуминовых кислот и кремнезема диатомита
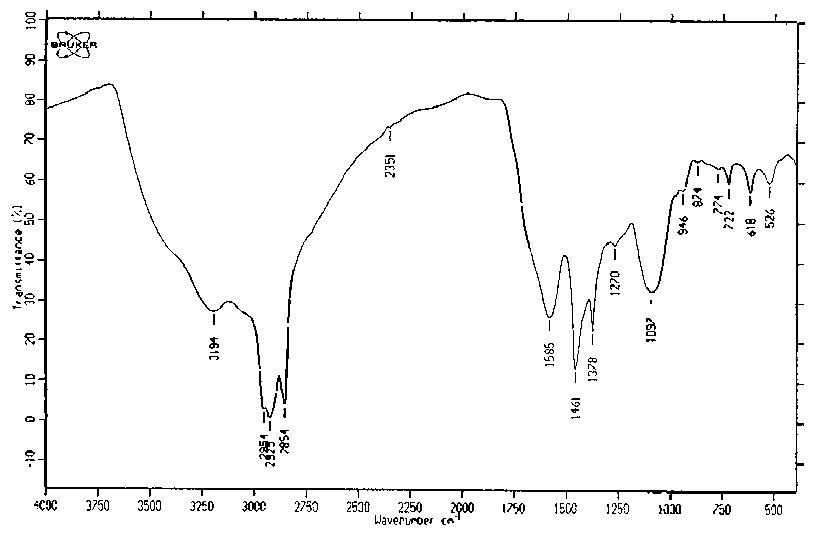
Рис. 2. ИК - Спектр продукта, полученного на основе гуминовых кислот и силикатов глин
ниевых кислот и силикатов при растворении кремнекислородных соединений породы в почвенных и грунтовых водах, постепенный перевод растворимых форм в золь и гель кремнезема, далее – осаждение в виде аморфного кремнезема, из которого с течением времени образуются малорастворимые кристаллические соединения. Аморфные формы кремнезема характеризуются ближним порядком в структуре и потому обладают большей удельной поверхностью, повышенной растворимостью, более высокой реакционной способностью, более высокой степенью гидратации по сравнению с кристаллическими формами [23]. Активные кремнекислородные соединения играют определяющую роль в миграции кремния в природных системах. И растворимость, и реакционная способность его соединений обусловливают не только передвижение кремния в почвенном покрове, природных водах и горных породах, но и его способность усваиваться живыми организмами.
Изучение растворимости кремнезема в воде показывает, что его переход в растворимые реакционноспособные формы – монокремниевую и
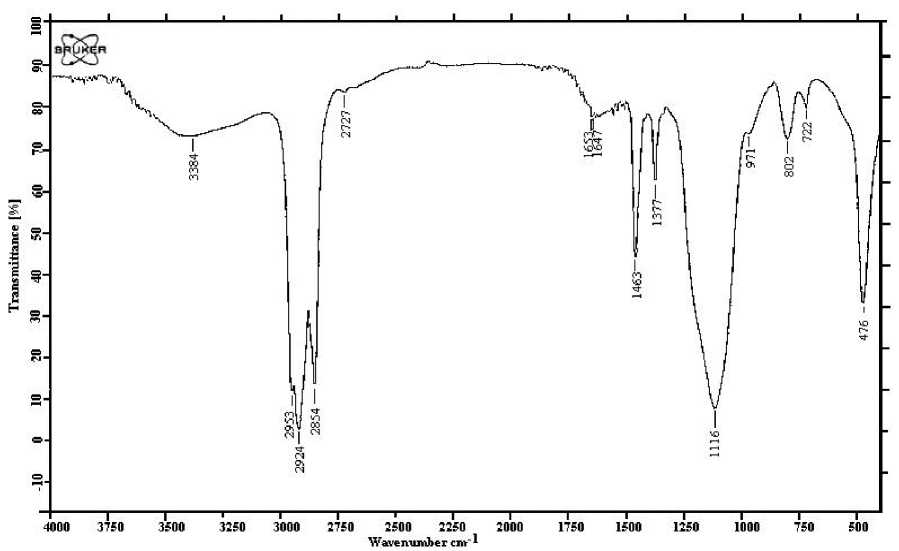
Рис. 3. ИК - Спектр продукта, полученного на основе гуминовых кислот и промышленного золя кремнезема
олигокремниевые кислоты, даже из пород с высоким содержанием растворимых форм кремнекислородных соединений происходит в незначительных масштабах. Однако такого количества кремнезема в почвенных водах может оказаться вполне достаточно для нормального питания растений.
Более активное растворение кремнекислородных соединений породы, расположенной под слоем почвы, происходит при контакте с органическими соединениями или их остатками, например, фульвокислотами или силикатразруша-ющими ферментами [1].
Кремнекислородные соединения в диапазоне нейтральных значений рН достаточно физически и химически инертны [1]. Устойчивость силоксановых связей Si-O в сравнении со связями кремния с другими элементами обусловливает малую реакционную способность кремнекислородных соединений и трансформацию всех других соединений кремния в кислородные при окислении и гидролизе. Устойчивые же соединения кремния с углеродом, участвующие в деятельности природных систем, – почве, природных водах, горных породах, живых организмах – обладают уникальной физико-химической прочностью, не свойственной углеродным аналогам. В природе прямой синтез кремнийорганических производных из кремнезема осуществляется микроорганизмами Proteus Mirabilis, которые могут синтезировать целый ряд сложных органических эфирных и амидных производных монокремниевой кислоты, включающих связи Si-O-C и Si-N-C, а также некоторое количество связей Si-C [27].
Функциональными центрами активных форм кремнекислородных соединений, в частности, амфотерной монокремниевой кислоты H2SiO3, или Si(OH)4 (по Айлеру Р.К. [1]), являются протоны, которые, подобно H+ других неорганических кислот, в том числе слабых – борной, угольной, содействуют окислению органических веществ, реакционноспособные гидроксильные группы, атом кремния, способный к образованию устойчивых комплексов путем присоединения от 4 до 6 органических лиганд.
В отсутствие силикатразрушающих ферментов и микроорганизмов и при средних значениях рН активные кремнекислородные соединения вступают во взаимодействие с некоторыми органическими веществами, содержащими ОН-группы, с получением стерически устойчивых соединений с тетра-, пента- и гексакоординиро-ванным атомом кремния. Устойчивость связи SiO-С связей в образующихся соединениях определяется величиной и строением органического радикала, числом алкокси-групп в молекуле и структурой молекулы в целом [3].
В лабораторных условиях кремнезем и другие кремнекислородные соединения растворяются в присутствии полифенолов с вицинальными ОН - группами (простейшие природные о-дигидроксибензолы – пирокатехин и танин), с образованием устойчивых к окислению и гидролизу солей полифенольных эфиров монокрем-ниевой кислоты с гексакоординированным атомом кремния [17, 18, 23] (рис. 4).
Вицинальные, или орто–ОН-группы в о-дигид-
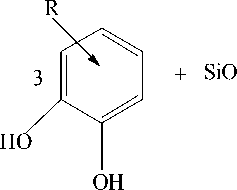
2KatOH
-4H 2 O
Рис. 4. Схема реакции кремнезема с полифенолами с вицинальными ОН-группами
Kat2
роксибензоле, как показано на рис. 4, расположены таким образом, что в продукте реакции образуется шесть одинарных связей кремния с шестью кислородами ОН – групп трех достаточно удаленными от него в пространстве о-дигидроксибензолов (и присоединенных к ним органических остатков различной природы, если они есть). Данный факт демонстрирует невозможность образования стеричес-ки устойчивых продуктов реакции кремнезема с ми п-дигидроксибензолами, что подтверждается экспериментально [23].
В почве большое количество фенольных групп, защищенных от окисления сложным полимерным строением соединения, содержится в гуминовых кислотах – важных компонентах гуминовых веществ, как отмечено в работе [11].
Нами была исследована растворимость кремнезема в присутствии пирокатехина и гуминовых кислот на примере хорошо растворимого кремнезема высококремнистой породы – диатомита.
Анализ результатов эксперимента показал, что в начальный период концентрация кремнезема в насыщенном растворе гуминовых кислот превосходит его содержание в насыщенном растворе пирокатехина в 13.3 раза. Можно сделать вывод, что количество кремнезема, переходящее в насыщенный раствор гуминовых кислот (для диатомита – 45,6%), ограничено только способностью самого кремнезема к растворению. Для кремнезема диатомита данное ограничение согласуется с величиной его растворимости в воде – в 2,3 раза меньше истинной растворимости аморфного кремнезема (0.0120%) [1], со значением его растворимости в щелочи – не более 40% [7], с более низким выходом кремнийорганических производных: 32% на основе кремнезема диатомита, по сравнению с 78% на основе золя кремнезема – коллоидного раствора реакционноспособных кремниевых кислот.
Таким образом, можно предположить, что в почве и контактирующей с ней породе практически весь кремнезем и соли кремниевых кислот различного состава активно растворяются при контакте с гуминовыми кислотами.
Обнаруженная нами высокая растворимость кремнезема в гуминовых кислотах, возможно, объясняется тем, что фенольные группы гуминовых кислот способны взаимодействовать с кремнеземом, образуя химически устойчивые кремнийорганические производные, подобные продуктам реакции диоксида кремния с о-дигид-роксибензолами. На получение сходных крем-нийорганических производных при взаимодействии кремнезема с гуминовыми кислотами указывают авторы работ [1, 16].
Используя методику синтеза кремнийорга-нических производных из кремнезема на основе пирокатехина, приведенную в работе [23], нами были получены соли гуминового эфира моно-кремниевой кислоты.
На основании результатов элементного анализа и ИК-спектроскопии, а также сравнением параметров ИК - спектров с данными подобных соединений на основе пирокатехина, с использованием сведений по составу гуминовых кислот [11], были выведены формулы полученных продуктов. Так как кремний не может входить в состав продуктов в виде силикатов (его вытесняют из солей более сильные кислоты), он образует эфирную связь Si-O-C с полифенолами или присутствует в составе сорбционного комплекса. Фосфат аммония и вода могут присутствовать в составе продукта в качестве примесей из раствора извлечения гуминовых кислот из почвы. Формула аммонийной соли гуминового эфира монокремниевой кислоты, полученной на основе кремнезема диатомита, предположительно может иметь вид: С60H30O24Si4(NH4)15(PO4)10, а формула соли на основе силикатов глины может быть передана так:
С60H52O24Si(NH4)4(PO4)4(H2O)4.
Полосы, характерные для аналогичных крем-нийорганических производных (КОП), обнаруживаются в ИК - спектрах почв различного типа
-
[12] . КОП растворимы в воде, устойчивы к химическому окислению и гидролизу. Вероятно, они разлагаются ферментативно, так как, согласно исследованию [6], при возрастании стерического фактора, роль ферментативного вклада в распад молекулы кремнийорганического соединения или производного увеличивается, роль химического вклада - уменьшается.
В процессах ферментативного гидролиза происходит разложение КОП и выделение растворимого кремнезема в виде монокремниевой кислоты или ее олигомеров и свободных гуминовых кислот. Таким образом, чувствительные только к действию ферментов, в почве КОП, возможно, являются своеобразным депо растворимого кремния и питательных веществ для растений.
Монокремниевая кислота и ее олигомеры, образующиеся при разложении кремнийоргани-ческих производных, конденсируются в золь кремнезема. В его стабилизации определяющую роль играют гуминовые кислоты, способные, как было показано, растворять кремнезем, образовывать с ним устойчивые растворимые кремнийор-ганические производные, а также, при избытке кремнезема или гуминовых веществ, нерастворимые продукты взаимной поликонденсации.
На этом основании можно предположить, что в почве растворимый кремнезем выполняет не только функцию питательного вещества для растений, но и препятствует вымыванию гуминовых кислот из почвы.
Полученные продукты поликонденсации представляют собой органо-минеральные агрегаты (ОМА) - твердые кремнекислородные соединения с включениями органического вещества. Нами выделены и идентифицированы ОМА, полученные при высоких концентрациях кремнезема и гуминовых кислот в растворе с использованием промышленного золя кремнезема. По данным элементного и ИК - спектрального анализа, химическая формула полученных нами ОМА может быть выражена в виде: (Si-O-Si)60C60O24N(NH4)3PO4(H2O)24. ОМА могут формироваться не только в ходе совместной коагуляции кремнезема и сопутствующих золей с органическими веществами почвы, но и в процессе сорбции гуминовых кислот минералами материнской породы, как отмечено в работе [15].
Растворимые только в сильнощелочных и сильнокислотных средах [2], ОМА и стабилизированный гуминовыми кислотами золь кремнезема структурируют почву, формируя почвенные частицы, и, в то же время, повышают влагоудерживающую способность почвы, как отмечено в работах [8, 22].
В сформированных почвах пополнение кремнием осуществляется как вследствие химическо- го выветривания минералов породы, так и за счет растительного опада, содержащихся в растительных клетках фитолитов, аэрозольного переноса, поверхностных и подземных вод.
На основании вышеизложенного необходимо отметить, что, несмотря на крайне низкую величину растворимости кремнезема в воде, его миграция из породы в почву вследствие присутствия гуминовых веществ и силикатразрушаю-щих ферментов может происходить в значительном масштабе. Растворение кремнезема под действием гумусовых гуминовых кислот идет с образованием химически устойчивых, растворимых соединений. Данные соединения являются кремнийорганическими производными и, вероятно, разлагаются ферментативно до свободных и доступных для питания растений монокремни-евой кислоты и органических остатков гуминовых кислот. При ферментативном разложении данных соединений, а также при избытке в почвенном растворе кремнезема или гуминовых кислот, сорбции кремнекислородными соединениями гуминовых веществ или совместной коагуляции гуминовых кислот и растворимых форм кремнезема происходит образование малорастворимых органоминеральных агрегатов, которые выполняют в почве структурирующую и влагоудерживающую функции.
Таким образом, баланс концентраций кремнезема и гуминовых кислот в почве в определенной степени обусловливает ее формирование, свойства и функционирование.
Результаты настоящего исследования могут быть использованы в агрохимических целях для улучшения свойств почвы, рекультивации почвенного покрова, создания искусственного почвенного слоя на местах сборов промышленных и бытовых отходов с использованием дешевого местного сырья – минералов и пород, содержащих доступный для растворения кремнезем (например, диатомита, вулканического пепла, глин и т.д.) и субстрата, богатого гуминовыми веществами (вермикомпостов, сапропелей и другого органического сырья).
Список литературы Кремний и гуминовые кислоты: моделирование взаимодействий в почве
- Айлер Р.К. Химия кремнезема: в 2 ч. М.: Мир, 1982. 1127 с.: ил. Iler, R.K. The chemistry of silica. Wiley, New York, 1979. 1127 p.
- Александрова Л.Н. Органическое вещество почвы и процессы его трансформации. Л.: Наука, 1980. 287 с.
- Андрианов К.А. Кремнийорганические соединения. М.: Госхимиздат, 1955. 520 с.
- Вернадский В.И. Биогеохимическая роль Al и Si в почвах//Докл. АН СССР. 1938. T.21. №.3. С.127-130.
- Григорьев П.Н., Матвеев М.А. Растворимое стекло. М.: Промстройиздат, 1956. 444 с.
- Дьяков В.М., Офицеров Е.Н., Фаттахова А.Н., Лазарев А.В. Влияние строения КОС на соотношение химического и ферментативного вклада в гидролиз связи Si-O//Сб. науч. тр. по материалам 13ой Международной конференции по химии соединений фосфора и 4го Международного симпозиума по химии и применению фосфор-, сера-и кремнийорганических соединений "Петербургские встречи". Санкт-Петербург, 26-31 мая, 2002. С. 371.
- Кремнистые породы СССР [под ред. У.Г. Дистанова]. Казань: Тат. кн. изд-во, 1976. 412 с.
- Матыченков В.В., Бочарникова Е.А., Амосова Я. М. Влияние кремниевых удобрений на растения и почву//Агрохимия. 2001. № 12. С. 30-38.
- Матыченков В.В., Шнайдер Г.С. Подвижные соединения кремния в некоторых почвах Южной Флориды // Почвоведение. 1996. №12. С. 1448-1453. (V. V. Matychenkov and G. S. Snyder. Mobile Silicon-Bound Compounds in Some Soils of Southern Florida // Eurasian Soil Science. 1996. №12. P. 1350-1355.)
- Опыт и перспективы применения гуминовых удобрений в сельском хозяйстве Ленинградской области//Стенограмма научно-практического семинара. Санкт-Петербург, 9 ноября 2001. 35 с.
- Орлов Д.С. Химия почв. М.: Изд-во Моск. ун-та, 1985. 376 с. (D. S. Orlov. Soil Chemistry/Translation of "Khimiya pochv", Moscow University Press. Oxford and IBH Publishing Co. Pvt. Ltd. New Delhi, Bombay, Calcutta. 1992.)
- Орлов Д.С., Осипова Н.Н. Инфракрасные спектры почв и почвенных компонентов М.: Изд-во Моск. ун-та, 1988. 180 с.
- Практикум по почвоведению [под ред. И.С. Кауричева]. М.: Агропромиздат, 1986. 336 с.
- Симонов Г.А. Органоминеральные комплексы почв: проблемы диагностики//Расширенные тез. докл. II Международного семинара "Минералогия и жизнь: биоминеральные взаимодействия". Сыктывкар, 17-22 июня 1996. C.62-63.
- Дистанов У.Г., Аксенов Е.М., Ведерников Н.Н. и др. Фанерозойские осадочные палеобассейны России: проблемы эволюции и минерагения неметаллов/Под ред. Н.В. Милитенко, А.Н. Лабутина. М.: ЗАО "Геоинформарк", 2000. 400 с.
- Фотиев В.А. К природе водного гумуса//Докл. АН СССР. 1971. Т. 1199. № 1. С. 198-201.
- Barnum D.W. Pyrocatechol Complexes with Silicon//Inorg. Chem. 1972. V. 9. № 8. P.1942-1943.
- Bodin A., Cerveaw G., Chuilt C., Corriu R.J.P., Reye C. Reactivity of Dianionic Hexacoordinated Silicon Complexes toward Nucleophiles: a New Route to Organosilanes from Silica//Organometallics. 1988. V. 7. № 5. P. 1165-1171.
- Clapp C. E., Cline V. W., Hayes M. H. B., Liu R. The Role of Humic Substances in Plant Growth//Abstracts of Humic Substances Seminar II. Northeastern University Boston, MA, USA. March 27, 1998.
- Karmin Z. Formation of ferrihy drite by inhibition of grun rust structures in the presence of silicon//Soil Sci. Soc. Amer. J. 1986. V.50. №.1. P.247-254.
- Marsan F.A., Torrent J. Fragipan bonding by silica and iron oxides in a soil from northwestren Italy//Soil Sci. Soc. Amer. J. 1989. V.53. №.4. P.1140-1145.
- Matichenkov V.V., Calvert D.V., Snyder G.H., et al. Nutrients leaching reduction by Si-rich substances in the model experiments//Proc. 7th Inter. Conf. Wetland Systems for Water Pollution Control. Lake Buena Vista, Florida. Nov. 11-16, 2000. P.583-592.
- Weiss A., Reiff G., Weiss A. Zur Kennthis Wasserbestandiger Kieselsaureester//Z. Anorg. Allgem. Chem. 1961. B.311. S.151-179.


