Криобиопсия в морфологической верификации центрального рака легких с некрозом
Автор: Маменко И.С., Васильев И.В., Беляев Г.С., Мортада М.М., Нефедов А.О., Новицкая Т.А., Яблонский П.К.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Актуальность. Диагностическая ценность стандартной щипцовой биопсии центрального рака легкого составляет 74 %. При этом информативность значительно снижается при наличии некроза в опухоли. В России на настоящий момент криобиопсия для диагностики центрального рака легкого применяется лишь в нескольких клинических центрах. Цель исследования - представить серию клинических случаев, показывающих эффективность метода криобиопсии в морфологической верификации центральных новообразований с некрозом. Описание клинических случаев. В статье представлены 3 клинических случая пациентов с центральным раком легкого, у которых стандартная щипцовая биопсия была неэффективна из-за наличия выраженного некроза в опухоли. Криобиопсия, выполненная на втором этапе обследования, позволила во всех случаях получить достаточное количество морфологического материала для гистологического и иммуногистохимического исследования и реканализировать просветы крупных бронхов. заключение. Криобиопсия - эффективный и безопасный метод морфологической верификации центрального рака легкого, имеющий преимущества перед стандартной щипцовой биопсией, в особенности при наличии видимого некротического компонента в структуре опухоли.
Центральный рак легкого, бронхоскопия, криобиопсия, криореканализация
Короткий адрес: https://sciup.org/140300156
IDR: 140300156 | УДК: 616.24-006.6-002.4-076 | DOI: 10.21294/1814-4861-2023-22-2-103-111
Текст научной статьи Криобиопсия в морфологической верификации центрального рака легких с некрозом
Актуальность
Рак легкого занимает 1-е место по заболеваемости у мужчин в России среди злокачественных опухолей и 1-е место по смертности среди мужчин и женщин как в России, так и в мире [1]. Рак легкого имеет две основные клинико-анатомические формы – центральную (70–75 %) и периферическую (25–30 %), с постепенным увеличением доли последней [2]. Для верификации процесса необходимо получение морфологического материала с возможностью гистологического исследования. По данным M.P. Rivera et al., диагностическая ценность стандартной щипцовой биопсии центральных новообразований легкого составляет 74 % [3].
При этом информативность эндобронхиальной биопсии значительно снижается при наличии некроза в опухоли [4]. Появление некроза, в свою очередь, зачастую свидетельствует о запущенном процессе, когда возможности хирургического лечения уже исчерпаны. Принципиальным в таких ситуациях является выполнение всей панели иммуногистохимического и молекулярно-генетического исследований, что позволяет адекватно выбрать специальное лечение. Методикой, позволяющей значительно улучшить показатели верификации, является криобиопсия, которая зарекомендовала себя в диагностике патологии периферических отделов легких [5, 6].
В Российской Федерации метод криобиопсии применяется лишь в нескольких клинических центрах. В отечественной научной литературе имеются единичные публикации о применении криотехнологии при биопсии центральных опухолей легких [7, 8].
Цель исследования – представить серию клинических случаев, показывающих эффективность метода криобиопсии в морфологической верификации центральных новообразований с некрозом.
Клинический случай № 1
Пациент Ф., 77 лет, в течение 10 лет отмечал кашель по утрам и одышку при физической нагрузке. Стаж курения 85 пачка/лет. К врачам не обращался, не обследовался. В декабре 2021 г.
заболел новой коронавирусной инфекцией с болями в грудной клетке справа, одышкой при умеренной физической нагрузке, в связи с чем впервые выполнена КТ органов грудной клетки (ОГК), при которой заподозрено новообразование правого легкого (рис. 1). При видеобронхоскопии (ВБС) выявлено центральное новообразование промежуточного бронха. С целью верификации выполнена щипцовая биопсия. По результатам гистологического исследования верифицировать процесс не удалось.
Пациент консультирован торакальным хирургом и направлен в СПб НИИФ для комплексного дообследования. В связи с неинформативностью предыдущей щипцевой биопсии принято решение выполнить криобиопсию опухоли в условиях общей анестезии. 11.04.22 пациент интубирован тубусом ригидного бронхоскопа Фриделя № 12 с исполь-
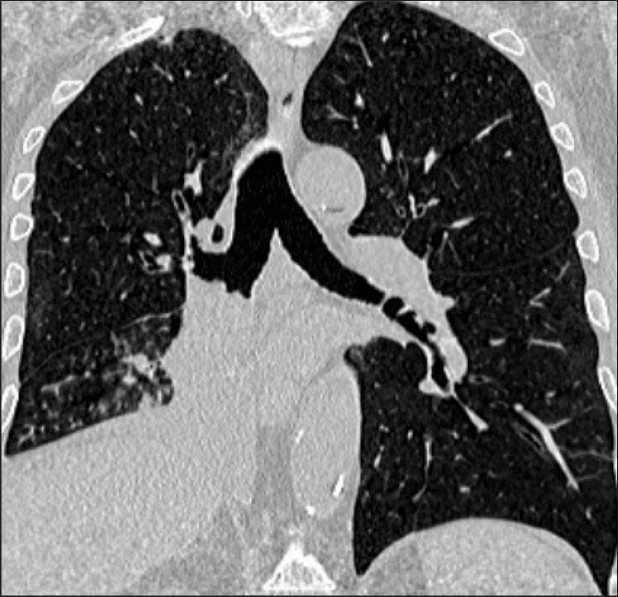
Рис 1. КТ пациента № 1. Просвет промежуточного бронха обтурирован новообразованием, исходящим из нижнедолевого бронха
Fig 1. CT scan of patient № 1. The lumen of the intermediate bronchus is obstructed by a neoplasm originating from the lower lobe bronchus

Рис. 2. Интубация трахеи тубусом ригидного бронхоскопа для выполнения криобиопсии
Fig. 2 Tracheal intubation with a rigid bronchoscope for cryobiopsy

Рис. 3. Удаление бронхоскопа вместе с криозондом и адгезированным к нему образцом опухолевой ткани
Fig. 3. Removal of a bronchoscope together with a cryoprobe and a sample of tumor tissue adhered to it
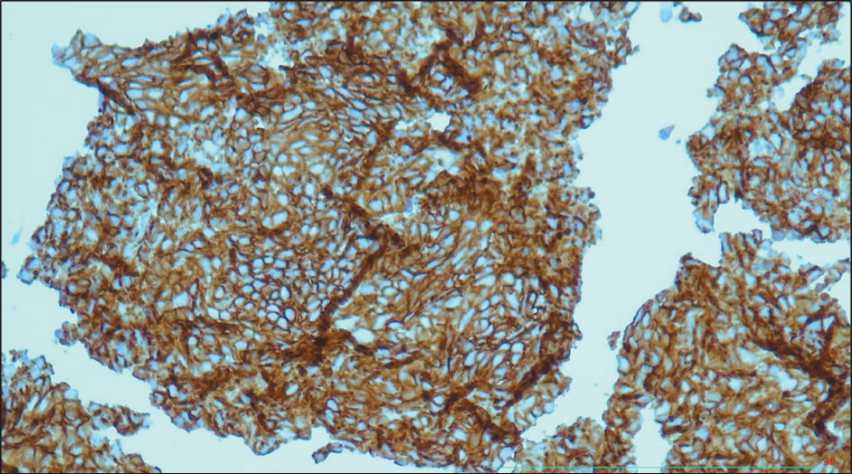
Рис. 4. ИГХ-исследование материала, полученного при криобиопсии: положительная экспрессия CD 56 у пациента с мелкоклеточным раком легкого, ×200
Fig. 4. IHC study of material obtained from cryobiopsy: positive expression of CD 56 in a patient with small cell lung cancer, ×200
зованием высокочастотной вентиляции (рис. 2). При ВБС: просвет промежуточного бронха перекрыт экзофитным опухолевым образованием с белесоватыми участками некроза, исходящим из нижнедолевого бронха. С помощью системы Erbecryo2 и гибкого криозонда 2,4 мм выполнено 5 сеансов криобиопсии опухоли со временем замораживания 4 сек (рис. 3). После удаления половины визуализируемого опухолевого образования просвет промежуточного бронха свободен, просвет нижнедолевого бронха продолжает оставаться перекрытым. Осложнений во время и после выполнения процедуры не отмечено. При гистологическом исследовании выявлены комплексы из атипичных клеток со светлой цитоплазмой, округлыми ядрами с большим количеством митозов, широкими полями некроза опухолевой ткани. При ИГХ-исследовании отмечена положительная экспрессия СKPAN, хромогранин А, TTF-1, CD 56 (рис. 4), установлен мелкоклеточный рак.
Клинический случай № 2
Пациент Ч., 50 лет, с лета 2021 г. стал отмечать боли в правом гемитораксе. В феврале 2022 г. при КТ ОГК выявлено новообразование нижней доли правого легкого, размером до 9×5,8×6,5 см, частично обтурирующее просвет нижнедолевого и промежуточного бронхов (рис. 5). При ПЭТ-КТ всего тела (4.03.22): признаки ПЭТ-позитивного образования нижней доли правого легкoго, патологической метаболической активной ткани в увеличенном лимфоузле корня правого легкого (10R), в увеличенном бифуркационном лимфоузле (7 гр.) и неувеличенном нижнем правом паратрахеальном лимфоузле (4R). После консультации онколога-торакального хирурга госпитализирован в СПб НИИФ для комплексного дообследования. Бронхоскопия (8.04.22): из устья нижнедолевого бронха исходит бугристое розовое новообразование с белесоватой бледной верхушкой с налетом фибрина, полностью обтурирующее просвет бронха (рис. 6). Верхний полюс образования на уровне средней трети промежуточного
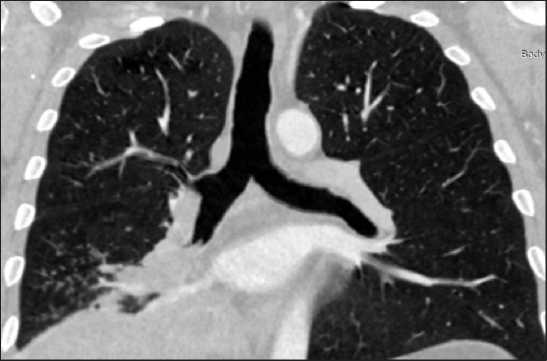
Рис. 5. КТ пациента № 2. Новообразование нижней доли правого легкого, выступающее в просвет дистального отдела промежуточного бронха
Fig. 5. CT scan of patient № 2. Neoplasm of the lower lobe of the right lung protruding into the lumen of the distal intermediate bronchus
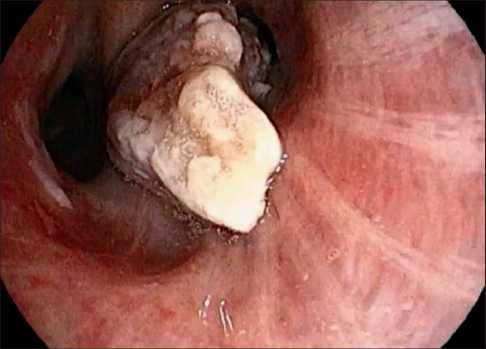
Рис. 6. Центральное новообразование нижней доли правого легкого с обтурацией нижнедолевого бронха, выступающее в просвет промежуточного бронха с явными некротическими изменениями и налетами фибрина
Fig. 6. Central neoplasm of the lower lobe of the right lung with obstruction of the lower lobe bronchus, protruding into the lumen of the intermediate bronchus with obvious necrotic changes and fibrin deposits
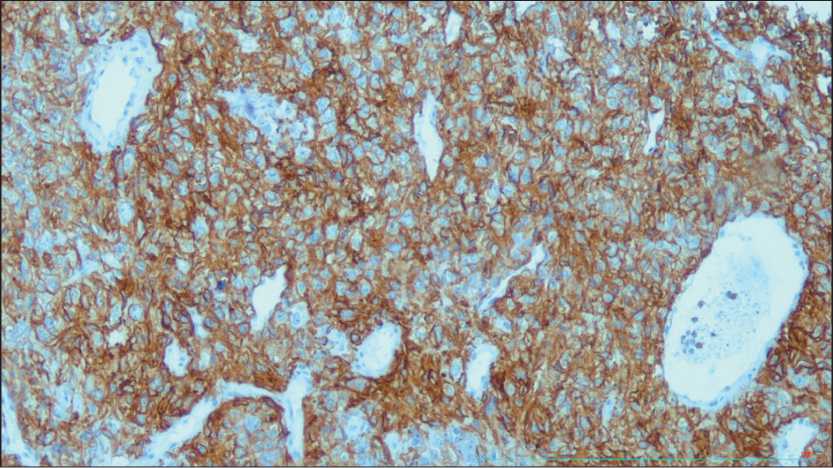
Рис. 7. ИГХ-исследование материала, полученного при криобиопсии: положительная экспрессия CD10 у пациента с саркоматоидным раком легкого, ×100
Fig. 7. IHC study of cryobiopsy specimen: positive expression of CD10 in a patient with sarcomo-toid lung cancer, ×100
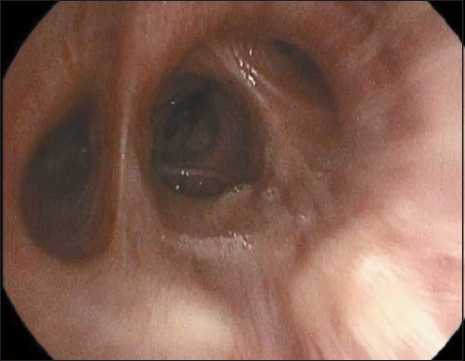
Рис. 8. Вид бронхиального дерева после выполнения криобиопсии: просветы промежуточного бронха и бронха 6-го сегмента полностью проходимы, визуализируется опухолевая ткань в просветах бронхов 8, 9, 10-го сегментов
Fig. 8. The view of the bronchial tree after performing cryobiopsy: the lumen of the intermediate bronchus and the bronchus of the 6 segment are visualized; the tumor tissue is visualized in the lumen of the bronchi of 8, 9, 10 segments
бронха. Среднедолевой бронх частично прикрыт образованием. Признаков распространения на верхнедолевой бронх нет. Выполнена щипцовая биопсия, № 5. Гистологическое заключение: фрагменты некротизированной ткани с очаговой, слабо выраженной воспалительной инфильтрацией, единичными клетками дистрофически измененного бронхиального эпителия. Вторым этапом принято решение выполнить криобиопсию опухоли под местной анестезией. С помощью гибкого бронхоскопа, системы Erbecryo2, и гибкого криозонда 2,4 мм выполнено 3 сеанса криобиопсии опухоли с временем замораживания – 4 сек. Удален значительный объем эндобронхиального компонента опухоли. Отмечалось умеренное кровотечение, купировавшееся самостоятельно. При гистологическом исследовании обнаружены атипичные полиморфные крупные клетки с гиперхромными ядрами, многоядерные клетки и участки некроза. ИГХ-исследование: опухолевые клетки позитивные на CD10 (рис. 7), фокально позитивные на р63, негативные на TTF1, CD30, CD45, CD117, CD3, CD20, BCL2, BCL6, PAX5, PAX8, CD15, CD23, CK7, CKPAN, Ki67 – 23 %. Установлен диагноз саркоматоидный рак. 19.04.22 – хирургическое стадирование методом видеоассистированной медиастинальной лимфаденэктомии (VAMLA), по результатам гистологического исследования в препаратах убедительных признаков опухоли не обнаружено. Принято решение выполнить операцию. При контрольной бронхоскопии перед операцией отмечена значительная регрессия эндобронхиального компонента опухоли (рис. 8). Выполнена торакотомия справа, расширенная нижняя лобэктомия справа с медиастинальной лимфаденэктомией (26.05.22). Гистологическое заключение: Саркоматоидный рак T4N0(0/4)M0, G3, IIIa стадия; в краях резекции опухолевого роста нет. Пациент отправлен под наблюдение
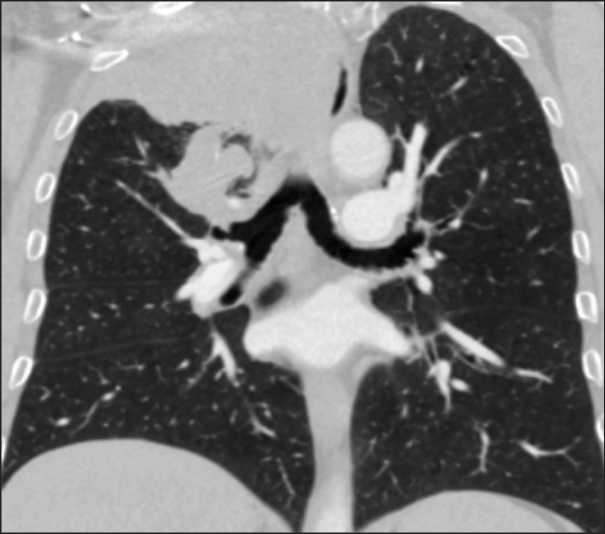
Рис. 9. КТ пациента № 3. Образование верхней доли правого легкого с централизацией в бронхе первого сегмента
Fig. 9. CT scan of patient № 3. Formation of the upper lobe of the right lung with centralization in the bronchus of the first segment онколога. Таким образом, использование криобиопсии подтвердило опухолевый генез заболевания и уменьшение объема опухоли, что позволило выполнить радикальную нижнюю лобэктомию.
Клинический случай № 3
Пациент Г., 64 лет, в течение 2 мес отмечал выраженные боли в области правой лопатки, не купируемые нестероидными противовоспалительными препаратами. После обращения к врачу назначена МСКТ органов грудной клетки с внутривенным контрастированием, на которой в верхней доле правого легкого выявлено объемное образование с деструкцией I ребра, размерами 117×96×119 мм, очаги в верхней доле правого легкого с лимфаденопатией средостения и надключичной области справа (рис. 9). Пациент консультирован торакальным хирургом и направлен в СПб НИИФ для комплексного дообследования.
При бронхоскопии (1.09.22): компрессионный стеноз средней трети трахеи 0–I ст. и бледнорозовое центральное новообразование с признаками некроза, полностью обтурирующее просвет первого сегментарного бронха справа (рис. 10).
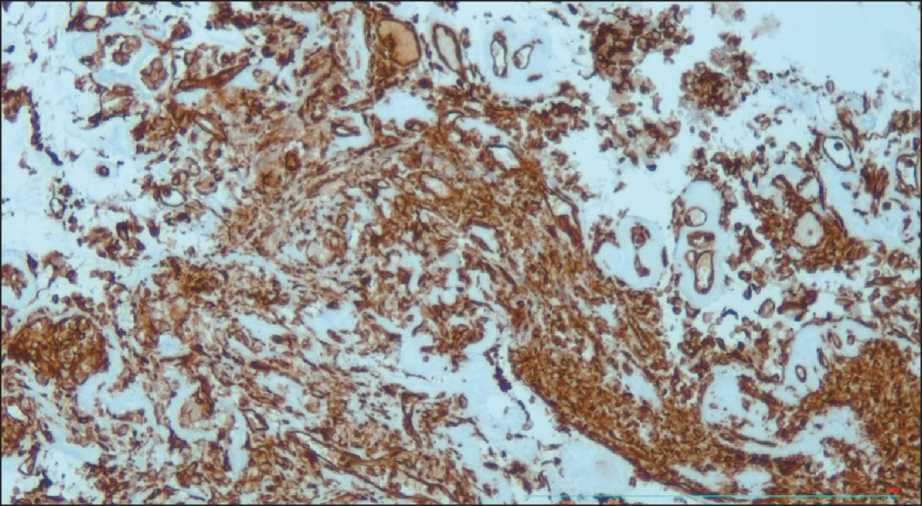
Рис. 11. ИГХ-исследование материала, полученного при криобиопсии: положительная экспрессия виментина, ×100 Fig. 11. IHC study of the cryobiopsy specimen: positive expression of vimentin, ×100
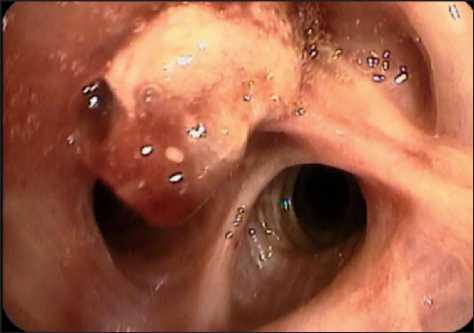
Рис. 10. Центральное новообразование первого сегментарного бронха с некротическими изменениями и налетом фибрина
Fig. 10. Central neoplasm of the first segmental bronchus with necrotic changes and fibrin deposits
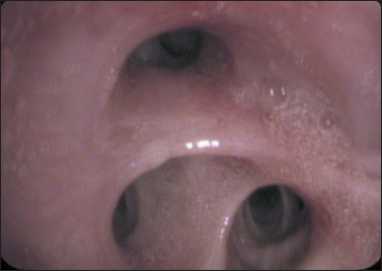
Рис. 12. Вид бронхиального дерева после выполнения криобиопсии: просветы первого сегментарного бронха и субсегментов визуализируются
Fig. 12. View of the bronchial tree after performing a cryobiopsy: the lumens of the first segmental bronchus and subsegments are visualized
Выполнена стандартная щипцовая биопсия новообразования, № 5. По данным гистологического исследования: мелкие фрагменты слизистой бронха с отеком, слабо выраженной смешанноклеточной воспалительной инфильтрацией и фокусы некроза с ядерно-клеточным детритом. Вторым этапом, также дважды, выполнена трансторакальная биопсия под рентген- и УЗ-навигацией, по данным которой получены фрагменты жировой, мышечной и легочной ткани без опухолевых структур. Принято решение третьим этапом выполнить эндобронхиальную криобиопсию легкого в условиях общей анестезии. 12.09.22 пациент интубирован тубусом ригидного бронхоскопа Фриделя № 12 с использованием высокочастотной вентиляции. Через ригидный бронхоскоп был заведен видеоброн- хоскоп и с помощью системы Erbecryo2 и гибкого криозонда 2,4 мм выполнено 4 сеанса криобиопсии опухоли с временем замораживания 4 сек. В результате криобиопсии просвет первого сегментарного бронха реканализирован. При выполнении процедуры отмечено умеренное кровотечение из просвета бронха, остановленное введением холодного физиологического раствора и окклюзией просвета эндоскопом. При гистологическом исследовании среди фиброзной ткани обнаружены атипичные слабо полиморфные клетки со светлой цитоплазмой, фрагменты стенки бронха с фиброзом, участки некроза. При ИГХ-исследовании позитивная реакция в опухолевых клетках на виментин (рис. 11), синаптофизин – слабое мозаичное окрашивание, индекс пролиферации Ki-67-70 %, негативная реакция на CD45, CK7, CD34, CD15, P63, CD30, CK PAN, INSM1, CD56, S-100, хромогранин A, что соответствует низкодифференцированной опухоли с неопределенным фенотипом. При контрольной бронхоскопии (21.09.22) отмечена полная проходимость первого сегментарного и субсегментарных бронхов, инфильтрация слизистой только на уровне субсегментов (рис. 12). В данном случае криобиопсия позволила получить достаточное количество материала для всех типов мофрологи-ческих исследований и реканализировать просветы доступных для визуализации бронхов.
Обсуждение
Криобиопсия – это метод, который в России только начинает входить в арсенал эндоскопических отделений. Сдерживающими факторами являются необходимость покупки соответствующего
Òàблицà /Table
Ðåзóльтàты иññлåдîвàниé ñðàвнåния îбычнîé щипцîвîé биîпñии и êðиîбиîпñии пðи цåнтðàльныõ нîвîîбðàзîвàнияõ лåгêиõ
Results of studies comparing conventional forceps biopsy and cryobiopsy in central lung neoplasms
|
Авторы и год публикации/ Authors and year of publication |
Количество пациентов/ Number of patients |
Диагностическая ценность (криобиопсия vs щипцовая биопсия)/ Diagnostic value (cryobiopsy vs forceps biopsy) |
Размер образцов (криобиопсия vs щипцовая биопсия)/ Sample size (cryobiopsy vs forceps biopsy) |
Частота легочных кровотечений (криобиопсия vs щипцовая биопсия)/ Frequency of pulmonary bleeding (cryobiopsy vs forceps biopsy) |
|
Aktas Z. et al., 2010 [9] |
41 |
92,7 vs 78,0 % (p=0,031) |
0,8 vs 0,2 см/cm (p<0,001) |
36,6 vs 34,1 % (p>0,05) |
|
Schumann C. et al., 2010 [10] |
55 |
81,9 vs 65,5 % (p<0,05) |
10,4 vs 5,2 мм2/mm2 (p<0,0001) |
Нет данных/No data |
|
Hetzel J. et al., 2012 [11] |
593 |
95,0 vs 85,1 % (p<0,001) |
Нет данных/No data |
80,0 vs 69,3 % (p=0,009) |
|
Chou C.-L. et al., 2013 [12] |
13,8 ± 3,8 |
|||
|
75 |
100,0 vs 69,3 % (p<0,0001) |
vs 1,9 ± 0,6 мм/mm (p<0,0001) |
Нет данных/No data |
|
|
Ehab A. et al., 2017 [13] |
5,9 ± 2,3 |
|||
|
47 |
74,5 vs 51,1 % (p=0,001) |
vs 2,5 ± 0,8 мм/mm (p≤0,001) |
40,4 vs 25,5 % (p=0,016) |
оборудования и осторожность, проявляемая к новому методу со стороны опытных эндоскопистов. В данной статье мы представили несколько случаев криобиопсии для морфологической верификации центрального рака легкого, для которых стандартная щипцовая биопсия оказалась неэффективной из-за значительного некротического компонента в структуре опухоли. Криобиопсия во всех случаях позволила получить достаточное количество морфологического материала для гистологического и иммуногистохимического исследований и реканализировать просветы крупных бронхов. В одном случае криовоздействие было выполнено под местной анестезией. Осложнений процедуры ни в одном из случаев не было.
По данным наиболее крупных исследований, сравнивающих данную методику со стандартной щипцовой биопсией для верификации центральных новообразований легких, диагностическая ценность криобиопсии и размеры полученных образцов во всех случаях значимо превосходили таковые при щипцовой биопсии (таблица). Криовоздействие не меняет морфологию опухоли, а, наоборот, позволяет получить биоптаты с мини- мальным нарушением их тканевой архитектоники без «краш-эффекта», свойственного для щипцовой биопсии [8]. Частота легочных кровотечений при сравнении этих методик была либо сопоставима, либо статистически чаще наблюдалась при криобиопсии [9–13]. Однако авторы отмечают, что количество значимых кровотечений, требующих эндоскопических методов остановки, не различалось между группами [11, 13]. Оценки диагностической ценности криобиопсии по сравнению с обычной биопсией в зависимости от наличия или отсутствия некротического компонента в центральном новообразовании в доступной научной литературе мы не нашли.
Список литературы Криобиопсия в морфологической верификации центрального рака легких с некрозом
- Лактионов К.К., АртамоноваЕ.В., Борисова Т.Н., БредерВ.В., Бычков Ю.М., Владимирова Л.Ю., Волков Н.М., Ергнян С.М., Жаби-наА.С., Кононец П.В., Кузьминов А.Е., ЛевченкоЕ.В., Малихова О.А., Маринов Д.Т., Миллер С.В., Моисеенко Ф.В., Мочальникова В.В., Новиков С.Н., Пикин О.В., РеутоваЕ.В., РодионовЕ.О., СакаеваД.Д., СеменоваА.И., Смолин А.В., СотниковВ.М., Тузиков С.А., ТуркинИ.Н., ТюринИ.Е, ЧхиквадзеВ.Д.,КолбановК.И., ЧерниченкоА.В., ФеденкоА.А., Филоненко Е.В., Невольских А.А., Иванов С.А., ХайловаЖ.В., Геворкян Т.Г., Бутенко А.В., Гильмутдинова И.Р., Гриднева И.В., Ере-мушкин М.А., Зернова М.А., Каспаров Б.С., Ковлен Д.В., Кондратьева К.О., Кончугова Т.В., Короткова С.Б., Крутов А.А., Обухова О.А., Пономаренко Г.Н., Семиглазова Т.Ю., СтепановаА.М., Ткаченко Г.А., ХуламхановаМ.М. Злокачественное новообразование бронхов и легкого. Современная онкология. 2021; 23(3): 369-402. [Laktionov K.K., Arta-monova E.V., Borisova T.N., Breder V.V., Bychkov Iu.M., Vladimirova L.Iu., VolkovN.M., Ergnian S.M., Zhabina A.S., Kononets P. V., Kuz'minovA.E., Levchenko E.V., Malikhova O.A., Marinov D.T., Miller S.V., Moiseen-ko F.V., Mochalnikova V.V., Novikov S.N., Pikin O.V., Reutova E.V., Rodi-onov E.O., Sakaeva D.D., Semenova A.I., Smolin A.V., Sotnikov V.M., Tuz-ikov S.A., Turkin I.N., Tiurin I.E., Chkhikvadze V.D., KolbanovK.I., Cher-nichenko A.V., Fedenko A.A., Filonenko E.V., Nevolskikh A.A., Ivanov S.A., Khailova Zh.V., Gevorkian T.G., Butenko A.V., Gi'mutdinova I.R., Gridne-va I.V., Eremushkin M.A., Zernova M.A., Kasparov B.S., Kovlen D.V., Kondrateva K.O., Konchugova T.V., Korotkova S.B., Krutov A.A., Obukho-va O.A., Ponomarenko G.N., Semiglazova T.Iu., StepanovaA.M., Tkachen-ko G.A., Khulamkhanova M.M. Malignant neoplasm of the bronchi and lung: Russian clinical guidelines. Journal of Modern Oncology. 2021; 23(3): 369-402. (in Russian)]. doi: 10.26442/18151434.2021.3.201048.
- Арсеньев А.И., Нефедов А.О., Новиков С.Н., Барчук А.А., Тарков С.А., Костицын К.А., Нефедова А.В., Аристидов Н.Ю., Семилетова Ю.В., Рязанкина А.А. Алгоритмы неинвазивной, малоинвазивной и инвазивной первичной и уточняющей диагностики рака легкого (научный обзор). Профилактическая и клиническая медицина. 2021; 2(79): 69-77. [Arseniev A.I., NefedovA.O., NovikovS.N., Barchuk A.A., Tarkov S.A., Kostitsin K.A., Nefedova A.V., Aristidov N.Yu., Semiletova Yu. V, RyazankinaA.A. Algorithms of non-invasive, minimally-invasive and invasive diagnostics for lung cancer (review). Preventive and Clinical Medicine. 2021; 2(79): 69-77. (in Russian)]. doi: 10.47843/2074-9120_2021_2_69.
- RiveraM.P., MehtaA.C., WahidiM.M. Establishing the diagnosis of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013; 143(5 Suppl): 142-65. doi: 10.1378/chest.12-2353.
- Karahalli E., Yilmaz A., Türker H., Ozvaran K. Usefulness of various diagnostic techniques during fiberoptic bronchoscopy for endoscopically visible lung cancer: should cytologic examinations be performed routinely? Respiration. 2001; 68(6): 611-4. doi: 10.1159/000050581.
- Kho S.S., Chan S.K., Yong M.C., Tie S.T. Performance of transbronchial cryobiopsy in eccentrically and adjacently orientated radial endobronchial ultrasound lesions. ERJ Open Res. 2019; 5(4). doi: 10.1183/23120541.00135-2019.
- Беляев Г.С., Васильев И.В., Маменко И.С., Табанакова И.А., Новицкая Т.А., Яблонский П.К. Эффективность трансбронхиальной криобиопсии легкого в сравнении с трансбронхиальной щипцевой биопсией в диагностике диссеминированных заболеваний легких. Медицинский Альянс. 2022; 2: 40-9. [Belyaev G.S., Vasil'ev I.V., Ma-menkoI.S., TabanakovaI.A., Novitskaya T.A., Yablonskii P.K. Comparison of the efficacy of transbronchial cryobiopsy with transbronchial forceps biopsy in the diagnosis of diffuse parenchymal lung diseases. Medical Alliance. 2022; 2: 40-9. (in Russian)]. doi: 10.36422/23076348-202210-2-40-49.
- Соколов В.В., Соколов Д.В., Телегина Л.В., Николаев А.Л., Кирюхин А.П., Кудрявцева Ю.Л. Новые технологии в криохирургии при эндоскопическом лечении опухолей дыхательных путей. Исследования и практика в медицине. 2017; 4(2): 29-36. [Sokolov V.V., Sokolov D.V., Telegina L.V., Nikolaev A.L., Kirukhin A.P., Kudryavtseva Yu.L. New technologies in cryosurgery endoscopic treatment of tumors of the respiratory tract. Research'n Practical Medicine Journal. 2017; 4(2): 29-36. (in Russian)]. doi: 10.17709/2409-2231-2017-4-2-4.
- Данилевская О.В., Аверьянов А.В., Черняев А.Л., СамсоноваМ.В. Криотехнологии в эндоскопической диагностике и лечении заболеваний дыхательных путей. Что нужно, чтобы начать? Эндоскопическая хирургия 2021; 27(6): 23-9. [Danilevskaya O.V., Averyanov A.V., Chernyaev A.L., Samsonova M.V. Cryotechnology in endoscopic diagnostics and treatment of respiratory diseases. What do you need to get started? Endoscopic Surgery. 2021; 27(6): 23-9. (in Russian)]. doi: 10.17116/endoskop20212706123.
- Aktas Z., Gunay E., Hoca N.T., Yilmaz A., Demirag F., Gunay S., Sipit T., Kurt E.B. Endobronchial cryobiopsy or forceps biopsy for lung cancer diagnosis. Ann Thorac Med. 2010; 5(4): 242-6. doi: 10.4103/18171737.69117.
- Schumann C., Hetzel J., Babiak A.J., Merk T., Wibmer T., Möller P., Lepper P.M., Hetzel M. Cryoprobe biopsy increases the diagnostic yield in endobronchial tumor lesions. J Thorac Cardiovasc Surg. 2010; 140(2): 417-21. doi: 10.1016/j.jtcvs.2009.12.028.
- Hetzel J., Eberhardt R., Herth F.J., Petermann C., Reichle G., Freitag L., Dobbertin I., Franke K.J., Stanzel F., Beyer T., Möller P., Fritz P., Ott G., Schnabel P.A., Kastendieck H., Lang W., Morresi-Hauf A.T., Szyrach M.N., Muche R., Shah P.L., Babiak A., Hetzel M. Cryobiopsy increases the diagnostic yield of endobronchial biopsy: a multicentre trial. Eur Respir J. 2012; 39(3): 685-90. doi: 10.1183/09031936.00033011.
- Chou C.L., Wang C.W., Lin S.M., Fang Y.F., Yu C.T., ChenH.C., Kuo C.H., HsiehM.H., Chung F.T. Role of flexible bronchoscopic cryo-technology in diagnosing endobronchial masses. Ann Thorac Surg. 2013; 95(3): 982-6. doi: 10.1016/j.athoracsur.2012.11.044.
- Ehab A., Khairy El-Badrawy M., Abdelhamed Moawad A., El-DosoukyAbo-ShehataM. Cryobiopsy versus forceps biopsy in endobronchial lesions, diagnostic yield and safety. Adv Respir Med. 2017; 85(6): 301-6. doi: 10.5603/ARM.2017.0052.


