Криохирургия опухолей печени
Автор: Мерзликин Николай Васильевич, Цхай Валентина Федоровна, Бражникова Надежда Архиповна, Комкова Татьяна Борисовна, Сало Вадим Николаевич, Максимов Максим Алексеевич, Навасардян Вреж Грачович, Нороева Туяна Алексеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.17, 2018 года.
Бесплатный доступ
Введение. Число больных как злокачественными, так и доброкачественными опухолями печени неуклонно растет. Из-за бессимптомности ранних стадий раков печени, поздней обращаемости больных операбельность остается низкой, высока послеоперационная летальность. Для улучшения результатов лечения применяют предоперационную химиоэмболизацию, склерооблитерацию сосудов, криовоздействие. При доброкачественных опухолях печени для снижения кровопотери, предупреждения рецидивов используют эмболизацию сосудов, различные виды коагуляций, сверхнизкие температуры. Цель работы - проанализировать результаты оперативного лечения больных со злокачественными и доброкачественными опухолями печени с применением созданной криоаппаратуры. материал и методы. В лечении больных применялась оригинальная криоаппаратура, создающая на рабочих элементах tо= -196 oC, защищенная зарубежными и отечественными патентами: криоультразвуковой и криовиброскальпель, криодеструктор, криоаппликаторы из пористого никелида титана, адаптированные для лапароскопических операций. С помощью криоинструментов оперированы: 81 пациент с раком печени, 6 - с опухолью Клацкина, 141 - с гемангиомой, 9 - с аденомой печени. Результаты. Резекции печени при злокачественных опухолях были в пределах гемигепатэктомий, расширенных гемигепатэктомий. У 9 больных они произведены криоультразвуковым скальпелем, у остальных - обычным с криодеструкцией культи печени по линии резекции. Отмечено уменьшение кровопотери на 25 % за счет промораживания сосудов до 1 мм. Умерло после резекции печени 4 человека (5,1 %), рецидив опухоли отмечен у 3,8 %. Выживаемость до 1 года составила 74,6 %, до 3 лет - 52 %, до 5 лет - 40 %. При гемангиомах произведено 20 криорезекций, 91 - резекция обычным скальпелем с криодеструкцией культи, 22 - лапароскопические криодеструкции небольших гемангиом (3-5 см). Применение криоинструментов уменьшало интраоперационную кровопотерю, вызывало асептический некроз с последующим склерозом небольших гемангиоматозных узлов. После резекции печени умерло 3 человека (2,7 %), отмечен один рецидив. По поводу аденом печени произведено 9 резекций органа в пределах гемигепатэктомий с криодеструкцией культи без летальных исходов и рецидивов заболевания. Заключение. Криовоздействие при операциях по поводу злокачественных и доброкачественных опухолей печени может осуществляться в виде: 1) криорезекций; 2) обычных резекций с криодеструкцией культи по линии рассечения; 3) криодеструкций небольших гемангиом и метастатических узлов, в том числе лапароскопически. Применение сверхнизких температур снижает кровопотерю, повышает абластичность операций.
Злокачественные опухоли печени, гемангиома, аденома, криоультразвуковой скальпель, криодеструкция, криоаппликатор
Короткий адрес: https://sciup.org/140254174
IDR: 140254174 | УДК: 616.36-006-089:615.832 | DOI: 10.21294/1814-4861-2018-17-2-41-48
Текст научной статьи Криохирургия опухолей печени
За последние десятилетия существенно выросло число больных с опухолями печени, что объясняет‑ ся ухудшением экологической обстановки, широ‑ ким применением гормональных контрацептивов, а также совершенствованием методов диагностики [1]. Бесспорным является значение для развития злокачественных новообразований печени цирро‑ тических изменений органа, вирусного гепатита, алкоголизма, паразитарных заболеваний. Особую роль в этиологии рака печени играет массивная описторхозная инвазия, ведущая к гиперплазии эпителия протоков, его пролиферации, в связи с чем
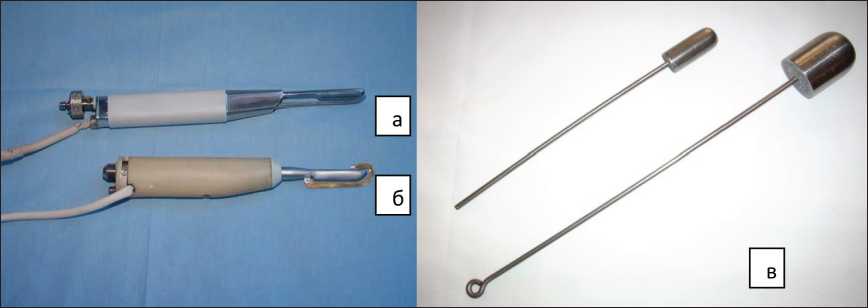
Рис. 1. Криоинструменты: а) криоскальпель, б) криоультразвуковой скальпель, в) криозонды из никелида титана для манипуляций на печени
регионы, где она распространена (Обь‑Иртышский бассейн), лидируют по частоте заболеваемости зло‑ качественными опухолями [2, 3]. Гораздо чаще (в 8–10 раз) первичных встречаются метастатические опухоли печени. Из доброкачественных опухолей печени превалируют гемангиомы, на 2‑м месте по частоте находятся аденомы.
Клиническая картина злокачественных новооб‑ разований печени многолика, на ранних стадиях они протекают практически бессимптомно, по мере роста опухоли появляются болевой синдром, уве‑ личение печени в размерах, повышение темпера‑ туры тела, потеря массы тела, развиваются анемия, портальная гипертензия. Симптоматика гемангиом печени зависит от размеров и локализации: тупые боли в правом подреберье, гепатомегалия, могут наблюдаться желтуха, асцит, при разрыве опухоли – внутреннее кровотечение, гемобилия. Аденомы печени до достижения значительных размеров характеризуются скудной клинической картиной. Современные методы диагностики позволяют по‑ ставить диагноз как злокачественных, так и добро‑ качественных опухолей печени, детализировать их формы, локализацию, размеры, наличие осложне‑ ний, решить вопрос об операбельности [4].
К сожалению, быстрый рост злокачественных опухолей печени, поздняя обращаемость больных обусловливают низкую операбельность (10–20 %), достаточно высокую послеоперационную леталь‑ ность – от 4–6,5 % до 12,5–21 % [5]. Операцией выбора является резекция печени, по объему это чаще гемигепатэктомии, расширенные гемигепат‑ эктомии. Для улучшения результатов лечения, предотвращения рецидивов заболевания опера‑ тивное вмешательство сочетают с лигированием, химиоэмболизацией, склерооблитерацией сосудов печени [6, 7, 8], технологиями двухэтапной резек‑ ции печени ALPPS и RALPPS [9–12], криовоздей‑ ствием [13, 14].
Что касается хирургического лечения добро‑ качественных опухолей, то при гемангиомах размером более 5 см и аденомах любых размеров показана резекция печени в пределах здоровых тканей. С целью снижения кровопотери, абластич‑ ности применяют предоперационную эмболиза‑ цию сосудов, плазменную и термокоагуляцию, сверхнизкие температуры [15].
Материал и методы
В клинике хирургических болезней с курсом травматологии и ортопедии Сибирского государ‑ ственного медицинского университета с 1978 г. в хирургии опухолей печени используется воз‑ действие сверхнизкими температурами (–196 оС) с помощью оригинальной криоаппаратуры. Она защищена 17 отечественными и 21 зарубежным патентами и представлена криоскальпелем, криоультразвуковым и криовиброскальпелем, криодеструктором (рис. 1). С 2005 г. применяют криодеструктор, адаптированный для лапароско‑ пических операций, с 2010 г. – криоаппликаторы из пористого никелида титана (рис. 2).
Сверхнизкие температуры, как показали наши экспериментальные исследования, позволяют воз‑ действовать на патологический очаг без значитель‑ ной реакции окружающих тканей с последующим образованием в зоне крионекроза нежного рубца.

Рис. 2. Эндоскопический криоаппликатор из пористого нике-лида титана таблица 1
характер оперативных вмешательств при злокачественных опухолях печени
|
Характер вмешательства |
Количество больных |
Умерло |
|
Криоультразвуковая резекция печени |
9 (10,7 %) |
‑ |
|
Резекция обычным скальпелем + криодеструкция культи печени |
58 (69,0 %) |
4 |
|
Гемиколонэктомия + правосторонняя гемигепатэктомия, криодеструкция культи печени |
2 (2,4 %) |
‑ |
|
Резекция печени, криодеструкция культи + криодеструкция метастатических узлов |
6 (7,1 %) |
‑ |
|
Ререзекция печени |
3 (3,6 5) |
‑ |
|
Криодеструкция опухоли протоков + стентирование протоков |
6 (7,1 %) |
‑ |
|
Итого |
84 (100 %) |
4 (4,8 %) |
Прекращение лимфотока и кровотока в области криовоздействия повышает абластичность вме‑ шательства, снижает интраоперационную крово‑ потерю (в эксперименте на животных – на 26 %, в клинической практике – на 25 %). Существенную роль при этом играет образование кристаллов льда из воды, составляющей значительную часть живой клетки. Объем ее увеличивается примерно на 10 %, что ведет к механическому повреждению мембран клеток и их гибели. Площадь и глубина крионекроза зависят от экспозиции и количества криоциклов. Деструктивное воздействие сверх‑ низких температур дает возможность использовать их и в качестве самостоятельного вмешательства для разрушения небольших по размеру гемангиом, метастатических опухолей.
Результаты и обсуждение
С применением криоаппаратуры оперирован 81 больной, из них первичные злокачественные опухоли печени наблюдались у 69 (85,2 %), мета‑ статические – у 12 (14,8 %). В 85 % наблюдений опухоли локализовались в правой доле, в 15 % – в левой. Размеры составляли от 5 см до 24. В боль‑ шинстве случаев первичный рак печени (ПРП) соответствовал IIIA стадии. У 6 больных отмечена опухоль Клацкина типа IIIа–IIIб по Bismuth – Cor‑ lette, с механической желтухой длительностью более 1 мес. Необходимо отметить связь ПРП с длительной описторхозной инвазией, которая вы‑ явлена у 61,4 % пациентов.
При анализе клинических данных нами выведен синдром «злокачественности», включающий в себя боли различной степени выраженности – в 92 %, увеличение размеров печени – в 90,7 %, давность заболевания менее 6 мес – в 70,8 %, пальпируемую опухоль – в 52,8 %, гипотрофию – в 47,8 %, желтуху – в 47,5 %, жалобы на нарастающую потерю массы тела – в 33,9 % наблюдений. Из лабораторных по‑ казателей в данный синдром входят увеличение СОЭ – в 88,5 %, гипоальбуминемия – в 85,7 %, гиперфибриногенемия – в 72,2 %, лимфопения – в 66,7 %, лейкоцитоз – в 39,6 % случаях. Концен‑ трация альфа‑фетопротеина >200 нг/мл отмечена у всех больных.
Из инструментальных методов диагностики наиболее доступным, позволяющим не только поставить диагноз рака печени, но и дифференци‑ ровать гепатоцеллюлярную форму от холангиоцел‑ люлярного рака (ХЦР) является УЗИ. Для первого гистотипа ПРП, по нашим данным, характерны: эхонегативная окантовка вокруг опухоли, четкие контуры, правильная форма, изоэхогенное изо‑ бражение, эхонегативные включения. Для холан‑ гиоцеллюлярного рака свойственны: правильная форма, нечеткие контуры, гипоэхогенность, эхо‑ негативные включения.
Как было отмечено выше, описторхозная инва‑ зия может привести к раковому поражению печени. Преобладающей формой рака при этом является холангиоцеллюлярная карцинома. Нами выделено 3 типа эхонегативной картины ХЦР: 1) опухоли внутрипеченочной локализации, развиваются из мелких протоков, характеризуются диффузно‑ инфильтративными изменениями паренхимы периферических отделов печени; 2) опухоли с поражением ворот печени (опухоль Клацкина) – объемные образования небольших размеров (до 3–5 см) без четких контуров, сопровождаются обструкцией желчных протоков; 3) опухоли с по‑ ражением дистальных желчных протоков.
К КТ, МРТ, ангиографии прибегали при неубе‑ дительных данных УЗИ для уточнения взаимоот‑ ношения опухоли с элементами ворот печени и нижней полой веной.
Характер оперативных вмешательств при зло‑ качественных новообразованиях с применением криовоздействия был следующим (табл. 1): резек‑ ция печени криоультразвуковым скальпелем – 9, обычная резекция с криодеструкцией культи по линии рассечения печени – 58, гемиколонэктомия в сочетании с правосторонней гемигепатэктоми‑ ей – 2; резекция печени, криодеструкция культи, криодеструкция метастатических узлов – 6. В трех наблюдениях произведена ререзекция печени при местных рецидивах опухоли.
Резекцию печени проводили по способу Б.И. Альперовича с предварительным наложением блоковидных швов по линии резекции, способ‑ ствующих уменьшению кровопотери и облегчаю‑ щих лигирование крупных сосудов (рис. 3). Все резекции по объему были обширными – удаление нескольких сегментов, гемигепатэктомии, рас‑ ширенные гемигепатэктомии. Применение крио‑
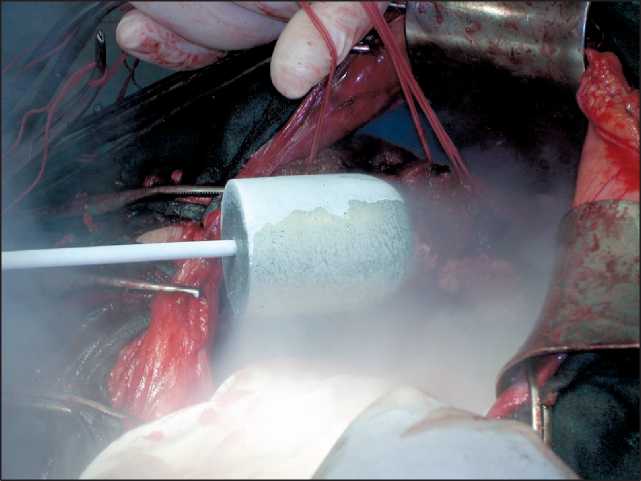
Рис. 3. Резекция печени с наложением по линии рассечения блоковидных швов по Б.И. Альперовичу и криодеструкцией культи
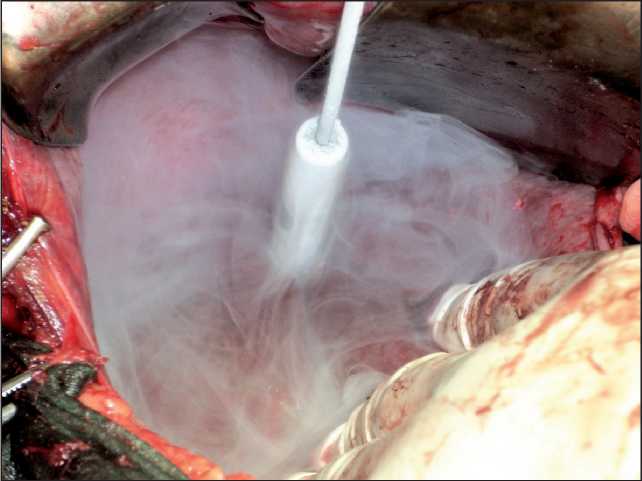
Рис. 4. Криодеструкция метастаза гепатоцеллюлярного рака печени
воздействия на 25 % уменьшило кровопотерю за счет промораживания мелких сосудов (до 1 мм), что улучшало визуализацию крупных сосудов в плоскости разреза и облегчало их перевязку, повышало абластичность операции за счет раз‑ рушения сверхнизкими температурами раковых клеток, попавших на поверхность культи. После резекций печени умерло 4 (5,1 %) человека. При‑ чина смерти – острая печеночная недостаточность, развившаяся после расширенных гемигепатэк‑ томий, при отсутствии гипертрофии оставшихся сегментов. У 3 больных в отдаленном периоде отмечен местный рецидив опухоли, именно им позднее были произведены ререзекции печени. Выживаемость больных составила до 1 года – 74,6 %, до 3 лет – 52 %, до 5 лет – 40 %.
Криодеструкцию можно применять и в качестве самостоятельной паллиативной операции – при небольших метастатических узлах либо при ло‑ кализации их в области крупных сосудов ворот печени (рис. 4). При опухолях Клацкина после их криодеструкции осуществлено стентирование окклюзированных протоков стентами из никелида титана.
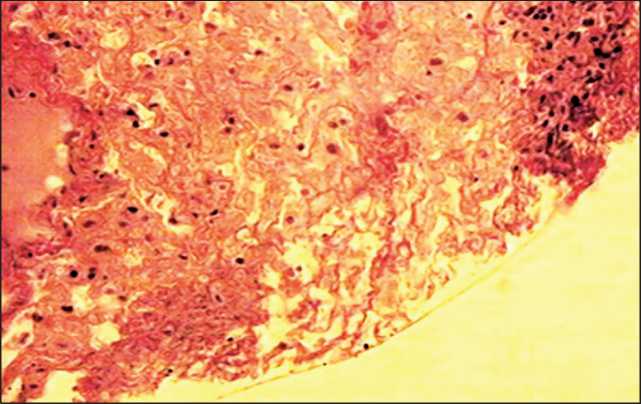
Рис. 5. Микрофото. Деструкция раковых клеток после криовоздействия
Оценивая эффективность применения сверхниз‑ ких температур в хирургии раков печени, можно констатировать, что криовоздействие уменьшает кровопотерю (ни разу не отмечено клинически значимого интраоперационного кровотечения), повышает абластичность вмешательств за счет де‑ струкции раковых клеток, которые могут оказаться в плоскости разреза, тем самым уменьшая число рецидивов заболевания (рис. 5).
Доброкачественные опухоли печени были пред‑ ставлены в основном гемангиомами. Клинически об этом заболевании можно думать при медленном росте новообразований (по нашим данным, в сред‑ нем – 3,6 года), наличии при пальпации опухоли овальной, округлой формы, мягкоэластической консистенции. Даже при больших гемангиомах со‑ судистых шумов над ними мы не выслушивали. Из инструментальных методов диагностики были ин‑ формативны селективная ангиография, КТ, эффек‑ тивность и чувствительность которых, по данным клиники, приближается к 100 %. Мало уступает им более доступное УЗИ, однако при больших раз‑ мерах гемангиом эхоскопическая картина трудно отличима от злокачественной опухоли.
Показаниями к оперативному лечению геманги‑ ом считаем: 1) одиночные опухоли размером более 5 см; 2) быстро растущие гемангиомы любых раз‑ меров в связи с риском сдавления магистральных протоков; 3) осложнения гемангиом (разрывы, на‑ гноения, некроз); 4) сомнения в характере опухоли. Всего оперировали 141 больного (табл. 2). Опера‑ цией выбора была резекция печени. Применение сверхнизких температур при гемангиомах печени осуществлялось в 3 вариантах. Криодеструкция с помощью криоскальпеля, криоультразвукового, криовиброскальпеля выполнена у 20 больных. Сред‑ няя кровопотеря при их применении – 300–700 мл, что значительно меньше, чем при резекции обыч‑ ным инструментом. Это особенно важно, посколь‑
При аденомах печени операции с использова‑ нием криоаппаратуры произведены у 9 человек: криорезекции – у 4, обычные резекции с криоде‑ струкцией культи печени – у 5. Клинические про‑
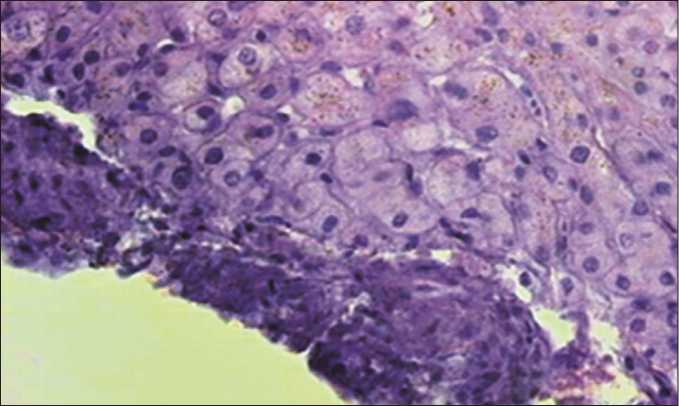
Рис. 6. Микрофото. Нарушение структурности гемангиомы после криодеструкции, картина асептического некроза
явления аденом были скудны, но болевой синдром той или иной выраженности отмечался у всех, про‑ пальпировать опухоль удалось лишь у 4 пациентов. Каких‑либо значимых изменений со стороны лабо‑ раторных показателей не найдено. Ультразвуковая картина характеризовалась наличием объемных образований различных размеров (от 3 до 25 см) с четкими контурами, однородной структуры, чаще гиперэхогенной. Крупные аденомы могут смещать сосуды в зоне поражения, вызывать ампутацию мелких. В плане дифференциальной диагностики у 4 больных пришлось прибегнуть к ангиографии, КТ.
Возможность развития осложнений, озлока‑ чествления аденом диктует необходимость опера‑ тивного лечения. В отличие от мнения некоторых гепатологов операцией выбора считаем резекцию печени в пределах здоровых тканей, а не околоопу‑ холевую резекцию органа. Объем резекции зависел от размеров опухоли, большинство их было в пре‑ делах гемигепатэктомии (масса опухоли в одном
Список литературы Криохирургия опухолей печени
- Гранов А.М., Тютин Л.А., Поздняков А.В. Современные возможности лучевой диагнотики рака печени. Вопросы онкологии. 2008; 54 (4): 410-16.
- Бражникова Н.А., Цхай В.Ф. Особенности рака печени при хроническом описторхозе. Анналы хирургической гепатологии. 2008; 13(3): 85-87.
- Мерзликин Н.В., Альперович Б.И., Бражникова Н.А., Цхай В.Ф., Сотников А.А., Комкова Т.Б., Толкаева М.В. Руководство по хирургии очаговых паразитарных заболеваний печени. Томск, 2014; 468.
- Багненко С.С., Труфанов Г.Е., Железняк И.С. Магнитно-резонансная томография в диагностике очаговых поражений печени. Анналы хирургической гепатологии. 2016; 21 (3): 64-69.
- Афанасьев С.Г., Тузиков С.А. Нерезектабельные опухоли печени (обзор литературы). Сибирский онкологический журнал. 2006; 1: 49-54.


