Криоконсервация - перспективный метод хранения промышленно ценных штаммов молочнокислых бактерий и дрожжей
Автор: Савкина О.А., Терновской Г.В., Локачук М.Н., Павловская Е.Н., Сафронова В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Корма: культуры, биотехнологии, контроль качества
Статья в выпуске: 4 т.49, 2014 года.
Бесплатный доступ
В кормопроизводстве к элементам технологии, обеспечивающей при силосовании подавление нежелательных микроорганизмов (маслянокислых бактерий, энтеробактерий и дрожжей, размножение которых вызывает соответственно контаминацию корма масляной кислотой и его аэробную порчу), относится применение препаратов молочнокислых бактерий (попытки указать на значение молочнокислого брожения при сенажировании подвергались критике). В хлебопекарной промышленности благодаря использованию чистых культур молочнокислых бактерий и дрожжей в качестве стартовых композиций контролируется направление процесса брожения в ржаных и пшеничных хлебных заквасках. Для снабжения различных отраслей промышленности чистыми культурами микроорганизмов необходимо постоянно поддерживать их в условиях музейной коллекции в активном состоянии, отслеживая сохранность биотехнологических свойств. Мы изучили влияние криоконсервации при -80 °С на жизнеспособность и биотехнологические свойства промышленно ценных штаммов на примере молочнокислых бактерий (МКБ) и дрожжей (коллекция СПбФ ГОСНИИ хлебопекарной промышленности). Проведенные исследования показали, что выживаемость 10 представителей рода Lactobacillus обусловлена особенностями штаммов, начальным титром клеток и наличием криопротекторов. При одновременном использовании 30 % глицерина и 17 % сахарозы в защитной среде, а также повышении титра исходных суспензий с помощью центрифугирования до 10 7-10 8 кл/мл наблюдалось незначительное снижение жизнеспособности и кислотообразующей активности МКБ после 2 лет хранения (соответственно менее чем на 20 и 16 %). Установлено, что результат криоконсервации дрожжей зависит как от наличия криопротектора, так и от возраста культуры. Выживаемость и бродильная активность штамма Saccharomyces cerevisiae, замороженного в стационарной фазе роста при использовании 15 % глицерина, к концу срока хранения составляли соответственно 99,8 и 77,9 %. Менее устойчивым оказался штамм Candida milleri, у которого жизнеспособность упала более чем на 30 %. Полученные результаты могут быть использованы для разработки методических рекомендаций по криоконсервации МКБ и дрожжей, применяемых в хлебопекарной промышленности, а также для сельскохозяйственных целей.
Криоконсервация, молочнокислые бактерии, дрожжи
Короткий адрес: https://sciup.org/142133518
IDR: 142133518 | УДК: 631.46:57.083
Текст научной статьи Криоконсервация - перспективный метод хранения промышленно ценных штаммов молочнокислых бактерий и дрожжей
К элементам технологии, обеспечивающей при силосовании подавление нежелательных микроорганизмов (маслянокислых бактерий, энтеробактерий и дрожжей, размножение которых вызывает соответственно контаминацию корма масляной кислотой и его аэробную порчу), относится применение препаратов молочнокислых бактерий (попытки указать на значение молочнокислого брожения при сенажировании подвергались критике) (1). Молочнокислые бактерии (МКБ) и дрожжи — специфичная микрофлора хлебопекарных полуфабрикатов. Применение чистых культур молочнокислых бактерий и дрожжей в качестве стартовых композиций обеспечивает нужное направление процесса брожения в ржаных и пшеничных хлебных заквасках. МКБ продуцируют молочную, уксусную и другие органические кислоты, которые влияют на реологические свойства теста, а также вкус и запах готовых изделий, особенно с использованием ржаной муки. Дрожжи выполняют роль биологических разрыхлителей в заквасках и тесте, оказывают существенное влияние на пористость мякиша и объем хлебобулочных изделий. Для снабжения предприятий чистыми культурами микроорганизмов необходимо постоянно поддерживать их в условиях музейной коллекции в активном состоянии, отслеживая сохранность биотехнологических свойств (2, 3).
Известны способы хранения культур микроорганизмов методом периодических пересевов, под слоем минерального масла, в сухой стерильной почве и песке, в солевых растворах, в лиофилизированном состоянии и при низких температурах (4). В настоящее время микроорганизмы в коллекции Санкт-Петербургского филиала Государственного НИИ (Гос-НИИ) хлебопекарной промышленности поддерживаются методом периодических пересевов. К недостаткам метода следует отнести необходимость соблюдать регламенты пересевов, потребность в большом количестве посуды, питательных сред, значительные затраты времени, ошибки при обозначении штаммов, высокий риск загрязнения культур, потери их жизнеспособности и целевых свойств (2, 5).
Перспективным методом долгосрочного хранения микроорганизмов считается криоконсервация. Ее преимущества заключаются в снижении риска генетических изменений, что приводит к сохранению в стабильном состоянии свойств культур, небольшие временные и материальные затраты, а также возможность использовать замороженные образцы в качестве прямого инокулята. Кроме того, как известно из специальной литературы, микроорганизмы, хранящиеся при низких температурах, повреждаются в меньшей степени и имеют более высокую жизнеспособность, чем высушенные и лиофилизированные (5-7). Именно поэтому метод криоконсервации рекомендован для широкого использования в национальных коллекциях микроорганизмов (8).
Наша цель заключалась в изучении влияния криоконсервации при - 80 ° С на жизнеспособность и биотехнологические свойства молочнокислых бактерий и дрожжей для разработки методических рекомендаций по их криоконсервации и использованию при производстве разных видов заквасок.
Методика . Объектами исследования были 10 промышленно ценных штаммов молочнокислых бактерий рода Lactobacillus ( L . brevis Е-36, L . bu-chneri 26, 30, L . fermentum 34, L . paracasei 5 и 63, L . plantarum 1, 78, И-30 и 13), а также два штамма дрожжей ( Saccharomyces cerevisiae Л-1 и Candida milleri Чернореченский) из коллекции «Молочнокислые бактерии и дрожжи для хлебопекарной промышленности» (Санкт-Петербургский филиал ГосНИИ хлебопекарной промышленности).
Криоконсервацию культур МКБ проводили в соответствии с двумя протоколами. В первом варианте культуры были выращены на солодовом сусле (12 % сухого вещества) с осадком без мела в течение 48 ч при оптимальной для каждого штамма температуре (30 и 37 ° С) до конечного титра примерно 10 7 -108 кл/мл и заморожены без использования криопротекторов. Согласно второму протоколу, жидкие культуры центрифугировали (6000 об/мин в течение 10 мин) и ресуспендировали в защитной среде (водный раствор, содержащий 30 % глицерина и 17 % сахарозы), конечный титр — 10 7 -108 кл/мл. Культуры дрожжей в стационарной и логарифмической фазе роста подвергались з амораживанию с использованием защитной среды (водный раствор, содержащий 1 % пептона, 0,5 % дрожжевого экстракта, 2 % глюкозы и 15 % глицерина) и без нее. Замораживание приготовленных суспензий, расфасованных по 200 мкл в криопробирки, проводили при - 20 ° С (скорость охлаждения — примерно 5 ° С/мин). После криоконсервации культуры помещали в Станцию низкотемпературного автоматизированного хранения биологических образцов при - 80 ° С («Liconic Instruments», Лихтенштейн), которая функционирует во Всероссийском НИИ сельскохозяйственной микробиологии (9).
Размораживание культур осуществляли при 37 ° C в течение 3 мин. Для определения жизнеспособности и биотехнологических свойств молочнокислых бактерий 0,1 мл размороженной суспензии переносили из криопробирки в колбу со 100 мл среды (солодовое сусло, содержащее 12 % сухого вещества, с осадком без мела), затем отбирали 1 мл полученной суспензии и помещали колбы в термостат на 48 ч при оптимальной для каждого штамма температуре (30 и 37 ° C). Жизнеспособность МКБ оценивали после разных сроков хранения (1, 3, 6, 15, 18 и 24 мес) методом глубинного посева на 3 чашки Петри (с последующим расчетом среднего значения) из разведений 10-4-10-7 в сусло-агар с мелом, содержащий 12 % сухого вещества, или на агаризованную среду Мозера-Рогоза-Шарпа (MRS). Чашки с посевами инкубировали при оптимальной для каждого штамма температуре (30 и 37 ° C) в течение 4 сут и подсчитывали выросшие колонии. Процент выживаемости микроорганизмов находили по отношению логарифма среднего значения числа колониеобразующих единиц (КОЕ) после размораживания к значениям, полученным в исходной культуре (до криоконсервации).
Кислотообразующую активность МКБ учитывали методом титрования, отбирая из колбы для подготовки 3 параллельные пробы (с расчетом среднего значения) по 10 мл культуры через 24 и 48 ч роста. Для определения жизнеспособности и биотехнологических свойств дрожжей 0,1 мл размороженной суспензии дрожжевых клеток переносили в колбу со 100 мл среды (солодовое сусло, содержащее 8 % сухого вещества), затем отбирали 1 мл полученной суспензии и помещали колбы в термостат на 48 ч при температуре 30±1 ° C. Жизнеспособность дрожжей после различных сроков хранения оценивали методом поверхностного рассева из разведений 10-410-6 в 3 чашки Петри (с расчетом среднего значения) на сусло-агар, содержащий 8 % сухого вещества, подсчитывая колонии после инкубации при 30±1 ° C в течение 48 ч. Процент выживаемости находили по отношению логарифма КОЕ после размораживания к значениям, полученным в исходной культуре (до криоконсервации). Бродильную активность дрожжей учитывали по количеству выделенного диоксида углерода при внесении 0,1 мл суспензии размороженной культуры в 100 мл солодового сусла, содержащего 8 % сухого вещества (колбы с сернокислотными затворами Мейселя), и инкубации в течение 48 ч при 30 ° C. О величине показателя судили по разнице между начальной и конечной массой колбы, которая соответствует расходу сухих веществ на брожение.
Для изучения технологических свойств МКБ и дрожжей после криоконсервации выполняли выведение ржаных заквасок в соответствии с приведенными инструкциями (10). Для приготовления заквасок использовали культуры, которые после размораживания выращивали в течение 48 ч.
Данные обрабатывали по t -критерию Cтьюдента (ошибки не приведены, поскольку выводы основаны на очевидно достоверных различиях).
Результаты . Установлено (рис. 1), что жизнеспособность культур МКБ, заложенных на хранение без криопротекторов, через 24 мес снизилась до 72,1-85,3 %. Криоконсервирование МКБ с использованием комплекса криопротекторов глицерина и сахарозы обеспечивало поддержание значительно более высокой жизнеспособности в течение всего срока хранения. Положительное влияние глицерина и сахарозы на криоустойчивость различных групп микроорганизмов, в том числе МКБ и дрожжей, было показано и ранее (4, 7, 11, 12). Применение защитной среды и повышение титра культур перед криоконсервацией при помощи центрифугирования позволило увеличить жизнеспособность промышленно ценных
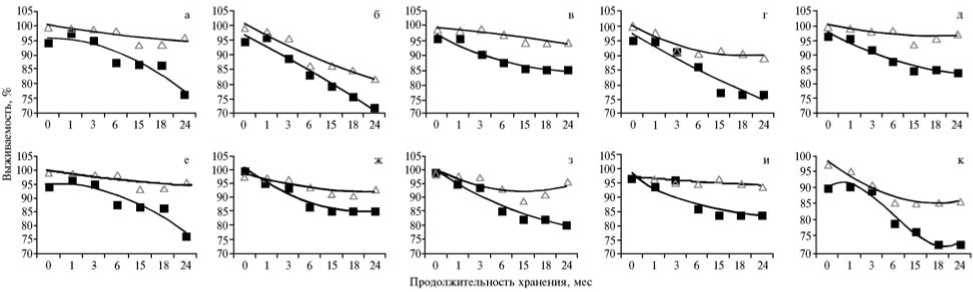
Рис. 1. Влияние продолжительности криохранения на выживаемость штаммов молочнокислых бактерий в зависимости
от начального титра клеток и наличия крио протекторов: а — Lactobacillus plantarum 1, б — L. buchneri 26, в — L. buchneri 30, г — L. fermentum 34, д — L. paracasei 63, е — L. paracasei 5, ж — L. plantarum 78, з — L. brevis E-36, и — L. plantarum И-30, к — L. plantarum 13; значения в вариантах с применением криопротекторов и центрифугированием суспензии перед криоконсервацией обозначены треугольниками, без использования криопротекторов и центрифугирования — квадратами.
штаммов МКБ до 81,9-97,4 %. В ряде случаев наблюдали повышение титра МКБ в процессе хранения, что может быть связано с разделением агглютинированных клеток.
Изученные культуры существенно различались по криорезистентности, однако корреляции между этим параметром и видовой принадлежностью штаммов установлено не было. Так, выживаемость трех штаммов L . plantarum (78, И-30 и 13) к концу срока хранения в защитной среде колебалась в пределах 85-95 % (см. рис. 1; ж, и, к). Наиболее криочувстви-тельным оказался штамм L . buchneri 26, максимальная выживаемость которого после 24 мес хранения составила 81,9 % (см. рис. 1, б).
В отношении изменения кислотообразующей активности МКБ в процессе криоконсервации было установлено (табл. 1.), что при хранении без криопротекторов в течение 24 мес этот показатель уменьшался не более чем на 6-31 %. Исключение составил штамм L. paracasei 63, активность которого снизилась на 54 %. При применении криопротекторов ки-слотообразование к концу срока хранения подавлялось не более чем на 616 %, у большинства штаммов МКБ наблюдался активный рост, что подтверждалось интенсивным равномерным помутнением среды, выделением пузырьков газа и высокими показателями кислотообразования.
1. Кислотообразующая активность молочнокислых бактерий ( Lactobacillus ) после криохранения в зависимости от его продолжительности и наличия криопротекторов
|
Вид и штамм |
Титруемая кислотность через 48 ч культивирования |
|
|
исходная, ° |
от исходной (по срокам криохранения), % |
|
|
0 мес \ 1 мес 3 мес 6 мес 15 мес 18 мес 24 мес |
||
Без криопротекторов
|
L. plantarum 1 |
11,1 |
100 |
100 |
82,9 |
91,9 |
75,7 |
100 |
100 |
|
L. buchneri 26 |
17,0 |
69,5 |
97,1 |
44,7 |
74,1 |
90,6 |
100 |
94,10 |
|
L. buchneri 30 |
10,7 |
100 |
95,3 |
95,3 |
100 |
97,2 |
100 |
100 |
|
L. fermentum 34 |
12,7 |
93,7 |
94,5 |
66,1 |
96,1 |
80,3 |
100 |
83,50 |
|
L. paracasei 63 |
10,4 |
100 |
100 |
65,4 |
67,3 |
82,7 |
100 |
46,20 |
|
L. paracasei 5 |
10,1 |
100 |
99,0 |
89,1 |
79,2 |
71,3 |
83,2 |
100 |
|
L. plantarum 78 |
11,4 |
94,7 |
91,2 |
77,2 |
71,9 |
66,7 |
100 |
85,96 |
|
L. brevis E-36 |
10,7 |
100 |
93,5 |
91,6 |
99,1 |
87,9 |
93,5 |
85,98 |
|
L. plantarum И-30 |
11,5 |
88,7 |
93,9 |
83,5 |
87,0 |
80,0 |
99,1 |
78,30 |
|
L. plantarum 13 |
12,2 |
91,8 |
100 |
86,9 |
67,2 |
72,1 |
75,2 |
68,90 |
|
C криопротекторами |
||||||||
|
L. plantarum 1 |
11,4 |
93,0 |
98,2 |
100 |
94,7 |
89,5 |
87,7 |
87,70 |
|
L. buchneri 26 |
17,6 |
100 |
98,3 |
96,6 |
89,8 |
90,9 |
79,5 |
83,90 |
|
L. buchneri 30 |
12,8 |
93,8 |
96,9 |
100 |
65,6 |
92,2 |
84,4 |
81,30 |
|
L. fermentum 34 |
11,8 |
100 |
100 |
100 |
93,2 |
96,6 |
89,8 |
88,10 |
|
L. paracasei 63 |
10,4 |
88,5 |
94,2 |
100 |
88,5 |
94,2 |
90,4 |
86,50 |
|
L. paracasei 5 |
10,4 |
94,2 |
98,1 |
100 |
86,5 |
88,5 |
86,5 |
86,50 |
|
L. plantarum 78 |
11,4 |
98,2 |
100 |
100 |
98,2 |
87,7 |
87,7 |
87,70 |
|
L. brevis E-36 |
9,4 |
95,7 |
97,9 |
100 |
89,4 |
97,9 |
91,5 |
87,20 |
|
L. plantarum И-30 |
10,6 |
100 |
100 |
100 |
86,8 |
88,7 |
86,8 |
94,30 |
|
L. plantarum 13 |
10,4 |
100 |
100 |
100 |
98,1 |
88,5 |
90,4 |
86,50 |
Таким образом, показано, что выживаемость 10 промышленно ценных представителей рода Lactobacillus в процессе криоконсервации была обусловлена биологическими особенностями штаммов, начальным титром клеток в образце и наличием криопротекторов. Использование глицерина и сахарозы в защитной среде, а также повышение титра исходных суспензий с помощью центрифугирования обеспечивали незначительное (менее 20 %) падение жизнеспособности культур после 2 лет хранения при - 80 ° C. Полученные результаты позволяют сделать вывод о преимуществах криоконсервации МКБ по сравнению с широко используемым методом лиофильного высушивания. По данным репрезентативного анализа жизнеспособности у 84 штаммов разных видов Lactobacillus после лиофилизации, средняя выживаемость в культурах составляла 58 % (13). В то же 116
время у лиофильно высушенных штаммов L . plantarum и L . paracasei после 120 сут хранения отмечено падение кислотообразующей активности на 3050 % (11). Более выраженное снижение жизнеспособности и кислотообразующей активности МБК в результате лиофилизации связано с дополнительным стрессовым воздействием, которое оказывает высушивание (14).
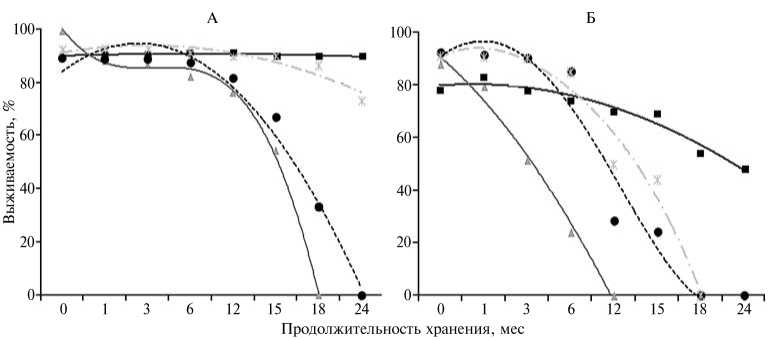
Рис. 2. Жизнеспособность дрожжей при криохранении в зависимости от его продолжительности, наличия криопротектора и фазы роста криоконсервируемой культуры: А — Saccharomyces cerevisiae Л-1, Б — Candida milleri Чернореченский; значения в вариантах с применением криопротекторов для культур в стационарной и логарифмической фазе отмечены соответственно квадратами и кружками, без применения криопротекторов для культур в стационарной и логарифмической фазе — соответственно звездочками и треугольниками.
2. Бродильная активность дрожжей после криохранения в зависимости от его продолжительности, наличия криопротекторов и фазы роста криоконсервируемой культуры
Количество СО2, выделившегося за 48 ч культивирования
|
Вариант протокола |
в исходной культуре, г |
от исходной (по срокам криохранения), % |
|
0 мес | 1 мес | 3 мес | 6 мес |12 мес|15 мес|18 мес|24 мес |
Saccharomyces cerevisiae Л - 1
С защитной средой, фаза роста культуры:
|
стационарная |
1,30 |
92,4 |
93,9 |
84,7 |
100,0 |
100,0 |
93,1 |
96,9 |
77,9 |
|
логарифмическая |
1,10 |
100,0 |
90,0 |
89,1 |
100,0 |
89,1 |
90,0 |
65,5 |
36,4 |
|
Без защитной среды, фаза роста культуры: |
|||||||||
|
стационарная |
1,16 |
100,0 |
84,5 |
81,0 |
81,9 |
80,2 |
85,3 |
86,2 |
84,8 |
|
логарифмическая |
1,10 |
100,0 |
90,0 |
87,3 |
93,6 |
80,0 |
85,5 |
47,3 |
29,1 |
|
Candida |
milleri |
Чернореченский |
|||||||
|
С защитной средой, фаза роста культуры: |
|||||||||
|
стационарная |
0,32 |
100,0 |
59,4 |
65,6 |
100,0 |
93,8 |
100,0 |
78,1 |
34,4 |
|
логарифмическая |
0,23 |
100,0 |
100,0 |
100,0 |
100,0 |
78,3 |
104,3 |
52,2 |
0,0 |
|
Без защитной среды, фаза роста культуры: |
|||||||||
|
стационарная |
0,20 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
75,0 |
0,0 |
|
логарифмическая |
0,28 |
92,9 |
75,0 |
67,9 |
53,6 |
39,3 |
0,0 |
0,0 |
0,0 |
Анализ показал (рис. 2), что выживаемость дрожжевых клеток в процессе криоконсервации зависит от использования криопротектора и фазы роста культуры перед замораживанием. У дрожжей S . cerevisiae Л-1, криокон-сервированных в стационарной фазе роста, использование глицерина в составе защитной среды позволило увеличить жизнеспособность к концу срока хранения до 99,8 %. При замораживании культуры, находящейся в логарифмической фазе (как с использованием глицерина, так и без него), роста биомассы дрожжей через 24 мес хранения не наблюдали. Менее криоустой-чивым оказался штамм C . milleri Чернореченский, который после 2 лет поддержания в замороженном состоянии сохранял жизнеспособность только при использовании культуры, находящейся в стационарной фазе роста, и защитной среды, при этом выживаемость упала более чем на 30 %.
Бродильная активность дрожжей, как и их жизнеспособность, зависела от наличия криопротектора и возраста культуры, подвергнутой замораживанию (табл. 2). У образцов S. cerevisiae Л-1, которые перед криоконсервацией достигли стационарной фазы роста, отмечали менее значительное снижение этого показателя, чем у находящихся в логарифмической фазе (как при наличии защитной среды, так и без нее). Бродильная активность у C. milleri Чернореченский уменьшалась во всех вариантах уже через 18 мес хранения. Через 2 года отмечалось сохранение бродильной активности только у культуры, замороженной в стационарной фазе роста с использованием защитной среды. Следовательно, для повышения эффективности низкотемпературного хранения этого штамма дрожжей необходима оптимизация протокола криоконсервации. В частности, большое значение имеет подбор температуры замораживания клеточных суспензий (15).
Анализ биотехнологических показателей качества ржаных заквасок (густых, жидких с заваркой и без нее) показал, что при криоконсервации чистых культур микроорганизмов с криопротекторами в течение 24 мес не отмечалось существенного изменения кислотообразующей активности, подъемной силы и объема по сравнению с заквасками на культурах, поддерживаемых в коллекции методом периодических пересевов.
Итак, у 12 штаммов (молочнокислые бактерии рода Lactobacillus и дрожжи Saccharomyces cerevisiae Л-1 и Candida milleri Чернореченский) изучены промышленно значимые свойства после криоконсервирования при - 80 ° С. Показано, что все культуры (за исключением штамма дрожжей C . milleri ) сохраняют высокую жизнеспособности и биотехнологическую активность в течение 24 мес и могут быть использованы при приготовлении разных видов заквасок для хлебопекарной промышленности в соответствии с установленным разводочным циклом. Разработана методика криоконсервации и реактивации исследованных коммерческих образцов молочнокислых бактерий и дрожжей, однако отмечается, что для некоторых штаммов может потребоваться подбор специальных условий замораживания. Выполненное определение жизнеспособности и ферментативной активности штаммов позволяет в целом положительно оценить перспективность криохранения микробиологических препаратов и в других областях, например в кормопроизводстве. В то же время тот выявленный факт, что результаты поддержания свойств культуры при криоконсервации зависят от биологических особенностей штамма, указывает на необходимость предварительной проверки и оптимизации протоколов закладки образцов на хранение.


