Криопреципитатаферез с трансфузией ультрафиолетом облученной аутоэритроцитарной массы в дифференцировке морфологической структуры эритроцитов
Автор: Федосейкин Илья Васильевич
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
Криопреципитатаферез с трансфузией облученной ультрафиолетовыми лучами аутоэритроцитарной массы ведет к фотодифференцировке мембран эритроцитов, положительно влияя на их морфофункциональное состояние, уменьшая количество структурно несостоятельных клеток и увеличивая их резистентность к эндотоксинам. По функциональным и клиническим показателям комбинированная эфферентно-квантовая операция значительно превосходит традиционное лечение по степени и глубине коррекции гомеостаза, что находит отражение в концепциях о приоритете плазмосохраняющих и фотомодификационных трансфузиологических операций.
Криопреципитатаферез, фотомодификация аутоэритромассы
Короткий адрес: https://sciup.org/14112887
IDR: 14112887 | УДК: 616.15-005
Текст научной статьи Криопреципитатаферез с трансфузией ультрафиолетом облученной аутоэритроцитарной массы в дифференцировке морфологической структуры эритроцитов
Введение. Сочетание эфферентного метода, позволяющего в большей степени удалять из кровеносного русла токсины различного происхождения, с фотомодификацион-ными, выполняющими в основном функцию стимуляции биоактивных веществ, представляется наиболее удачным [1, 3]. Преимуществом криопреципитатафереза (КПА) является сохранение собственной плазмы больного, а изолированное облучение форменных элементов решает проблему с экстракорпоральной стимуляцией защитных сил организма [3].
Трансфузия фотомодифицированной аутоэритромассы в клинике основывалась на усилении процессов фотоизомеризации эритроцитов при их изолированном облучении, что приводит к изменениям примембранного слоя клеток и влечет за собой, с одной стороны, положительные сдвиги в функциональном состоянии эритроцитов, с другой – поступление в кровеносное русло веществ, обладающих биологической активностью (гистамин, биогенные амины, гистидин, ацетилхолин) [2].
Лечебное действие фотомодифицирован-ной аутоэритромассы является следствием образования веществ в оптимальных концен- трациях, которое не может быть воспроизведено с помощью лекарственных препаратов.
Цель исследования. Изучить влияние криопреципитатафереза с трансфузией облученной ультрафиолетовыми лучами аутоэритроцитарной массы на морфологическую структуру мембран эритроцитов.
Материалы и методы. Проведено 69 операций КПА с аутотрансфузией ультрафиолетом облученной аутоэритроцитарной массы (АУФОЭМ), полученной в результате гравитационного разделения компонентов крови у 21 больного острыми гнойными абсцессами легких.
Анализ динамики изменений морфологического состава периферической крови проведен у 21 больного острыми гнойными абсцессами легких, в комплексном лечении которых применяли КПА+АУФОЭМ. Полученные данные сравнивали с результатами исследования аналогичных параметров у 25 пациентов, в отношении которых применялся КПА, и 26 – с традиционным лечением.
Результаты и обсуждение. В опытах in vitro установлено: облучение изолированных эритроцитов, в отличие от фотомодификации цельной крови, ведет к более выраженной их дифференцировке. J. Cook, E. Marchall ука- зывали на фотогемолиз при ультрафиолетовом облучении (УФО) отмытых эритроцитов. Апробация этого эффекта в нашей лаборатории подтвердила данный факт, но лишь при использовании сверхбольших доз УФО. С увеличением количества плазмы, в которой находились эритроциты, явления фотогемолиза уменьшались, а при терапевтических дозах УФО (239–365 нм) гемолиз эритроцитов не наблюдался даже в отмытых пробах.
Применению АУФОЭМ у больных гнойно-воспалительными заболеваниями предшествовало изучение безопасности данного метода в свете реакции фотогемолиза эритроцитов при их изолированном облучении, а также возможности многократного использова- ния данного метода у одного больного. На эту идею нас натолкнули существенные различия в изолированном и неизолированном облучении эритроцитов in vitro.
При электронно-микроскопическом исследовании тонких и ультратонких срезов эритроцитов после изолированного облучения определялась тенденция к увеличению количества дискоцитов и уменьшению числа эхиноцитов и сфероцитов. Данные изменения не происходили и/или были менее выражены при облучении цельной крови. Также при изолированном облучении наблюдалась стабилизация цитоплазматической мембраны, и содержимое эритроцитов становилось более гомогенным (рис. 1).
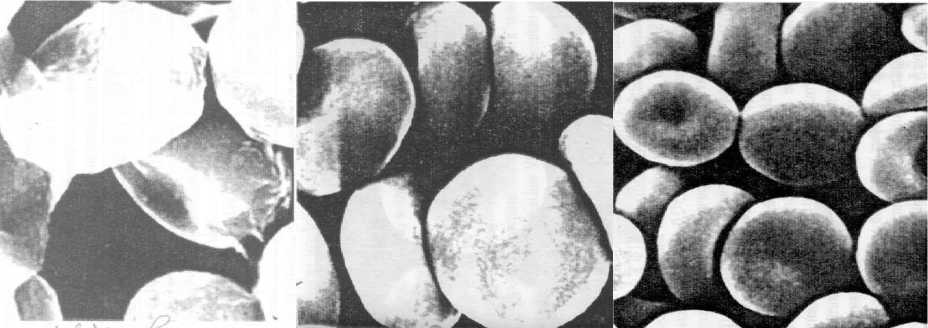
а б в
Рис. 1. Электронограмма эритроцитов больного острым гнойным абсцессом легкого: а – при поступлении; б – после облучения цельной крови; в – после АУФОЭМ
Изолированное облучение с последующей трансфузией эритроцитов вело к уменьшению их структурной несостоятельности. В эритрограмме при поступлении больных в стационар (с гемолизирующим агентом – соляной кислотой) преобладали популяции эритроцитов с низкой резистентностью.
В то же время в крови больных после курса КПА+АУФОЭМ возрастало количество высокостойких и среднестойких форм эритроцитов. Увеличение резистентности эритроцитов при АУФОЭМ связано с микроструктурной фотодифференцировкой их мембраны. Если при поступлении в стационар у больного определялось повышенное количество деформированных эритроцитов (в сравнении с донорами), то после КПА+АУФОЭМ происходило их уменьшение в 2,4 раза (p<0,01), вплоть до достижения нормальных величин (табл. 1). После проведения сеансов КПА+АУФОЭМ гемолиза эритроцитов не наблюдалось.
После завершения курса ГКПА+АУФОЭМ количество гемоглобина достоверно возрастало на 22,1 %, после КПА – на 22,4 %, в группе с традиционным лечением – на 17,0 % (табл. 2).
Таблица 1
|
Эритроциты |
Традиционное лечение |
КПА |
КПА+ АУФОЭМ |
Доноры |
|
|
Высокостойкие, % |
ПП |
21,7 ± 2,4 |
20,9 ± 2,7 |
21,1 ± 2,0 |
20–30 |
|
ПЛ |
23,1 ± 3,2* |
24,2 ± 3,1* |
34,9 ± 2,6** |
||
|
Среднестойкие, % |
ПП |
42,4 ± 3,1 |
41,8 ± 3,5 |
42,9 ± 3,4 |
40–55 |
|
ПЛ |
44,7 ± 3,8* |
46,1 ± 4,1* |
53,6 ± 3,7** |
||
|
Пониженностойкие, % |
ПП |
35,9 ± 3,6 |
37,3 ± 4,1 |
36,0 ± 2,4 |
20–35 |
|
ПЛ |
32,2 ± 3,0* |
29,7 ± 2,9* |
11,5 ± 1,2** |
||
Примечание. * – достоверное изменение показателя в группах, ** – достоверное изменение показателя относительно группы сравнения. ПП – при поступлении, ПЛ – после лечения.
Эритрограмма больных в исследуемых группах
Таблица 2
Динамика содержания гемоглобина у больных в исследуемых группах, г/л
|
Метод лечения |
До лечения |
После лечения |
|
Традиционное лечение, n=26 |
104,4 ± 6,9 |
122,1 ± 5,8* |
|
КПА, n=25 |
103,8 ± 7,2 |
127,0 ± 6,1* |
|
КПА+АУФОЭМ, n=21 |
102,9 ± 6,8 |
130,1 ± 6,2* |
Примечание. * – достоверное изменение показателя в группах.
Сеансы КПА с АУФОЭМ улучшают аппетит и общее самочувствие больных, усиливают отток отделяемого из полости абсцесса, уменьшают боли, снижают температуру тела.
Выводы:
OF ULTRAVIOLET-TREATED AUTOERYTHROCYTIC MASS
TO DIFFERENTIATION MORPHOLOGICAL
STRUCTURALLY ERYTHROCYTE
Mordovian State University
Список литературы Криопреципитатаферез с трансфузией ультрафиолетом облученной аутоэритроцитарной массы в дифференцировке морфологической структуры эритроцитов
- Белых В. И. Использование экстракорпоральных методов (плазмаферез, аферез-псорален-ультрафиолетовая терапия) в лечении иммунных заболеваний: автореф. дис. … д-ра мед. наук. Барнаул, 2001. 37 с.
- Векслер Н. Ю. Многообразие методов эфферентной терапии, что выбрать?//Общ. реаниматология. 2006. Т. 2, № 4/1. С. 68-70.
- Дуткевич И. Г., Марченко А. В. Фотогемотерапия -итоги и перспективы//Эндогенные интоксикации. СПб., 1994. С. 163-168.


