Криосохранение каллусных клеток Lupinus angustifolius L. при низких температурах в условиях электроморозильника
Автор: Сергушкина М.И., Зайцева О.О., Полежаева Т.В., Соломина О.Н., Худяков А.Н., Шуплецова О.Н.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Научные статьи
Статья в выпуске: 7 (73), 2024 года.
Бесплатный доступ
По мере развития биологических наук разработка новых протоколов для криосохранения различных биологических объектов становится все более востребованной. Особую актуальность имеет оптимизация современных способов долгосрочного хранения каллусных тканей растений, отличающихся труднодоступностью и высокой стоимостью. В статье оценивали возможность сохранения каллусных клеток Lupinus angustifolius L. в течение семи суток в условиях бытового электроморозильника, установленного на температуру -80 °С с применением традиционного криопротектора диметилсульфоксида. Показана перспективность представленного способа криоконсервирования каллуса. Исследования в данном направлении будут продолжены.
Каллус, криосохранение, жизнеспособность, электроморозильник, диметилсульфоксид
Короткий адрес: https://sciup.org/149146781
IDR: 149146781 | УДК: 581.143.6+57.043 | DOI: 10.19110/1994-5655-2024-7-127-132
Текст научной статьи Криосохранение каллусных клеток Lupinus angustifolius L. при низких температурах в условиях электроморозильника
В настоящее время исследователи разного профиля широко используют каллусные культуры для разработки и выпуска биологически активных веществ (далее – БАВ) и новых, более эффективных цепочек соединений. Именно поэтому столь важно соблюдать все необходимые условия и брать во внимание все факторы, в том числе генотип, характеристики питательной среды, тип экспланта и т. д., обеспечивающие наращивание каллусной ткани. Далее для сохранения ценных свойств необходимо периодически пересаживать каллус на свежую питательную среду (каждые четыре недели) [1]. Однако в результате частой пересадки в каллусных культурах возникают негативные изменения (инфицирование, образование мутантных клеток, утрата способности к делению, возникновение сома-клональных вариантов, гибель клеток и т. д.). [2]. Одним из методов снижения частоты пассирования является использование метода криоконсервирования каллуса. Исследователи разработали множество способов криоконсервирования животных клеток и тканей с сохранением репродуктивной способности (ооциты, сперматозоиды, эмбрионы) [3], сохраняя клетки для клеточной терапии (стволовые клетки, кровь и др.) [4, 5] и т. д. Но, вместе с тем, использование минусового температурного режима бывает трудно реализовать, так как животные и растительные клетки обладают довольно весомыми отличиями. Отметим несколько особенностей: наличие жестких стенок растительных клеток влияет на проникновение растворенных веществ, метаболическую активность и зародышеобразование льда [6]; активная деятельность хлоропластов может быть ответственна за чрезмерный окислительный стресс, особенно на этапе оттаивания, когда аппарат фотосинтеза и антиоксидантные системы еще не полностью восстановились [7]; вакуоли вообще могут образовывать на себе большой объем льда, так как жидкость просто поддается замораживанию. Следовательно, для замораживания растительной ткани необходимо правильно выбрать подходы замораживания, определенные температурные режимы. При этом следует брать во внимание и специфику самой клетки, видовые свойства культур, подвергающихся замораживанию. Современные технологии предполагают для сохранения каллуса использование жидкого азота. Традиционным криопротектором для повышения выживаемости криоконсервированного растительного материала при температуре жидкого азота (-196 °С) является диметилсульфоксид (далее – ДМСО) [8]. Криоконсервации подвергают клетки и ткани растений ценного генофонда или обладающих высокой метаболической активностью синтеза практически значимых БАВ: суспензионные культуры, культуры меристем, пыльца, протопласты, эмбриоиды. Однако чаще объектами для применения метода являются каллусные культуры. Методы криосохранения разрабатываются с учетом самых разнообразных факторов, в том числе и свойств клеток, так как самый оптимальный вариант – это небольшие клетки, в которых не содержится большой объем жидкости. Каждая отдельная ситуация требует к себе конкретного и специфического отношения как в процессе замораживания, так и последующего оттаивания материала. Необходим подбор оптимальных условий, обеспечивающих высокую выживаемость клеток при оттаивании и рекультивации. Обязательным условием успешности метода является сохранение после размораживания морфогенетических потенций и способности регенерировать жизнеспособные растения. В случае применения криоконсервации к клеткам – источнику БАВ, необходимо сохранять их продуктивность (количественный и качественный составы целевых вторичных метаболитов). Именно поэтому необходимо тщательно соблюдать все условия и правила проведения подобных экспериментов, связанных с воздействием низких температур.
Процедура заморозки с использованием жидкого азота связана с большими трудностями (дорогостоящее оборудование и его обслуживание, необходимость специального обучения персонала и др.).
Благодаря тому, что отечественные лаборатории и многие исследовательские центры обладают довольно неплохим лабораторным оборудованием, сегодня предоставлена возможность проводить любые опыты и исследования. В частности, протоколы для заморозки культур клеток без применения жидкого азота. Поэтому цель данной работы – оценить эффективность применения криопротектора (ДМСО) для сохранения каллусных клеток при температуре -80 °С в условиях бытового электроморозильника.
Материалы и методы
Культивирование растительной клеточной культуры люпина узколистного ( Lupinus angustifolius L.) проводили в термостатах Binder (Германия) при +26 °С в темноте в течение 21 суток на питательной среде Мурасиге-Скуга, содержащей витамины (мг/л: В1 – 1,0; В2 – 0,5; В3 – 2,0; В5 – 1,0; В6 – 1,0; В7 – 1,0; В9 – 0,5; В12 – 0,0015) и фитогормоны (нафтилуксусная кислота – 1,0 мг/л; кинетин – 0,1 мг/л). Каллус характеризуем как гомогенный белого цвета, рыхлый, умеренно обводненный, с удельной скоростью роста 0,99±0,25 сут-1.
Криоконсервация клеток. В качестве биологического объекта использовали клетки каллуса (в возрасте 15 дней) двудольного растения люпина узколистного ( Lupinus angustifolius L.), известного источника алкалоидов и обладающего высоким уровнем каллусогенеза. Цвет каллусной ткани – белый без примесей. Для эксперимента от каллус-ной ткани отделяли агрегат размером 10 × 10 мм и помещали в криопробирку с 1,5 мл питательной среды Мурасиге и Скуга (далее – МС) [10] при pH 6,1. Каллусы замораживали в средах МС (контрольная группа) и МС с криопротектором ДМСО 10 % по двум схемам. Схема 2 отличается дополнительной экспозицией экспланта с криопротектором при +7 °С в течение 1 ч. Известно, что ДМСО проникает в клетки каллуса с разной скоростью в зависимости от их диффе-
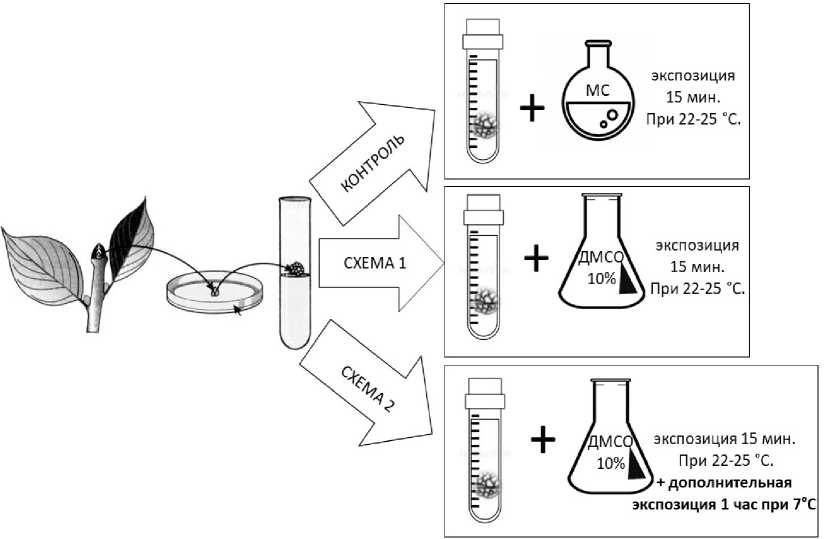
многие исследователи получили Рисунок 1. Схемы криоконсервирования клеток каллуса. возможность разрабатывать новые Figure 1. Cryopreservation schemes of callus cells.
ренциации [9]. Каллус имеет дифференцированные и недифференцированные клетки. Поэтому для эффективного воздействия криопротектора необходимо исключить возможность недостаточного влияния криопротектора, а также сравнить выживаемость клеток каллуса с дополнительным воздействием ДМСО и без него. Схемы криоконсервирования клеток каллуса представлены на рис. 1.
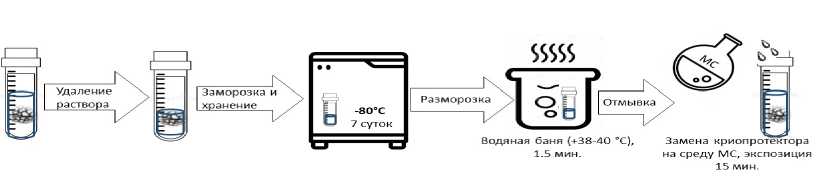
Емкости с материалами помещали в морозильные камеры для последующего замораживания и хранения при температуре –80 °С. Процесс охлаждения протекает при температурном режиме от +20...–20 в течение 2,6 мин., а затем температура опускалась до –80 °С, замораживание длилось около 3,5 мин. Хранение материала происходило в течение недели, далее он подвергался оттаиванию в водяной ванне, в которую набирали теплую воду с температурой около 40 °С. В процессе оттаивания емкости с материалами периодически встряхивали, в среднем по 1–1,5 мин. Все опыты с замораживанием и последующим оттаиванием материла повторяли 21 раз.
Определение жизнеспособности каллусных клеток. В процессе проведения экспериментов с материалами основное внимание было уделено такому параметру, как клеточная жизнеспособность. В ходе опыта посредством применения микроскопов живые ткани клеток проверяли на предмет их целостности при помощи витального красителя трипанового синего. Отбирали пинцетом часть каллуса и помещали его в эппендорф, далее добавляли 400 мкл среды МС и аккуратно встряхивали каллус. Пипеткой Пастера отбирали 100 мкл жидкости с клетками, каплю помещали на предметное стекло и добавляли 100 мкл 0,1 %-ного раствора трипанового синего, накрывали покровным стеклом, излишки убирали фильтровальной бумагой. Препарат оценивали под микроскопом при увеличении 10 × 10. Процент жизнеспособных клеток в образце (на 100 клеток) определяли исходя из способности краски, проходя через травмированную мембранную ткань мертвых клеток, придавать им синий оттенок. Параллельно с этим живые клетки не пропускали через свои оболочки краситель. Поэтому мы делаем вывод, что целостность мембраны, а также выполнение ею своей защитной функции и является важным залогом жизнедеятельности клеток.
Статистический анализ. Проведение статистического исследования имеющейся информации позволяет получить средние значения и отклонение. В целях вычисления статистической значимости разницы между всеми параметрами использовалось специальное ПО, а также подходы Уилкоксона и Мани-Уитни. Получаемые значения определялись в качестве точных при условии, что р <0,05. Сохранность представляли в процентах по отношению к уровню до замораживания, принятого за 100 %.
Результаты и их обсуждение
Изначальное оценивание реализовывали методом осмотра, при котором изучали перемены, произошедшие в тканях. До воздействия низкой температуры во всех трех пробах отмечали белый цвет каллуса без примесей, его рыхлую консистенцию и легкость разделения на агрегаты (фото).
После семи суток хранения каллусной ткани при низкой температуре (-80 °С) и последующей разморозки в пробах во всех вариантах цвет каллуса изменился на желтоватый, повысилась плотность и, как следствие, разделение на агрегаты стало более трудоемким. Температурные переходы вызывают изменения количества внутриклеточной и внеклеточной воды, которая занимает огромную роль для регулирования состояния и функционирования мембран клеток. В процессе заморозки и оттаивания в биологической мембране происходят перестройка и изменения структурного состояния бислоя, что влечет за собой изменения условий взаимодействия ее компонентов (белков, фосфолипидов, гликопротеинов и т. д.), в результате компоненты мембраны могут находиться в более упорядоченном состоянии, и вся клеточная мембрана теряет свойства своей первоначальной подвижности, внешне это проявляется повышением плотности каллуса и изменением его цвета.
При воздействии отрицательной температуры клетки повреждаются и даже погибают, это является следствием механического воздействия растущих кристаллов льда и их расширением при замораживании. Также одним из факторов гибели каллусных клеток является осмотический дисбаланс и, как результат, неконтролируемое

АБ
Фото. Внешний вид каллуса Lupinus angustifolius L.: А – макрофотография: Б – микрофотография (фото Е. Э. Душиной).
Photo. Appearance of Lupinus angustifolius L. callus: A – macrophotograph, Б – microphotograph (photos by E. E. Dushina).
Показатели целостности клеточной мембраны каллусных клеток (M ± σ, n=7), хранившихся при -80 °С в течение семи суток
Cell membrane integrity parameters of callus cells (M ± σ, n=7) stored at -80 °C for seven days
|
Серия |
Показатели# |
|
|
До замораживания |
После отогрева |
|
|
Каллус без криопротектора (контроль) |
83,0±2,0 |
21,4±2,3* |
|
Каллус + ДМСО 10 % (схема 1) |
82,0 ± 2,6 |
38,0 ± 2,1* |
|
Каллус + ДМСО 10 % (схема 2) |
82,8 ± 2,5 |
38,0± 2,1* |
Примечание. # - данные представлены в процентах по отношению к уровню до замораживания, принятого за 100 %. * - различие с показателем до замораживания р <0,05. Note. # - data are given in percent in relation to the level before freezing, taken as 100 %. * – difference with the index before freezing p < 0.05.
обезвоживание, что для растений может иметь решающую роль при длительном хранении при низких температурах. В нашем исследовании установлено, что при использовании криопротектора ДМСО показатель целостности клеточной мембраны каллусных клеток был статистически значимо выше. Статистической разницы между схемами 1 и 2 замораживания с использованием ДМСО не выявлено. Диметилсульфоксид – это проникающий криопротектор, основное его действие направлено на предотвращение быстрого образования льда. Известно, что высокие концентрации данного криопротектора вызывают токсическое действие на клетки, разрушая двуслойную структуру мембраны [11]. В нашем исследовании показано, что токсическое действие 10 % ДМСО не зависит от времени экспозиции клеток каллуса с криоконсервирующим раствором.
Стоит отметить, что при микроскопировании обычно видны окрашенные клетки, расположенные в большем или меньшем количестве по поверхности агрегата, в то время как в его глубине они отсутствуют. Исходя из этого, основным параметром результативности выбранного подхода должна стать регенерация после процедуры размораживания, благодаря которой ткани начинают разрастаться и делиться, располагаясь на искусственной питательной среде.
В процессах заморозки и оттаивания ведущая роль отводится состоянию клеточных мембран и мембран органелл. Образование льда и дегидратация являются основными факторами, способными привести клетку к гибели при замораживании. По результатам эксперимента определено, что применение криопротектора ДМСО положительно влияет на сохранность каллусных клеток даже при -80 °С (рис. 2). Это связано с тем, что ДМСО увеличивает общую концентрацию осмотических веществ, связывает свободную внутриклеточную воду, повышает вязкость, тем самым, предупреждая повреждения клеток кристаллами льда.
Заключение
Криоконсервирование растительных клеток является перспективной научной сферой. Современные условия
Сохранность %
Каллус без криопротектора
-
■ Каллус + ДМСО 10% (схема 1)
Каллус+ДМСО 10% ( схема2)
Рисунок 2. Показатель сохранности каллусных клеток (M ± σ, n=7), хранившихся при -80 °С в течение семи суток. y – различие с показателем сохранности серии «каллус без криопротектора» р <0.05.
Figure 2. Preservation rate of callus cells (M ± σ, n=7) stored at -80 °C for seven days. y – difference with the index of preservation of the series “callus without cryoprotectant” p < 0.05.
предполагают разработку новых, доступных протоколов для долгосрочного хранения биологических материалов. По результатам проведенного исследования можно сделать вывод, что применение низких температур (-80 °С) и традиционного криопротектора ДМСО для сохранения каллусных клеток является перспективным способом в области криоконсервирования. Однако представленные результаты носят предварительный характер и требуют дальнейшего изучения.
Список литературы Криосохранение каллусных клеток Lupinus angustifolius L. при низких температурах в условиях электроморозильника
- Пунгин, А. В. Каллусные культуры Spergularia marina (L.) Griseb.: получение и фитохимический анализ / А. В. Пунгин, Л. О. Ларцева, М. В. Кулаков [и др.] // Вестник Балтийского федерального университета им. И. Канта. Сер: Естественные и медицинские науки. – 2023. – № 1. – С. 89–112.
- Филиппова, С. Н. Разработка эффективных способов депонирования каллусных культурценных лекарственных растений / С. Н. Филиппова, Т. И. Дитченко, А. О. Логвина [и др.] // Труды БГУ. Физиологические, биохимические и молекулярные основы функционирования биосистем. – 2015. – Т. 10, № 1. – С. 211–226.
- Karp, A. Somaclonal variation as a tool for crop improvement / A. Karp // Euphytica. –1995. – Vol. 85. – P. 295–302.
- Venkatesh, S. Semen additives for improving frozen- thawed buffalo and cattle semen – a review/ S. Venkatesh, K. Murugavel, H. Hemalatha, S. Kantharaj, G. Shalini // CryoLetters. – 2024. – Vol. 45, № 4. – P. 194–211.
- Sergushkina, M. I. The use of pectins as part of a cryoprotective solution for long-term storage of human platelet concentrates / M. I. Sergushkina, A. N. Khudyakov, O. O. Zaitseva, T. V. Polezhaeva, O. N. Solomina [ et al.] // Cryo- Letters. – 2022. – Vol. 43. – № 6. – Р. 316–321.
- Sergushkina, M. I. Apple pectin as a new component for cryopreservation of nucleated cells / M. I. Sergushkina, O. O. Zaitseva, A. N. Khudyakov, T. V. Polezhaeva, O. N. Solomina // Biopreservation and Biobanking. – 2022. – Vol. 20, № 1. – Р. 84–89.
- Stegner, M. Freeze dehydration versus supercooling of mesophyll cells: impact of cell wall, cellular and tissue traits on the extent of water displacement / M. Stegner, A. Flörl, J. Lindner, S. Plangger, T. Schaefernolte [ et al.] // Physiologia Plantarum. – 2022. – Vol. 174, № 6. – P. e13793.
- Stock, J. The transcription factor WRKY22 is required during cryo-stress acclimation in Arabidopsis shoot tips / J. Stock, A. Bräutigam, M. Melzer, G. P. Bienert, B. Bunk [et al.] // Journal of Experimental Botany. – 2020. – Vol. 71, № 16. – P. 4993–5009.
- Sun, D. Cryopreservation of Schisandra chinensis (Turcz.) Baill callus and subsequent plant regeneration / D. Sun, Y-F. Yu, H-Y. Qin, P-L. Xu, Y. Zhao [et al.] // Genetics and Molecular Research. – 2016. – Vol. 15. – № 4. – P. gmr15049342.
- Murashige, T. A Revised medium for rapid growth and bio assays with tobacco tissue culture / T. Murashige, F. Scoog. // Physiologia Plantarum. – 1962. – Vol. 15. – P. 473–497.
- Nagel, M. Plant cryopreservation: Principles, applications, and challenges of banking plant diversity at ultralow temperatures / M. Nagel, V. Pence, D. Ballesteros, M. Lambardi, E. Popova [et al.] // Annual Review of Plant Biology. – 2024. – Vol. 75. – P. 797–824.


