Криовоздействие как метод профилактики рецидива рака печени после расширенных гемигепатэктомий
Автор: Ханевич М.Д., Манихас Г.М., Диникин М.С.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.20, 2025 года.
Бесплатный доступ
В настоящее время основной радикальной операцией при гепатоцеллюлярном раке и обширном метастатическом поражении одной из половин печени является расширенная гемигепатэктомия, при которой удаляется до 70% объёма печени. Однако оставшийся объём печёночной ткани может оказаться функционально недостаточным. У такого рода больных быстро развивается печёночная недостаточность, которая является основной причиной послеоперационной летальности. С другой стороны при уменьшении объёма гемигепатэктомии может страдать радикальность операций. Нами с целью профилактики рецидива опухали при расширенных гемигепатэктомиях с успехом использовался метод интраоперационного криовоздействия на раневую поверхность оставшейся части печени, который был применён у 29 больных с гепатоцеллюлярным раком. У 9 пациентов операции выполнялись без применения криовоздействия. Следует подчеркнуть, что во всех 38 случаях во время гемигепатэктомии не было возможности отступить от края опухали более, чем на 15 мм. Анализ отдалённых результатов показал, что применение криовоздействия позволило достоверно сократить количество больных с рецидивами опухоли.
Рак печени, расширенная гемигепатэктомия, интраоперационное криовоздействие
Короткий адрес: https://sciup.org/140310008
IDR: 140310008 | DOI: 10.25881/20728255_2025_20_2_37
Текст научной статьи Криовоздействие как метод профилактики рецидива рака печени после расширенных гемигепатэктомий
После выполнения расширенных гемигепатэктомий остаётся высокий риск как рецидива опухоли, так и развития тяжёлой печёночной недостаточности, которая в большинстве случаев является причиной летального исхода в раннем послеоперационном периоде. Это связано с тем, что при такого вида резекциях печени возникает необходимость оставления не более 40% объёма печени. Кроме того, менее чем на 10 мм сокращается расстояние между краем резекции и опухолевой тканью, что неизбежно приводит к оставлению опухолевых клеток или фрагментов ткани опухоли на раневой поверхности. Риск рецидива заболевания в таких случаях становится неизбежным [1]. Лишь у 30% больных применение регионарной или системной химиотерапии дает положительный эффект. Одним из эффективных способов, способных остановить рост опухолевой ткани из раневой поверхности печени ряд исследователей считают использование интраоперационного криовоздействия на раневую поверхность сразу после удаления пораженной опухолью части печени [2]. Это касается как, R1 резекций (наличие опухолевых клеток на раневой поверхности оставшейся части печени при микроскопическом исследовании отпечатков), так и R2 резекций (наличие фрагментов опухолевой ткани на раневой поверхности оставшейся части печени).
Цель
Улучшить результаты лечения больных раком печени при выполнении расширенных гемигепатэктомий путём интраоперационного криовоздействия на раневую поверхность сразу после удаления поражённой части печени.
Материал и методы
Под нашим наблюдением находилось 38 больных, которым по поводу злокачественного новообразования печени были выполнены расширенные гемигепатэкто-мии, предусматривающие удаление больше половины объёма печени. У всех пациентов в дооперационном

периоде путем чрескожной пункционной биопсии был установлен гепатоцеллюлярный рак. У 29 пациентов во время операции раневая поверхность оставшейся части печени подвергалась криовоздействию. В этой группе мужчин было 18, женщин – 11. Возраст больных колебался от 48 до 76 лет. Согласно Международной классификации опухолей по системе TNM (8-я редакция, 2017) основную группу составили пациенты с III А стадией заболевания – 16 человек, с III Б стадией было 7 человек и IVА стадией – 6 человек. В группе сравнения у всех 9 пациентов была установлена III А стадия заболевания. Во всех случаях опухоль локализовались в правой половине печени. В связи с этим хирургические вмешательства заключались в выполнении расширенных гемигепатэктомий [3].
В 18 (47,4%) случаях у наблюдаемых нами больных ранее был установлен цирроз печени. При этом время от момента установления цирроза до обнаружения опухоли печени составило 15–18 лет. Тем не менее на момент операции они не имели развернутой клиники портальной гипертензии. Лишь у 6 пациентов был установлен незначительный асцит, у 8 – варикозно расширенные вены пищевода первой и второй степени. У 4 больных имело место лишь цирротическое поражение печени. Согласно классификации тяжести печёночной недостаточности по Chld – Pugh класс А определен у 14 пациентов, класс В – у 4.
Объём операции включал: срединную лапаротомию, ревизию органов брюшной полости и зоны хирургического вмешательства. Для диагностики внутрипеченочного распространения опухолевого процесса, выявления дополнительных очагов, определения архитектоники венозного и артериального русла всем пациентам проводилось интраоперационное чрескапсульное УЗИ печени (Рис. 1).
Далее осуществлялась мобилизация печени. Пересекался связочный аппарат: круглая связка, серповидная связка, венечная связка, правая треугольная связка. Для выведения в зону манипуляций правой половины печени пересекалась печеночно – почечная связка. Перевязывались и пересекались нижние печеночные вены (от 3 до 5). Затем производилось выделение с лимфодиссекцией элементов печеночно – двенадцатиперстнокишечной связки. Последовательно выделялись и пересекались правый печеночный проток, правая ветвь собственной печеночной артерии, правая ветвь воротной вены. О прекращении кровоснабжения правой половин печени свидетельствовало изменение окраски поверхности печени в темно-вишневый цвет с ярко выраженной демаркационной линией (Рис. 2).
Непосредственно сама резекция печени у 31 больного осуществлялась с поэтапным пересечением и перевязкой сосудов в зоне резекции отступя 10–15 мм от края опухоли. У 8 больных рассечение тканей происходило с помощью аппарата радиочастотной термоабляции (Рис. 3).
Как показали гистологические исследования применение радиочастотной термоабляции вызывало глубокие термические ожоги остающейся части ткани печени с последующим длительным процессом отторжения некротиче-
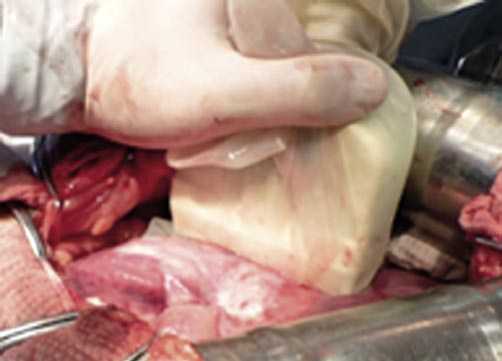
Рис. 1. Интраоперационное УЗИ печени. Датчик расположен на диафрагмальной поверхности печени в проекции IV сегмента.
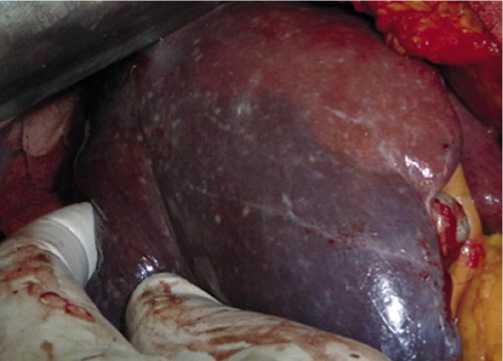
Рис. 2. Правосторонняя гемигепатэктомия. Изменение цвета ткани печени и появление демаркационной линии после пересечения сосудов, кровоснабжающих правую половину печени.
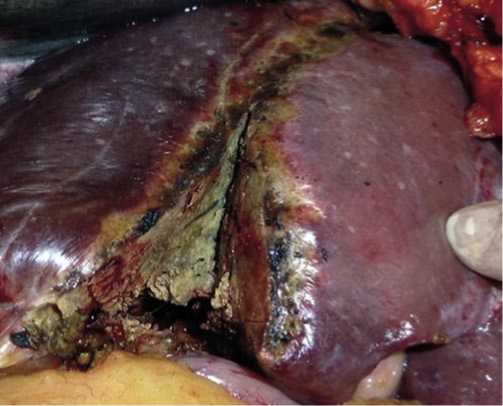
Рис. 3. Правосторонняя расширенная гемигепатэктомия. Рассечение ткани печени после выполнения радиочастотной термоабляции насадкой «Habib 4x».

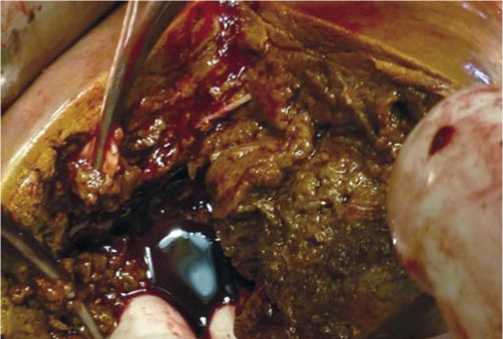
Рис. 4. Правосторонняя расширенная гемигепатэктомия. Пережатие зажимом с последующей перевязкой сосуда в зоне резекции.
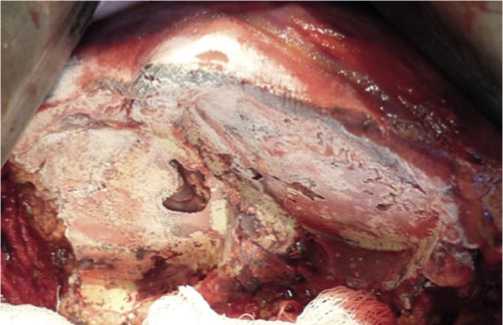
Рис. 6. Правосторонняя расширенная гемигепатэктомия (R1). Внешний вид раневой поверхности оставшейся части печени, подвергшейся криовоздействию.
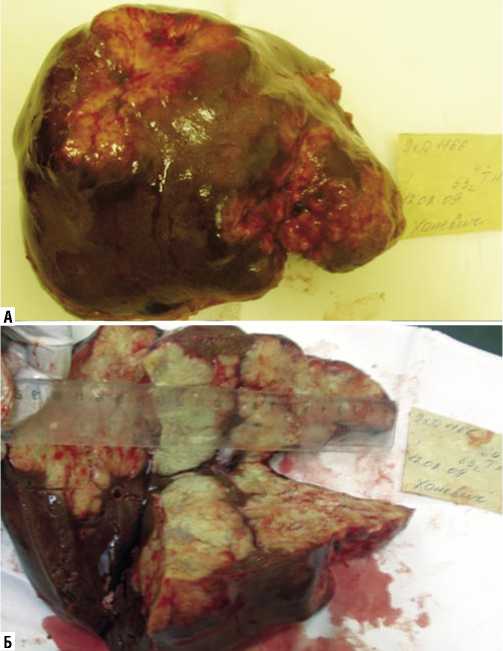
Рис. 5. Правосторонняя расширенная гемигепатэктомия. А – общий вид удалённой части печени. Б – удалённая часть печени на разрезе. Метастазами гепатоцеллюлярного рака поражены IV–VIII сегменты печени.
ских фрагментов печёночной ткани. Кроме того, на 10–12% уменьшался объём оставшейся части печени, что привело у 3 пациентов к развитию тяжёлой печёночной недостаточности в раннем послеоперационном периоде. Поэтому нами отдавалось предпочтание рассечению печени скальпелем с поэтапной перевязкой сосудов в зоне резекции (Рис. 4).
После удаления поражённой опухолью части печени оценивали абластичность вмешательства (Рис. 5). С этой целью исследовали удалённый препарат, а также с помощью
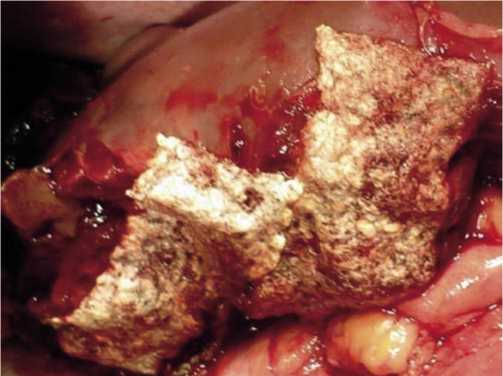
Рис. 7. Правосторонняя расширенная гемигепатэктомия. Внешний вид раневой поверхности печени после укрытия пластинами ТахоКомба.
стерильного предметного стекла делали отпечатки (соско-бы) с раневых поверхностей с последующим экстренным цитологическим исследованием материала. Для оценки эффективности криовоздействия экстренное морфологическое исследование проводили до и после применения холода.
Разработанная криогенная технология раневой поверхности печени предусматривала использование аппликатора диаметром 50 мм. В качестве криосистемы применялась криоустановка «КРИО – МТ» (Россия), с помощью которой на аппликаторе за счет циркуляции жидкого азота достигались сверхнизкие показатели температуры (-196С) [4]. Экспозиция холодом составляла 5–6 минут. При R1 резекции печени криовоздействие осуществляли трёхкратно, соблюдая принцип: «быстрое охлаждение, самостоятельное медленное оттаивание». Мы убедились, что эффект от применения холода возможен, лишь в тех случаях, если аппликаторами по схеме «олимпийских колец» покрывалось вся раневая поверхность оставшейся части печени (Рис. 6, 7).
После завершения криовоздействия с целью предупреждения гемо– и желчеистечения раневая поверхность

укрывалась пластинами Тахокомба. Операцию завершали установкой двух контрольных дренажей в зоне раневой поверхности печени. После ушивания лапаротомной раны пациенты на продлённой ИВЛ помещались в реанимационное отделение, где находились до купирования острой печёночной недостаточности. Ввиду высокого риска возникновения печёночной недостаточности адъювантная химеотерапия в послеоперационном периоде не проводилась.
Результаты и их обсуждения
В наших наблюдениях найболее сложным и ответственным моментом было принятие решения о выполнении расширенной операции. Ни в одном из случаев гемигепатэктомии, предусматривающей удаление с IV по VIII сегменты, нам не удалось отступить от края опухоли более, чем на 15 мм. Лишь в 8 наблюдениях сохранялась ткань IV сегмента. Как показали дальнейшие исследования, оставление даже незначительной части печеночной ткани, при объеме оставшейся части печени от 35 до 45%, имеет существенное значение для профилактики тяжелых форм печеночной недостаточности.
Проведенный анализ срочных микроскопических исследований показал, что при разрезе печеночной ткани на расстоянии до 5 мм от края опухоли раковые клетки были обнаружены во всех 10 исследованиях, при разрезе печеночной ткани на расстоянии от 5 до 10 мм – в 12 из 22 исследований, при разрезе печеночной ткани на расстоянии от 10 до 15мм – в 2 из 7 исследований. Таким образом, у пациентов, которым производились расширенные гемигепатэктомии, раковые клетки на оставшейся части печени были обнаружены у 24 (63,2%). В группе сравнения из 9 больных положительный результат был установлен у 6. Таким образом, следует считать, что в обеих группах потенциальный риск продолженного роста опухоли или ее рецидива сохранялся, что требовало проведения дополнительных лечебных мероприятий.
Анализ четырехкратного исследования отпечатков с поверхности печени (до криовоздействия, а также после первого, второго и третьего сеансов применения холода) показал, что при выполнении R1 резекций надежный эффект дает двукратная заморозка. После однократной заморозки жизнеспособные раковые клетки были обнаружены в 16 случаях. Повторная заморозка во всех случаях привела к разрушению оставшихся опухолевых комплексов. У 9 пациентов с R0 резекцией печени, несмотря на отсутствие раковых клеток при исследовании отпечатков, производилось однократное криовоздействие раневой поверхности. Основная цель – повышение абластичности в условиях высокого риска рецидива заболевания.
В ближайшем послеоперационном периоде у 19 (50,0%) из 38 больных развилась печеночная недостаточность. У 13 пациентов она носила тяжелый прогрессирующий характер и, несмотря на интенсивную терапию, наступил летальный исход. Из них 9 (31,0%) больных умерли после выполнения криовоздействия. Еще двое пациентов после криовоздействия умерли от гнойных-воспалительно осложнений. Таким образом, послеоперационная летальность после выполнения расширенных правосторонних гемигепатэктомий у больных гепатоцеллюлярным раком составила 38,5%, у больных, подвергшихся криовоздействию – 37,9%.
Отдаленные результаты прослежены у 22 больных (у 17 после криовоздействия и у 4 – без него). В группе сравнения у двух пациентов рецидив (продолженный рост) был выявлен в первый год наблюдения и еще у двух – в период от двух до трех лет. Более 5 лет не прожил ни один из больных. В основной группе рецидив заболевания возник у 7 (31,8%) больных. Во всех случаях он был выявлен через 3 года после операции. Более пяти лет прожили 10 пациентов.
Заключение
При выполнении расширенных гемигепатэктамий, ввиду необходимости оставления 30–40% печёночной ткани, у больных с гепатоцеллюлярным раком возникает высокая вероятность нарушения абластичности хирургического вмешательства. В тоже время уменьшение объёма оставляемой печёночной ткани, особенно у больных циррозом печени, приводит к развитию печёночной недостаточности, от которой в раннем послеоперационном периоде погибает более 35% больных. С помощью многократного криовоздействия оставшейся части печени и установлении R1 резекции, можно в значительной степени улучшить абластичность хирургического вмешательства. Об этом свидетельствует достоверное увеличение безрецидивного периода у пациентов после двукратной криообработки раневой поверхности печени. До 30% больных с гепатоцеллюлярным раком после выполнения расширенных ге-пигепатэктомий с интраоперационным криовоздействием на раневую поверхность оставшейся части печени, имеют возможность увеличить безрецидивный период до 5 лет.
Список литературы Криовоздействие как метод профилактики рецидива рака печени после расширенных гемигепатэктомий
- Шабунин А.В., Бедин В.В., Греков Д.Н., Тавобилов М.М., Дроздов П.А., Лебедев С.С., Карпов А.А., Чеченин Г.М., Цуркан В.А. Гепатоцеллюлярный рак. Современные тенденции и результаты хирургического лечения // Анналы хирургической гепатологии. - 2022. -Т.27. - №3. - С.22-32. EDN: KUANVG
- Мерзликин Н.В., Цхай В.Ф., Бражникова Н.А., Комкова Т.Б., Сало В.Н., Максимов М.А., Навасардян В.Г., Нороева Т.А. Криохирургия опухолей печени // Сибирский онкологический журнал. - 2018. - Т.17. - №2. - С.41-48. EDN: XNTQBF
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. - М.: Медицина, 2007. - 448 с. EDN: QLOYOP
- Хирургическое лечение опухолей печени и поджелудочной железы с использованием криохирургической техники / Под. ред. проф. М. Д. Ханевича. - СПб.: Аграф +, 2017. - 128 с.


