Кристалличность ароматических полиамидинов
Автор: Холхоев Бато Чингисович, Бурдуковский Виталий Федорович, Субанаков Алексей Карпович
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2015 года.
Бесплатный доступ
Методом РФА исследована степень кристалличности ароматических полиамидинов, полученных в расплаве, растворе ионной жидкости и реагенте Итона. Было найдено, что степень кристалличности полиамидинов зависит от способа проведения реакции.
Ароматические полиамидины, ионные жидкости, реагент итона, кристалличность
Короткий адрес: https://sciup.org/148182886
IDR: 148182886 | УДК: 541.64,
Текст научной статьи Кристалличность ароматических полиамидинов
Полиамидины (ПАД) в последнее десятилетие привлекают повышенное внимание вследствие возможности их использования в оптоэлектронике, металлорганическом катализе, медицине и др. [1]. Однако, несмотря на перспективность полимеров, они до сих пор остаются малоизученными соединениями. Так, в одной из крупнейших в мире единой реферативной базе данных Scopus® [2] имеется 77 работ, посвященных ПАД (тогда как, например, для полибензимидазолов – 1575, для полиамидов – 37756), хотя первая публикация, в которой упомянуты эти полимеры, вышла в 1947 г.
По расположению амидиновой группировки в полимерной цепи выделяют две группы ПАД:
I
H
I
I
H
II
При этом, судя по количеству работ, значительно более изученными являются ПАД-I, которые, как показано в работе [3], в зависимости от способа получения имеют различную степень кристалличности (СК), обусловленную образованием межмолекулярных водородных связей между амидиновыми группами. Пленкообразующие ПАД-II впервые были получены нами сравнительно недавно [4– 7], поэтому представлялось целесообразным изучить кристалличность полимеров, поскольку СК, как известно, определяет значительную часть свойств полимеров, в т.ч. способность к переработке в изделие [8].
Экспериментальная часть
Все ПАД получены по методикам, приведенным в работах [4–7].
РФА проводили на дифрактометре D8 Advance Bruker AXS (Cu K α -излучение). Образцы полимеров для РФА предварительно сушили в вакууме при 60–70 °С в течение 24 ч, затем тщательно перетирали в ступке. Степень кристалличности (СК) полимеров определяли из отношения площадей пиков кристаллических фаз к общей площади аморфных и кристаллических фаз.
ИК-спектры регистрировали на спектрофотометре «Excalibur FTS 3000NX» (Varian) в диапазоне волновых чисел 4000–400 см-1. Образцы снимали в виде пленки или таблеток с KBr.
Молекулярные массы полимеров определяли с помощью гель-проникающей хроматографии, которую проводили на хроматографе фирмы "Waters", насадка колонок – U-Styragel Linear, рефрактометрический детектор, растворитель - тетрагидрофуран, Т = 20 ° С, скорость потока 0.5 мл/мин. Система обработки данных "Maxima", калибровка по полистирольным стандартам.
Результаты и их обсуждение
Изучение СК ПАД, полученных в расплаве, в растворе ионной жидкости (1-бутил-3-метилимидазолия гептахлордиалюминат) и в реагенте Итона, осуществляли с помощью метода РФА и пакета программ Diffract plus Bruker AXS.
Результаты, обобщенные в таблице, показывают, что СК ароматических ПАД значительно зависит от способа получения. Так, из всего ряда исследованных ПАД (рис. 1, 2), наибольшей СК обладает полимер, полученный полиприсоединением динитрилов и диаминов в расплаве (ПАД-1) – 76.15 % . Такая высокая СК, очевидно, достигается за счет жесткоцепной природы полимера, обусловленной наличием пара -фениленовых фрагментов, низкой молекулярной массы и более эффективного образования водородных связей между макромолекулами. При синтезе такого ПАД в ионной жидкости, содержащей подвижные ионы в реакционной среде, происходит, очевидно, сольватация амидинового фрагмента, что делает невозможным образование водородных связей [9, 10] и полимер имеет аморфную структуру. Аналогичная зависимость наблюдалось в случае ПАД-3.
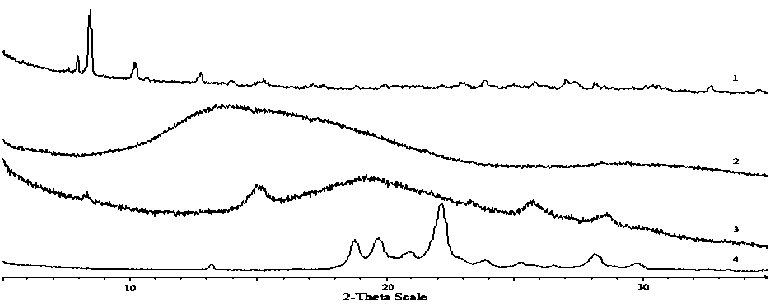
Рис. 1. Рентгенограммы ПАД-1 (1), ПАД-2 (2), ПАД-3 (3), ПАД-4 (4)
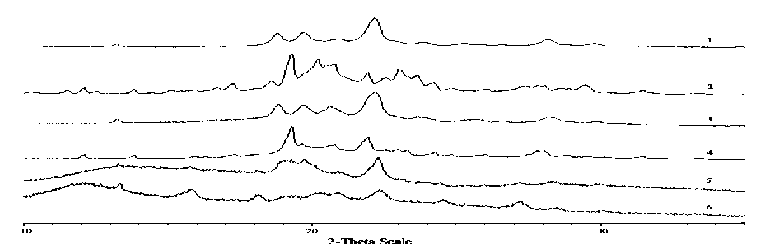
Рис. 2. Рентгенограммы ПАД-4 (1), ПАД-5 (2), ПАД-6 (3), ПАД-7 (4), ПАД-8 (5), ПАД-9 (6)
Интересные закономерности были обнаружены при исследовании СК ПАД, полученных в реагенте Итона. Несмотря на то, что реакция полимерообразования протекала в растворе, все синтезированные ПАД обладали кристалличностью. При этом СК, как видно из таблицы, зависит от жесткости полимерной цепи. Так, ПАД-4, содержащий одну мостиковую группу, обладает наибольшей СК.
Таблица
Свойства полиамидинов
|
№ |
ПАД |
Способ полу-чения1 |
M w ∙10-3 2 |
СК, % |
d3, Å |
|
1 |
NH O NH II II ∗ CN NC HH |
расплав |
8 |
76.15 |
|
|
2 |
ИЖ |
19 |
– |
5.67, 2.92 |
|
|
3 |
NH NH ∗ ∗ CN NC HH O |
ИЖ |
13 |
– |
|
|
4 |
РИ |
17 |
36.49 |
4.22 |
|
|
5 |
O O NH NH ∗ ∗ N N HH O |
РИ |
8 |
35.66 |
4.28 |
|
6 |
OSO NH NH II II • ∗ CN NC ∗ HH O |
РИ |
15 |
28.52 |
4.29 |
|
7 |
O NH NH ∗ CN NC ∗ HH O |
РИ |
20 |
20.04 |
4.32 |
|
8 |
O H NH O N C ∗ II II ∗ C NH H |
РИ |
25 |
14.07 |
6.39 4.25 3.01 |
|
9 |
РИ4 |
25 |
52.69 |
6.90 4.18 |
1 – ИЖ и РИ – полимер синтезирован в ионной жидкости и в реагенте Итона (соответственно); 2 – по данным гель-проникающей хроматографии; 3 – среднее расстояние между полимерными цепями; 4 – пленка полимера, синтезированного в реагенте Итона
При введении мостиковой сульфоновой группы (ПАД-6) СК уменьшается и составляет 28.52 % . Далее было установлено, что введение в диаминный фрагмент вместо сульфоновой группы простых эфирных групп (ПАД-7,8) приводит к еще большему снижению СК, при этом введение одной мостиковой группы (ПАД-7) приводит к снижению СК до 20.04 % , двух (ПАД-8) - до 14.07 %. Средние расстояния (d) между макромолекулярными цепями, рассчитанные по величине максимума гало [3], имели близкие значения (4.22–4.32 Å), при этом более высокие СК соответствовали меньшим расстояниям между полимерными цепями.
Известно [11], что введение в полимерную цепь объемных кардовых группировок в некоторых случаях приводит к образованию аморфных полимеров. Однако ПАД, содержащий дифенилфталид-ную кардовую группировку, обладает достаточно высокой СК, сравнимой с ПАД-4. Причинами столь высокой СК кардового ПАД являются, вероятно, образование межмолекулярных водородных связей с участием более электроноакцепторного атома кислорода карбонильной группы и ориентация ПАД по типу изотактических полимеров.
Растворение ПАД-8 в ДМФА с выдерживанием при 20 оС в течение суток с последующим осаждением водой приводит к получению полностью аморфного полимера. Однако пленка этого полимера, полученная из 10 %-ного раствора в ДМФА, обладает кристалличностью, превосходящей СК исходного полимера более чем в 3.5 раза. На рентгенограмме исходного ПАД-8 наблюдается три области гало, что соответствует значениям d 6.39, 4.25 и 3.01 Å. Тогда как на дифрактограмме пленки присутствует только две области гало, соответствующие величинам d 6.90 и 4.18 Å. Очевидно, при медленном испарении ДМФА происходит взаимная ориентация макромолекул дальнего порядка, при этом наблюдается изменение расстояния между полимерными цепями.
Образование межмолекулярных водородных связей в случаях кристаллических ПАД наглядно иллюстрируется значительным уширением полос колебания NH-групп (3500–2500 см-1) в ИК-области в сравнении с аморфными полимерами.
Таким образом, в работе показано, что ароматические ПАД в зависимости от строения элементарного звена и способа получения обладают различной степенью кристалличности, которая связана с возникающим упорядочением системы за счет образования водородных связей между амидиновыми группами.
Список литературы Кристалличность ароматических полиамидинов
- Wang Z.T., Zhang Y.S., Zhao Y.X., Zhu G.M. Recent progress of polyamidine//Polym. Mater. Sci. Eng. -2007. -Vol. 23. -P. 6-9.
- http://www.scopus.com/home.url
- Böhme F., Klinger C., Komber H., Haussler L., Jehnichen D. Synthesis and properties of polyamidines//J. Polym. Sci. Part A: Polym. Chem. -1998. -Vol. 36. -P. 929-938.
- Холхоев Б. Ч., Бурдуковский В.Ф., Могнонов Д.М. Синтез ароматических полиамидинов в реагенте Итона//Высо-комолек. соедин.Б. -2013. -Т. 55, № 12. -С. 1506-1509.
- Kholkhoev B. Ch., Burdukovskii V.F., Mognonov D.M. Preparation of aromatic polyamidines and their transformation in polybenzimidazoles//EXPRESS Polymer Letters. -2014. -Vol. 8, № 9. -С. 635-646.
- Холхоев Б. Ч., Бурдуковский В.Ф., Могнонов Д.М. Синтез полиамидинов на основе 1,4-дицианобензола и 4,4’-диаминодифенилоксида в ионных жидкостях//Изв. PÆH Серия хим. -2010. -Т. 59, № 11. -С. 2104-2105.
- Холхоев Б. Ч., Бурдуковский В.Ф., Могнонов Д.М. Полиамидины на основе динитрилов и диаминов//Журн. приклад. химии. -2011. -Т. 84, № 3. -С. 519-520.
- Аверко-Антонович И.Ю., Бикмуллин Р. Т. Методы исследования структуры и свойств полимеров. -Казань: Изд-во КГТУ, 2002. -С. 360-364.
- Wang B., Tang Y., Wen Zh., Wang H. Dissolution and regeneration of polybenzimidazoles using ionic liquids//Eur. Polym.J. -2009. -Vol. 45. -P. 2962-2965.
- Ионные жидкости и их использование для растворения природных полимеров/Н.П. Новоселов //Журн. общей химии. -2007. -Т. 77, № 8. -С. 1317-1327.
- Виноградова С.В., Васнев В.А., Выгодский Я.С. Кардовые полигетероарилены. Синтез, свойства и своеобразие//Успехи химии. -1996. -Т. 65. -С. 266-295.


