Критический обзор современных средств и методов фиксации имплантатов в минимально инвазивной герниологии
Автор: Матвеев Н.Л., Макаров С.А., Куприянова А.С., Армашов В.П.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 (48), 2020 года.
Бесплатный доступ
В статье дано подробное описание методов и приспособлений для фиксации сетчатых имплантатов, используемых для пластики вентральных грыж. Приведено иллюстрированное описание техники фиксации имплантатов при лапароскопической операции IPOM.
Фиксаторы для герниопластики, имплантаты для герниопластики, эндоскопическая герниопластика, операция ipom
Короткий адрес: https://sciup.org/143176781
IDR: 143176781 | УДК: 616.34-007.43-189.844 | DOI: 10.20340/vmi-rvz.2020.6.7
Текст научной статьи Критический обзор современных средств и методов фиксации имплантатов в минимально инвазивной герниологии
Cite as: Matveev N.L., Makarov S.A., Kupriyanova A.S., Armashov V.P. A critical review of modern tools and methods of implant fixation in minimally invasive herniology Bulletin of the Medical Institute Reaviz. Rehabilitation, Doctor and Health. 2020;6(48):55–65.

В эру протезирующей пластики вентральных грыж очень важным аспектом, существенно влияющим на ближайшие и отдаленные результаты операций, является выбор способа фиксации имплантатов в тканях брюшной стенки.
Фиксация сетчатого имплантата должна быть достаточно прочной, чтобы противодействовать его смещению и сморщиванию, по крайней мере, на протяжении срока его интеграции в ткани. В то же время, фиксация должна быть минимально достаточной, чтобы уменьшить риск хронической боли и не замкнуть герметично (в случае использования техники IPOM) пространство между имплантатом и париетальной брюшиной (профилактика хронической серомы). Баланс в этих границах найти достаточно трудно. Этому посвящено большое количество исследований, также достаточно противоречивых.
Существует несколько групп средств для фиксации имплантатов в слоях брюшной стенки, которые можно использовать изолированно или в сочетании. Это трансабдоминальные (трансфасциальные) лигатуры, нерассасывающиеся или рассасывающиеся фиксаторы-кнопки (спиралевидные, шуруповидные, гарпунные, скобочные (табл. 1)) и биологические адгезивы.
Механические способы фиксации
Ряд хирургов поддерживает использование только трансабдоминальных швов. Применение нитей вместо степлера удешевляет операцию. Помимо двух-четырех позиционирующих швов, они накладывают дополнительные швы через каждые 5 см по периметру сетки. Однако это увеличивает продолжительность операции, вероятность инфекции и хронической боли, не снижая частоты рецидивов [1].
Sarela не отметил существенных различий при использовании трансабдоминальных швов и скобок [2], хотя швы были более выгодны экономически. В других отношениях, проведение швов более трудоемко, связано с более выраженной послеоперационной болью и несколько худшим косметическим результатом [3].
Важность влияния расположения грыжевых ворот на выбор метода фиксации подчеркнули Muysoms и соавт. [4]. Проведя рандомизированное исследование в группах с фиксацией сетки только кнопками, методом «двойной короны» или с помощью лигатур и кнопок, они выявили, что отказ от лигатур сокращает время операций, уменьшает послеоперационную боль, не влияя на частоту рецидивов. Авторы заключили: при грыжах, расположенных далеко от костных границ живота, трансфасциальные швы можно не накладывать, если кнопками создается «двойная корона».
Метод «двойной короны» подразумевает частую (через каждые 1–1,5 см) фиксацию протеза двумя кольцами кнопок – по периметру грыжевых ворот и по периметру протеза. Этот метод был предложен в середине 90-х годов прошлого века для надежной фиксации имплантатов из пористого политетрафторэтилена (пПТФЭ) – единственного материала для лапароскопической гернио-пластики, доступного в то время. пПТФЭ не взаимодействует с тканями, не прорастает коллагеном и поэтому имеет пожизненную тенденцию к смещению с рецидивировани-ем грыжи, если не выполнить такую жесткую фиксацию. При хорошем показателе прочности этот метод увеличивает частоту хронической боли и образования сером, особенно в сочетании с микропористыми протезами, так как практически герметизирует грыжевой мешок. Даже такой пионер и сторонник этого метода, как S. Morales-Conde, описывает 46 %-ю частоту развития ретропротезной серомы в течение первых трех месяцев после ЛВГП [5].
По данным Sajid и соавт. [6], фиксация протеза при лапароскопической операции IPOM кнопками сопровождается меньшей продолжительностью операций и меньшей послеоперационной болью. Фиксация кнопками сопоставима с фиксацией лигатурами в плане интраоперационных осложнений, продолжительности госпитализации и частоты рецидивов.
Таблица 1. Характеристика кнопочных фиксаторов для имплантатов
|
Название, производитель |
Конструкция |
Материал |
Глубина проникновения |
Количество в инструменте |
|
Рассасывающиеся фиксаторы |
||||
|
AbsotbaTack (Medtronic) |
Остроконечный шуруповидный фиксатор; ограниченно изгибаемый (до 3 см) инструмент, 5 мм |
Полигликолид-L-лактид сополимер, срок фиксации/полного рассасывания 3–5/~12 мес. |
4,1 мм, зона удержания 5,1 мм2, с крылышками 8,6 мм2 |
15 или 30 |
|
OptiFix (BD – C.R. Bard Davol) |
Гарпунный фиксатор; жесткий инструмент, 5 мм |
Поли (D,L)-лактид, срок фиксации/полного рассасывания 3–5/~12 мес. |
6,1 мм, зона удержания 9,0 мм2 |
15 или 30 |
|
ReliaTack (Medtronic) |
Остроконечный шуруповидный фиксатор; изгибаемый (до 65) инструмент, 5 мм |
Полигликолид-L-лактид сополимер, срок фик-сации/полного рассасывания 3–5/~12 мес. |
4,1 мм или 6,0 мм, зона удержания 5,1 мм2, с крылышками 8,6 мм2 |
Кассеты по 5 или 10 стандартных фиксаторов/ по 5 или 8 удлиненных фиксаторов |
|
Securestrap (Ethicon) |
П-образная скобка, гарпунная фиксация; жесткий инструмент, 5 мм |
Полидиоксанон + Полигликолид-L-лактид сополимер, срок фик-сации/полного рассасывания 4–6/~12-18 мес. |
6,7 мм, зона удержания 1,8 мм2 |
12 или 25 |
|
SorbaFix (BD – C.R. Bard Davol) |
Тупоконечный шуруповидный фиксатор, продвигаемый по острому проводнику; жесткий инструмент, 5 мм |
Поли (D,L)-лактид, срок фиксации/полного рассасывания 3–5/~12 мес. |
6,0 мм, зона удержания 9,0 мм2 |
15 или 30 |
|
Перманентные фиксаторы |
||||
|
CapSure (BD – C.R. Bard Davol) |
Остроконечный спиральный фиксатор с закрытым торцом, жесткий инструмент, 5 мм |
Нержавеющая сталь, торцевой колпачок из полиэфир-эфиркетона |
3,2 мм |
15 или 30 |
|
EndoUniversal (Medtronic) |
П-образная закрывающаяся скобка, изгибаемый инструмент, 12 мм |
Титан |
4 мм или 4,8 мм, в закрытом состоянии 2 мм |
Кассеты по 10 скобок, гарантированный ресурс инструмента 50 скобок |
|
PermaFix (BD – C.R. Bard Davol) |
Тупоконечный шуруповидный фиксатор, продвигаемый по острому проводнику; жесткий инструмент, 5 мм |
Сополимерный полиоксиметилен (полиацеталь) |
6,0 мм |
15 или 30 |
|
ProTack (Medtronic) |
Остроконечный спиральный фиксатор с открытым торцом, жесткий инструмент, 5 мм |
Титан |
3,8 мм |
30 |
|
Tacker (Medtronic) |
Остроконечный спиральный фиксатор с открытым торцом, жесткий инструмент, 5 мм |
Титан |
3,8 мм |
30 или 20 в сменных трубках |
Akkary и соавт. считают, что при маленьких грыжах допустимо выполнять IPOM без трансфасциальных швов, даже у пациентов с ожирением [7]. Напротив Smietanski и соавт., использовав оригинальную мате- матическую модель вентральной грыжи, в эксперименте на свиньях показали, что только кнопок недостаточно для удержания герниопротезов на месте [8].
Таким образом, фиксация только трансабдоминальными швами и «двойной короной» сопоставимы по частоте рецидивов [9]. Плюсы швов – дешевизна и меньшая частота сером. Плюсы кнопок – меньшая продолжительность операции и меньшая частота хронической боли. Отдельный вопрос касается связи числа кнопок и хронической боли.
Schoenmaeckers и соавт. [10] оценили выраженность боли через 2, 6 и 12 недель после IPOM при использовании для фиксации протеза, в среднем 45,4 ± 9,6 или 20,4 ± 1,4 кнопок. Авторы выявили достоверную связь выраженности боли с числом кнопок лишь через 12 недель после операции, то есть, когда боль скорее можно связать с реакцией на имплантат. Повреждение нервов кнопками должно было бы проявить себя раньше. Недаром хроническая боль после IPOM с фиксацией кнопками больше всего коррелирует с размерами протеза, а не с числом фиксаторов [11].
Невропатический боль возникает при попадании рассасывающегося или перманентного фиксатора непосредственно в крупный нерв, которых в брюшной стенке не так много. Это подтверждается и более ранним исследованием Eriksen и соавт. [12], а также работой Christoffersen и соавт., которые в общенациональном проспективном когортном исследовании 816 пациентов оценили отдаленный (4 года) риск рецидива и хронической боли при использовании в ходе IPOM рассасывающихся или нерасса-сывающихся фиксаторов. При многомерном анализе независимым фактором риска рецидива было использование рассасывающихся фиксаторов, которые не влияли на хроническую боль [13].
В рандомизированном исследовании Bansal и соавт. [14] показали, что фиксация протеза при IPOM нерассасывающимися кнопками – экономически выгодный метод, имеющий результаты, сравнимые с фиксацией рассасывающимися кнопками в отношении боли, качества жизни и удовлетворенности пациентов.
Описано несколько анекдотических случаев образования грыж в местах проведения трансабдоминальных лигатур [15–17]. Также описаны псевдоаневризмы нижних эпигастральных артерий в местах фиксации протеза [18] и тампонада сердца из-за протрузии фиксировавшей сетку спирали через 9 дней после операции [19].
Тем не менее, Beldi и соавт., признавая большую встречаемость хронической боли в связи с трансабдоминальными швами (однако различие сохранялось лишь до 6 мес. после IPOM), отмечают, что усадка сетки через 6 мес. достоверно больше после фиксации спиралями [20].
Рандомизированное исследование Wassenaar и соавт., в котором сравнивали три техники фиксации (рассасывающиеся швы с кнопками, только «двойная корона» из кнопок, нерассасывающиеся швы с кнопками) не смогло показать достоверных отличий между группами в отношении в хронической послеоперационной боли [21].
Биоадгезивы
Синтетические адгезивы
Glubran 2 (GEM, Италия). Со-мономер н-бутил-2-цианоакрилат+метакрилокси-сульфолан. Капсулы с клеем (0,25 мл, 0,5 мл или 1,0 мл в капсуле); аппликаторы для капельного нанесения или распыления газом для открытой хирургии и лапароскопии (в том числе, с изгибаемым концом). Температура при полимеризации 45 °С, время полимеризации 60–90 с, образуется эластичная плёнка. Прочность на отрыв 45 кг/см2. Разрушается путем гидролиза ферментом карбоксилэстеразой до меркаптанов в течение 5–6 месяцев. Не препятствует физиологической репарации. При сравнении с механической фиксацией перманентными или рассасывающимися кнопками Glubran показал сопоставимую надежность [22].
LiquiBand FIX8 (Advanced Medical Solutions, Великобритания). Мономер н-бутил-2-цианоакрилат. Специально предназначен для фиксации имплантатов в открытой и эндоскопической хирургии. Несменяемая капсула 1,5 мл адгезива. Дозатор поставляет каплю адгезива за одно нажатие курка, всего 33 дозы. Время полимеризации 10 с. В клинических испытаниях успешная фиксация была достигнута в 90 % случаев, засорение наконечника происходило в 14,7 % случаев [23]. Отмечалась крайне невыраженная боль.
Экспериментальные исследования подтвердили, что тканевые адгезивы на основе цианоакрилатов дают хорошую инкорпорацию синтетических имплантатов в ткани пациента при низкой частоте осложнений и невыраженной острой тканевой реакции. Через 30 дней после операции не отмечалось признаков отрыва или смещения имплантатов, которые были фиксированы плотной оформленной соединительной тканью, богатой волокнами коллагена I типа [24].
Адгезивы на основе фибрина
Фибриновый клей может быть альтернативным способом фиксации имплантатов при небольших грыжах, значительно снижая риск послеоперационной боли и способствуя оптимальной интеграции сеток в мягкие ткани, уменьшая число швов или скобок. Но он существенно влияет на стоимость операции. Кроме того, фибриновый клей не фиксируется к брюшине, что создает проблемы при IPOM [25]. Последние данные говорят о том, что фиксация фибриновым клеем дает больше рецидивов грыж [26].
Адгезивы на основе сыворотки крови и полиальдегида/полиэтиленглколя
Bioglue (CryoLife, США), Preveleak (Baxter, США), Tridyne и Progel (BD C.R. Bard, США). Двухкомпонентные хирургические адгезивы, состоящие из сыворотки человеческой или бычьей крови и глютаральдеги-да/полиальдегида или полиэтиленгликоля. Наносятся из шприца со специальным аппликатором-миксером, предназначенным только для открытой хирургии. Полиальде-гид/полиэтиленгликоль создает прочные ковалентные связи между молекулами сыворотки, коллагеном и материалом имплантата. Наносится на сухие ткани. Время полимеризации 2 мин. Эти адгезивы используются, в основном, для герметизации сосудистого шва (в том числе, с протезами) или легочной ткани. Время их резорбции составляет 4–7 дней, и, в силу этого, для фиксации сетчатых имплантатов к брюшной стенке они мало пригодны.
Лапароскопическая герниопластика с фиксацией имплантата Bioglue сопровождалась уменьшением частоты хронической боли по сравнению с механической фиксацией, без увеличения числа осложнений или рецидивов [27].
В литературе нет убедительных данных для того, чтобы отдать явное предпочтение какому-либо типу фиксации в отношении частоты хронической боли и частоты рецидивов. Поэтому мы поделимся своими соображениями, основанными на многолетнем личном опыте применения фиксаторов при IPOM.
Прежде всего, хотелось бы подчеркнуть, что условия применения фиксаторов при вентральной (особенно при послеоперационных грыжах) и паховой герниопла- стике принципиально различаются в плане размеров фиксируемого имплантата и грыжевых ворот, анатомии, выраженности рубцовых изменений тканей, а также нагрузки на фиксаторы. Поэтому нельзя прямолинейно переносить опыт фиксации, полученный от паховых герниопластик, на IPOM.
Ни один из современных механических способов фиксации имплантатов при эндоскопических герниопластиках не способен предотвратить невропатическую боль. Надежность фиксации клеевыми композициями не столь очевидна.
Достоинства перманентных металлических фиксаторов состоят в их хорошей фиксирующей способности, даже при сравнительно небольшой глубине проникновения, а также в относительно низкой цене. Неизбежной обратной стороной медали является пожизненная возможность их миграции. Опубликованы клинические наблюдения миграции в стенку кишки, а также кишечной непроходимости, связанной с фиксацией штрангов к открытым торцам спиралей. Однако эти наблюдения крайне редки. В нашей практике такие случаи не встречались.
Конструктивные изменения, призванные закрыть торец спиральных металлических фиксаторов, прогрессивны, но пока не приводят к должному успеху. Утолщение головки спирали при сохранении её общих габаритов дает укорочение фиксирующей части, что может сделать фиксацию ненадежной.
В любом случае, предпочтительно использовать перманентные фиксаторы из титана, которые не дают помех при последующих КТ и МРТ исследованиях.
Применение рассасывающихся фиксаторов позволяет не оставлять в тканях потенциально травматичных инородных тел. Но для достижения прочной фиксации их приходится делать длиннее (6–7 мм против 4 мм), увеличивая риск повреждения глубжележащих анатомических структур. Кроме этого, эти фиксаторы плохо прошивают рубцовую ткань, сложенные вдвое края им- плантата не входят в костные структуры, что нередко требуется при операциях по поводу послеоперационных грыж. Достоверно неизвестно, достаточно ли срока поддержки в 3–5 месяцев, чтобы гернио-протез надежно интегрировался в фиброз-но измененные ткани брюшной стенки. К тому же, рассасывающиеся фиксаторы существенно дороже перманентных. Описаны несколько случаев выхода грыж через отверстия в сетчатом протезе, оставшиеся после резорбции таких фиксаторов [28].
Полиацеталевые фиксаторы соединяют в себе недостатки обеих групп – из-за мягкости материала они имеют травматичную большую длину и низкую пенетрирующую способность и, в то же время, не рассасываются.
Мы обобщили эксплуатационные достоинства и недостатки групп фиксаторов в таблице 2.
Для фиксации сетчатых герниопроте-зов при первичных срединных (особенно небольших) вентральных грыжах оправдано применение рассасывающихся фиксаторов. При послеоперационных грыжах, особенно «трудных», сопровождающихся значительными нарушениями анатомии и фиброзом брюшной стенки, при необходимости фиксации больших и/или плотных протезов в ложе сложной конфигурации мы отдаём предпочтение спиралевидным титановым фиксаторам.
Исходя из вышеизложенного, оптимальным методом фиксации может быть компромиссный между шовной и кнопочной техниками: использование нескольких опорных трансабдоминальных швов в сочетании со свободной (через каждые 2,5–3 см) фиксацией спиральными кнопками по периметру грыжевых ворот и по всей остальной площади контакта протеза с брюшной стенкой.
Мы фиксируем герниопротезы именно таким образом. Сквозь брюшную стенку проводим предварительно пришитые к протезу двойные лигатуры (монофиламентная нерассасывающаяся синтетическая нить).
Таблица 2. Сравнительные характеристики средств для фиксации имплантатов в клиническом аспекте
|
Тип фиксации |
Металл |
ПМК/ПГК |
Трансабдоминальные швы |
Адгезив |
|
Временные затраты |
+ |
+ |
– |
± |
|
Стоимость |
– |
– – |
+ |
– |
|
Болевой синдром |
– |
– |
– – |
+ |
|
Контакт с внутренностями |
– |
+ |
+ |
+ |
|
Надежность фиксации |
+ |
± |
++ |
± |
|
Профилактика усадки имплантата |
± |
– |
+ |
± |
Примечание: «+» достоинство; «–» недостаток.
Делаем это с помощью специального проводника (EndoClose, Medtronic), вводимого через заранее сделанные проколы. Каждую нить проводим через отдельный пункционный канал в брюшной стенке (рис. 1). В ходе проведения нитей нужно избегать захвата зажимами тех их частей, которые останутся в пациенте. Это ослабит нити и может вызвать их перелом, что, в свою очередь, может вызвать рецидив грыжи. Экстракорпорально на концы нитей накладываем зажимы-держалки (рис. 2).
Затем снова временно эвакуируем пневмоперитонеум и последовательно завязываем лигатуры (рис. 3). Даже у пациентов с выраженной подкожной клетчаткой узлы обычно удается завязать на уровне мышечно-апоневротического слоя брюшной стенки. Узлы нужно завязывать достаточно туго, но не слишком, чтобы предотвратить смещение сетки и, в то же время, минимизировать связанный со сдавлением нервов брюшной стенки болевой синдром.
При опускании узла может образоваться вдавление на коже в месте прокола. Это происходит из-за захвата подкожной ткани в узел. Такую ямку можно устранить заведя через прокол под кожу кончик тонкого гемостатического зажима (например, Halsted) и подняв кожу.
Важно осмотреть брюшную стенку с завязанными трансабдоминальными швами после полной повторной инсуффляции, чтобы убедиться в полном устранении ямок. Если этого не сделать, то косметический результат может быть неудовлетворительным.
Если при лапароскопическом осмотре будет обнаружено, что лигатура завязана слишком свободно, то ее нужно будет заменить. При небольшом провисании сетки в области лигатуры достаточно дополнительно укрепить это место кнопкой.
Если трансабдоминальные лигатуры проведены в соответствии с разметкой, то сетка, после их завязывания, устанавливается в правильное положение (рис. 4).
Стандартно мы используем от 2 до 4 трансабдоминальных швов по сторонам протеза в зависимости от его размеров. Они позволяют точно его ориентировать и обеспечивают более прочную фиксацию, чем кнопки. Но увеличение числа трансабдоминальных швов коррелирует с интенсивностью послеоперационной боли, а также увеличивает продолжительность операции. Поэтому мы накладываем дополнительные швы только в местах наибольшей нагрузки, при «трудных» грыжах (рис. 5).
Мы отказались от фиксации центра сетчатого протеза трансабдоминальным швом при неушитых грыжевых воротах, так как этот шов затягивает протез в грыжевые ворота при повышении внутрибрюшного давления (рис. 6) и мешает опорожнению серомы.
После визуального подтверждения правильности положения протеза дополнительно равномерно фиксируем его по периметру и по площади титановыми спиральными фиксаторами примерно через каждые 2–3 см, отступя примерно 5 мм от края (рис. 7).
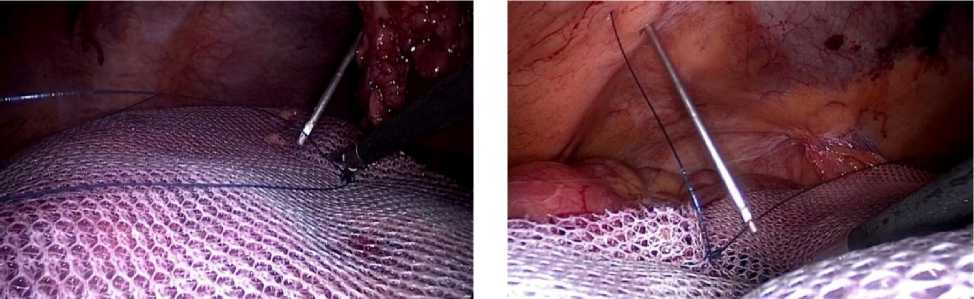
Рис. 1. Этапы проведения трансабдоминальных лигатур
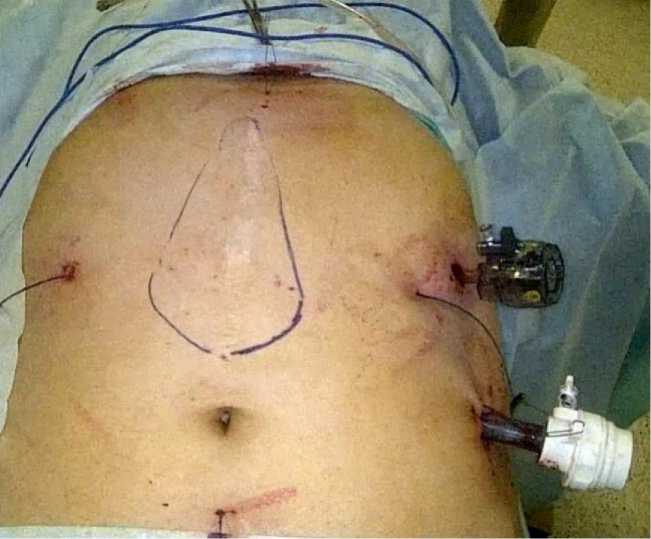
Рис. 2. Имплантат расправлен на трансабдоминальных лигатурах

Рис. 3. Завязывание лигатуры с погружением узла под кожу
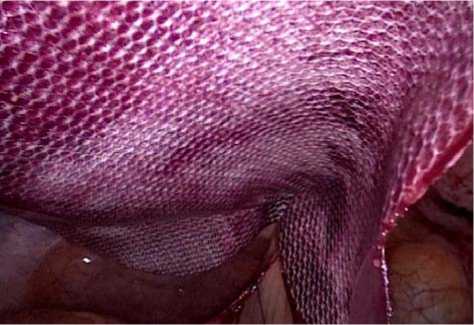
Рис. 4. Имплантат расправлен на 4-х трансабдоминальных лигатурах
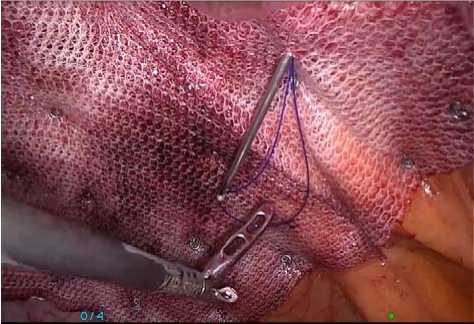
Рис. 5. Фиксация протеза дополнительными трансабдоминальными швами

Рис. 6. «Втягивающий эффект» центрального шва
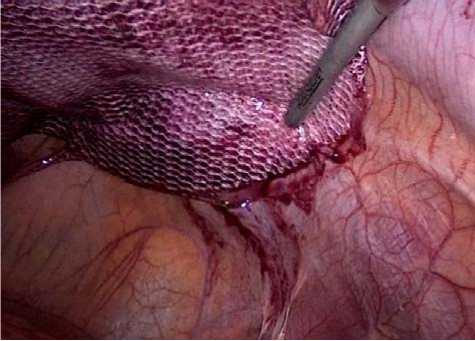
Рис. 7. Фиксация протеза герниостеплером
Таким образом, учет и оптимальное сочетание подробно описанных характеристик современных средств для фиксации имплантатов даст хирургу возможность
сделать герниопластику эффективной и безопасной, в отношении частоты как рецидивов грыж, так и хронической боли и сером.
Список литературы Критический обзор современных средств и методов фиксации имплантатов в минимально инвазивной герниологии
- Silecchia G, Campanile FC, Sanchez L, Ceccarelli G, Antinori A, Ansaloni L et al. Laparoscopic ven-tral/incisional hernia repair: updated Consensus Development Conference based guidelines [corrected]. Surg Endosc. 2015;29(9):2463-2484. https://doi.org/10.1007/s00464-015-4293-8
- Sarela AI. Controversies in laparoscopic repair of incisional hernia. J Minim Access Surg. 2006;2(1):7-11. https://doi.org/10.4103/0972-9941.25670
- Bansal VK, Misra MC, Kumar S, Rao YK, Singhal P, Goswami A et al. A prospective randomized study comparing suture mesh fixation versus tacker mesh fixation for laparoscopic repair of incisional and ventral hernias. Surg Endosc. 2011;25(5):1431-1438. https://doi.org/10.1007/s00464-010-1410-6
- Muysoms F, Vander Mijnsbrugge G, Pletinckx P, Boldo E, Jacobs I, Michiels M, Ceulemans R. Randomized clinical trial of mesh fixation with «double crown» versus «sutures and tackers» in laparoscopic ventral hernia repair. Hernia. 2013;17(5):603-612. https://doi.org/10.1007/s10029-013-1084-9
- Morales-Conde S, Suarez-Artacho G, Socas-Macias M, Barranco-Moreno A. Retroprosthetic seroma after laparoscopic ventral hernia repair: incidence, risk factors and clinical significance. Hernia. 2015;19(6):943-947. https://doi.org/10.1007/s10029-015-1352-y
- Sajid MS, Parampalli U, McFall MR. A meta-analysis comparing tacker mesh fixation with suture mesh fixation in laparoscopic incisional and ventral hernia repair. Hernia. 2013; 17(2): 159-166. https://doi.org/10.1007/s10029-012-1017-z
- Akkary E, Panait L, Roberts K, Duffy A, Bell R. Sutureless laparoscopic ventral hernia repair in obese patients. JSLS. 2011;15(2):154-159. https://doi.org/10.4293/108680811X13022985131859
- Smietanski M, Bigda J, Iwan K, Kotodziejczyk M, Krajewski J, Smietanska IA, Gumiela P, Bury K, Bielecki S, Sledzinski Z. Assessment of usefulness exhibited by different tacks in laparoscopic ventral hernia repair. Surg Endosc. 2007;21(6):925-928. https://doi.org/10.1007/s00464-006-9055-1
- LeBlanc KA. Proper mesh overlap is a key determinant in hernia recurrence following laparoscopic ventral and incisional hernia repair. Hernia. 2016;20(1): 85-99. https://doi.org/10.1007/s10029-015-1399-9
- Schoenmaeckers EJ, de Haas RJ, Stirler V, Raymakers JT, Rakic S. Impact of the number of tacks on postoperative pain in laparoscopic repair of ventral hernias: do more tacks cause more pain? Surg Endosc. 2012;26(2):357-360. https://doi.org/10.1007/s00464-011-1876-x
- Diana M, Callari C, D'Agostino J, Wu HS, Mutter D, Marescaux J. Laparoscopic tension-free abdominal wall repair: impact of mesh size and of different fixation devices in a consecutive series of 1 20 patients. Surg Laparosc Endosc Percutan Tech. 2014;24(5):461-464. https://doi.org/10.1097/SLE.0b013e3182901571
- Eriksen JR, Poornoroozy P, J0rgensen LN, Jacobsen B, Friis-Andersen HU, Rosenberg J. Pain, quality of life and recovery after laparoscopic ventral hernia repair. Hernia. 2009;13(1):13-21. https://doi.org/10.1007/s10029-008-0414-9
- Christoffersen MW, Brandt E, Helgstrand F, Westen M, Rosenberg J, Kehlet H, Strandfelt P, Bisgaard T. Recurrence rate after absorbable tack fixation of mesh in laparoscopic incisional hernia repair. Br J Surg. 2015;102(5):541-547. https://doi.org/10.1002/bjs.9750
- Bansal VK, Asuri K, Panaiyadiyan S, Kumar S, Subramaniam R, Ramachandran R et al. Comparison of absorbable versus nonabsorbable tackers in terms of long-term outcomes, chronic pain, and quality of life after laparoscopic incisional hernia repair: a randomized study. Surg Laparosc Endosc Percutan Tech. 2016;26(6): 476-483. https://doi.org/10.1097/SLE.0000000000000347
- Barzana D, Johnson K, Clancy TV, Hope WW. Hernia recurrence through a composite mesh secondary to transfascial suture holes. Hernia. 2012;16(2):219-221. https://doi.org/10.1007/s10029-010-0728-2
- Khandelwal RG, Bibyan M, Reddy PK. Transfascial suture hernia: a rare form of recurrence after laparoscopic ventral hernia repair. J Laparoendosc Adv Surg Tech A. 2010;20(9):753-755. https://doi.org/10.1089/lap.2010.0314
- Muysoms FE, Cathenis KK, Claeys DA. «Suture hernia»: identification of a new type of hernia presenting as a recurrence after laparoscopic ventral hernia repair. Hernia. 2007;11(2):199-201. https://doi.org/10.1007/s10029-006-0170-7
- Nichols-Totten K, Pollema T, Moncure M. Pseudoaneurysm of the inferior epigastric artery: a rare complication of laparoscopic ventral hernia repair. Surg Laparosc Endosc Percutan Tech. 2012;22(1):e25-27. https://doi.org/10.1097/SLE.0b013e31823cd8bc
- Malmstr0m ML, Thorlacius-Ussing O. Cardiac tamponade as a rare complication in laparoscopic incisional hernia repair. Hernia. 2010;14(4):421-422. https://doi.org/10.1007/s10029-009-0557-3
- Beldi G, Wagner M, Bruegger LE, Kurmann A, Candinas D. Mesh shrinkage and pain in laparoscopic ventral hernia repair: a randomized clinical trial comparing suture versus tack mesh fixation. Surg Endosc. 2011; 25(3):749-755. https://doi.org/10.1007/s00464-010-1246-0
- Wassenaar E, Schoenmaeckers E, Raymakers J, van der Palen J, Rakic S. Mesh-fixation method and pain and quality of life after laparoscopic ventral or incisional hernia repair; a randomized trial of three fixation techniques. Surg Endosc. 2010;24(6):1296-1302. https://doi.org/10.1007/s00464-009-0763-1
- Harsl0f S, Krum-M0ller P, Sommer T, Zinther N, Wara P, Friis-Andersen H. Effect of fixation devices on postoperative pain after laparoscopic ventral hernia repair: a randomized clinical trial of permanent tacks, absorbable tacks, and synthetic glue. Langenbecks Arch Surg. 2018; 403(4): 529-537. https://doi.org/10.1007/s00423-018-1676-z
- Dauser B, Szyszkowitz A,-Seitinger G,-Fortelny RH, Herbst F. A novel glue device for fixation of mesh and peritoneal closure during laparoscopic inguinal hernia repair: short and medium-term results. Eur Surg. 2017;49(1):27-31. https://doi.org/10.1007/s10353-016-0450-0
- Poli A, Parisi F, Millanta F, Solfanelli L, García-Pastor P, Magliaro C et al. Fixation of polyvinylidene fluoride (PVDF) mesh with cyanoacrylate-derived glues in a rat experimental model: histopathologic immunohisto-chemical and morphometric study. Hernia. 2019 Nov 26. Epub ahead of print. https://doi.org/10.1007/s10029-019-02078-5
- Eriksen JR, Bisgaard T, Assaadzadeh S, Jorgensen LN, Rosenberg J. Randomized clinical trial of fibrin sealant versus titanium tacks for mesh fixation in laparoscopic umbilical hernia repair. Br J Surg. 2011;98(11):1537-1545. https://doi.org/10.1002/bjs.7646
- Bittner R, Bain K, Bansal VK, et al. Update of Guidelines for laparoscopic treatment of ventral and incisional abdominal wall hernias (International Endohernia Society (IEHS)) - Part A. Surg Endosc. 2019;33(10):3069-3139. https://doi.org/10.1007/s00464-019-06977-7
- Antoniou SA, Kohler G, Antoniou GA, Muysoms FE, Pointner R, Granderath FA. Meta-analysis of randomized trials comparing nonpenetrating vs mechanical mesh fixation in laparoscopic inguinal hernia repair. Am J Surg. 2016;211(1):239-249.e2. https://doi.org/10.1016/j.amjsurg.2015.06.008
- LeBlanc KA. Tack hernia: a new entity. JSLS. 2003;7(4):383-387.


