Кросс-секционное исследование подходов к терапии люминального HER2-негативного метастатического рака молочной железы в реальной практике в г. Москва
Автор: Жукова Л.Г., Гречухина К.С., Хатькова Е.И., Акопян А.А., Волконский М.В., Калистратова Н.Ю., Крамская Л.В., Криволапова Л.В., Покатаев И.А., Романчук О.В., Филиппова В.М., Юрченков А.Н.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.14, 2024 года.
Бесплатный доступ
Введение: Терапия пациентов с метастатическим люминальным HER2 негативным раком молочной железы (мРМЖ) включает в себя разные лекарственные опции, которые можно принципиально разделить на эндокринотерапию и химиотерапию. Согласно имеющимся Клиническим рекомендациям, как международным, так и отечественным, «золотым стандартом» 1 линии терапии пациентов с метастатическим люминальным HER2 негативным раком молочной железы (мРМЖ) является комбинация ингибиторов циклинзависимых киназ 4/6 (iCDK4/6) с эндокрино терапией (ЭТ). Однако до последнего времени мы не имели полных данных о характеристике российской популяции пациенток с люминальным HER2 негативным РМЖ, вариантах их терапии и ее результатах. Цель: Провести анализ профиля пациенток и текущих подходов к терапии пациентов с люминальным HER2мРМЖ в рутинной клинической практике в г. Москве. Материалы и методы: Исследование выполнено как наблюдательное, кросссекционное и ретроспективное. Про анализированы данные 2500 пациенток из лечебнопрофилактических учреждений (ЛПУ) г. Москвы, получавших лекарственную терапию по поводу люминального HER2мРМЖ в августеоктябре 2021 года. Результаты: Наибольшее количество пациенток получали iCDK4/6 + ЭТ в первой и второй линии: 69,0% и 52,0% соответственно. В первой линии 54,6% пациентов получали рибоциклиб, 43,1% — палбоциклиб и 2,3% — абема циклиб. Во второй линии 50,6% пациентов получали рибоциклиб, 47,8% — палбоциклиб и 1,6% — абемациклиб По мере увеличения предлеченности пациенток предпочтение отдавалось другим методам лечения, поэтому доля комбинированной ЭТ снижалась до 34,0% в третьей линии и 25,0% — в четвертой и последующей линиях. Заключение: Полученные данные свидетельствуют о том, что назначение iCDK4/6 + ЭТ производится в соответ ствии с Клиническими рекомендациями по лечению рака молочной железы МЗ РФ от 2021 г., и предпочтительным вариантом первой линии лечения пациентов с люминальным HER2мРМЖ в г. Москве является именно назначение комбинированной эндокринотерапии.
Люминальный HER2‑негативный метастатический рак молочной железы, реальная клиническая практика, кросссекционное исследование, iCDK4/6, абемациклиб, палбоциклиб, рибоциклиб
Короткий адрес: https://sciup.org/140309793
IDR: 140309793 | DOI: 10.18027/2224-5057-2024-028
Текст научной статьи Кросс-секционное исследование подходов к терапии люминального HER2-негативного метастатического рака молочной железы в реальной практике в г. Москва
Рак молочной железы (РМЖ) является ведущей онкологической патологией у женского населения Российской Федерации, занимая в 2020 году 21,7% в структуре заболеваемости [1]. На протяжении последних лет отмечается неуклонный рост числа новых случаев РМЖ. Так, в Москве в 2020 г. было выявлено 5897 новых случаев рака молочной железы, в 2021 г. — 7205, в 2022 г. — 7059, а в 2023 г. — 7765 новых случаев. De novo метастатический рак молочной железы (мРМЖ) диагностируется лишь в 6–8% случаев, а наибольшую долю среди всех наблюдений мРМЖ составляют пациентки, у которых развилось прогрессирование заболевания после проведенного «радикального» лечения [1,2].
За последнее десятилетие в нашу практику был внедрен ряд эффективных опций лечения, которые позволили значительно увеличить продолжительность жизни пациентов с раком молочной железы, что стало отражаться и на динамике смертности (–10,84%) и значимо увеличило 5-летнюю выживаемость при этом ЗНО. С 2020 г. 5-лет- няя выживаемость пациентов РМЖ в г. Москве составляет 64,8–64,9%.
Цель лечения мРМЖ — увеличение продолжительности жизни и улучшение ее качества при уверенном контроле симптомов заболевания. По мере развития лекарственной противоопухолевой терапии мРМЖ трансформировался в хроническое заболевание с возможностью длительного продления жизни, однако по-прежнему остается неизлечимым и требующим пожизненного применения терапии. Лечение мРМЖ выбирают исходя из суррогатных фенотипов на основе молекулярно-биологических характеристик опухоли (экспрессии в опухолевой клетке рецепторов эстрогенов (ЭР) и/или прогестерона (РП), HER2-статуса), а также распространенности болезни, локализации метастазов; безрецидивном интервале и варианте предшествующей терапии у предлеченных больных, а также ряда других клинических характеристик.
Среди всех типов РМЖ особое место занимает люминальный подтип, который встречается в 70% случаев [3]. Золотым стандартом лечения для таких пациенток является эндокринотерапия, а наиболее предпочтительной опцией 1 или 2 линий — комбинация ингибиторов циклин-зависимых киназ 4/6 (iCDK4/6) с эндокринотерапией (ЭТ), т. е. ингибиторами ароматазы или фулвестрантом. Внедрение данной опции стало возможным после проведения цикла рандомизированных клинических исследований PALOMA, MONALEESA и MONARCH, которые изучали эффективность от добавления iCDK4/6 (палбоциклиба, рибо-циклиба и абемациклиба соответственно) к ЭТ. Продемонстрировано, что подобная терапия способна существенно улучшить результаты лечения пациенток с люминальным HER2-негативным (HER2–) мРМЖ и позволяет адекватно контролировать болезнь длительное время при хорошей переносимости [4–9].
С момента одобрения в 2015 г. первого iCDK4/6 палбо-циклиба доля пациентов, которые получают комбинацию iCDK4/6 + ЭТ уже в реальной клинической практике, неуклонно растет. Так, в 2019 г. Brufsky и соавт. представили данные кросс-секционного анализа, проведенного в период с 2015 по 2018 гг. В период наблюдения доля пациенток с люминальным HER2-мРМЖ, которая получала комбинированную эндокринотерапию в первой линии лечения, увеличилась с 22% до 49%. Однако авторы отмечали, что в эту группу попадали преимущественно пожилые пациентки с изолированными костными метастазами, а в группу химиотерапии — с висцеральными метастазами [10].
На сегодняшний день в Клинических рекомендациях МЗ РФ от 2021 г. применение комбинированной эндокри-нотерапии рекомендуется в первой линии лечения даже при наличии висцеральных метастазов. Если пациентка по каким-то причинам не получила в первой линии указанный режим лечения, возможно его применение во второй и последующей линии лечения, но при условии доказанной предшествующей эндокриночувствительности. Среди рекомендуемых режимов рассматривается любой из препаратов iCDK4/6 (абемациклиб, палбоциклиб или рибоциклиб) в комбинации с ингибиторами ароматазы (анастрозолом или летрозолом) или фулвестрантом [11]. Важно отметить, чтоу пациенток с активной функцией яичников при назначении комбинированной эндокринотерапии необходимо проведение овариальной супрессии — либо медикаментозной (аналогами ГНРГ), либо хирургической (овариэктомия).
В 2019 г. с выходом Постановления Правительства Москвы №177-ПП от 12.03.2019 г. «О гарантиях дополнительного лекарственного обеспечения граждан, страдающих онкологическими заболеваниями» лекарственное обеспечение г. Москвы претерпело положительные изменения [12]. В соответствии с документом, пациенты с верифицированным раком молочной железы получают гарантию дополнительного лекарственного обеспечения за счет бюджетных ассигнований и средств обязательного медицинского страхования. Это позволило шире использовать различные современные опции, предложенные Клиническими рекомендациями МЗ РФ, для лечения пациенток с люминальным подтипом HER2-мРМЖ.
До последнего времени мы не имели полных данных о характеристике российской популяции пациенток с лю- минальным HER2- РМЖ, вариантах их терапии и результатах этой терапии. Многие вопросы до сих пор остаются без ответа: какие препараты и комбинации чаще всего используются в различных линиях лечения? В частности, используются ли iCDK4/6 в соответствии с Клиническими рекомендациями МЗ РФ? Этим обусловлена необходимость проведения кросс-секционного исследования для изучения применяемых методов лечения, последовательности назначения химиотерапии, моно- и комбинированной (т. е. в комбинации с iCDK4/6) ЭТ у обозначенной популяции больных в г. Москве.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью исследования является анализ профиля пациентов с люминальным HER2-мРМЖ, получающих различные варианты лекарственной терапии, и анализ текущих подходов к терапии больных люминальным HER2-мРМЖ в рутинной клинической практике в г. Москве.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено как кросс-секционное. Протокол исследования был одобрен независимым локальным этическим комитетом ГБУЗ «МКНЦ им. А.С. Логинова» и независимым комитетом по этике при АНО «Научноисследовательский институт общественного здоровья». Исследование проводилось в соответствии с принципами Хельсинкской декларации.
С августа по декабрь 2021 г. проанализированы данные 2500 пациенток из лечебно-профилактических учреждений (ЛПУ) г. Москвы, находящихся в процессе лечения по поводу люминального HER2-мРМЖ. Критерии включения и исключения представлены в таблице 1. Пациентки, включенные в исследование, были стратифицированы в подгруппы в зависимости от линии лечения по поводу мРМЖ.
Таблица 1. Критерии включения и исключения в исследование
Table 1. Inclusion and exclusion criteria for the study
|
Критерии включения |
Критерии исключения |
|
• Диагноз люминальный HER2-мРМЖ не подтвержден данными морфологического и ИГХ исследований |
Сбор данных осуществлялся врачом-онкологом в ходе амбулаторного приема или во время госпитализации пациента с помощью функционала разработанной электронной регистрационной карты. Среди клинических характеристик оценивали возраст пациентов, менструальный статус, а также регистрировали всю информацию, относящуюся к анамнезу мРМЖ. Информацию получали либо на основании первичной медицинской документации, либо на основании данных, полученных врачом при осмотре пациента.
При проведении исследования использованы стандартные методы описательного, частотного, логистического статистического анализа.
РЕЗУЛЬТАТЫ
Характеристика пациентов
В исследование включены 2500 пациентов из различных ЛПУ г. Москвы. Средний возраст пациенток при постановке диагноза РМЖ составил 57,2 года (размах 23–89) при медиане 58 ± 12,2 лет. На момент включения в регистр исследования средний возраст составил 63,4 года (размах 32–90) при медиане 64 ± 11,6 лет. Распределение пациентов по возрасту представлено на рисунке 1.
Полная клиническая характеристика пациентов представлена в таблице 2.
У всех пациенток оценивали менструальный статус. За менопаузу принимали ситуацию, соответствующую критериям, обозначенным в Клинических рекомендациях МЗ РФ: • билатеральная овариэктомия;
-
• возраст ≥ 60 лет;
-
• возраст < 60 лет, но:
– в отсутствие химиотерапии или гормонотерапии тамоксифеном или торемифеном и овариальной
супрессии: аменорея в течение ≥ 12 мес. в сочетании с постменопаузальными уровнями ФСГ и эстрадиола;
– в процессе терапии тамоксифеном или тореми-феном: постменопаузальные уровни ФСГ и эстрадиола.
На момент включения в исследование у 8% пациенток (n = 206) отмечена сохранная функция яичников, а у 92% (n = 2289) менструации отсутствовали. При определении уровня ФСГ и эстрадиола пациенток стратифицировали в соответствии с их статусом: в группу пременопаузы (n = 31; 1,2%), менопаузы (n = 699; 28,0%), постменопаузы (n = 1481; 59,2 %), также отдельно выделяли пациенток, у которых аменорея была индуцирована проведением химотерапии (n = 78; 3,1 %).
Учитывая обязательную необходимость морфологической верификации диагноза для включения в исследования, пациентки были стратифицированы в зависимости от гистологического подтипа РМЖ. Ожидаемо, наиболее распространенным типом РМЖ оказался инвазивный неспецифический подтип (NST) — 82% (n = 2050). Дольковый подтип РМЖ выявлен у 12,1% пациенток (n = 303).
Оценивалась интенсивность иммуногистохимического окрашивания при определении уровня экспрессии рецепторов эстрогенов (РЭ) и прогестерона (РП). За «положительные» принимались значения ≥ 1 балла по шкале Allred. У абсолютного большинства пациенток отмечена экспрессия и рецепторов эстрогенов, и рецепторов прогестерона (92,4 %, n = 2310). У ~70% пациенток отмечено значение Ki-67 > 20%, что принималось за «высокий уровень экспрессии», из них у 48% — Ki-67 ≥ 30%. Также оценивали сочетание экспрессии РЭ/РП и уровень Ki-67: 47,8% пациенток относились к подгруппе РЭ+ / РП+, Ki-67 ≥ 30 %.
Части пациенток, которые удовлетворяли критериям необходимости определения мутации в генах BRCA1/2 согласно Клиническим рекомендациям МЗ РФ, проводили
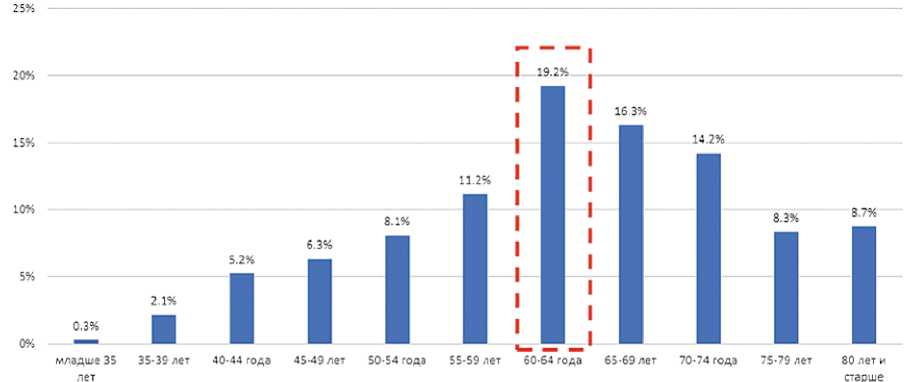
Рисунок 1. Распределение пациенток, включенных в исследования по возрасту. Красной линией обозначена наиболее распространенная подгруппа (60–64 года)
Figure 1. Distribution of patients included in the studies by age. The red line indicates the most common subgroup (60–64 years)
молекулярно-генетический анализ методом ПЦР (n = 319; 12,8%). К ним относятся либо пациентки с отягощенным семейным анамнезом, либо с подтверждённым РМЖ в возрасте ≤ 45 лет. Также у 241 пациентки (9,6 %) было выполнено определение мутации в гене PIK3CA. При анализе пациенток, которым проводились сочетанные молекулярно-генетические тесты, были выявлены 5 случаев сочетанных мутаций в генах BRCA1 и BRCA2, а также 2 случая с наличием трех мутаций в генах BRCA1, BRCA2 и PIK3CA.
Важной клинической характеристикой является локализация метастатических очагов. Оценить локализацию метастазов удалось у 74,8% (n = 1871) пациенток. Для аналитического удобства пациенток в целом распределяли на три группы: наличие только висцеральных метастазов, только невисцеральных метастазов (костная ткань, кожа, лимфатические узлы) и смешанная локализация. Среди группы висцеральных метастазов особое внимание уделили локализации метастазов в печени и/или легких. В нашем исследовании доля пациенток с висцеральным распространением составила 17,2% (n = 430), среди которых метастатическое поражение печени отмечено у 4,1% (n = 102) пациенток, а легких — у 5,0% (n = 124). Примечательно, что сочетание этих локализаций метастазирования выявлено у 0,4% пациенток (n = 10). Также анализировали варианты комбинаций прочих локализаций метастазов с поражением печени или легких (табл. 2).
Средняя продолжительность заболевания у включенных пациенток составила 75,4 месяца (размах 1–899) при медиане в 52 ± 76,8 месяцев. У 25,9% (n = 647) исследованных пациенток распространенный РМЖ выявлен de novo.
Среди пациенток, которые раннее получили радикальное лечение по поводу ранних стадий заболевания, оценили показатели безрецидивной выживаемости и проведенную адъювантную терапию при наличии таковой (n = 1853).
Безрецидивный интервал определялся, как время от постановки диагноза до развития отдаленных метастазов. У четверти пациенток (n = 457; 24,7%) прогрессирование произошло в течение одного года, а в течение первых двух лет после постановки диагноза метастазы развились у суммарно 38,5% (n = 795) пациенток. Также более трети пациенток (n = 675; 36,4%) пережили рубеж в 5 лет без признаков прогрессирования, их них 14,7% (n = 272) — более 10 лет (табл. 3). Средняя продолжительность времени от проведения радикальной операции до появления метастазов составила 70,5 месяцев (размах 0–438) при медиане 52,5 ± 63,7 месяцев.
Дополнительно определяли период от окончания адъювантной терапии до появления метастазов. В группе, которая ранее получила радикальную терапию по поводу ранних стадий РМЖ, у большинства пациенток произошло прогрессирование в течение первого года после завершения терапии — 21,5% (n = 398). Отсутствие прогрессирования в течение более 5 лет отмечено у 11,5% (n = 213). Стоит отметить, что у 26,2% пациенток (n = 485) адъювантная терапия не проводилась (табл. 3).
Таблица 2. Клиническая характеристика пациенток, включенных в исследование
Table 2. Clinical characteristics of patients included in the study
|
Клиническая характеристика |
n (%) |
|
Менструальный статус: Наличие менструации Отсутствие менструации Пременопауза Менопауза Постменопауза Аменорея, индуцированная х/т Нет данных |
206 (8,2) 2289 (91,6) 31 (1,2) 699 (28,0) 1481 (59,2) 78 (3,1) 5 (0,2) |
|
Морфология РМЖ: Дольковый Инвазивная микропапиллярная карцинома Инвазивный NST Муцинозная карцинома Папиллярный рак Солидно-папиллярный рак Нет данных о типе |
311 (12,4) 33 (1,3) 2050 (82,0) 23 (0,9) 5 (0,2) 3 (0,1) 78 (3,1) |
|
Ki-67: < 20% 20–30% ≥ 30% Нет данных |
525 (21,0) 550 (22,0) 1200 (48,0) 225 (9,0) |
|
Соотношение РЭ/РП: РЭ+/РП+ РЭ+/РП– |
2310 (92,4) 190 (7,6) |
|
Соотношение РЭ/РП и Ki-67: РЭ+/РП+, Ki-67 < 20% РЭ+/РП–, Ki-67 < 20% РЭ+/РП+, Ki-67 20–30% РЭ+/РП–, Ki-67 20–30% РЭ+/РП+, Ki-67 ≥ 30 % РЭ+/РП–, Ki-67 ≥ 30% |
525 (21,0) 39 (1,6) 562 (22,5) 44 (1,8) 1195 (47,8) 135 (5,4) |
|
BRCA1 Тест проводился Наличие мутации Отсутствие мутации Тест не проводился |
319 (12,8) 24 (1,0) 295 (11,8) 2181 (87,2) |
|
BRCA2 Тест проводился Наличие мутации Отсутствие мутации Тест не проводился |
319 (12,8) 21 (0,8) 298 (11,9) 2181 (87,2) |
|
PIK3CA Тест проводился Наличие мутации Отсутствие мутации Тест не проводился |
241 (9,6) 50 (2,0) 191 (7,6) 2259 (90,4) |
|
Локализация метастазов Только невисцеральные Только висцеральные Печень Легкие Печень и легкие Легкие + другие локализации (кроме печени) Печень + другие локализации (кроме легких) Смешанная локализация Нет данных |
674 (27,0) 430 (17,2) 102 (4,1) 124 (5,0) 10 (0,4) 109 (4,4) 80 (3,2) 767 (30,7) 629 (25,2) |
|
Характер мРМЖ: De novo Прогрессирование |
647 (25,9) 1853 (74,1) |
NST — Invasive carcinoma of no special type; мРМЖ — метастатический рак молочной железы; РП — рецепторы прогестерона;
РЭ — рецепторы эстрогена
Таблица 3. Клиническая характеристика пациенток, включенных в исследование, у которых метастатический РМЖ развился после проведенного радикального лечения Table 3. Clinical characteristics of patients included in the study, in whom metastatic breast cancer developed after radical treatment
|
Клиническая характеристика |
n (%) |
|
Безрецидивный интервал (n = 1853):
1–2 года 2–5 лет 5–10 лет
|
457 (24,7) 238 (12,8) 483 (26,1) 403 (21,7) 272 (14,7) |
|
Период от окончания адъювантной терапии до появления метастазов (n = 1853):
1–2 года 2–5 лет
Отсутствие адъювантной терапии Нет данных |
398 (21,5) 122 (6,6) 192 (10,4) 213 (11,5) 485 (26,2) 443 (23,9) |
|
Характер адъювантной терапии при назначении первой линии (n = 1065): Химиотерапия Эндокринотерапия Тамоксифен Торемифен Ингибиторы ароматазы Анастрозол Летрозол Эксеместан Фулвестрант Отсутствие адъювантной терапии Нет данных |
100 (9,4) 593 (55,7) 303 (28,5) 5 (0,5) 283 (26,6) 235 (22,1) 46 (4,3) 2 (0,2) 2 (0,2) 362 (34,0) 10 (0,9) |
У пациенток, включенных в исследование и получающих 1 линию терапии (n = 1065), оценили характер проведенной адъювантной терапии. Наименьшей части пациенток проводили адъювантную химиотерапию (n = 100; 9,4%), а наибольшей — эндокринотерапию (n = 593; 55,7%). Среди компонентов эндокринотерапии назначали чаще всего тамоксифен либо ингибиторы ароматазы: 28,5% и 26,6% соответственно (табл. 3). У 362 пациенток, которым назначалась первая линия лечения в рамках исследования, адъювантную терапию не проводили.
ХАРАКТЕРИСТИКАПОЛУЧАЕМОЙ ТЕРАПИИ
Пациентки были распределены в подгруппы в зависимости от получаемой линии лечения по поводу мРМЖ.
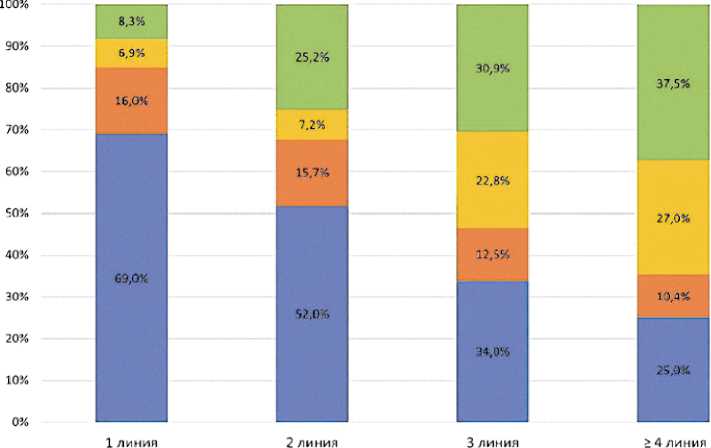
Среди всех анализируемых пациентов на момент проведения среза данных наибольшая часть пациентов получали терапию первой линии (n = 1065). По мере увеличения предлеченности количество уменьшалось: 2 линию лечения получали 833 пациентки, 3 линию — 335 пациенток, 4 и последующую — 267 пациенток. В рамках одной линии лечения рассматривали любую терапию: как химиотерапию, так и комбинированную или моноэндокринотера-пию (рис. 2). В категорию «Другое» включались пациентки, получавшие комбинацию химиотерапии с бевацизумабом или с эндокринотерапией.
■ Комбинированная эндокринотерачия ■ Моноэндокринотерапия
■ Химиотерапия □ Другое
Рисунок 2. Соотношение различных методов лечения пациенток на разных этапах противоопухолевой терапии по поводу люминального HER2-мРМЖ
-
Figure 2. The ratio of different treatment methods for patients at different stages of
antitumor therapy for luminal HER2- metastatic breast cancer
Таблица 4. Распределение пациенток, включенных в исследования, в зависимости от вида получаемой терапии в 1, 2, 3 и ≥ 4 линиях
Table 4. Distribution of patients included in the studies depending on the type of therapy received in 1, 2, 3 and ≥ 4 lines
В первой линии лечения чаще всего назначали комбинированную ЭТ, т. е. сочетание iCDK4 /6 с ингибиторами ароматазы или фулвестрантом (n = 735; 69,0%). Наиболее распространенным эндокринным партнером в первой линия лечения были ингибиторы ароматазы: их применяли в 54,7% случаев (n = 583), в то время как фулвестрант назначали в 14,3% случаев (n = 152). Среди возможных ингибиторов CDK4/6 использовали как палбоциклиб, так и абемациклиб или рибоциклиб. Полные данные по распределению терапии пациенток представлены в таблице 4.
В 16 % наблюдений (n = 170) пациенткам назначали моноэндокринотерапию, среди которой наибольшую долю занимали анастрозол (n = 70; 6,6%) и фулвестрант (n = 76; 7,1 %).
В остальных случаях пациенткам назначали химиотерапию либо ее комбинацию с антиангиогенными препаратами (бевацизумабом) или с эндокринотерапией (табл. 4).
Подгруппа пациенток на первой линии терапии представляла собой гетерогенную популяцию с точки зрения локализации метастатических очагов. Как следует из рисунка 3, в каждой из представленных подгрупп были пациентки и с висцеральными метастазами, и с невисцеральными метастазами. В подгруппе пациенток, при лечении которых был сделан выбор в пользу химиотерапии, преобладали висцеральные метастазы, в то время как в группе комбинированной эндокринотерапии — пациентки смешанной и невисцеральной локализации.
Во 2 линии лечения 52,0% (n = 433) пациенток получили комбинированную ЭТ. В качестве эндокринного компонента выбирали ингибиторы ароматазы (n = 221; 26,6 %) или фулвестрант (n = 212; 25,4 %) в практически равном соотношении ~ 1:1. Конкретное распределение по препаратам группы iCDK4/6 приведено в таблице 4. Моно-эндокринотерапию в качестве 2 линии лечения получали 15,7 % (n = 131) пациенток. Преимущественно в качестве этой опции использовали фулвестрант — 11,3 % (n = 94). Химиотерапию или различные комбинации с ней назначали в 32,4% случаев (n = 270).
Анализ подгруппы пациентов, получавших на момент среза данных 2 линию лечения, показал, что большинство из этих пациенток получали в первой линии моноэндо-кринотерапию (48%) и химиотерапию с бевацизумабом или без него (40%); 11% пациенток получали в первой линии лечения комбинированную эндокринотерапию.
В 3 линии лечения моноэндокринотерапию применяли у 12,5% пациенток (n = 42), при этом чаще всего назначали фулвестрант (n = 30; 8,9 %). Комбинированную эндо-кринотерапию получили 34% пациенток (n = 114), при этом преимущественно в комбинации с фулвестрантом (23,4% против 10,7% для ингибиторов ароматазы). На этом этапе лечения химиотерапию и прочие виды терапии назначили уже 53,7% больных (n = 180).
В 4 и последующей линии лечения моноэндокрино-терапии отдали предпочтение в 10,4 % случаев (n = 28), как отражено в таблице 4. Примечательно, что в этом случае возвращались к опциям тамоксифена или ингибиторов ароматазы, а также использовали мегестерол. Комбинация iCDK4/6 и ЭТ осталась вариантом выбора для 25% пациенток (n = 67), при этом преимущественно назначали фулвестрант (16,8% против 8,3 % для ингибиторов ароматазы).
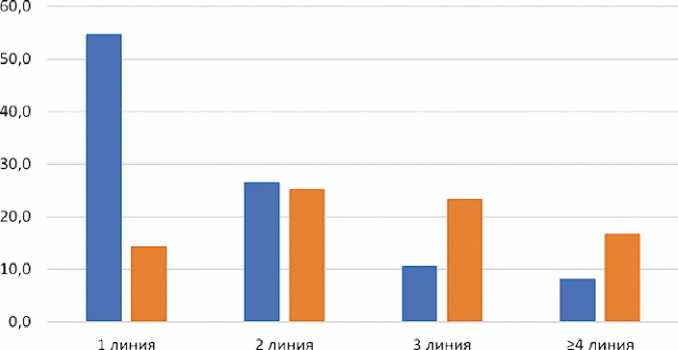
При изучении частоты назначения iCDK4/6 с ингибиторами ароматазы и фулвестрантом отмечено, что по мере увеличения предлеченности пациенток соотношение ИА и фулвестранта обратно изменялось. Так, в 1 линии лечения абемациклиб, палбоциклиб или рибоциклиб чаще назначали с ИА, а в 3 и последующей линии — с фулве-странтом (рис. 4).
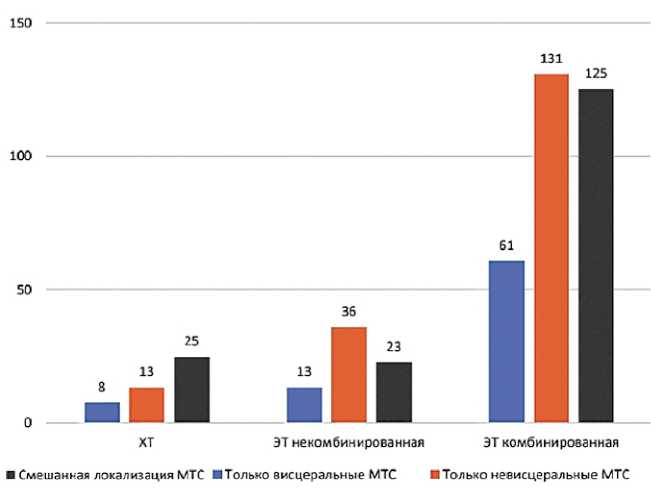
Рисунок 3. Распределение пациенток, получающих первую линию лечения по поводу люминального HER2-мРМЖ, в зависимости от локализации метастатических очагов и типа терапии
-
Figure 3. Distribution of patients receiving first-line treatment for luminal HER2-metastatic breast
cancer, depending on the location of metastatic lesions and the type of therapy
■ iCDK4/6 + ингибиторы ароматазы ■ ICDK4/6 + фулвестрант
Рисунок 4. Изменение частоты назначения iCDK4/6 с ингибиторами ароматазы и фулвестрантом по мере предлеченности пациенток
Figure 4. Change in the frequency of iCDK4 / 6 administration with aromatase inhibitors and fulvestrant with increasing pretreatment status of patients
ОБСУЖДЕНИЕ
Данные реальной клинической практики позволяют составить более актуальное представление о вариантах терапии пациенток с мРМЖ. Часто они отличаются от результатов рандомизированных клинических исследований (РКИ), поскольку для включения в РКИ пациент должен подходить под довольно жёсткие критерии включения и при этом зачастую не иметь отягощенной соматической патологии [13]. На сегодняшний день отсутствуют данные реальной клинической практики, которые бы позволили охарактеризовать лечение, получаемое российскими пациентками по поводу люминального HER2-мРМЖ. В мировой литературе были описаны результаты анализа базы данных, которые позволили составить представление о текущей ситуации и об изменениях тенденций в противоопухолевой терапии.
В США был проведен ретроспективный анализ базы данных Flatiron Health, задачей которого было охарактеризовать пациентов, получавших терапию iCDK4 / 6 + ЭТ. В период с 2015 по 2018 гг. исследователи проанализировали данные 4112 пациентки в гетерогенной популяции. Авторами отмечено, что доля пациенток, которым назначается комбинированная эндокринотерапия, выросла за время исследования с 22% до 48%, в то время как доля больных на моноэндокринотерапии снизилась с 56% до 36% (рис. 5а). Последняя чаще использовалась у пожилых пациентов с костными метастазами. Важно отметить, что доля больных, которым назначали химиотерапию, незначительно снизилась в период наблюдения — с 22% до 16% [10,14]. Для назначения химиотерапии чаще рассматривались пациенты со значительной распространенностью болезни и наличием висцеральных метастазов [15].
Еще один кросс-секционный анализ реальной клинической практики изучил данные 906 пациенток из стран Европы в период с 2019 по 2020 гг. Подавляющее большинство получали iCDK4/6 + ЭТ в первой линии лечения (42%), при этом максимум (52%) зарегистрирован в Италии, а ми- нимальный показатель — в Германии (26%). Среди всех пациенток, получавших комбинированную эндокрино-терапию, в 74% в качестве эндокринного агента использовали ингибитор ароматазы. Доля пациенток, которым была назначена химиотерапия, составила 23% среди всей популяции, при этом чаще всего ее назначали в Германии (32%), а реже всего — в Италии и Испании (по 16%) [16].
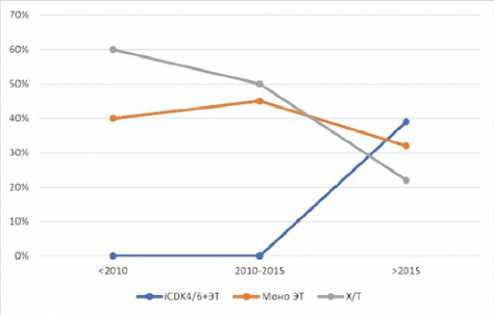
Наконец, был проведен австрийский ретроспективный анализ Austrian AGMT_MBC-Registry, который включал 931 пациентку, получавшую лечение по поводу люминального HER2-мРМЖ. Авторы охарактеризовали терапию, которая назначалась пациенткам в разные временные промежутки: до 2010 г., в период с 2010 по 2015 гг. и после 2015 г. В более ранний период (до 2010 г.) вариантом выбора оставалась химиотерапия, в то время как в период 2010–2015 гг. соотношение пациенток на химиотерапии и эндокринотерапии составило уже 1:1. После 2015 г. количество «химиотерапевтических пациенток» снизилось с прежних 60–50% до 22%: в этом периоде большая часть больных (39%) получила комбинированную эндокрино-терапию [17]. Данное исследование продемонстрировало изменение тенденций в лечении пациенток с люминальным HER2-мРМЖ в пользу комбинированной эндокринотерапии с течением времени (рис. 5б). Важно отметить, что химиотерапия продемонстрировала значимо худшие результаты по сравнению с ЭТ и iCDK4 / 6 + ЭТ как в отношении мВБП — HR 0,63 (95% ДИ 0,52–0,77, р < 001) и HR 0,19 (95% ДИ 0,13–0,29, р < 001) соответственно, так и в отношении мОВ — HR 0,59 (95% ДИ 0,49–0,72, р < 001) и HR 0,35 (95% ДИ 0,23–0,51, р < 001) соответственно.
В нашем исследовании произведен кросс-секционный анализ 2500 пациенток, получавших лекарственную терапию по поводу HR+/HER2-мРМЖ в ЛПУ г. Москвы. Согласно статистическим данным, средний возраст пациенток, заболевших РМЖ в 2020 г., составляет 61,0 год. В нашем исследовании основная часть больных (пятая часть) сосредоточена в возрастной группе 60–64 года, что делает выборку репрезентативной.
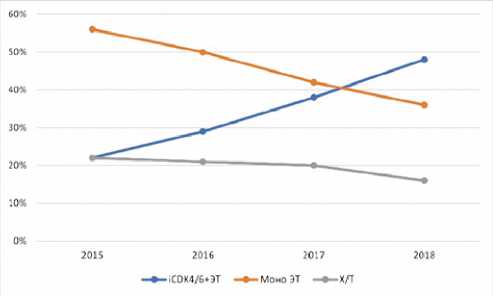
Рисунок 5. Изменение тенденций в лечении люминального HER2-мРМЖ в реальной клинической практике: а) по данным исследования Flatiron Health US; б) по данным исследования Austrian AGMT_MBC-Registry [10,17]
-
Figure 5. Changing trends in the treatment of luminal HER2-metastatic breast cancer in real clinical practice:
-
a) according to the Flatiron Health US study; b) according to the Austrian AGMT_MBC-Registry study [10,17]
На рисунке 2 приведено соотношение различных видов терапии на последовательных этапах лечения пациенток.
На сегодняшний день моноэндокринотерапия является все еще возможным, хотя и не оптимальным, вариантом лечения отдельных случаев люминального HER2-мРМЖ. Моноэндокринотерапия назначалась пациенткам на всех этапах лечения, при этом, в основном, на этот режим лечения рассматривались пациентки с невисцеральной локализацией метастазов. В основном, использовали фулвестрант или ингибиторы ароматазы (табл. 4). Важно отметить, что по мере увеличения предлеченности или развития признаков гормонорезистентности доля пациенток на этом типе лечения снижалась. Обратно пропорционально нарастала доля больных на химиотерапии и ее комбинации с прочими методами лечения, что объясняется прогрессирующим висцеральным поражением и исчерпанием стандартных опций лечения.
Согласно результатам нашего кросс-секционного исследования, комбинированную эндокринотерапию (т. е. комбинацию iCDK4/6 + ЭТ) получают большинство пациенток в первой и второй линии: 69,0% и 52,0% соответственно. По мере увеличения предлеченности больных предпочтение отдается другим методам лечения, поэтому доля комбинированной ЭТ снижается до 34,0% в третьей линии и 25,0% в четвертой и последующей линиях (рис. 6). Полученные данные соотносятся с Клиническими рекомендациями МЗ РФ, в которых указано, что наиболее предпочтительной опцией является назначение комбинации iCDK4/6 и эндо-кринотерапии именно в первой или второй линии лечения.
Анализ показал, что в первой линии комбинированной терапии 54,6% пациентов получали рибоциклиб, 43,1 % — палбоциклиб и лишь 2,3% — абемациклиб. При использовании данного подхода во второй линии соот- ношение iCDK4/6 выглядит следующим образом: 47,8% для палбоциклиба, 50,6% для рибоциклиба и 1,6% для абема-циклиба. В третьей, четвертой и последующих линиях: 53,6%; 45,3% и 1,1%, соответственно.
Использование комбинации возможно с двумя типами эндокринного партнера — ингибитором ароматазы или фулвестрантом. Использование фулвестранта одобрено, в том числе и при развившейся эндокринорезистентности, и потому может рассматриваться как оптимальный вариант лечения для пациенток, у которых развилось прогрессирование заболевания на фоне адъювантной эндокрино-терапии или в процессе лечебной терапии ингибитором ароматазы. Примечательно, что по мере развития заболевания роль фулвестранта возрастает, что нашло отражение в результатах исследования: в первой линии лечения предпочтение отдавали ингибиторам ароматазы, а во второй и последующих — фулвестранту (рис. 4).
До внедрения iCDK4/6 в рутинную практику онколога эндокринотерапия хоть и использовалась в первой линии лечения люминального HER2-мРМЖ, но не у большинства больных. При этом наличие висцеральных метастазов делало пациентку неподходящим кандидатом на менее агрессивное лечение, направленное на подавление пути активации стероид-зависимой пролиферации клетки, в связи с чем вариантом выбора являлась химиотерапия. Так, по данным ретроспективного анализа MarketScan (n = 19120), 60% пациентов получали эндокринотерапию, а 40% — химиотерапию в первой линии лечения. Однако оказалось, что абсолютному большинству пациенток с висцеральным или смешанным поражением назначали химиотерапию и только при невисцеральной локализации начинали с эндокринотерапии [18,19]. В нашем исследовании назначение комбинированной эндокринотерапии
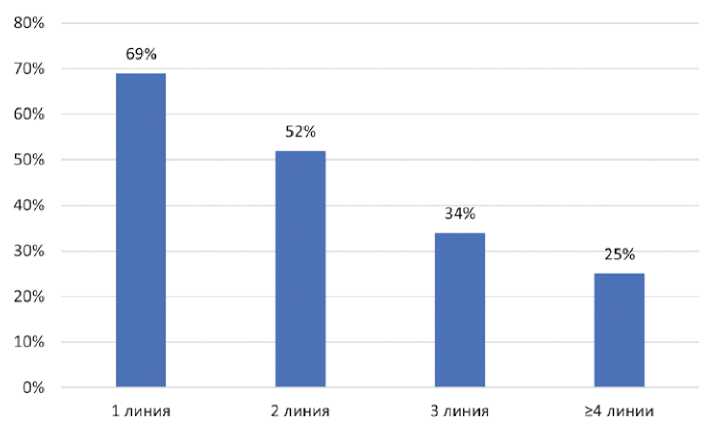
Рисунок 6. Динамика назначения комбинированной эндокринотерапии в зависимости от предлеченности пациенток с люминальным HER2-негативным распространенным РМЖ
-
Figure 6. Dynamics of the prescription of combined endocrine therapy depending on pretreatment
of patients with luminal HER2-negative advanced breast cancer использовалось при наличии висцерального метастазирования, в том числе при наличии таких факторов негативного прогноза, как наличие метастазов в печени и/или легких. В целом наблюдается мировая тенденция к уверенному назначению комбинации эндокринотера-пии и iCDK4/6 при любых локализациях метастатических очагов, к чему привело несколько причин. Произошло накопление опыта применения iCDK4/6 + ЭТ и увеличение «доверия» к этому режиму лечения. Также крайне важным стало уточнение термина «висцеральный криз». До введения этого понятия зачастую химиотерапия назначалась при висцеральных метастазах даже при отсутствии признаков нарушения функции внутренних органов. На сегодняшний день, согласно зарубежным рекомендациям (таким как ESMO, ASCO) и Клиническим рекомендациям МЗ РФ, определение звучит следующим образом: «состояние, признаками которого является множественное метастатическое поражение внутренних органов; клинические и/или лабораторные признаки нарушения функции внутренних органов, создающие угрозу жизни пациента и требующие быстрого достижения противоопухолевого эффекта».
Опубликованные данные позволяют сделать вывод о том, что в среднем в мире ~40–50% пациенток получают терапию первой линии в режиме iCDK4 /6 + ЭТ. В нашем исследовании доля таких пациенток составила 69,0%, что является значительно большим показателем в сравнении с зарубежными данными. Доступность современного противоопухолевого лечения для жителей г. Москвы обеспечена согласно Постановлению Правительства Москвы
№177-ПП от 12.03.2019 г. «О гарантиях дополнительного лекарственного обеспечения граждан, страдающих онкологическими заболеваниями», что позволило проводить терапию по последним мировым стандартам широкому кругу больных.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что назначение iCDK4 / 6 + ЭТ производится в соответствии с Клиническими рекомендациями по лечению рака молочной железы МЗ РФ от 2021 г., и предпочтительным вариантом первой линии лечения пациентов с люминальным HER2-мРМЖ в г. Москва является назначение комбинированной эндокринотерапии: 69,0% пациенток получают в первой линии лечения именно этот современный вид лечения, что значимо выше, чем во многих других странах. В перспективе результаты исследования позволят провести полный фармако-экономический анализ различных лечебных подходов врачей-онкологов в реальной клинической практике и оптимизировать бюджет здравоохранения, выделяемый на терапию пациентов с люминальным HER2-мРМЖ при сохранении высокого уровня оказываемой медицинской помощи данной категории пациентов.


