Ксеновакцинотерапия меланомы в эксперименте
Автор: Кащенко Э.А., Белогородцев С.Н., Селедцова Г.В., Самарин Д.М., Майбородин И.В., Селедцов В.И., Шишков А.А., Савкин И.В., Козлов В.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (31), 2009 года.
Бесплатный доступ
Показано, что вакцинация мышей C57BL6, несущих меланому В16, лизатом клеток человеческой меланомы Bro приводила к повышению сывороточной концентрации интерлейкина-4 (ИЛ-4) и к инфильтрации опухоли преимущественно нейтрофилами. В то же время вакцинация опухоленосителей лизатом клеток В16 приводила к повышению сывороточного интерферона-гамма (ИФ-гамма) и к инфильтрации опухоли нейтрофилами и лимфоцитами. Гистологический анализ показал высокую степень гибели опухолевых клеток в обеих группах вакцинированных животных. Тем не менее только ксеногенная, но не сингенная вакцинация ассоциировалась с пролонгацией жизни опухоленосителей. Таким образом, полученные данные указывают на важность в механизме противоопухолевого действия ксеновакцинации иммунных реакций, опосредуемых Т-хелперами 2-го типа.
Меланома, ксеногенная клеточная вакцина, т-клеточная реакция
Короткий адрес: https://sciup.org/14055111
IDR: 14055111 | УДК: :
Текст научной статьи Ксеновакцинотерапия меланомы в эксперименте
Многочисленными исследованиями установлено, что иммунная система способна распознавать и активно уничтожать туморогенные клетки. Поэтому противоопухолевая вакцинация является одним из наиболее перспективных подходов как к профилактике, так и к лечению опухолевых заболеваний. Среди большого разнообразия разрабатываемых противоопухолевых вакцин ксеновакцины привлекают особое внимание. С одной стороны, опухолеассоциированные антигены (ОАА) разных видов имеют высокую степень гомологии. С другой стороны, показано, что структурные отличия ксеногенных ОАА от их гомологов в вакцинируемом организме придают им дополнительную иммуногенность и делают их высокоэффективными в индукции противоопухолевых иммунных реакций [3, 5–8, 12–14]. Однако механизм иммуногенного действия ксеногенных ОАА изучен недостаточно. В частности, остаются вопросы, касающиеся цитокиновой направленности индуцируемых ксеногенными ОАА иммунных реакций. Данные настоящего исследования указывают на важность в механизме действия ксеновакцины иммунных реакций, опосредуемых T-хелперами 2-го типа.
Материал и методы
В работе использовались самцы мышей линии С57BL/6 (В6, Н-2b), 6–9-месячного возраста, полученные из питомника лабораторных животных СО РАМН (г. Новосибирск). Клетки меланомы В16, перевиваемые на мышах B6, и клетки человеческой меланомы Bro были получены из Онкологического научного центра РАМН (г. Москва). Опухолевые клетки сохраняли in vitro в среде RPMI 1640, содержавшей 10 % инактивированной сыворотки плодов коров, 5 мМ HEPES, 2 мМ L-глютамина и антибиотики (все реактивы Sigma, США). Для получения вакцины клеточные суспензии помещали в пластиковые пробирки (50 мл) и центрифугировали
10 мин (2000 об/мин) при t=4–8оС. Далее клетки ресуспендировали в охлажденной дистиллированной воде и повторно центрифугировали при указанных выше условиях. После центрифугирования лизат помещали в охлажденный физиологический раствор и в расфасованном виде хранили до использования при –20ºС.
Для индукции опухолевого роста клетки меланомы В16 (5х105/ мышь) имплантировали под кожу передней брюшной стенки сингенных мышей. Через 3 дня животных вакцинировали лизатом клеток В16 или Bro (5х106/ мышь). Две последующие вакцинации проводили с интервалом в 3–5 дней. В контроле животным вместо вакцины вводили физиологический раствор. Для проведения иммунологических исследований часть мышей из каждой группы выводилась из эксперимента на 15-й день после имплантации опухоли.
В пролиферативном тесте клетки селезенки культивировали в среде RPMI 1640, содержавшей 5 % инактивированной сыворотки плодов коров, 5 мМ HEPES, 2 мМ L-глютамина, 5×10-5 М меркаптоэтанола и антибиотики (все реактивы Sigma, США), в 96-луночном планшете (3x105/лунка) в присутствии лизированных клеток B16 (5*105/лунка) или сингенных спле-ноцитов в контроле. За 6 ч до окончания культивирования в культуры вносили [3H]-тимидин (0,75 мкCi/лунку). Уровень пролиферативной клеточной активности определяли по включению [3H]-тимидина. Индекс стимуляции (ИС) вычисляли по формуле: ИС = опыт (имп/мин) / контроль (имп/мин).
Уровни интерферона-гамма (ИФ-гамма) и интерлейкина-4 (ИЛ-4) в сыворотках мышей определяли с использованием коммерческих иммуноферментных тест-систем, согласно инструкции фирмы-изготовителя (BioSource, Intrenational, Inc.).
Для гистологического исследования срезы опухоли толщиной 5-7 мкм окрашивали гематоксилином и эозином. Препараты исследовали на световом микроскопе «Triton» (Seti, Бельгия) при увеличении 600 раз. Степень лейкоцитарной инфильтрации и гибели клеток опухоли оценивали по 5-балльной шкале (0 - нет, 1 - слабо выражена, 2 – умеренно выражена, 3 – выражена, 4–5 – резко выражена).
Представленные данные (средние значения, дополненные соответствующими стандартными отклонениями) были воспроизведены не менее чем в 3 однотипных экспериментах. Статистическую обработку результатов проводили с помощью непараметрического критерия Манна–Уитни и критерия Каплан и Майер.
Результаты и обсуждение
Уровень Т-клеточной сенсибилизации вакцинированных мышей к ОАА меланомы В16 был оценен в пролиферативном тесте (таблица). Достоверный прирост пролиферативного ответа клеток селезенки на меланомные антигены имел место в группе мышей, иммунизированных сингенной вакциной (р<0,002). Такого прироста не наблюдалось в группе мышей, иммунизированных ксеногенной вакциной.
Известно, что Т-хелперы 1-го типа, ответственные за развитие клеточных иммунных реакций, продуцируют интерферон-гамма (ИФ-гамма), тогда как T-хелперы 2-го типа, ответственные в большей степени за развитие гуморальных реакций, продуцируют интерлейкин-4 (ИЛ-4). Поэтому уровни этих цито-
Таблица
Пролиферативный ответ клеток селезенки на антигены клеток В16, концентрация сывороточных ИФ-гамма и ИЛ-4, степень инфильтрации и гибели клеток в опухолевой ткани
|
Группа животных |
Индекс пролиферации |
ИФ-гамма, пг/мл |
ИЛ-4, пг/мл |
Степень инфильтрации |
Степень гибели клеток |
|
Контроль |
1 |
0 |
0 |
1 |
1 |
|
Иммунизация сингенной вакциной (В16) |
4,6 ± 0,3 |
6,5 ± 2,1 |
0 |
4 |
4 |
|
Иммунизация ксеногенной вакциной (Bro) |
1,3 ± 0,3 |
0 |
6,2 ± 0,8 |
4 |
4 |
Э.А. КАЩЕНКО, С.Н. БЕЛОГОРОДЦЕВ, Г.В. СЕЛЕДЦОВА И ДР.
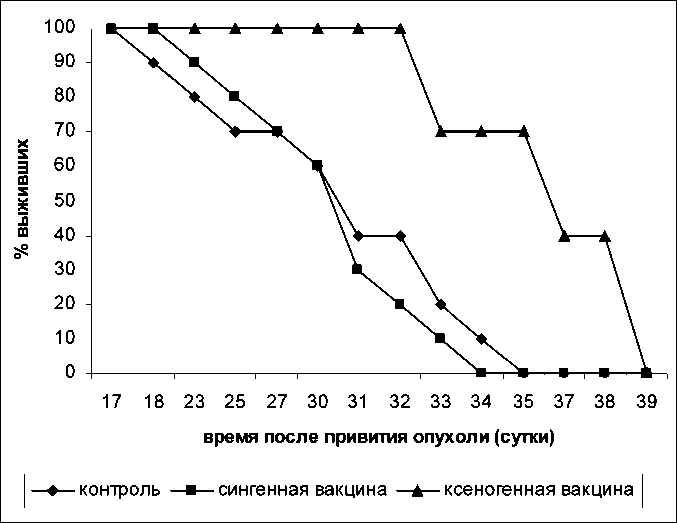
Рис. 1. Выживаемость экспериментальных животных-опухоленосителей в сравниваемых группах кинов в крови могут являться индикаторами направленности и активности происходящих в организме иммунных процессов. В сыворотках крови мышей контрольной группы содержание ИФ-гамма и ИЛ-4 не превышало минимально определяемых концентраций (1пг/мл и 5 пг/мл соответственно). В группе мышей, иммунизированных сингенной вакциной, содержание в сыворотке ИФ-гамма возрастало до 6,5 ± 2,1 пг/мл. В группе мышей, иммунизированных ксеновакциной, сывороточная концентрация ИФ-гамма не претерпевала существенных изменений. В то же время в этой группе наблюдался подъем ИЛ-4 до определяемого значения 6,2 ± 0,8 пг/мл (таблица).
При гистологическом исследовании только слабо выраженная лейкоцитарная инфильтрация опухоли и незначительная степень гибели опухолевых клеток (апоптоз и некроз) были отмечены в контрольной группе. В обеих опытных группах инфильтрация и степень гибели опухолевых клеток были резко выражены. В группе ксеновакцинированных животных большая часть инфильтрирующих клеток была представлена нейтрофилами, тогда как в группе мышей, вакцинированных сингенными ОАА, соотношение нейтрофилов и лимфоцитов в инфильтрате было близким к 1 (данные не представлены).
Кроме того, ксеновакцинация статистически достоверно (p<0,05) пролонгировала выживаемость опухоленосителей. В то же время выживаемость в группе животных, вакцинированных сингенной вакциной, существенно не отличалась от выживаемости, демонстрируемой контрольной группой (рис. 1).
В целом, полученные данные указывают на то, что вакцинация ксеногенными ОАА индуцировала иммунные реакции, опосредуемые преимущественно T-хелперами 2-го типа. Отсюда можно предполагать, что значимая роль в сдерживании развития опухолевого процесса может принадлежать опухолеспецифическим антителам. В этом случае в качестве цитотоксических эффекторов могут выступать несущие Fc-рецепторы полиморфонуклеарные лейкоциты. Вакцинация сингенными ОАА, по-видимому, в большей степени стимулирует иммунные реакции, опосредуемые T-хелперами 1-го типа. Интересно, что прирост пролиферативной Т-клеточной активности, достигнутый за счет вакцинации сингенными ОАА, не ассоциировался с пролонгацией жизни опухоленосителей.
Полученные данные входят в определенное противоречие с представлением о ведущей роли в формировании противоопухолевого эффекта иммунных реакций, опосредуемых Т-хелперами 1-го типа [7, 12]. По-видимому, вклад той или иной ветви иммунного ответа в противоопухолевый эффект может значительно варьировать в зависимости от особенностей как вакцины, так и вакцинируемого объекта.
Ранее было показано, что иммунизация меланомных пациентов клеточной вакциной, содержащей мышиные меланомные и карцином-ные ОАА, приводила к значимому увеличению концентрации в сыворотках как ИФ-гамма, так и ИЛ-4 [1, 11]. Сходные данные были получены при исследовании вакцинированных пациентов с опухолями желудочно-кишечного тракта [2, 10]. Ксеновакцинотерапия, по-видимому, активизирует у пациентов иммунные процессы, опосредуемые Т-хелперами как 1-го, так и 2-го типа. Это утверждение согласуется с опубликованными данными, свидетельствующими о генерации клеточных и гуморальных иммунных реакций у ксеновакцинированных пациентов [10, 11]. Человек и мышь – дискордантные по отношению к друг другу виды. Это означает, что при попадании в организм человека мы- шиные клетки опсонизируются естественными (пресуществующими) антителами и далее посредством опосредуемого Fc-рецепторами фагоцитоза попадают в профессиональные антиген-презентирующие клетки (макрофаги, дендритические клетки). Активное вовлечение этих клеток в процессинг чужеродного материала и презентацию ОАА в комплексе с продуктами главного комплекса гистосовместимости как II, так и I класса может быть важным элементом в механизме генерации у человека противоопухолевых иммунных реакций, опосредуемых Т-хелперами 1-го типа [4, 9]. У мышей нет пред-существующих антител к антигенам человека. Это подразумевает возможность относительно длительной персистенции интактных человеческих ОАА в организме мыши. Возможно, что такая персистенция создает благоприятные условия для более эффективного вовлечения в иммунный процесс Т-хелперов 2-го типа и В-клеток и обеспечивает превалирование этой ветви иммунного ответа над иммунными реакциями, опосредуемыми Т-хелперами 1-го типа и цитотоксическими Т-лимфоцитами (ЦТЛ).
Известно, что большинство ОАА (продукты генов MAGE, BAGE, GAGE, RAGE, белки теплового шока, онкофетальные антигены и др.) относятся к так называемым общим ОАА, которые могут экспрессироваться на опухолях разного гистогенеза. Такое антигенное сходство разных опухолей, по-видимому, является следствием вовлечения сходных внутриклеточных механизмов в процессы малигнизации разных типов клеток. Теоретически это означает, что одна и та же ксеногенная полиантигенная вакцина может быть эффективно использована в лечении разных опухолевых заболеваний. Представляется также важным то, что антигенный состав ксеновакцины может быть расширен или изменен в зависимости от решаемых за- дач. Высокая иммуногенность ксеновакцины, технологичность и относительная дешевизна ее получения открывают, по нашему мнению, широкие перспективы для ее практического применения в будущем.


