КТ-семиотика репаративных процессов в большеберцовой кости при интрамедуллярном остеосинтезе имплантатами с покрытием нитридами титана и гафния в эксперименте
Автор: Ахтямов Ильдар Фуатович, Шакирова Ф.В., Гатина Эльмира Биктемировна, Алиев Э.И., Мечов М.П.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Цель. Сравнительное изучение локального состояния костной ткани в зоне регенерации при фиксации отломков большеберцовой кости спицами из стали 12ХI8H9T с нанотехнологическим покрытием в эксперименте. Материалы и методы. В эксперименте на 40 беспородных кроликах были изучены биологические свойства нанопокрытия на основе сверхтвердых соединений нитридов титана и гафния. Результаты. Отмечено положительное влияние на формирование регенерата у животных с исследуемым покрытием. Перестроечные процессы костной ткани происходили в более ранние сроки в отличие от группы сравнения, что определялось более высокой плотностью кортикальной пластинки. Заключение. Применение имплантатов с покрытием нитридами титана и гафния, обладающих высокой прочностью, термической и химической стабильностью, сопровождалось формированием кортикальной пластинки в зоне остеоклазии с более высокими показателями плотностных характеристик.
Имплантат, компьютерная томография, нитрид титана и гафния
Короткий адрес: https://sciup.org/142121827
IDR: 142121827 | УДК: 616.718.5-001.5-003.93-089.227.843-092.9-073.756.8:[661.882 | DOI: 10.18019/1028-4427-2015-2-53-56
Текст научной статьи КТ-семиотика репаративных процессов в большеберцовой кости при интрамедуллярном остеосинтезе имплантатами с покрытием нитридами титана и гафния в эксперименте
Актуальной задачей травматологии является проблема выбора оптимального способа фиксации костных отломков и правильный выбор материалов, используемых при остеосинтезе и имплантации [12].
Металлические имплантаты имеют ряд недостатков, связанных с невысокой стойкостью к коррозии, особенно под воздействием биологически активных сред, что приводит к металлозу, несовместимости с тканями живого организма и отторжению имплантатов. Чаще это заканчивается несращением перелома, развитием гнойных процессов. В этой связи постоянно ведутся разработки по созданию оптимальных конструкций имплантатов и изыскиваются соответствующие биосовместимые материалы [9].
Одним из решений проблемы получения нового поколения имплантатов является использование схемы «металлическая основа-биопокрытие», то есть нанесение на их поверхность биосовместимых нерезорбируе-мых покрытий [2]. В настоящее время в этом качестве рассматриваются покрытия на основе нитридов титана. Они привлекательны биосовместимостью, обеспечивают низкий коэффициент трения и адекватную остеоинтеграцию [13]. Потенциально перспективными представляются также покрытия, содержащие нитрид гафния, который характеризуется химической инертностью, хорошей устойчивостью к окислению в экстремальных условиях [14], а также бактерицидностью [1]. Однако исследования этого вида покрытий единичны.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились на кафедре ветеринарной хирургии ФГБОУ ВПО Казанской государственной академии ветеринарной медицины имени Н.Э. Баумана. Все экспериментальные исследования, содержание, уход и эвтаназия проводились согласно требованиям «Европейской конвенции по защите позвоночных животных, используемых для экспериментов и других научных целей» (1986) [7].
Использованные в эксперименте имплантаты представляли собой спицы из стали 12ХI8H9T, диаметром 2 мм. Часть спиц была подвергнута камерному нанесению покрытий из нитридов титана и гафния методом конден- сации из плазменной фазы при ионной бомбардировке.
Эксперименты были проведены согласно ГОСТ ИСО (Р) 10993 (п. 11, 12) и одобрены Локальным Этическим Комитетом при ФГБОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (протокол № 5 от 25 июня 2013 г.).
Экспериментальная модель использована на 40 кроликах в возрасте 6-7 месяцев с массой тела 2 526±74,4 г. Длина большеберцовой кости кроликов составила 105±3 мм. Животные были подобраны по принципу аналогов и разделены на две равные группы по 20 в каждой. Кролики содержались в одинаковых условиях, на одинаковом рационе, согласно рекомендациям по кормлению и содержанию лабораторных животных (Приказ Минздрава СССР от 12.08.1977 № 755).
При проведении опыта операцию осуществляли под общей анестезией (Rometar 2 % – 0,15-0,2 мл/кг, Золетил 100 – 10-15 мг/кг). Всем экспериментальным животным осуществлена открытая остеоклазия большеберцовой кости в области средней трети диафиза с медиальной поверхности голени с последующим ретроградным введением в костномозговую полость одной интрамедуллярной спицы [10]. В послеоперационном периоде проводилась внешняя иммобилизация оперированной конечности гипсовой повязкой до 10 суток.
При нарушении целостности большеберцовой кости путем остеоклазии у 38 кроликов (95 %) отмечался поперечный перелом, а у 2-х кроликов (5 %) оскольчатый.
Длительность эксперимента составила 180 суток. В послеоперационном периоде за животными вели ежедневные клинические наблюдения на протяжении всего периода лечения.
Компьютерную томографию проводили на муль-тиспиральном компьютерном томографе Toshiba Aquilion-16 (МСКТ) на 10, 30, 60, 90, 120,150 и 180 сутки после оперативного вмешательства (параметры – 120 кВ, 200 мАс, фильтр Bone, толщина среза 0,5 мм) [3, 11]. При проведении денситометрии определяли плотность периостальной мозоли и кортикальной пластинки в зоне остеоклазии.
Статистическую обработку полученных цифровых данных выполняли с применением пакета программ «SPSS», версия 13. Вычисляли среднеарифметическое выборочное значение показателя (М), стандартную ошибку среднеарифметического значения (m) по каждой из сравниваемых величин с определением достоверности различий (p) по методу Стьюдента-Фишера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении МСКТ костей голени интактных кроликов плотность кортикальной пластинки большеберцовой кости в зоне в средней трети диафиза составляла 2890,0±63,1 HU (табл. 1).
На 10 сутки после операции на серии рентгеновских компьютерных томограмм у животных обеих групп были получены изображения костей голени правой конечности, фиксированных интрамедуллярной конструкцией (рис. 1). В обеих группах в зоне остеоклазии наблюдалась сформировавшаяся периостальная реакция. Плотность формировавшейся периостальной мозоли у животных группы сравнения на данном сроке составляла 443,0±44,0 HU, что в 1,9 раза ниже чем у животных опытной группы (877,0±30,0 HU) (р=0,001) (табл. 1).
На 30-е сутки были выявлены достоверные различия между группами, где плотность кортикальной пластинки у животных с имплантатами из стали без покрытия была достоверно меньше на 23 % – 1163±44,8 НU, чем у животных с имплантатами, покрытыми нитридами титана и гафния (1429±6,8HU) (р=0,001) (рис. 2). Отмечалась полная консолидация отломков большеберцовой кости у животных обеих групп.
Плотность вновь сформированной кортикальной пластинки в зоне остеоклазии у животных группы сравнения на 60 сутки (имплантаты из стали 12ХI8H9T) составила 1708,0±171,6 HU и была достоверно ниже на 26 %, чем у животных опытной группы – 2159,7±80,8 HU (р=0,045) (рис. 3).
При проведении МСКТ на последующих сроках (90-х, 120-х, 150-х суток) отмечалась тенденция к увеличению плотности кортикального слоя большеберцовой кости, где показатели опытной группы были на 15,5 % выше аналогичных значений животных группы сравнения.
При проведении МСКТ костей голени на 180 сутки плотность кортикальной пластики у животных группы сравнения составила 2414,5±115,5 HU, что на 18 % ниже, чем у животных с исследуемым покрытием – 2857,5±200,5 HU (рис. 4).
Таблица 1
Денситометрические показатели кортикальной пластинки (HU)
|
Группа животных |
До операции |
10 сутки |
30 сутки |
60 сутки |
90 сутки |
120 сутки |
150 сутки |
180 сутки |
|
Группа сравнения |
2890,0±63,1 |
443,0±44,0+++ |
1163,3±44,8+++ |
1708,0±171,6+ |
2191,0±277,0 |
2247,5±38,5 |
2321,0±284,0 |
2414,5±115,5 |
|
Опытная группа |
877,0±30,0 |
1429,3±6,8 |
2159,7±80,8 |
2299,0±165,2 |
2742,5±287,5 |
2754,5±291,5 |
2857,5±200,5 |
Примечание: + – достоверные различия в отношении показателей опытной группы: + – р<0,05, +++ – р<0,001.

Рис. 2. МСКТ большеберцовой кости, зона перелома. 30-е сутки эксперимента (MPR): а – группа сравнения; б – опытная группа
Рис. 1. МСКТ большеберцовой кости в области перелома на 10-е сутки (MPR): а – группа сравнения, б – опытная группа
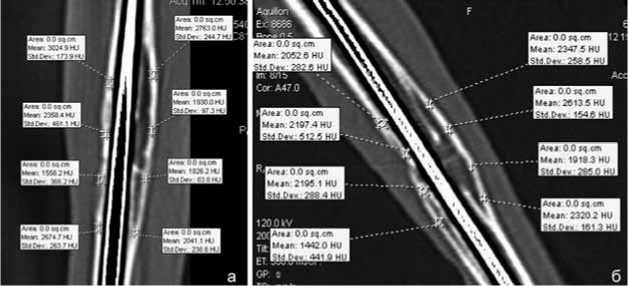
Рис. 3. МСКТ большеберцовой кости, зона перелома. 60-е сутки эксперимента (MPR): а – группа сравнения; б – опытная группа

Рис. 4. МСКТ большеберцовой кости, зона перелома. 180 сутки эксперимента (MPR): а – группа сравнения; б – опытная группа
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное исследование позволяет заключить, что применение имплантатов с покрытием нитридами титана и гафния, обладающих высокой прочностью, термической и химической стабильностью, сопровождается формированием кортикальной пластинки в зоне остеоклазии с более высокими показателями плотностных характеристик. Так, на 10 сутки эксперимента плотность формировавшейся периостальной мозоли у животных опытной группы была достоверно выше в 1,9 раза. Подобные результаты отмечались на всех последующих сроках эксперимента. На 30-е сутки плотность кортикальной пластинки у животных с исследуемым покрытием была выше на 23 %, на 60-е сутки – на 26 %. На 90-е, 120-е, 150-е, 180-е сутки не было выявлено достоверных различий между группами, но плотность кортикального слоя большеберцовой кости у животных с имплантатами, покрытыми нитридами титана и гафния, была выше в среднем на 15-18 %.
Исходя из результатов исследования можно заключить, что процессы ремоделирования костной ткани в зоне остеоклазии у животных, где применялись имплантаты с покрытием нитридами титана и гафния, происходила в более ранние сроки в отличие от группы сравнения.
Применение имплантатов с покрытием нитридами титана и гафния при погружном остеосинтезе следует считать перспективным, клинически оправданным методом и позволяет рекомендовать его для широкого клинического внедрения.
Список литературы КТ-семиотика репаративных процессов в большеберцовой кости при интрамедуллярном остеосинтезе имплантатами с покрытием нитридами титана и гафния в эксперименте
- Абдуллин И. Ш., Миронов М. М., Гарипова Г. И. Бактерицидные и биологически стойкие покрытия для медицинских имплантатов и инструментов//Мед. техника. 2004. № 4. С. 20-22
- Клинические аспекты современной лучевой диагностики в травматологии и ортопедии/Г.В. Дьячкова, Ю.Л. Митина, К.А. Дьячков, Д.А. Алекберов, А.Н. Бакарджиева, Р.В. Степанов, Е.В. Скрипкин, Ю.М. Александров, А.В. Акуленко//Гений ортопедии. 2011. № 2. С. 91-97.
- Дьячков К.А., Дьячкова Г.В., Александров Ю.М. Рентгеноморфологические особенности и плотность корковой пластинки большеберцовой кости на различных этапах удлинения//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2012. № 4. С. 58-61.
- Оценка качества кости методом мультисрезовой компьютерной томографии у больных хроническим остеомиелитом/Г.В. Дьячкова, К.А. Дьячков, С.М. Александров, Т.А. Ларионов, Н.М. Клюшин//Травматология и ортопедия России. 2013. № 3. С. 88-94.
- Анализ репаративного костеобразования при лечении больных с переломами длинных трубчатых костей по данным компьютерной томографии и двухэнергетической рентгеновской абсорбциометрии/Г.В. Дьячкова, Р.В. Степанов, Л.В. Суходолова, С.П. Бойчук, Н.Д. Хубаев, Н.Ф. Обанина//Вестн. новых мед. технологий. 2006. № 3. С. 74-78.
- Завадовская В.Д. Лучевая диагностика: учеб. пособие. Ч. 1. Методы лучевой диагностики. Лучевая анатомия органов и систем. Основные патологические синдромы. М.: Видар, 2009. 375 с.
- Карлов А.В., Шахов В.П. Системы внешней фиксации и регуляторные механизмы оптимальной биомеханики. Томск: STT, 2001. 480 с.
- Кишновская Е.А. Сращение переломов//Вестн. рентгенологии и радиологии. 1980. № 3. С. 27-30.
- Корнилов Н.В., Грязнухин Э.Г. Травматология и ортопедия: рук. для врачей. Т. 1. Общие вопросы травматологии и ортопедии. СПб.: Гиппократ, 2004. 786 с.
- Лопухин Ю.М. Экспериментальная хирургия. М.: Медицина,1971. 346 с.
- Прокоп М., Галански М. Спиральная и многослойная компьютерная томография: учеб. пособие. В 2 т. Т. 2/пер. с англ.; под ред. А.В. Зубарева, Ш.Ш. Шотемора. 2-е изд. М.: МЕДпресс-информ, 2011. 712 с.
- Самошкин И.Б., Слесаренко Н.А. Реконструктивно-восстановительная хирургия опорно-двигательного аппарата у собак: рук. для ветеринарных врачей. М.: Советский спорт, 2008. 200 с.
- Sovak G., Weiss A., Gotman I. Osseointegration of Ti6Al4V alloy implants coated with titanium nitride by a new method//J. Bone Joint Surg. Br. 2000. Vol. 82, No 2. P. 290-296.
- Nanomechanical properties of hafnium nitride coating/T. Laha, Y. Chen, K. Balani, A. Agarwal//Scripta Materialia. 2008. Vol. 58. P. 1121-1124.


