Культивирование проростков льна (Linum L.) и их реакция на действие ионов кадмия в условиях in vitro: уровень стрессовой реакции и накопление полифенолов
Автор: Гончарук Е.А., Нечаева Т.Л., Карташов А.В., Загоскина Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технологии in vitro
Статья в выпуске: 5 т.59, 2024 года.
Бесплатный доступ
В видовом многообразии рода Linum L., представленного более чем 200 видами, единственным культурным является Linum usitatissimum L. К наиболее востребованным продуктам возделывания льна относятся льняное волокно высокой прочности, жмых, костра (отходы после трепания льна - одревесневшие части стебля, преимущественно в виде мелкой соломки), а также высокопитательное льняное масло - источник короткоцепочечных полиненасыщенных омега-3 и омега-6 жирных кислот, линоленовой кислоты, витаминов A, B, D и E, клетчатки и белка. Отмечены также высокие декоративные качества льна в ландшафтном озеленении. На сегодняшний день экологическая обстановка в льносеющих регионах неблагоприятна, в том числе из-за загрязнения окружающей среды тяжелыми металлами, в частности кадмием (Cd) - высокотоксичным и подвижным в почвенном растворе элементом первого класса опасности. Его праймерное действие ингибирует физиологически важные ростовые процессы, повышает генерацию активных форм кислорода, инициирует процессы окисления белков и липидов. Все это нарушает эффективное функционирование и активность антиоксидантной системы в растениях, в том числе ее неферментативную составляющую, представленную низкомолекулярными антиоксидантами, к числу которых относятся полифенолы. Последние способны взаимодействовать с активными формами кислорода, количество которых повышается при действии Cd. В настоящей работе впервые проведена оценка стрессовой реакции на действие этого представителя тяжелых металлов у in vitro проростков трех разновидностей льна как модельной биотехнологической системы, а также изучена их способность к накоплению полифенолов - эффективных биоантиоксидантов и основных компонентов фенольного комплекса. Мы сравнили ответные реакций in vitro проростков на действие Cd по их морфофизиологическим характеристикам, уровню перекисного окисления липидов (ПОЛ) и содержанию фенольных соединений, в том числе фенилпропаноидов и флавоноидов. Объектом исследования служили in vitro стерильные проростки льна прядильного (лен-долгунец, сорт Ленок), масличного (лен масличный, сорт Санлин) ( Linum usitatissimum L.), а также декоративного (лен крупноцветковый Linum grandiflorum Desf., сорт Red) назначения. Для их получения проводили последовательную стерилизацию семян, которые затем помещали на содержащие сахарозу (2 %) безгормональные агаризованные питательные среды Мурасиге-Скуга (лен-долгунец и лен масличный) и Гамборга В5 (лен крупноцветковый). При проведении эксперимента 14-суточные проростки льна подвергали экзогенному воздействию 75 мкМ водного раствора нитрата кадмия (опытный вариант) или воды (контрольный вариант) посредством внесения в прикорневую зону. После 7 сут воздействия анализировали морфометрические параметры проростков (длина гипокотиля и главного корня) и содержание в них воды. Биохимические определения проводили в растительном материале, зафиксированном жидким азотом. Содержание Cd анализировали методом атомно-абсорбционной спектрофотометрии. Фенольные соединения извлекали 96 % этанолом и проводили спектрофотометрическое определение содержания суммы фенольных соединений, фенилпропаноидов и флавоноидов. Уровень ПОЛ определяли по реакции с тиобарбитуровой кислотой. Установлено, что in vitro проростки трех разновидностей льна различались по физиолого-биохимическим параметрам, что и определяет их ответную реакцию на действие Cd. Уже на ранних этапах онтогенеза в условиях in vitro видоспецифичность проявлялась при формировании корневой системы, образовании реакционных продуктов ПОЛ, а также в накоплении фенольных соединений и поглощении тяжелого металла. Самое высокое содержание Cd выявлено у in vitro проростков льна-долгунца - более эффективного аккумулятора Cd относительно льна масличного и льна крупноцветкового. Оно превышало этот показатель у льна масличного и льна крупноцветкового соответственно на 20,2 и 23,6 % (р ≤ 0,05). При этом уровень ПОЛ снижался только у льна масличного и льна крупноцветкового - соответственно на 24,2 и 34,2 % (р ≤ 0,05) относительно контроля, что свидетельствует об активации их защитных систем в ответ на действие поллютанта. Повышение суммарного содержания фенольных соединений, а также их различных классов (фенилпропаноидов и флавоноидов) в ответ на действие Cd отмечено только у льна масличного (соответственно на 14 %, 70 % и 49 %, р ≤ 0,05) относительно контроля, что указывает на активацию защитных систем. Все полученные данные демонстрируют различные ответные реакции in vitro проростков трех разновидностей льна под влиянием Cd, что обусловлено их видоспецифичностью. В этих условиях более выраженный ответ на уровне фенольного метаболизма характерен для льна масличного, у которого способность синтезировать эти вторичные соединения и активировать функции антиоксидантной системы была выше, чем у двух других представителей рода Linum.
Linum usitatissimum l, linum grandiflorum desf, проростки in vitro, кадмий, морфология, перекисное окисление липидов, полифенолы
Короткий адрес: https://sciup.org/142243779
IDR: 142243779 | УДК: 633.52:581.1 | DOI: 10.15389/agrobiology.2024.5.995rus
Текст научной статьи Культивирование проростков льна (Linum L.) и их реакция на действие ионов кадмия в условиях in vitro: уровень стрессовой реакции и накопление полифенолов
К биологически и хозяйственно ценным представителям рода Linum L. относится лен обыкновенный ( Linum usitatissimum L.), характеризующийся большим разнообразием (1, 2). Лен-долгунец широко используется как прядильная культура, лен-кудряш и лен-межеумок — как масличные культуры ( L. usitatissimum ), лен крупноцветковый ( L. grandiflorum Desf.) — в качестве декоративного растения. Лен-долгунец служит уникальным источником высококачественного длинного волокна для текстильной промышленности, тресты (обработанная льняная солома, используемая для дальнейшего отделения волокна) и костры (отходы после трепания льна — одревесневшие части стебля, преимущественно в виде мелкой соломки), успешно применяемой в качестве субстрата для культур закрытого грунта и адсорбента (3, 4). Лен масличный — продуцент нутрицевтически ценного льняного масла с высоким содержанием альфа-линоленовой кислоты и обогащенного полиненасыщенными омега-3 жирными кислотами (5, 6). Это масло находит применение не только в фармацевтическом и пищевом производстве, но также в лакокрасочной и полимерной промышленности. Лен крупноцветковый успешно используется при озеленении городов благодаря его ярким цветкам и устойчивости к техногенным воздействиям (7, 8).
Одна из проблем нашего времени — загрязнение окружающей среды различными токсикантами. К наиболее токсичных и широко распространенным техногенным поллютантам относится кадмий (Cd) (9, 10). Его накопление в окружающей среде связано с деятельностью предприятий, производящих краски, антисептические вещества, щелочные аккумуляторы (11). Кроме этого, в сельском хозяйстве применение фосфорных удобрений, содержащих Cd в виде примеси, приводит к повышению его количества в почве (12). Сd также может поступать в окружающую среду со сточными водами, где его содержание иногда достигает значительных величин (13, 14).
Загрязнение биосферы Cd оказывает токсическое действие на растения. Это проявляется в задержке их роста, повреждении корневой системы, хлорозе и некрозе листьев (9, 15). Отмечены изменения различных физиолого-биохимических процессов, включая фотосинтез, дыхание, водный обмен, а также поглощение, транспорт и усвоение минеральных питательных веществ (16-18). Это касается и образования вторичных метаболитов, в том числе полифенолов, характерная особенность которых — высокая биологическая активность (9, 19, 20).
Полифенолы, или фенольные соединения, разнообразны по структуре и свойствам (20, 21). Их содержание и состав видо- и органоспецифичны, зависят от возраста растений и стадии онтогенеза (22, 23). Фенольные соединения выполняют также важную роль в качестве веществ-антиоксидантов благодаря способности взаимодействовать с активными формами кислорода (АФК), количество которых повышается при стрессах, в том числе при воздействии тяжелых металлов (24, 25).
Несмотря на значительное число работ по изучению влияния тяжелых металлов, в том числе Cd, на растения наши знания о его действии до сих пор недостаточны. Это касается и льна, который значительно отлича- ется от других полевых культур спецификой метаболизма и, как следствие, продуктивностью (26, 27). Сообщалось об образовании у представителей рода Linum соединений фенольной природы — п-гидроксибензойной, хлорогеновой, феруловой и п-кумаровой кислот, а также лигнанов (28, 29, 30). Однако эти данные крайне фрагментарны и не дают четких представлений о характере накопления различных классов полифенолов в растениях льна.
При изучении метаболизма растений, а также их ответной реакции на воздействие различных факторов, в том числе тяжелых металлов, успешно используются методы биотехнологии, в частности in vitro стерильные проростки (31, 32). Их преимущества — возможность проводить лабораторные исследования круглогодично (вне зависимости от погодных условий и времени года), а также стерильность материала и контроль условий выращивания, что позволяет изучать ответные реакций модельных систем растений на воздействие различных экзогенных факторов.
В представленной работе впервые исследовано праймерное действие кадмия на in vitro проростки льна и продемонстрированы ответные реакции этих растений-аккумуляторов на присутствие поллютанта.
Цель работы — сравнение влияния кадмия на in vitro проростки льна прядильного, масличного и декоративного назначения по морфофизиологическим характеристикам, интенсивности перекисного окисления липидов и содержанию фенольных соединений, в том числе фенилпропа-ноидов и флавоноидов.
Методика. Объектом исследования были in vitro стерильные проростки льна обыкновенного ( Linum usitatissimum L.) (лен-долгунец сорта Ленок и лен масличный сорта Санлин), а также льна крупноцветкового ( Linum grandiflorum Desf., сорт Red). Для получения простаков семена последовательно стерилизовали 0,01 % водным раствором перманганата калия (7 мин) и 0,1 % раствором двухлористой ртути (8 мин). После каждой обработки материал 3-5 раз промывали стерильной дистиллированной водой. Подготовленные таким образом семена помещали на содержащие сахарозу (2 %) безгормональные агаризованные питательные среды Мураси-ге-Скуга (лен-долгунец и лен масличный) и Гамборга В5 (лен крупноцветковый). Стерильные проростки выращивали в факторостатной камере (ИФР РАН) при 25 ° С, 70 % относительной влажности воздуха, 16-часовом фотопериоде и интенсивности света 50 мкм/(м2•с).
При проведении эксперимента 14-суточные проростки льна подвергали экзогенному воздействию 75 мкМ водного раствора Cd(NO 3 ) 2 (опытный вариант) или воды (контрольный вариант), которые вносили в прикорневую зону, используя для этого стерилизующую фильтрующую насадку SLGV033NS (Millipore, «Sigma-Aldrich», США). Выбор используемой концентрации обусловлен отсутствием ингибирующего действия кадмия на рост проростков льна (33). После 7 сут воздействия анализировали морфометрические параметры проростков и содержание в них воды. Надземные части фиксировали в жидком азоте и хранили в холодильнике при - 80 ° С для последующих биохимических определений.
Морфофизиологическое состояние культур оценивали по их внешним характеристикам (цвет, плотность, наличие некротических участков). У 10 проростков в каждом варианте измеряли длину гипокотиля и главного корня.
Содержание воды в растительных тканях (5 растений в одной биологической повторности каждого варианта) определяли после их высушивания до постоянной массы при +70 ° С и выражали в процентах (34).
Содержание Cd (15 растений в одной биологической повторности каждого варианта) анализировали в растительном материале после минерализации в течение 24 ч при 25 ° С в растворах концентрированных HNO 3 и HClO 4 (2:1 v/v), после чего инкубировали в термостате TDB-A-400 при 150 ° С и 180 ° С (35). Содержание Cd измеряли на атомно-абсорбционном спектрофотометре Формула ФМ-400 (ООО «НТЦ ЛабИст», Россия) с применением ламп с полым катодом («Hamamatsu Photonics K.K.», Япония) и выражали в мкг/г сухой массы. Для калибровки прибора использовали растворы нитрата кадмия в различной концентрации, приготовленные из стандартного раствора Cd ГСО 7874-2000.
Фенольные соединения извлекали 96 % этанолом из замороженного и измельченного растительного материала (7 растений в одной биологической повторности каждого варианта) при 45 ° С в течение 45 мин. Экстракты центрифугировали (13000 об/мин, 15 мин), надосадочную жидкость использовали для спектрофотометрического определения разных классов фенольных соединений (36, 37). Содержание суммы фенольных соединений определяли с реактивом Фолина-Чокольтеу при X = 725 нм, содержание фенилпропаноидов — методом прямого спектрофотометрирования растворов при X = 330 нм, флавоноидов — с 2 % раствором хлорида алюминия при X = 510 нм. Содержание суммы фенольных соединений и флавоноидов выражали в мг-экв. рутина/г сухой массы, содержание фенилпропанои-дов — в мг-экв. кофейной кислоты/г сухой массы.
Уровень перекисного окисления липидов (ПОЛ) определяли в растительном материале, используя реакцию с тиобарбитуровой кислотой (38). Для этого навеску (7 растений в одной биологической повторности каждого варианта) замороженных в жидком азоте тканей гомогенизировали в 0,1 М Трис-HCl буфере (рН 7.5), содержащем 0,35 М NaCl. Затем добавляли 0,5 % раствор тиобарбитуровой кислотой в 20 % трихлоруксусной кислоте и инкубировали на кипящей водяной бане. Через 30 мин реакционную смесь охлаждали, надосадочную жидкость отделяли и измеряли ее оптическую плотность при X = 532 нм (спектрофотометр Specord M40, «Carl Zeiss, AG», Германия). Для расчета содержания малонового диальдегида (МДА) использовали коэффициент молярной экстинкции е , равный 1,56х1о - 5 см - 1 • М - 1 (39).
Все определения проводили в трех биологических и трех аналитических повторностях. Статистическую обработку полученных данных осуществляли с помощью программы Microsoft Excel 2010 и SigmaPlot12.2 (анализ ANOVA). На рисунках представлены средние арифметические значения определений ( М ) и их стандартные ошибки (±SEM). Достоверность различий средних значений оценивали по t -критерию Стьюдента при р < 0,05 и обозначали ее разными латинскими буквами.
Результаты. Морфофизиологические характеристики растений служат важными показателями их онтогенетического развития и продукционной способности (40). Для льна более медленный рост надземной части относительно корневой системы отмечен после завершения онтогенетических фаз «всходы» и «елочка» (41). У in vitro проростков льна-дол-гунца и льна масличного в контрольном варианте развитие соответствовало норме (рост корневой системы происходил более интенсивно относительно гипокотиля) (табл.).
Иная тенденция выявлена у льна крупноцветкового, где более эффективным был рост надземной части (см. табл.). Это согласуется с данными других исследователей, сообщавших об отличиях в характере его роста от такового у двух других представителей рода Linum в естественных условиях произрастания (42).
Морфометрические показатели и содержание воды в in vitro проростках льна-долгунца (сорт Ленок) , льна масличного (сорт Санлин) (лен обыкновенный Linum usitatissimum L.) и льна крупноцветкового (сорт Red) ( L. grandiflorum Desf.) в контроле (К) и под влиянием кадмия (Cd) ( M ±SEM, факторостатная камера)
|
Сорт |
Длина главного корня, см |
Высота проростка, см |
Содержание воды, % |
|||
|
К |
Cd |
К |
п Cd |
К |
1 Cd |
|
|
Ленок |
8,4±0,7Aa |
7,5±0,6Ba |
6,3±0,7Aa |
7,0±0,6Aa |
93,1±0,1Ab |
94,4±0,2Aa |
|
Санлин |
10,0±0,9Aa |
9,0±0,9Aa |
6,1±0,7Aa |
7,0±0,8Aa |
93,3±0,2Aa |
93,7±0,8Aa |
|
Red |
3,3±0,4Ca |
2,8±0,3Ca |
5,9±0,6Aa |
4,9±0,6Bb |
90,0±0,1Ba |
90,5±0,3Ba |
Пр им еч ан и е. Измерения морфометрических показателей проводили на 10 проростках каждого варианта, содержание воды определяли в трех биологических повторностях. Статистическую обработку полученных данных осуществляли с помощью программы Microsoft Excel 2010 и SigmaPlot12.2. Разными латинскими буквами отмечены статистически значимые различия между вариантами при р ≤ 0,05 (ANOVA): прописными — между разновидностями льна контрольных и опытных вариантов, строчными — внутри каждой разновидности.
Следует отметить, что максимальные показатели длины главного корня характерны для контрольного варианта in vitro проростков льна масличного, которые превышали таковые у льна-долгунца и льна крупноцветкового соответственно на 16 и 67 % (р ≤ 0,05). Что касается высоты проростка, то анализируемый показатель у этих контрольных вариантов имел близкие значения (см. табл.). Все перечисленное свидетельствует о том, что при выращивании проростков льна в условиях in vitro видоспе-цифичность проявляется только при формировании корневой системы. Такая реакция может быть следствием ранних этапов онтогенеза растений льна (41, 43).
Воздействие такого металла, как Cd, в большинстве случаев ингибирует рост растений, а также влияет на митотический цикл и подавляет процесс деления клеток (9, 44, 45). У in vitro проростков всех разновидностей льна прослеживалась тенденция к уменьшению длины главного корня. Так, у льна-долгунца и льна масличного на среде с Cd главный корень был короче относительно контрольного варианта соответственно на 10,8 и 10,5 % (р ≤ 0,05), тогда как у льна крупноцветкового — на 15,1 % (р ≤ 0,05). Аналогичная тенденция характерна и для гипокотиля льна крупноцветкового (снижение на 16,9 %, р ≤ 0,05). При этом у in vitro проростков льна-долгунца и льна масличного в условиях действия Cd наблюдалась тенденция к незначительному увеличению длины гипокотиля относительно контроля — соответственно на 11,1 и 14,7 % (р ≤ 0,05 ). Следовательно, эти разновидности льна различаются по физиолого-биохимическим параметрам, что и определяет их ответную реакцию на действие Cd.
Содержание воды в растительных тканях относится к значимым показателям их физиологического состояния, которое особенно важно при изменении условий роста или действии экзогенных факторов (46). Согласно нашим данным, этот показатель не различался у in vitro проростков льна-долгунца и льна масличного и был немного выше, чем у льна крупноцветкового (см. табл.). Эта тенденция отмечалась как для контрольных, так и для опытных вариантов. Воздействие Cd не влияло на содержание воды в in vitro проростках, исключением оказался лен-долгунец, у которого этот показатель ненамного, но статистически значимо повышался. Такой эффект обусловлен инициацией процессов вакуолизации растительных клеток, как отмечалось другими исследователями (47).
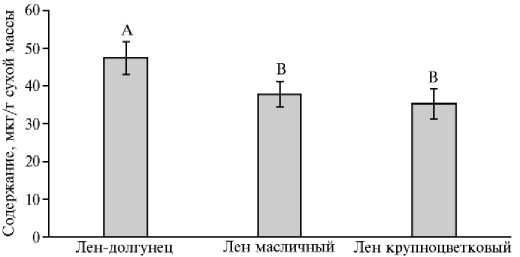
Рис. 1. Содержание кадмия в in vitro проростках льна-долгунца (сорт Ленок) , льна масличного (сорт Санлин) (лен обыкновенный Linum usitatissimum L.) и льна крупноцветкового (сорт Red) ( L. grandiflorum Desf.), выращиваемых в присутствии металла в течение 7 суток. Определения проводили в трех биологических и трех аналитических повторностях ( M ±SEM, факторостатная камера). Статистическую обработку полученных данных осуществляли с помощью программы Microsoft Excel 2010 и SigmaPlot12.2. Латинскими буквами обозначены статистически значимые различия между вариантами при р ≤ 0,05 (ANOVA).
Лен относится к растениям-аккумуляторам, способным накапливать тяжелые металлы не только при их высокой концентрации в почве, но и при низкой (48, 49). Согласно нашим данным, Cd поступал в надземные органы in vitro проростков льна (рис. 1). Наибольшее его содержание отмечено у льна-долгунца. Оно превышало этот показатель у льна масличного и льна крупноцветкового на соответственно 20,2 и 23,6 % (р ≤ 0,05). Следовательно, in vitro проростки льна-долгунца эффективно аккумулируют Cd, что отмечалось для льна прядильного назначения в условиях in vivo (50).
Редокс-гомеостаз в клетках растений, обусловленный содержанием АФК, представляет собой существенную составляющей метаболизма (51, 52). Показателем редокс-гомеостаза служит уровень ПОЛ, оцениваемый по содержанию МДА (38). Следует отметить, что АФК всегда образуются в клетках растений, однако их уровень может значительно повышаться при действии экзогенных факторов, в том числе Cd (9, 53).
Определение содержания МДА показало его различия у in vitro проростков трех разновидностей льна в контрольных вариантах (рис. 2).
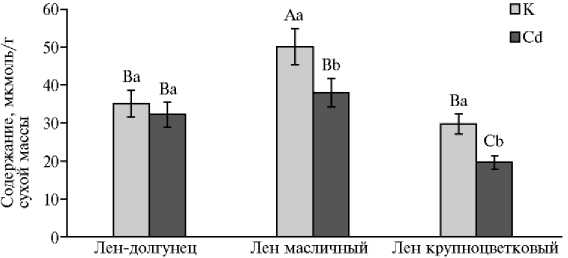
Рис. 2. Содержание малонового диальдегида в in vitro проростках льна-долгунца (сорт Ленок) , льна масличного (сорт Санлин) (лен обыкновенный Linum usitatissimum L.) и льна крупноцветкового (сорт Red) ( L. grandiflorum Desf.) в контроле (К) и при воздействии кадмия (Cd) . Определения проводили в трех биологических и трех аналитических повторностях ( M ±SEM, факторостатная камера). Статистическую обработку полученных данных осуществляли с помощью программы Microsoft Excel 2010 и SigmaPlot12.2. Разными латинскими буквами обозначены статистически значимые различия между вариантами при р ≤ 0,05 (ANOVA): прописными — между разновидностями льна контрольных и опытных вариантов, строчными — внутри каждой разновидности.
У льна масличного мы отмечали наибольший показатель, который превышал таковой у льна-долгунца (на 30 %, р ≤ 0,05) и особенно у льна крупноцветкового (на 40,5 %, р ≤ 0,05). Это свидетельствует о различиях в функциональной активности редокс-потенциала у трех представителей рода Linum в условиях in vitro.
При действии Cd у in vitro проростков у льна-долгунца содержание МДА оставалось на уровне контроля, тогда как у льна масличного и льна крупноцветкового оно снижалось (соответственно на 24,2 и 34,2 %, р ≤ 0,05). Следствием этих изменений стало практически равное его содержание у льна-долгунца и льна масличного в отличие от льна крупноцветкового, у которого содержание МДА было ниже (соответственно в 1,6 и 1,9 раза).
Таким образом, воздействие Cd приводило к изменениям в функционировании антиоксидантной системы у in vitro проростков льна масличного и льна крупноцветкового. Это проявлялось в уменьшении содержания МДА, что свидетельствует о возможной активации защитных систем, снижении количества АФК в клетках и нормализации баланса про-и антиоксидантов. О влиянии экзогенных факторов, в том числе тяжелых металлов, на антиоксидантную систему растений сообщалось в литературе (51, 54).
К эффективным антиоксидантам в клетках растений относятся фенольные соединения — представители низкомолекулярных (неферментативных) антиоксидантов (19, 55). В последние годы их рассматривают в качестве так называемой второй линии защиты от АФК, поскольку активность высокомолекулярных (ферментативных) антиоксидантов первой линии более выражена при первичном воздействии стресса (51).
Определение суммарного содержания фенольных соединений позволяет оценить способность растительных тканей к образованию этих низкомолекулярных антиоксидантов (36). Согласно представленным данным (рис. 3, А), в in vitro проростках льна-долгунца и льна крупноцветкового в контрольном варианте оно было статистически равным и значительно превышало таковое у льна масличного (на 22,6% в обоих случаях).
При экзогенном действии Cd у in vitro проростков льна-долгунца и льна крупноцветкового статистически достоверных изменений в содержании суммы фенольных соединений мы не отмечали. Иная тенденция характерна для льна масличного, у которого оно повышалось на 14 % (р ≤ 0,05). Следствием этих изменений стало практически равное суммарное содержание фенольных соединений у разных представителей льна in vitro при действии Cd.
Фенилпропаноиды — характерные для растений льна биогенетически ранние фенольные соединения (19). Их содержание в контроле было максимальным у in vitro проростков льна крупноцветкового, которое превышало таковое у льна-долгунца (на 31 %, р ≤ 0,05) и особенно у льна масличного (на 70 %, р ≤ 0,05) (см. рис. 3, Б). Полученные данные свидетельствуют об особенностях образования фенилпропаноидов у льна масличного, что проявляется в их незначительном накоплении у этой культуры, специализированный метаболизм которой направлен на синтез поли-ненасыщенных жирных кислот (5).
При экзогенном действии Cd содержание фенилпропаноидов у in vitro проростков льна-долгунца и льна крупноцветкового не изменялось относительно контрольного варианта. Иная тенденция характерна для льна масличного, у которого оно повышалось практически на 49 % (р ≤ 0,05). В результате таких изменений содержание фенилпропаноидов у льна-долгунца и льна масличного при действии кадмия становилось практически равным, хотя в обоих случаях остается ниже такового у льна крупноцветкового на 31 % (р ≤ 0,05). Полученные данные указывают на повышенную способность последнего к накоплению обсуждаемых биогенетически ранних фенольных метаболитов (как в контроле, так и при действии Cd) относительно двух других разновидностей льна. Это согласуется c ранее полученными нами данными по активации биосинтеза фенилпропаноидов в кал-лусной культуре льна крупноцветкового при действии дрожжевого экстракта (56).
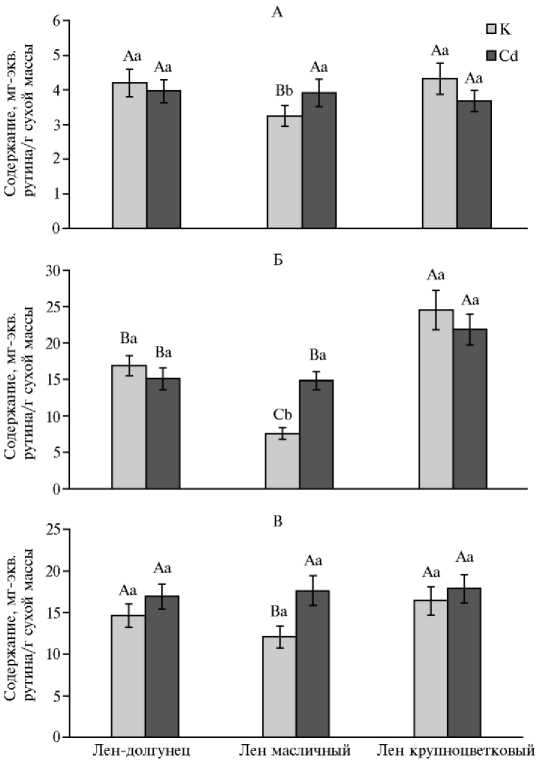
Рис. 3. Суммарное содержание фенольных соединений (А) , фенилпропаноидов (Б) и флаванои-дов (В) в in vitro проростках льна-долгунца (сорт Ленок) , льна масличного (сорт Санлин) (лен обыкновенный Linum usitatissimum L.) и льна крупноцветкового (сорт Red) ( L. grandiflorum Desf.) в контроле (К) и при воздействии кадмия (Cd) . Определения проводили в трех биологических и трех аналитических повторностях ( M ±SEM, факторостатная камера). Статистическую обработку полученных данных осуществляли с помощью программы Microsoft Excel 2010 и SigmaPlot12.2. Разными латинскими буквами обозначены статистически значимые различия между вариантами при р ≤ 0,05 (ANOVA): прописными — между разновидностями льна контрольных и опытных вариантов, строчными — внутри каждой разновидности.
Флавоноиды — одни из наиболее распространенных в надземных органах растений фенольных метаболитов (19). Из большее и практически равное содержание мы отмечали у in vitro проростков льна-долгунца и льна крупноцветкового, которое превышало таковое у льна масличного соответственно на 17,4 и 24,4 % (р ≤ 0,05) (см. рис. 3, В). После воздей- ствия Cd во всех исследованных вариантах содержание флавоноидов было равным и достоверно повышалось только у льна масличного (на 31,4 %, р ≤ 0,05). На основании этих данных можно сделать заключение об отсутствии ответной реакции на действие Cd у in vitro проростков льна-долгунца и льна крупноцветкового. Что касается льна масличного, то для него характерно увеличение содержания флаваноидов, являющееся, по-видимому, следствием активации флавоноидного пути фенольного метаболизма.
Полученные нами данные позволяют предположить возможность выращивания льна масличного и льна-долгунца в неблагоприятных агроэкологических условиях: льна масличного — за счет инактивации поллютанта благодаря функционированию неферментативной антиоксидантной системы, а льна прядильной разновидности — учитывая его стратегию увеличения аккумуляции металла в инертных клеточных органеллах.
Итак, представленные в настоящем сообщении данные свидетельствуют о различиях в ответных реакциях in vitro проростков разновидностей льна — льна-долгунца (сорт Ленок), льна масличного (сорт Санлин) ( Linum usitatissimum L.), а также льна крупноцветкового ( Linum grandiflorum Desf, сорт Red) на действие Cd. В присутствии поллютанта происходило ингибирование морфометрических параметров, что в разной степени было для них характерно и, по-видимому, обусловлено подавлением деления клеток за счет влияния металла на процессы митотического цикла. Следует отметить активацию функций антиоксидантной системы у in vitro проростков льна масличного и льна крупноцветкового при действии кадмия. Этот процесс у льна масличного назначения сопровождался повышением суммарного содержания фенольных соединений, увеличением содержания биогенетически ранних фенольных метаболитов — фенилпропаноидов, а также флавоноидов как индикаторов активации флавоноидного пути фенольного метаболизма, что было не характерно для двух других разновидностей in vitro проростков льна. Разная степень выраженности изменений морфометрических и физиолого-биохимических показателей обусловлены видоспецифичностью изучаемых объектов. Полученные данные указывают на наличие у льна масличного и льна-долгунца фиторемедиационной способности. Эти культуры можно использовать при техногенном загрязнении среды, что благотворно повлияет на экологическую обстановку в регионах их возделывания.
Список литературы Культивирование проростков льна (Linum L.) и их реакция на действие ионов кадмия в условиях in vitro: уровень стрессовой реакции и накопление полифенолов
- Rogers C.M. The systematics of Linum sect. Linopsis (Linaceae). Plant Systematics and Evolution, 1982, 140(2-3): 225-334 (doi: 10.1007/bf02407299).
- Светлова А.А. Таксономический обзор рода Linum L. (Linaсеае) флоры России и сопредельных государств Новости систематики высших растений, 2010, 41: 99-65 (doi: 10.31111/novitates/2010.41.99).
- Ramesh M.J.P.I.M.S. Flax (Linum usitatissimum L.) fibre reinforced polymer composite materials: A review on preparation, properties and prospects. Progress in Materials Science, 2019, 102: 109-166 (doi: 10.1016/j.pmatsci.2018.12.004).
- Pisupati A., Willaert L., Goethals F., Uyttendaele W., Park C.H. Variety and growing condition effect on the yield and tensile strength of flax fibers. Industrial Crops and Products, 2021, 170: 113736 (doi: 10.1016/j.indcrop.2021.113736).
- Yang J., Wen C., Duan Y., Deng Q., Peng D., Zhang H., Ma H. The composition, extraction, analysis, bioactivities, bioavailability and applications in food system of flaxseed (Linum usitatissimum L.) oil: A review. Trends in Food Science and Technology, 2021, 18: 252-260 (doi: 10.1016/j.tifs.2021.09.025).
- Page J., Amziane S., Gomina M., Djelal C., Audonnet F. Using linseed oil as flax fibre coating for fibre-reinforced cementitious composite. Industrial Crops and Products, 2021, 161: 113168 (doi: 10.1016/j.indcrop.2020.113168).
- Asad B., Khan T., Gul F.Z., Ullah M.A., Drouet S., Mikac S., Garros L., Ferrier M., Bose S., Munsch T., Tungmunnithum D., Lanoue A., Giglioli-Guivarc’h N., Hano C., Abbasi B.H. Scarlet flax Linum grandiflorum (L.) in vitro cultures as a new source of antioxidant and anti-inflammatory lignans. Molecules, 2021, 26 (15): 4511 (doi: 10.3390/molecules26154511).
- Villalvazo-Hernández A., Burgos-Hernández M., González D. Phylogenetic analysis and flower color evolution of the subfamily Linoideae (Linaceae). Plants, 2022, 11(12): 1579 (doi: 10.3390/plants11121579).
- Goncharuk E.A., Zagoskina N.V. Heavy metals, their phytotoxicity, and the role of phenolic antioxidants in plant stress responses with focus on cadmium: review. Molecules, 2023, 28: 3921 (doi: 10.3390/molecules28093921).
- Yang G.L., Zheng M.M., Tan A.J., Liu Y.T., Feng D., Lv S. M. Research on the mechanisms of plant enrichment and detoxification of cadmium. Biology, 2021, 10(6): 544 (doi: 10.3390/biology10060544).
- Andresen E., Küpper H. Cadmium toxicity in plants. Metal Ions in Life Sciences, 2013, 11: 395 (doi: 10.1007/978-94-007-5179-8_13).
- Ulrich A.E. Cadmium governance in Europe’s phosphate fertilizers: Not so fast? Science of the Total Environment, 2019, 650: 541-545 (doi: 10.1016/j.scitotenv.2018.09.014).
- Li B., Chen Z., Li Y., Yang W., Wang W. Visualization analysis of graphene and its composites for heavy metal wastewater applications. Environmental Science and Pollution Research, 2019, 26: 27752-27760 (doi: 10.1007/s11356-019-05983-5).
- Hui C.Y., Guo Y., Li H., Gao C.X., Yi J. Detection of environmental pollutant cadmium in water using a visual bacterial biosensor. Scientific reports, 2022, 12(1): 6898 (doi: 10.1038/s41598-022-11051-9).
- Zulfiqar U., Ayub A., Hussain S., Waraich E.A., El-Esawi M.A., Ishfaq M., Ahmad M., Ali M., Maqsood M.F. Cadmium toxicity in plants: Recent progress on morpho-physiological effects and remediation strategies. Journal of Plant Nutrition and Soil Science, 2022, 22: 212-269 (doi: 10.1007/s42729-021-00645-3).
- Ivanov A.A., Kosobryukhov A.A. Ecophysiology of plants under cadmium toxicity: Photosynthetic and physiological responses. In: Plant ecophysiology and adaptation under climate change: mechanisms and perspectives I. Springer: Singapore, 2020: 429-484 (doi: 10.1007/978-981-15-2156-0_15).
- Khaliq M.A., James B., Chen Y.H., Saqib H.S.A., Li H.H., Jayasuriya P., Guo W. Uptake, translocation, and accumulation of Cd and its interaction with mineral nutrients (Fe, Zn, Ni, Ca, Mg) in upland rice. Chemosphere, 2019, 215: 916-924 (doi: 10.1016/j.chemosphere.2018.10.077).
- Cuypers A., Vanbuel I., Iven V., Kunnen K., Vandionant S., Huybrechts M., Hendrix S. Cadmium- induced oxidative stress responses and acclimation in plants require fine-tuning of redox biology at subcellular level. Free Radical Biology and Medicine, 2023, 199: 81-96 (doi: 10.1016/j.freeradbiomed.2023.02.010).
- Zagoskina N.V., Zubova M.Y., Nechaeva T.L., Kazantseva V.V., Goncharuk E.A., Katanskaya V.M., Baranova E.N., Aksenova M.A. Polyphenols in plants: structure, biosynthesis, abiotic stress regulation, and practical applications (Review). International Journal of Molecular Sciences, 2023, 24: 13874 (doi: 10.3390/ijms241813874).
- Wang Y., Lei Z., Ye R., Zhou W., Zhou Y., Zou Z., Li J., Yi L., Dai Z. Effects of cadmium on physiochemistry and bioactive substances of muskmelon (Cucumis melo L.). Molecules, 2022, 27: 2913 (doi: 10.3390/molecules27092913).
- Belšcak-Cvitanovic A., Durgo K., Hudek A., Bacun-Družina V., Komes D. Overview of polyphenols and their properties. In: Polyphenols: properties, recovery, and applications /C.M. Galanakis (ed.). Elsevier, Amsterdam, 2018: 3-44 (doi: 10.1016/B978-0-12-813572-3.00001-4).
- Nurzyńska-Wierdak R. Phenolic compounds from new natural sources — plant genotype and ontogenetic variation. Molecules, 2023, 28(4): 1731 (doi: 10.3390/molecules28041731).
- Rogge S.A., Neugart S., Schreiner M., Meyhöfer R. Phenolic compounds in different stages of ontogenesis in chrysanthemum—a potential for thrips-resistance characterisation. Horticulturae, 2024, 10(8): 822 (doi: 10.3390/horticulturae10080822).
- Moazzen A., Öztinen N., Ak-Sakalli E., Kosar M. Structure-antiradical activity relationships of 25 natural antioxidant phenolic compounds from different classes. Heliyon, 2022, 8: e10467 (doi: 1016/j.heliyon.2022.e10467).
- Гончарова Ю.К., Гончаров С.В., Харитонов Е.М., Фотев Ю.В., Симонова В.В., Очкас Н.А. Антиоксиданты растительного происхождения и их нетрадиционные источники (обзор). Сельскохозяйственная биология, 2024, 59(1): 39-53 (doi: 10.15389/agrobiology.2024.1.39rus).
- Cullis C.A. Fundamental insights into plant biology that might be offered by flax. In: Genetics and genomics of Linum, Springer, Cham., 2019: 261-263 (doi: 10.1007/978-3-030-23964-0_17).
- Goudenhooft C., Bourmaud A., Baley C. Flax (Linum usitatissimum L.) fibers for composite reinforcement: exploring the link between plant growth, cell walls development, and fiber properties. Frontiers in Plant Science, 2019, 10: 411 (doi: 10.3389/fpls.2019.00411).
- Ramsay A., Fliniaux O., Quéro A., Molinié R., Demailly H., Hano C., Paetz C., Roscher A., Grand E., Kovensky J., Schneider B., Mesnard F. Kinetics of the incorporation of the main phenolic compounds into the lignan macromolecule during flaxseed development. Food Chem. 2017, 217: 1-8 (doi: 10.1016/j.foodchem.2016.08.039).
- Garros L., Drouet S., Corbin C., Decourtil C., Fidel T., de Lacour J.L., Leclerc E.A., Renouard S., Tungmunnithum D., Doussot J., Abassi B.H., Maunit B., Laine E., Fliniaux O., Mesnard F., Hano C. Insight into the influence of cultivar type, cultivation year, and site on the lignans and related phenolic profiles, and the health-promoting antioxidant potential of flax (Linum usitatissimum L.) seeds. Molecules, 2018, 23: 2636 (doi: 10.3390/molecules23102636).
- Gai F., Janiak M.A., Sulewska K., Peiretti P.G., Karamac M. Phenolic compound profile and antioxidant capacity of flax (Linum usitatissimum L.) harvested at different growth stages. Molecules, 2023, 28: 1807 (doi: 10.3390/molecules28041807).
- Le T.N., Luong H.Q., Li H.P., Chiu C.H., Hsieh P.C. Broccoli (Brassica oleracea L. var. italica) sprouts as the potential food source for bioactive properties: a comprehensive study on in vitro disease models. Foods, 2019, 8(11): 532 (doi: 0.3390/foods8110532).
- Sharde R., Tripathi M.K., Bhatt D., Tiwari S., Sharma M., Tomar Y., Tripathi N. Influence of plant growth regulators on in vitro morphogenesis in sprout culture of potato (Solanum tuberosum L.). Potato Research, 2024, 67: 399-420 (doi: 10.1007/s11540-023-09640-w).
- Гончарук Е.А., Загоскина Н.В. Кадмий как регулятор защитно-приспособительных реакций растений. Субтропическое и декоративное садоводство, 2018, 64: 144-149.
- Рогожин В.В., Рогожина Т.В. Практикум по физиологии и биохимии растений. СПб, 2013.
- Shevyakova N.I., Il'Ina E.N., Stetsenko L.A., Kuznetsov V.V. Nickel accumulation in rape shoots (Brassica napus L.) increased by putrescine. International Journal of Phytoremediation, 2011, 13(4): 345-356 (doi: 10.1080/15226514.2010.495147).
- Николаева Т.Н., Лапшин П.В., Загоскина Н.В. Метод определения суммарного содержания фенольных соединений в растительных экстрактах с реактивом Фолина-Дениса и реактивом Фолина-Чокальтеу: модификация и сравнение. Химия растительного сырья, 2021, 2: 291-299 (doi: 10.14258/jcprm.2021028250).
- Goncharuck E.A., Kazantseva V.V., Zagoskina N.V. Effect of hypothermia on the composition of phenolics in buckwheat plants with different ploidy. Russian Journal of Plant Physiology, 2021, 68: 1227-1235 (doi: 10.1134/S1021443721050046).
- Barriuso B., Astiasarán I., Ansorena D. A review of analytical methods measuring lipid oxidation status in foods: a challenging task. European Food Research and Technology, 2013, 236: 1- 15 (doi: 10.1007/s00217-012-1866-9).
- Hodges D.M., DeLong J.M., Forney C.F., Prange R.K. Improving the thiobarbituric acidreactive- substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 1999, 207(4): 604-611 (doi: 10.1007/s004250050524).
- Серебрякова Т.И., Воронин Н.С., Еленевский А.Г., Батыгина Т.Б., Шорина Н.И., Савиных Н.П. Ботаника с основами фитоценологии: Анатомия и морфология растений. М., 2006.
- Рогаш А.Р. Льноводство. М., 1967.
- Литвинова И.И., Гладков Е.А. Введение в культуру клеток у растений, используемых в качестве кормовых, лекарственных и декоративных, для получения стрессоустойчивых форм. Сельскохозяйственная биология, 2012, 4: 94-99 (doi: 10.15389/agrobiology.2012.4.94eng).
- Жученко А.А. Адаптивная система селекции растений (экологогенетические основы). М., 2001.
- Серегин И.В., Иванов В.Б. Физиологические аспекты токсического действия кадмия и свинца на высшие растения. Физиология растений, 2001, 4: 606-630.
- Hendrix S., Jozefczak M., Wójcik M., Deckers J., Vangronsveld J., Cuypers A. Glutathione: A key player in metal chelation, nutrient homeostasis, cell cycle regulation and the DNA damage response in cadmium-exposed Arabidopsis thaliana. Plant Physiology and Biochemistry, 2020, 154: 498-507 (doi: 10.1016/j.plaphy.2020.06.006).
- Brodersen C., McElrone A. Maintenance of xylem network transport capacity: a review of embolism repair in vascular plants. Frontiers in Plant Science, 2013, 4: 108 (doi: 10.3389/fpls.2013.00108).
- Farjaminezhad R., Garoosi G. Prediction of the effect of chitosan on cell suspension culture of Azadirachta indica by response surface methodology. Plant Cell, Tissue and Organ Culture (PCTOC), 2021, 146(2): 323-337 (doi: 10.1007/s11240-021-02072-9).
- Saleem M.H., Ali S., Hussain S., Kamran M., Chattha M.S., Ahmad S., Ageel M., Rizwan M., Aliarba N.A., Alrahtani S., Abdel-Daim M.M. Flax (Linum usitatissimum L.): a potential candidate for phytoremediation? Biological and economical points of view. Plants, 2020, 9(4): 496 (doi: 10.3390/plants9040496).
- Сиромля Т.И., Загурская Ю.В. Проблемы исследования процессов аккумуляции и гипераккумуляции растениями химических элементов. Журнал общей биологии, 2021, 82(4): 283-296 (doi: 10.31857/S0044459621030076).
- Горбунова В.А., Зубкова В.М., Белозубова Н.Ю. Продуктивность и фотосинтетическая деятельность растений льна-долгунца при загрязнении почвы кадмием. Аграрная Россия, 2020, 3: 27-32 (doi: 10.30906/1999-5636-2020-3-27-32).
- Hasanuzzaman M, Borhannuddin Bhuyan M.H.M., Zulfiqar F., Raza A., Mohsin S.M., Al Mahmud J. Reactive oxygen species and antioxidant defense in plants under abiotic stress: revisiting the crucial role of a universal defense regulator. Antioxidants, 2020, 9(8): 681-733 (doi: 10.3390/antiox9080681).
- Новохатин В.В., Шеломенцева Т.В., Драгавцев В.А. Новый комплексный подход к изучению динамики повышения адаптивности и гомеостатичности у сортов мягкой яровой пшеницы (на примере длительной истории селекции в Северном Зауралье). Сельскохозяйственная биология, 2022, 7(1): 81-97 (doi: 10.15389/agrobiology.2022.1.81rus).
- Huang H., Ullah F., Zhou D.X., Yi M., Zhao Y. Mechanisms of ROS regulation of plant development and stress responses. Frontiers in Plant Science, 2019, 10: 800 (doi: 10.3389/fpls.2019.00800).
- Ali A.M.A., El-Nour M.E.M., Yagi S.M. Total phenolic and flavonoid contents and antioxidant activity of ginger (Zingiber officinale Rosc.) rhizome, callus and callus treated with some elicitors. Journal of Genetic Engineering and Biotechnology, 2018, 16(2): 677-682 (doi: 10.1016/j.jgeb.2018.03.003).
- Прадедова Е.В., Ишеева О.Д., Саляев Р.К. Классификация системы антиоксидантной защиты как основа рациональной организации экспериментального исследования окислительного стресса у растений. Физиология растений, 2011, 58(2): 177-185.
- Goncharuk E.A., Saibel O.L., Zaitsev G.P., Zagoskina N.V. The elicitor effect of yeast extract on the accumulation of phenolic compounds in Linum grandiflorum cells cultured in vitro and their antiradical activity. Biology Bulletin, 2022, 49(6): 599-607 (doi: 10.1134/S1062359022060061).


