Культивируемые органотрофные бактерии, изолированные из воды реки Селенги
Автор: Дагурова О.П., Зайцева С.В., Замбалаев А.В.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 1 (30), 2025 года.
Бесплатный доступ
Из воды реки Селенги выделено 18 чистых культур органотрофных бактерий, определена таксономическая принадлежность 13 культур с помощью спектроскопии MALDI-TOF. Штаммы были отнесены к видам Pseudomonas fluorescens, Pseudomonas syringae complex, Bacillus altitudinis/pumilus и Bacillus cereus. Все штаммы были каталазоположительны, большинство было способно к потреблению крахмала, некоторые могли потреблять углеводороды и фенол. Культуры утилизировали широкий спектр сахаров, спиртов и органических кислот, что может свидетельствовать об их адаптационном потенциале. Полученные данные расширяют представления о культивируемых бактериях речных экосистем.
Река селенга, чистые культуры, штаммы, бактерии, микроорганизмы, экосистема
Короткий адрес: https://sciup.org/148331742
IDR: 148331742 | УДК: 579.26 | DOI: 10.18101/2542-0623-2025-1-31-41
Текст научной статьи Культивируемые органотрофные бактерии, изолированные из воды реки Селенги
Изучение бактерий в водных экосистемах имеет огромное значение для решения проблем, важных для человечества: понимание и контроль процессов круговорота вещества в экосистеме, сохранение здоровья человека, безопасное водоснабжение, индикация качества воды, развитие экобиотехнологий.
Микроорганизмы в пресных водных экосистемах главным образом отвечают за процесс деструкции органического вещества, который осуществляется группой органотрофных бактерий. Это широкая эколого-трофическая группа, разнообразная по составу, которая осуществляет разложение различных органических соединений, обеспечивая самоочищение водоема. Для изучения свойств бактерий необходимо выделение чистых культур бактерий и изучение их свойств.
Река Селенга — наиболее крупный приток озера Байкал, обеспечивающий до половины всей воды, поступающей в озеро, внесенное в список объектов Всемирного наследия ЮНЕСКО. На российском участке реки Селенги ранее исследователями определялась численность органотрофных бактерий [Бархутова и др., 1998; Ковадло, Дрюккер, 2010; Дагурова и др., 2024]. Культуры органотрофных бактерий выделялись из дельты реки Селенги и придельтовых районов озера Байкал [Бархутова и др., 1998; Парфенова и др., 2006; Белых и др., 2013; Дагурова и др., 2018]. Выделение и изучение органотрофных бактерий из реки Селенги ранее не проводилось. Целями данной работы являются выделение, идентификация и описание чистых культур бактерий из воды реки Селенги.
Объекты и методы исследования
Пробы воды для выделения бактерий были отобраны в июне 2023 г. на российском участке реки Селенги. Два участка расположены на юге Республики Бурятия, остальные пробы отобраны около г. Улан-Удэ. Пробы воды помещали в стерильные емкости и хранили до выделения при температуре 4 ˚С.
Из проб воды готовили ряд последовательных десятикратных разведений в стерильной водопроводной воде. Посев материала проводили в чашках Петри глубинным методом на среду ГРМ (питательная среда на основе гидролизата рыбной муки) и богатую среду LB (лизогенная среда с триптоном). Культивирование осуществлялось в термостате при температуре 22 °С. Чистые культуры получали путем пересева изолированных колоний в чашки Петри со средой ГРМ методом истощающего штриха. Чистоту культур контролировали визуально и микроскопически. Морфологические свойства выделенных культур изучали микроскопированием фиксированных мазков, окрашенных по Граму, с помощью микроскопа Аxiostarplus (Carl Zeiss, Германия) при увеличении в 1 000 раз.
Идентификация выделенных чистых культур микроорганизмов проводилась с помощью времяпролетной матрично-активированной лазерной десорбционной/ ионизационной масс-спектрометрии MALDI-TOF в бактериологической лаборатории ГАУЗ «РК БСМП им. В. В. Ангапова» на приборе VITEK MS-DS путем сравнения полученных масс-спектров с базой данных. Идентификация бактерий MALDI-TOF является точным и экономически эффективным методом для быстрой таксономической идентификации [Emami et al., 2015].
Проверку способности штаммов к утилизации углеводородов и фенола проводили методом лунок в агаризованной среде Диановой-Ворошиловой, а также в жидкой среде Диановой-Ворошиловой [Практикум... 2005]. Все посевы выполняли в двух повторностях. Наличие роста в жидкой среде определяли, сравнивая с контролем, по помутнению среды или образованию бактериальной пленки.
Способность к потреблению спектра углеводов, органических спиртов и органических кислот определяли по наличию/отсутствию роста в жидкой среде. В качестве минеральной основы готовили среду Пфеннига следующего состава (г/л дистиллированной воды): KH2PO4 — 0,33; NH4C1 — 0,33; CaC12 — 0,33; MgC12 — 0,33; дрожжевой экстракт — 0,15. К среде в качестве субстрата добавляли 10 %-ные растворы органических веществ до концентрации 1%. Посевной материал суспендировали петлей, хорошо перемешивали. Культивирование проводили в пробирках с ватными пробками при 30 °С в течение 5 дней. Наличие роста в жидкой среде определяли, сравнивая с контролем, по помутнению среды или образованию бактериальной пленки.
Амилолитическая активность была определена путем посева культур штрихом в чашки Петри с агаризованной средой Пфеннига с добавлением крахмала в количестве 1,5 %. Инкубировали в термостате при температуре 30 °С в течение 7 суток. После инкубации на поверхность агара добавляли раствор Люголя. Положительный результат определяли визуально по зонам просветления на агаре.
Каталазную активность штаммов определяли по выделению пузырьков при воздействии 3 %-ного Н2О2 на суточную культуру бактерий.
Результаты и обсуждение
Из различных точек отбора на российском участке реки Селенги было выделено 18 аэробных органотрофных штаммов бактерий. В чистую культуру были выделены типы колоний, численно преобладающие в чашках и доминирующие в условиях роста на данных питательных средах.
Выросшие на используемых средах колонии бактерий внешне не отличались разнообразием. Морфологическое описание колоний и клеток культур представлено в таблице 1. У 17 культур клетки имели палочковидную форму, у одной культуры — кокковидную. Клетки большинства выделенных штаммов окрашивались по Граму отрицательно (10 культур). К грамположительным бактериям отнесено 8 культур.
Морфологическое описание выделенных штаммов органотрофных бактерий из р. Селенга
Таблица 1
|
№ |
Штамм |
Среда выделения |
Описание колоний на твердой среде |
d, мм |
Форма клеток, окраска по Граму |
|
1 |
С1 |
ГРМ |
Белая, округлая, поверхность гладкая, глянцевая, с ровными краями, непрозрачная, с поверхности агара |
3 |
Короткие палочки, Гр- |
|
2 |
С4 |
ГРМ |
Белая, форма округлая, поверхность шероховатая, с ризоидным краем |
10 |
Палочки, Гр- |
|
3 |
С5 |
ГРМ |
Белая, из толщи агара |
1 |
Изогнутые короткие палочки, Гр+ |
Продолжение табл. 1
|
№ |
Штамм |
Среда выделения |
Описание колоний на твердой среде |
d, мм |
Форма клеток, окраска по Граму |
|
4 |
С6 |
ГРМ |
Белая, форма округлая, поверхность гладкая, глянцевая, с ровным краем |
4 |
Изогнутые короткие палочки, Гр+ |
|
5 |
С7 |
ГРМ |
Кремовая, форма округлая, поверхность гладкая, с ризоидным краем |
11 |
Палочки, Гр+ |
|
6 |
С8 |
ГРМ |
Белая, форма округлая, поверхность гладкая, глянцевая, с ровным краем |
8 |
Палочки, Гр- |
|
7 |
С9 |
ГРМ |
Желтоватая, форма округлая, поверхность гладкая, с ровным краем |
4 |
Палочки, Гр- |
|
8 |
С10 |
ГРМ |
Белая, форма округлая, поверхность гладкая, глянцевая, с ровным краем |
4 |
Кокки, Гр+ |
|
9 |
С12 |
ГРМ |
Белая, форма овальная, поверхность гладкая, глянцевая |
13 |
Палочки, Гр- |
|
10 |
С13 |
ГРМ |
Белая, форма округлая, поверхность гладкая, глянцевая, с ровным краем |
8 |
Палочки, Гр+ |
|
11 |
С14 |
ГРМ |
Белая с желтоватым оттенком, форма округлая, поверхность гладкая, блестящая |
10 |
Палочки, Гр- |
|
12 |
С15 |
ГРМ |
Белая, форма округлая, поверхность гладкая, с ровным краем |
5 |
Палочки, Гр+ |
|
13 |
С16 |
ГРМ |
Белая, из толщи агара |
1 |
Палочки, Гр- |
|
14 |
С17 |
ГРМ |
Кремовая, форма округлая, поверхность гладкая, с ровным краем |
10 |
Палочки, Гр- |
|
15 |
С18 |
ГРМ |
Белая, полупрозрачная, из глубины агара |
5 |
Палочки, Гр- |
|
16 |
С19 |
LB |
Белая, ризоидная, нитевидная |
10 |
Крупные палочки, спорообразующие, Гр+ |
|
17 |
С20 |
LB |
Белая, ризоидная, нитевидная |
10 |
Крупные палочки, спорообразующие, Гр+ |
|
18 |
С21 |
LB |
Белая, форма округлая, поверхность гладкая, с ровным краем |
5 |
Палочки, Гр- |
Была проведена идентификация культур методом MALDI-TOF. Определена видовая принадлежность 13 штаммов, 5 штаммов не удалось определить (табл. 2).
Все штаммы были отнесены к двум родам — Pseudomonas (семейство Pseudo-monadaceae класса Gammaproteo bacteria) и Bacillus (семейство Bacillaceae филума Bacillota, или по старой классификации Firmicutes). Определено 3 вида рода Pseudomonas — Pseudomonas fluorescens (4 штамма) и Pseudomonas syringae comp lex (6 штаммов); 2 вида рода Bacillus — Bacillus altitudinis/pumilus (1 штамм) и Bacillus cereus (2 штамма). Выделенные бактерии являются представителями класса Gammaproteo bacteria и филума Firmicutes, групп, широко распространенных в микробных сообществах пресных экосистем [Newton et al., 2011].
Таблица 2
Видовая принадлежность штаммов бактерий, выделенных из р. Селенга
|
№ |
Штамм |
Результат идентификации |
|
С4 |
Bacillus altitudinis/pumilus |
|
|
С7 |
Pseudomonas fluorescens |
|
|
С8 |
Pseudomonas fluorescens |
|
|
С9 |
Pseudomonas syringae complex |
|
|
С12 |
Pseudomonas fluorescens |
|
|
С13 |
Pseudomonas syringae complex |
|
|
С14 |
Pseudomonas syringae complex |
|
|
С16 |
Pseudomonas fluorescens |
|
|
С17 |
Pseudomonas syringae complex |
|
|
С18 |
Pseudomonas syringae complex |
|
|
С19 |
Bacillus cereus |
|
|
С20 |
Bacillus cereus |
|
|
С21 |
Pseudomonas syringae complex |
Представители рода Pseudomonas демонстрируют большое метаболическое разнообразие и способны развиваться в различных экологических нишах, широко распространены в природных водах (рис. 1). Установлено, что они всегда присутствуют среди культивируемых гетеротрофных бактерий, выделяемых в чистые культуры из различных биотопов озера Байкал (вода, осадки, биопленки), дельты Селенги и Селенгинского мелководья [Павлова и др., 2003, Парфенова и др., 2006, Белых и др., 2013; Белькова и др., 2018, Дагурова и др., 2018]. Показано, что бактерии рода Pseudomonas доминировали в культивируемом сообществе, в основном в чистых районах акватории озера Байкал, не подверженных влиянию антропогенных факторов [Павлова и др., 2003]. Среди культивируемых органотрофных бактерий в сообществе воды озера Байкал доля псевдомонад достигает 88,6 %, что позволяет их считать доминирующими в культивируемом сообществе озера Байкал и дельты р. Селенги [Парфенова и др., 2006]. Возможно, это связано с их высокой приспособляемостью и способностью к культивированию на различных питательных средах. Вид Pseudomonas fluorescens был выделен из различных биотопов озера Байкал и других водных экосистем, вид Pseudomonas syringae относится к фитопатогенным бактериям. Он повсеместно распространен в большинстве наземных и водных экосистем, в том числе в реках и озерах [Morris et al., 2008; Pietsch et al., 2017]. Рассматривается вопрос о реках и озерах как источников инокулята для вспышек болезней растений, вызываемых P. syringae [Pietsch et al., 2017]. Некоторые штаммы P. syringae обладают активностью нуклеации льда (INA), что позволяет бактериям катализировать замерзание воды, влияя на круговорот воды и климат, обуславливает их важную роль в гидросфере.
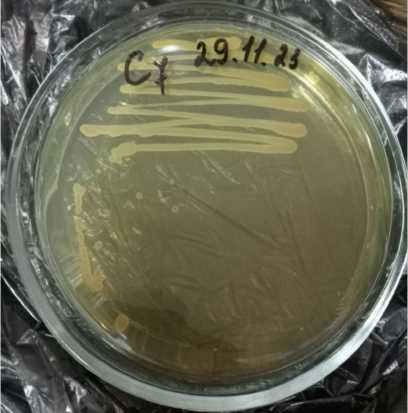
А
Рис. 1. Штамм С7 ( Pseudomonas fluorescens ): (А) рост на плотной среде; (Б) окрашенные по Граму клетки под микроскопом (Гр-)
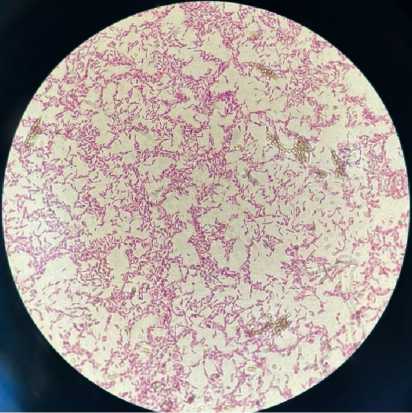
Б
Грамположительные спорообразующие бактерии рода Bacillus широко распространены в природе, выделенные нами виды Bacillus altitudinis / pumilus и Bacillus cereus ранее выделялись из воды и осадков озера Байкал и дельты р. Селенги [Парфенова и др., 2005; Суслова, 2007] (рис. 2). Было показано большое количество бактерий рода Bacillus в устье р. Селенги по сравнению с водами оз. Байкал. Бактерии рода Bacillus составляли значительную часть культивируемого сообщества, обладали разнообразной ферментативной активностью, были способны к деградации полициклических углеводородов [Суслова, 2007].
Определение амилолитической активности показало, что половина выделенных штаммов была способна к расщеплению крахмала амилазой (табл. 3). Амилолитическую активность показали 9 из 18 выделенных штаммов. Наибольшую активность показали штаммы С4 и С18.
Каталаза — широко распространенный фермент, она содержится почти во всех аэробных и факультативно-анаэробных бактериях. Функция каталазы заключается в защите организма от активных кислородсодержащих радикалов и пероксида водорода. Культуры были проверены на каталазную активность, все относятся к каталазоположительным.
Таблица 3
|
№ |
Штамм |
Зона просветления (см) |
Интенсивность роста |
|
С1 |
0 |
нет роста |
|
|
С4 |
5,0 |
интенсивный рост |
|
|
С5 |
0 |
нет роста |
|
|
С6 |
0 |
нет роста |
|
|
С7 |
0 |
нет роста |
|
|
С8 |
0 |
нет роста |
|
|
С9 |
2,5 |
умеренный рост |
|
|
С10 |
0 |
нет роста |
|
|
С12 |
0,5 |
слабый рост |
|
|
С13 |
0,5 |
слабый рост |
|
|
С14 |
0,8 |
умеренный рост |
|
|
С15 |
0 |
нет роста |
|
|
С16 |
0,5 |
слабый рост |
|
|
С17 |
0,2 |
слабый рост |
|
|
С18 |
12,0 |
интенсивный рост |
|
|
С19 |
0,5 |
слабый рост |
|
|
С20 |
0 |
нет роста |
|
|
С21 |
0 |
нет роста |
Штаммы были проверены на способность к утилизации углеводородов и фенола (табл. 4). Предположительная способность к потреблению углеводородов была обнаружена у 8 из 18 проверенных штаммов. Фенол в основном подавлял рост штаммов, но очень слабый рост в жидкой среде присутствовал у 2 штаммов. Способность разлагать оба поллютанта была присуща штамму С15, таксономическую принадлежность которого не удалось определить, и штамму С21, относящемуся к виду Pseudomonas syringae complex .
Разложение углеводородов и фенола штаммами бактерий, выделенными из реки Селенги
Таблица 4
|
№ |
Штамм |
Контроль |
Фенол |
Углеводороды |
||
|
плотная среда |
жидкая среда |
плотная среда |
жидкая среда |
|||
|
С1 |
+ |
- |
- |
+ |
- |
|
|
С4 |
++ |
- |
- |
++ |
+ |
|
|
С5 |
+++ |
- |
- |
++ |
- |
|
|
С6 |
++ |
- |
- |
++ |
+ |
|
|
С7 |
+ |
+ |
- |
- |
- |
|
|
С8 |
++ |
- |
- |
++ |
+ |
|
|
С9 |
+ |
- |
- |
- |
- |
|
|
С10 |
+ |
+ |
- |
+ |
- |
|
|
С12 |
+++ |
- |
- |
++ |
+ |
|
|
С13 |
+++ |
+ |
- |
+ |
- |
|
|
С14 |
+++ |
- |
- |
++ |
- |
|
|
С15 |
+++ |
+ |
+ |
++ |
+ |
|
|
С16 |
++ |
- |
- |
- |
- |
|
|
С17 |
++ |
- |
- |
+ |
- |
|
|
С18 |
++ |
- |
- |
+ |
+ |
|
|
С19 |
++ |
+ |
- |
++ |
- |
|
|
С20 |
++ |
+ |
- |
++ |
+ |
|
|
С21 |
++ |
+ |
+ |
+ |
+ |
|
«+++» интенсивный рост, «++» умеренный рост, «+» слабый рост, «-» нет роста
Для определения способности к потреблению спектра углеводов, органических спиртов и органических кислот было отобрано 5 штаммов, показавших активный рост на плотной среде (табл. 5).
Изученные штаммы благодаря наличию широкого ферментного спектра могут потреблять все представленные субстраты. Исключение составляли штамм С4, который не потреблял рамнозу, и штамм С20, который не потреблял рафинозу.
Таблица 5
|
Субстрат |
S -Й ^ Л тГ ^ "В |
8 § а ОО |
О |
о О |
|
|
Глюкоза |
+ |
+ |
+ |
+, осадок |
+ |
|
Лактоза |
+ |
+ |
+ |
+, осадок |
+ |
|
Фруктоза |
+ |
+ |
+ |
++ |
+ |
|
Ксилоза |
+ |
+ |
+ |
+ |
+ |
|
Рамноза |
- |
+ |
+ |
+ |
+ |
|
Сахароза |
+ |
++ |
+ |
++ |
+ |
|
Целлюлоза |
+ |
+ |
+ |
++ |
+ |
|
Мальтоза |
+ |
++ |
+ |
+ |
+ |
|
Галактоза |
+ |
+ |
+ |
++ |
+ |
|
Рафиноза |
+ |
+ |
+ |
+ |
- |
|
Этанол |
+ |
+ |
+ |
+ |
+ |
|
Дульцит |
+ |
+ |
+ |
+ |
+ |
|
Глицерин |
+ |
+ |
+ |
++ |
+ |
|
Сорбит |
+ |
+ |
++ |
+ |
+ |
|
Маннит |
++ |
++ |
++ |
+ |
+ |
|
Пируват |
+++ |
+ |
+ |
+ |
+ |
|
Цитрат |
+, пленка |
+ |
+ |
+ |
+ |
|
Лактат |
++ |
++ |
++ |
+ |
+ |
|
Сукцинат |
+ |
++ |
++ |
+ |
++ |
|
Твин |
++ |
++ |
++ |
+ |
+ |
«++» умеренный рост, «+» слабый рост, «-» нет роста
Способность к потреблению спектра углеводов, органических спиртов и органических кислот
Заключение
Таким образом, из воды реки Селенги выделено 18 чистых культур органотроф-ных бактерий, определена таксономическая принадлежность 13 культур. Штаммы были отнесены к видам Pseudomonas fluorescens (4 штамма), Pseudomonas syrin-gae complex (6 штаммов), Bacillus altitudinis / pumilus (1 штамм) и Bacillus cereus (2 штамма). Они относятся к наиболее часто выделяемым группам бактерий. Все штаммы были каталазоположительны, большинство было способно к потреблению крахмала. Была проверена их способность к потреблению углеводородов и фенола: 8 из 18 штаммов могли использовать углеводороды, 2 штамма — фенол. Культуры были способны утилизировать широкий спектр сахаров, спиртов и органических кислот, что может свидетельствовать об их адаптационном потенциале.
Полученные данные расширяют представления о культивируемых бактериях реки Селенги и их свойствах. Дальнейшие исследования позволят более подробно изучить выделенные штаммы и оценить их биотехнологический потенциал.


