Культурные актинобактерии, ассоциированные с байкальскими водорослями: разнообразие и антимикробная активность
Автор: Аксенов-грибанов Д.В., Костка Д.В., Протасов Е.С., Емшанова В.А., Верещагина К.П., Краснова М.Е., Горбенко И.В., Лубяга Ю.А., Войчеховская И.В., Тимофеев М.А.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.14, 2018 года.
Бесплатный доступ
Целью исследования было оценить биологическое разнообразие культивируемых штаммов актинобактерий, выделенных из пресноводных водорослей Байкала Draparnaldioides baicalensis, и оценить антимикробную активность соединений против грамположительных бактерий. В ходе этого исследования мы выделили как широко распространенные штаммы рода Streptomyces, так и редких представителей рода Saccharopolyspora, Nonomuraea, Rhodococcus и Micromonospora. Мы продемонстрировали, что штаммы производят натуральные продукты с антимикробной активностью. Учитывая большое количество редких и активных штаммов, связанных с эндемическими водорослями D. baicalensi, мы показали, что эти микроорганизмы имеют значение для биомедицинского и биотехнологического развития и для открытия новых природных соединений, в том числе антибиотиков.
Короткий адрес: https://sciup.org/143165196
IDR: 143165196
Текст научной статьи Культурные актинобактерии, ассоциированные с байкальскими водорослями: разнообразие и антимикробная активность
Важную роль для биотехнологии представляют симбионтные штаммы актинобактерий, поскольку данные микроорганизмы являются продуктивными источниками новых биологически активных соединений (Timoshkin et al. , 2001). Целью исследования являлась оценка биоразнообразия культивируемых штаммов актинобактерий, выделенных из пресноводной байкальской водоросли Draparnaldioides baicalensis и определение антимикробной активности синтезируемых соединений против некоторых модельных штаммов грамположительных бактерий.
MATERIALS AND METHODS
В ходе исследования проведено выделение чистых культур актинобактерий из пресноводной водоросли D. baicalensis . Образцы водоросли, отобранные в пос. Большие. Коты (Южный Байкал), были помещены в стерильные микропробирки, где хранились в растворе стерильного 20% глицерина в морозильнике при температуре – 20 °С до высева на твердые питательные среды. Размороженные и гомогенизированные образцы водоросли интенсивно взбивали на мешалке при скорости 480–620 об/мин в течение 30 минут. Полученный водно–глицероловый экстракт был высеян газоном на стерильные твердые питательные среды (MS, агар Чапека, Actinomycete-isolation agar) с добавлением антибиотиков, подавляющих рост бактерий и грибов: циклогексимида и фосфомицина (Kieser et al. , 2000).
Идентификацию штаммов проводили посредством амплификации и секвенирования фрагмента гена 16S рРНК с праймерами: 8F (AGA GTT TGA TYM TGG CTC AG), 1510R (TAC GGY TAC CTT GTT ACG ACT T), ACT235F (CGC GGC CTA TCA GCT TGT TG) и ACT878R (CCG TAC TCC CCA GGC GGG G). Секвенирование проводили на базе ООО Синтол (г. Москва).
Для определения антибиотической активности выделенные штаммы культивировали в трех жидких питательных средах, в т.ч. NL-19, SM17, SG. Штаммы культивировали при температуре 28 °С в течение 7 дней на шейкере при интенсивности перемешивания 180 rpm. Культуральная жидкость и биомасса были разделены центрифугированием при 3 000 g в течение 10 мин. Вторичные метаболиты экстрагированы этилацетатом из культуральной жидкости. Для биомассы использовали смесь ацетона и метанола в соотношении 1:1. Полученные экстракты были сконцентрированы в токе азота при 40 °С, а сухой остаток растворен до концентрации 25 мкг/л в метаноле (Sigma, St. Louis, USA) (Sarker et al., 2005). Анализ антимикробной активности проводили спектрофотометрически на базе планшетного спектрофотометра Tecan M200 (Австрия) при длине волны 610 нм. В качестве положительных контролей использовали антибиотики – цефтриаксон и стрептомицин. Эксперимент проведен трехкратно.
RESULTS AND DISCUSSION
В ходе данной работы выделено 9 культивируемых штаммов актинобактерий. BLAST – анализ последовательностей выявил высокую схожесть штаммов по гену 16S рРНК для изолятов актинобактерий, ассоциированных с водорослью D. baikalensis , с последовательностями штаммов актинобактерий, полученными из базы данных GenBank (NCBI) (не менее 97 %). В ходе проведенной работы идентифицированы все выделенные штаммы. Установлено, что 5 штаммов принадлежали представителям рода Streptomyces . Также, было выделено по одному представителю родов Sacсharopolyspora, Micromonospora, Rhodococcus и Nonomurea .
Макрофотографии штаммов, выделенных в ходе настоящего исследования, и схема разнообразия культивируемых актинобактерий представлены на рис. 1.
На рис. 2. приведено бескорневое филогенетическое дерево, построенное методом максимального правдоподобия на основании сравнения результатов секвенирования полученных последовательностей гена 16S рРНК с последовательностями актинобактерий из GenBank, NCBI. В качестве внешней группы (аутгруппы) использовали бактерию вида Bacillus licheniformis , зачастую наблюдаемую в составе микробных сообществ ризосферы различных растений. Исходя из представленных материалов видно, что выделенные штаммы формируют отдельные клады с представителями схожих видов.
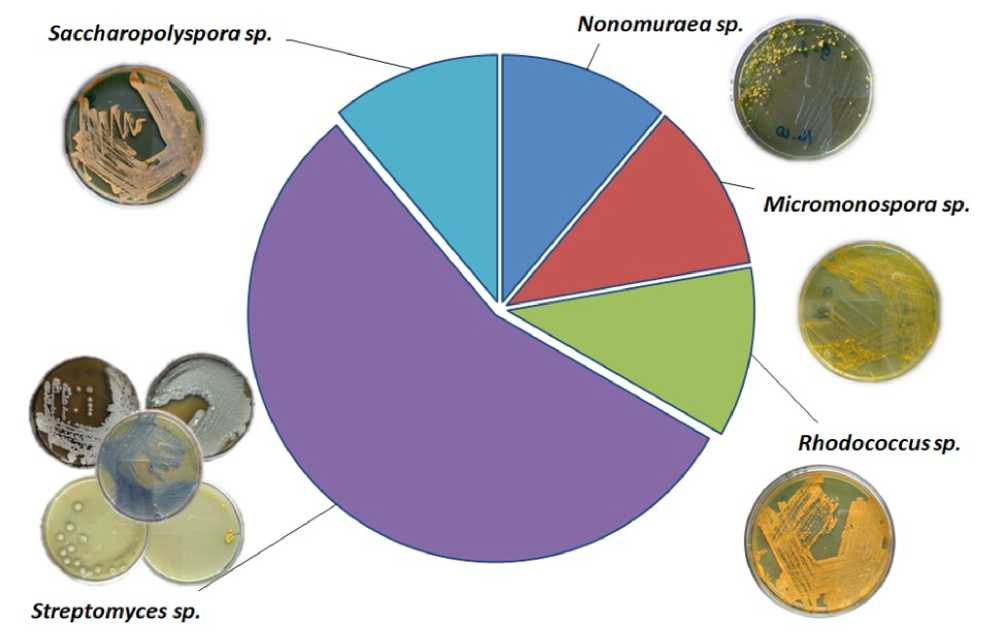
Figure 1. Распределение и макрофотографии штаммов актинобактерий, ассоциированных с водорослью D.
baikalensis .
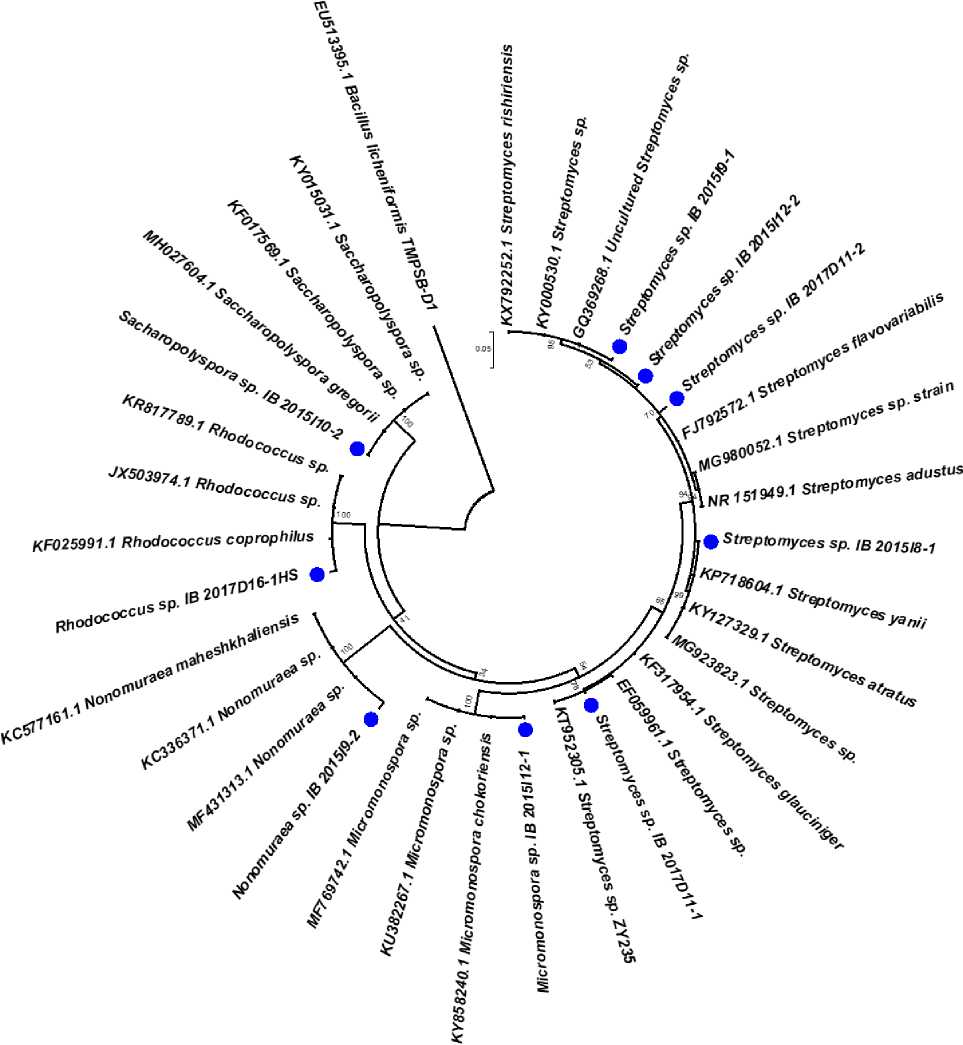
Figure 2. Филогенетическое древо, построенное методом максимального правдоподобия на основании сравнения результатов секвенирования полученных последовательностей гена 16S рРНК с последовательностями актинобактерий, зарегистрированными в GenBank NCBI. Бутстреп - 1000. Анализ включал 34 последовательности длиной 432 нуклеотида, в т.ч. 9 бактерий, выделенных в ходе настоящего исследования. Анализ проведен в программе MEGA 7. Внешняя группа – B. licheniformis . Синий маркер – штаммы, выделенные в ходе настоящего исследования.
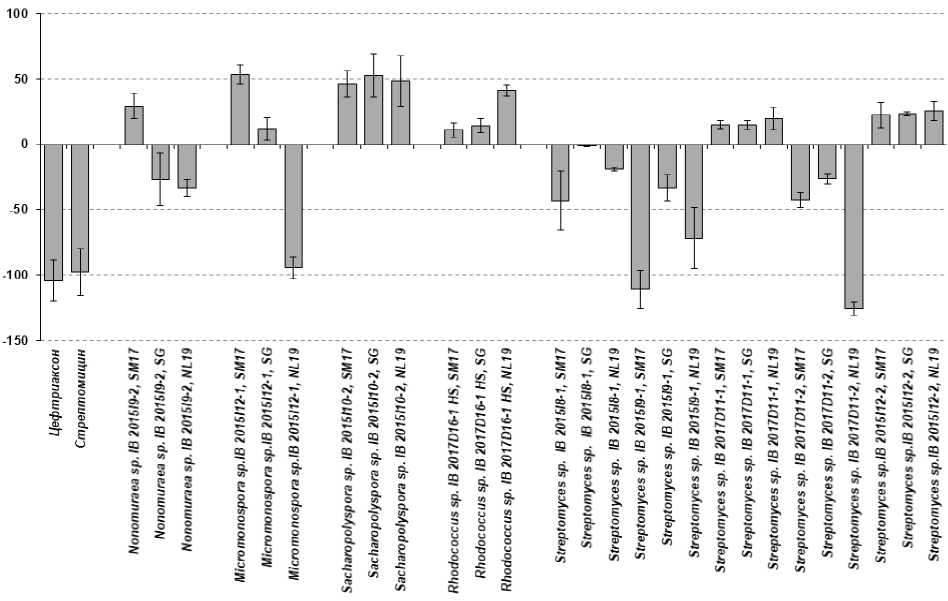
Figure 3. Антимикробная активность экстрактов культуральной жидкости выделенных штаммов при концентрации 25 мкг/л против B. subtilis . Ось абсцисс – наименование выделенных штаммов и питательных сред. Ось ординат – интенсивность роста (гибели) тест – культуры B. subtilis.
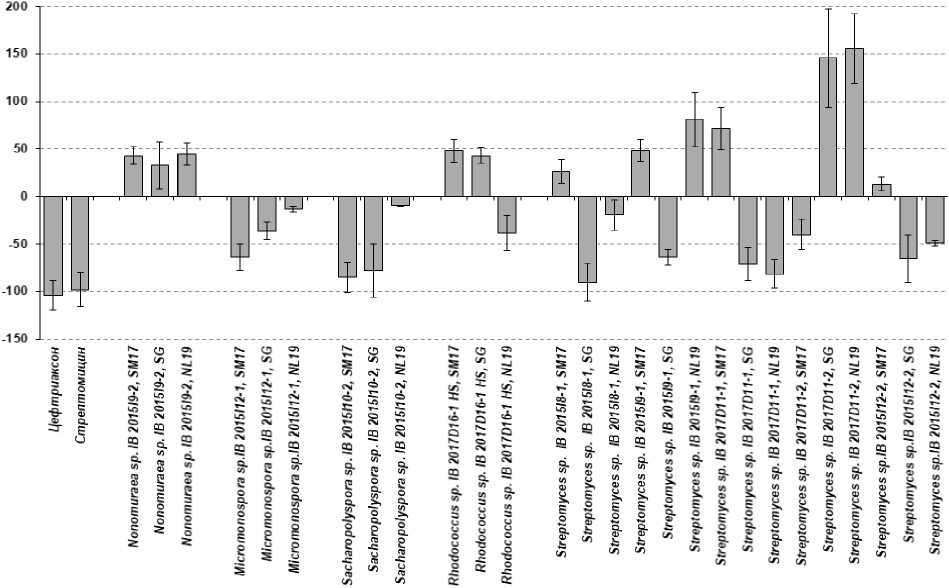
Figure 4. Антимикробная активность экстрактов клеточной биомассы выделенных штаммов при концентрации 25 мкг/л против B. subtilis . Ось абсцисс – наименование выделенных штаммов и питательных сред. Ось ординат – интенсивность роста (гибели) тест – культуры B. subtilis.
При оценке антимикробной активности установлено, что наиболее выраженной антимикробной активностью против роста B. subtilis при концентрации 25 мкг/л обладали экстракты культуральных жидкостей штаммов Micromonospora sp. IB 2015I12-1, Streptomyces sp. IB 2015I9-1 и Streptomyces sp . IB 2017D11-2 (Рис.3). Однако экстракты, полученные из биомассы этих штаммов активности против B. subtilis не проявляли. Среди экстрактов, полученных из биомассы, активностью обладали штаммы Sacсharopolyspora sp . IB 2015I10-2, Streptomyces sp. IB 2017D8-1 и Streptomyces sp. IB 2017D11-1 (Рис. 4).
Таким образом, в ходе исследования из образцов водоросли D. baicalensis выделены как широко распространенные штаммы рода Streptomyces , так и менее распространенные представители родов Sаcсharopolispora, Nonomuraea, Rhodococcus и Micromonospora .
Стоит отметить, что согласно полученным материалам, разнообразие культивируемых штаммов актинобактерий, выделенных из образцов D. baicalensis, сопоставимо с разнообразием культивируемых актинобактерий, выделенных ранее из пыльцы сосны обыкновенной (Axenov-Gribanov et al., 2016), произрастающей на берегу озера Байкал. В то же время, разнообразие культивируемых актинобактерий выделенных из водоросли значительно превышает актинобактериальное разнообразие культивируемых штаммов, описанное для макробеспозвоночных, байкальской воды и осадков озера Байкал (Terkina et al., 2006; Axenov-Gribanov et al., 2016; Protasov et al. 2017). Подобно и иным исследованиям, проводимым в Байкальском и других регионах, род Streptomyces является наиболее распространенным и доминантным. При этом, в ходе настоящего исследования впервые для экосистемы озера Байкал были выделены представители родов Nonomuraea sp. и Saccharopolyspora sp. Необходимо отметить, что в ходе настоящей работы представители рода Nonomuraea sp. впервые были выделены из водорослей, а для рода Saccharopolyspora sp. в системе NCBI зарегистрирована лишь одна нуклеотидная последовательность для представителей данного рода, которая получена при оценке микробных сообществ водоросли Nostoc sp. Таким образом, настоящее исследование служит первым упоминанием обитания актинобактерий рода Nonomuraea sp. и Saccharopolyspora sp. в экосистеме озера Байкал.
Обращаясь к оценке роли бактериальных сообществ в жизнедеятельности водорослей, в исследовании Michel et al. (2010) показано, что некоторые водоросли и актинобактерии тесно связаны в своей эволюции. К примеру, известно что водорослью Ectocarpus siliculosus унаследованы от актинобактерий терминальные стадии биосинтеза целлюлозы и гемицеллюлозы (путем горизонтального переноса генов). Вместе с тем, другим примером роли данных микроорганизмов в жизнедеятельности водорослей служит перенос генов поликетидсинтаз актинобактерий в организм аскомицетов, входящих в сообщества лишайников (Hock, 2012).
Микроорганизмы нетривиальных экосистем и экстремофильных сообществ зачастую выступают источниками новых антибиотиков и природных соединений. Среди работ с водорослями таким известным примером выступает актинобактерия Nocardia sp. ALAA 2000, выделенная из водоросли Laurenica spectabilis. Исследованиями El-Gendy et al., (2008) показано, что данная бактерия синтезирует 4 антибиотика, в т.ч. chrysophanol 8-methyl ether, asphodelin, justicidin B и ayamycin. Данные антибиотики обладают выраженной антимикробной активностью как против грамположительных и грамотрицательных бактерий, так и против грибов при минимальной ингибирующей концентрации 0,110 мкг/мл.
Таким образом, штаммы, способные подавлять рост и развитие иных микроорганизмов имеют важное биотехнологическое значение. Принимая во внимание большое число редких и активных штаммов, ассоциированных с эндемичной водорослью D. baicalensis, нами показано, что данные микроорганизмы обладают ценностью для биомедицинских и биотехнологических разработок и открытия новых природных соединений, в том числе и антибиотиков.
ACKNOWLEDGEMENT
Настоящее исследование проведено при частичной финансовой поддержке проектов РНФ (1714-01063), РФФИ (16-34-60060, 18-34-00294), проектов Минобрнауки РФ 6.9654.2017/8.9, 6.12738.2018/12.2, а также Фонда поддержки прикладных экологических разработок и исследований «Озеро Байкал»
Список литературы Культурные актинобактерии, ассоциированные с байкальскими водорослями: разнообразие и антимикробная активность
- Acevedo, E. (1993) Potential of carbon isotope Axenov-Gribanov D. V., Voytsekhovskaya I. V., Rebets Y. V., Tokovenko B. T., Penzina T. A., Gornostay T. G., & Timofeyev M. A. (2016). Actinobacteria possessing antimicrobial and antioxidant activities isolated from the pollen of scots pine (Pinus sylvestris) grown on the Baikal shore. Anton Leeuw Int J G, 109(10), 1307-1322
- El-Gendy M. M., Hawas U. W., & Jaspars M. (2008). Novel bioactive metabolites from a marine derived bacterium Nocardia sp. ALAA 2000. J Antibiot, 61(6), 379
- Hock B. (Ed.). (2012). Fungal associations (Vol. 9). Springer Science & Business Media
- Jenke-Kodama H., & Dittmann E. (2009). Evolution of metabolic diversity: insights from microbial polyketide synthases. Phytochemistry, 70(15-16), 1858-1866
- Kieser T., Bibb M. J., Buttner M. J., Chater K. F., & Hopwood D. A. (2000). Growth and preservation of Streptomyces. Practical Streptomyces Genetics, 43-61
- Michel G., Tonon T., Scornet D., Cock J. M., & Kloareg B. (2010). The cell wall polysaccharide metabolism of the brown alga Ectocarpus siliculosus. Insights into the evolution of extracellular matrix polysaccharides in Eukaryotes. New Phytol, 188(1), 82-97
- Protasov E.S., Axenov-Gribanov D.V., Rebets Y.V., Voytsekhovskaya I.V., Tokovenko B.T., Shatilina Z.M., & Timofeyev M.A. (2017). The diversity and antibiotic properties of actinobacteria associated with endemic deepwater amphipods of Lake Baikal. Anton Leeuw Int J G, 110(12), 1593-1611
- Sarker S. D., Latif Z., & Gray A. I. (Eds.). (2005). Natural products isolation (Vol. 20). Springer Science & Business Media
- Terkina I. A., Drukker V. V., Parfenova V. V., & Kostornova T. Y. (2002). The biodiversity of actinomycetes in Lake Baikal. Microbiology, 71(3), 346-349
- Timoshkin O.A., Sitnikova T.Y., Rusinek O.T., Pronin N.M., Proviz V.I., Mel'nik N.G., Kamaltynov R.M., Mazepova G.F., Adov F.V., Anohin B.A., Arov I.V., Baldanova D.R., Biserov V.I., Bondarenko N.A., Burdukovskaja T.G., Grajger M.Dzh., Danilov S.N., Dzjuba E.V., Dubeshko L.N., Dugarov Zh.N., Dudichev A.L., Evstigneeva T.D., Efremova S.M., Zhil'cova L.A., Kavakatsu M., Korgina E.M., Korobkova N.V., Krickaja U.A., Kutikova L.A., Ljamkin V.F., Natjaganova A.V., Naumova T.V., Nekrasov A.V., Novikova O.A., Obolkina L.A., Okuneva G.L., Podtjazhkina M.M., Pomazkova G.I., Popov V.V., Pronina S.V., Rozhkova N.A., Sanzhieva S.D., Semernoj V.P., Sideleva V.G., Slugina Z.V.,Starobogatov Ja., Stepan'janc S.D., Tanichev A.I., Tuzovskij P.V., Hamnueva T.R.,. Calolihin S.Ja, Sheveleva N.G., Shibanova I.V., Shirokaja A.A.,Shoshinin A.V. (2001) Index of animal species inhabiting Lake Baikal and its catchment area, Nowosibirsk: Nauka
- Tiwari K., & Gupta R. K. (2012). Rare actinomycetes: a potential storehouse for novel antibiotics. Crit Rev Biotechnol, 32(2), 108-132


