Квантово-химические исследования процесса дегидроксилации слюд
Автор: Шишелова Т.И., Липовченко Е.Л., Шульга В.В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 7 т.9, 2016 года.
Бесплатный доступ
Технология слюдокомпозитов предусматривает высокотемпературный нагрев исходных материалов. Природная слюда, утрачивая воду, переходитв дегидроксилат, который вступает в химическое взаимодействие с компонентами связующего. Понимание механизма дегидроксилации важно при получении композиционных материалов на основе слюд. Физическая сущность механизма этого явления раскрыта далеко не полностью и требует дальнейших рассмотрений. Интересны вопросы о внутримолекулярных перегруппировках на стадии, предшествующей процессу миграции протона, анализ изменения координационных связей, устойчивости элементарной ячейки мусковита в процессе дегидроксилации. Рассмотрен процесс дегидроксилации с точки зрения квантово-химической модели на примере элементарной ячейки мусковита. Этот метод наиболее надежно передает геометрические параметры, кинетические характеристики и потенциальные поверхности внутримолекулярных процессов. Полученные результаты квантово-химической модели элементарной ячейки мусковита свидетельствуют о ее существовании в трех изомерных формах относительно протонов гидроксильных групп. Процесс дегидроксилации мусковита - это внутримолекулярные перегруппировки в гексагональной области Aℓ -октаэдров, связанные с подготовкой оптимальной ориентации мигрирующих групп или атомов. Переход протона от одной гидроксильной группы к другой с образованием молекулярной воды приводит к миграции молекул воды, из чего следует, что атомы алюминия октаэдрической области изменяют свое координационное число с 6 до 5.
Квантовая химия, дегидроксилация, мусковит
Короткий адрес: https://sciup.org/146115138
IDR: 146115138 | УДК: 530.96 | DOI: 10.17516/1999-494X-2016-9-7-1097-1103
Текст научной статьи Квантово-химические исследования процесса дегидроксилации слюд
Понимание механизма образования дегидроксилата важно для корректной оценки, прежде всего термической стойкости слюд, а также выявления механизма межфазовых взаимодействий рассматриваемых веществ при получении композиционных материалов на основе слюд.
Несмотря на то что изучению эффекта дегидроксилации посвящено большое количество работ, физическая сущность механизма этого явления раскрыта далеко не полностью и требует дальнейших рассмотрений. Ранее в работах [5, 6] с позиции квантовой механики рассмотрен механизм дегидроксилации минералов. Процесс гидроксилации представлен как процесс делокализации протона в системе «два атома кислорода и протон между ними». Такое перемещение протона обусловлено его переходом в возбужденное состояние. При нагреве происходит увеличение энергии протона, в связи с этим растет прозрачность среднего барьера. Учтено и наличие туннельного эффекта – наличие вероятности перехода частицы сквозь барьер. Показано, что имеется возможность оценить степень дегидроксилации по уменьшению интенсивности полос ОН.
Остается интересным вопрос, с чего начинается дегидроксилация, т.е. вопрос о рассмотрении внутримолекулярных перегруппировок, связанных с изометрией гидроксильных групп на стадии, предшествующей процессу миграции протона, анализ изменения координационных связей, оценка относительной устойчивости элементарной ячейки мусковита в процессе деги-дроксилации.
Анализ литературных данных показал, что в этом плане перспективным представляются работы, относящиеся к построению квантово-химических моделей [5, 7-14]. При наличии такого рода моделей проще изучать свойства разнообразных минералов [3-4].
Следует признать, что большое количество факторов (природа минерала, размеры частиц и т.д.) оказывают влияние на процесс дегидроксилации и приводят к огромному многообразию полученных экспериментальных данных [6]. В данном вопросе до сих пор нет окончательной ясности.
Актуальными и перспективными представляются работы, посвященные квантовохимическим исследованиям свойств алюмосиликатов и термостойкости различных слюд.
Рассмотрен процесс дегидроксилации с точки зрения квантово-химической модели на примере элементарной ячейки мусковита. Этот метод, позволяющий изучить большой круг проблем, используется в последнее время довольно широко. Поэтому имеется принципиальная возможность использовать его и для исследования процесса дегидроксилации слюды. Данный метод наиболее надежно определяет геометрические параметры, кинетические характеристики и потенциальные поверхности внутримолекулярных процессов. Некоторые варианты этого метода дают хорошие результаты для молекулярных систем с водородными связями.
Известно [2, 13-15], что термически активируемая реакция дегидроксилации в мусковите в температурном интервале до 800 °С является обратимой. Это указывает на то, что в данном температурном интервале кристаллическая решетка, а в особенности ее тетраэдрические слои, не претерпевают каких-либо существенных изменений. Это возможно только в том случае, если все координатные связи тетраэдрической сетки с гексагональной Aℓ-октаэдрической сеткой остаются неизменными. Поэтому не без основания можно полагать, что в процессе деги-– 1099 – дроксилации в указанном температурном интервале претерпевают изменения только водородные и координатные связи алюминий-гидроксильной группы.
В процессе дегидроксилации в указанном температурном интервале претерпевают изменения только водородные и координационные связи алюминий-гидроксид.
Нами была проведена следующая работа:
-
• были рассмотрены внутримолекулярные перегруппировки, связанные с изометрией гидроксильных групп на стадии, предшествующей миграции протона;
-
• проведена оценка потенциальных функций внутримолекулярного переноса протона и образования связанной молекулы воды;
-
• сделан анализ полученных активационных параметров процесса и их сопоставление с прочностью координационной связи гидроксид-алюминий для выявления возможности внутримолекулярной миграции гидроксильной группы и образования связанной воды;
-
• осуществлен анализ изменения координационных связей в гексагональной A ℓ-октаэдрической области;
-
• дана оценка относительной устойчивости элементарной ячейки мусковита до и после процесса дегидроксилации.
Стартовые геометрические параметры элементарной ячейки идеальной модели мусковита взяты из рентгеноструктурных данных [5, 6].
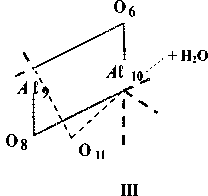
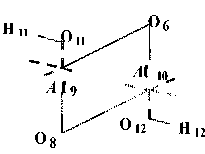
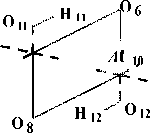
Квантово-химические расчеты проведены с частичной оптимизацией геометрии по критерию полной энергии. В процессе оптимизации участвовали внутренние геометрические параметры гексагональной A ℓ-октаэдрической области. Схема, по которой проведено исследование процесса дегидроксилации, изображена на рис. 1, для большей наглядности приведена только центральная A ℓ-октаэдрическая часть элементарной ячейки, принимающей наиболее активное участие в данной реакции. Возможность образования кристаллических изомеров за счет поворотной изометрии гидроксильных групп (рис. 2) делает необходимой оценку их относительной устойчивости, путей взаимных переходов и влияния, которое оказывает изомерная форма на процесс дегидроксилации в целом.
Среди большого многообразия поворотно-изомерных форм можно выделить три наиболее устойчивые структуры, разделенные достаточными активационными барьерами внутренних взаимных переходов, исключающих их свободное взаимопревращение. Это формулы с транс-транс(1а), цис-транс(1б) и цис-цис(1в) взаимным расположением протонов гидроксильных
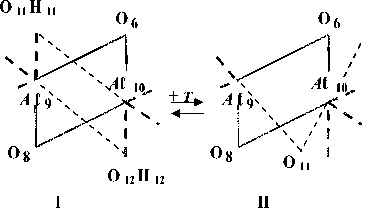
Рис. 1. Общая схема процесса дегидроксилации, рассматриваемая в расчетах (представлена только Aℓ-октаэдрическая область)
1а
Рис. 2 Схематическое представление наиболее устойчивых октаэдрической области элементарной ячейки мусковита
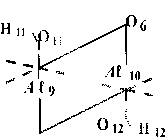
O 8
1б
1в
изомерных форм центральной Aℓ-
,
кДж моль
4 . 0
25 I б
I В
31,5
II А
II б
32,8
3 . 5 3 . 0 2 . 5 2 . 0 1 . 5 1 . 0 0 . 5
R H 11 K O 12
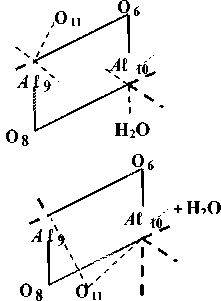
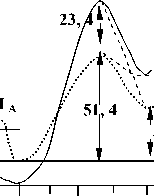
Рис. 3. Потенциальная функция внутреннего переноса протона
групп (рис. 2). Квантово-химические расчеты показали, что форма 1а наименее устойчива по сравнению с 1б на 4,1 ккал/моль по сравнению с 1в (рис. 3).
Активационные параметры внутренних переходов 1а—1б и 1б—1в различаются незначительно и составляют 8,30 кДж/моль и 10,9 кДж/моль соответственно. Предпочтительность цис-транс-формы 16 по сравнению с транс-транс-формой 1а объясняется образованием водородной связи 011... Н12 с межатомным расстоянием 0,315 нм и энергией водородной связи, равной 5,34 кДж/моль, а также уменьшением невалентных взаимодействий протона Н 12 в цис- по сравнению с транс-положением. Этот выигрыш составляет примерно 8,3 кДж/моль. Еще более благоприятная картина в смысле уменьшения невалентных взаимодействий наблюдается в цисцис-форме 1в, что и делает ее наиболее устойчивой по сравнению с изомерами 1а и 16. На рис. 3 приведены потенциальные функции внутримолекулярного переноса от одной гидроксильной группы к другой, в качестве одной из осей координат выступает полная энергия молекулярной системы, в качестве другой – межатомное расстояние 0 11 ... Н 12 . Внутримолекулярный перенос протона для переходов 16—П и 1в—П осуществляется в расчетах по прямой 011... Н12 с шагом 0,3 А, в каждой точке проводилась корректировка внутренних геометрических параметров A ℓ-октаэдрической области.
Более высокий барьер перехода 1в—П по сравнению с 1б—П объясняется дополнительной внутренней перестройкой, связанной с внутренним вращением связи Н-012 вокруг координационной связи 0 12 ... A ℓ (вынужденная цис-транс-изометрия).
В результате миграции протона прототропная форма П-а не является с точки зрения минимума полной энергии оптимальной и переходит в более устойчивую П-б-форму (рис. 3). Эта форма характерна тем, что лишенный протона атом кислорода занимает такое положение, при котором он образует две равноценные координационные связи с атомами A ℓ 9 и A ℓ 10 . Межатомное расстояние Н20 ... A ℓ10 увеличивается при этом с 0,189 до 0,211 нм. Угол, образованный плоскостью 0 6 A ℓ 10 0 8 и связью A ℓ 10 ...ОН 2 , также увеличивается со 101° до 116°, т.е. происходит выталкивание связанной молекулы Н20 за пределы внутренней части элементарной ячейки.
Особенностью конечной дегидратированной структуры является пентакоординирован-ный характер атомов A ℓ 9 и A ℓ 10 . Это устойчивое состояние с эквивалентными пентакоордини-рованными атомами алюминия единственное. Расчеты, выполненные с нарушением эквивалентности этих атомов, не приводят к стационарным состояниям.
Для выявления возможности внутримолекулярной миграции гидроксильных групп оценена прочность координационной связи гидроксил-алюминий как двуцентровой составляющей полной энергии. Полученное значение Е ≈ 167 кДж/моль свидетельствует о том, что этот механизм не конкурентоспособен механизму протонной перегруппировки (рис. 3).
Полученные таким образом результаты изученной квантово-химической модели элементарной ячейки мусковита позволяют сделать следующие выводы:
-
1 . Элементарная ячейка может существовать в трех изомерных формах относительно протонов гидроксильных групп. Эти формы близки по энергии и довольно легко переходят из одной формы в другую.
-
2 . Процесс дегидроксилации мусковита можно рассмотреть как совокупность трех наиболее вероятных этапов:
-
- внутримолекулярные изомерные перегруппировки в гексагональной области A ℓ-октаэдров, связанные с подготовкой оптимальной ориентации мигрирующих групп или атомов, т.е. переход гидроксильных ионов в позиции цис-транс- или в энергетически более выгодную цис-цис-ориентацию;
-
- переход протона от одной гидроксильной группы к другой с образованием молекулярной воды, связанной с элементарной ячейкой;
-
- миграция молекул воды к периферии кристалла по тетраэдрическим каналам через свободные ячейки с образованием промежуточных водородных связей (сорбированная вода). Образование в кристалле связанной воды может осуществляться только за счет прототропных перегруппировок;
-
- в процессе дегидроксилации атомы алюминия октаэдрической области изменяют свое координационное число с 6 до 5.
Список литературы Квантово-химические исследования процесса дегидроксилации слюд
- Шишелова Т.И. Слюдосодержащие композиционные материалы: дис. … д-ра техн. наук. Ленинград, 1990, 350 с.
- Шишелова Т.И., Тюрин Н.Г., Чайкина Е.А., Леонов С.Б. Физико-химические основы производства слюдокомпозитов. Екатеринбург, Ладъ, 1993, 212 с.
- Мецик М.С. Физика расщепления слюд. Иркутск, В-С. кн. изд-во, 1967, 208 с.
- Шишелова Т.И. Вода в минералах. Иркутск, Изд-во ИрГТУ, 2011, 112 с.
- Шишелова Т.И., Липовченко Е.Л. Механизм дегидроксилации минералов с позиций квантовой механики. Фундаментальные исследования. 2015. №.6. Ч. 2. С. 311-315.
- Vedder W., Wilkins R.W.T. Dehydroxylation and rehydroxylation, oxidation and reduction of micas. American Mineralogist. 1969, 54. С. 482-509.
- Блатов В.А., Шевченко А.П., Пересыпкина Б.В. Полуэмпирические расчётные методы квантовой химии. Самара: Универс-групп, 2005, 32 с.
- Новосадов В.К. Методы решения уравнений квантовой химии. М.: Наука, 1985, 183 с.
- Степанов Н.Ф. Квантовая механика и квантовая химия. М.: Мир, 2001, 519 с.
- Степанов Н.Ф., Пупышев В.И. Квантовая механика и химия. М.: Изд-во МГУ, 1991, 384 с.
- Фларри Р. Квантовая химия. Введение. М.: Мир, 1985, 472 с.
- Мотт Н., Снеддон И. Волновая механика и её применения. М.: Изд-во КОМКНИГА Теоретическая физика, 2007, 432 с.
- Шишелова Т.И., Мецик М.С., Соколов К.Я. Изменение ИК-спектров слюд при нагревании. Журнал прикладной спектроскопии. 1974, Т. 20. Вып.6. С. 1042-1044.
- Балашов В.В., Долинов В.К. Курс квантовой механики. Ижевск: НИЦ “Регулярная и хаотическая динамика”. 2001, 336 с.
- Шишелова Т.И., Мецик М.С., Соколов К.Я. Исследование дегидратации слюд и слюдопластовых материалов методом ИК-спектроскопии. тр. ИПИ. Иркутск: Изд-во ИПИ, 1972, Вып.7. С. 15-17.


