Квантово-химические расчеты бутин-2-диола-1,4 и их винилового эфира
Автор: Юсупова Лола Азимовна, Нурмонов Сувонкул Эрхонович, Эргашев Ркин Тулкин Угли
Журнал: Life Sciences and Agriculture.
Статья в выпуске: 3-2, 2020 года.
Бесплатный доступ
Исследован фазовый состав молекул бутин-2-диол-1,4 и его производных распределения электронной плотности и зарядов в молекулах. Кванта-химические величины соединений определены с помощью полуэмпирического методы кванта - химического РМЗ программы STAT пакета 7,0 Hyper Chem Activation.
Бутин-2-диол-1, электронной плотности, кванта- химические, полуэмпирического методы, геометрическая структура
Короткий адрес: https://sciup.org/14125681
IDR: 14125681 | DOI: 10.24411/2181-0761/2020-10128
Текст научной статьи Квантово-химические расчеты бутин-2-диола-1,4 и их винилового эфира
Квантовая химия в принципе позволяют дать объяснение любит экспериментальным данным о реакционной способности органических соединений и предсказать возможные пути протекании реакций. В основе современной квантовой химии лежит уравнение Шредингира для стационарных состояний. Он обычно решается в адиабатическом процессе для стационарных состояний [3, 4].
Результатом применения методов квантовой химии является информация о плотностях электронных состояний, распределении электронной плотности, потенциальных поверхностях реакций и расчеты различных спектроскопических величин. В настоящее время методы квантовой химии являются более дешевыми, доступными и универсальными методами исследовании электронной структуры молекул [5,6]. Правда, необходимо понимать, что тем не менее, невозможно совсем отказаться от дорогостоящих экспериментальных методов исследования вещества.
Активность молекулы в каких-либо реакциях, в основном зависит от ее структуры и энергетических характеристик. Предсказание реакционной способности органических молекул является весьма трудной и актуальной задачей. С развитием квантовохимических методов расчетов химики приобрели, возможность планирования экспериментальных исследований и проведения направленного синтеза целевых продуктов.
В данной работе были исследованы геометрическая структуры, распределение зарядов и электронной плотности ацетилена, метаналь, бутин-2-диола-1,4 и его моно и дивинилового эфира, бензене-1,3-диол, 3,6-диметилоктин-4-диола-3,6 и его моно- (ди) виниловых эфиров широко распространенной программой Hyper Chem полуэмпирическим квантовохимическим методом РМЗ.
В качестве примера приводим результаты изучения геометрии и электронного строения молекул бутин-2-диола-1,4, бутиндиола-1,4, бензене-1,3-диол и его моно-и дивиниловых эфиров.
На рис. 1 приведена геометрическая структура бутин-2-диола-1,4. Наблюдается, что в ней С 1 и С 4 имеют sp3 гибридизацию в тетраэдрическом положении, С 2 и С 3 имеют линейную структуру в положении sp-гибридизации. За счет этого углеродной цеп молекулы образуют линейную структуры.
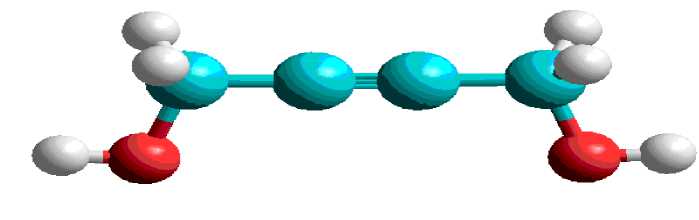
Рис. 1. Геометрическая структура бутин-2-диола-1,4
На рис. 2. приведены зарядов в молекуле бутин-2-диола-1,4. Показано, что оби гидроксильную группу имеет одинаковую положению, а также водороды гидроксильной группы имеет одинаковой заряд (+0,184). Эта также показано при расчете распределении электронной плотности молекула бутин-2-диола-1,4 (рис. 3.).
Сопоставление значений электронных зарядов выбранных молекул показало, что наибольшее количество отрицательного заряда в молекуле бутин-2-диола-1,4 сконцентрировано на атоме кислорода. Вероятнее всего из-за этого атом кислорода является реакционным центром, по которому идёт реакция каталитического винилирования ацетиленом в присутствии высокоосновной системы КОН-ДМСО.
Исследовании геометрическая структура моновинилового эфира бутин-2-диола-1,4 (Рис.4.) показало винильная группа имеет плоскую структура, гибридизации углеродов sp2. Молекула имеет более развернутий углеродной цепи. Расприделении электронной плотности и зарядов в молекуле моновинилового эфира бутин-2-диола-1,4 (Рис. 5.) показывает изменении зарядов атома водорода гидроксильной группы (+0,186) при образовании моновинилового эфира. Можно сказать, что водорода гидроксильной группы диола, активнее чем спирта, т.е. винилированием одного гидроксильного группы приводит пассивации второго. Процесс образования дивинилового эфира протекает через образованием моновинилового. Лимитирующий стадии процесса является винилирования второго гидроксильной группы. По этому селективность каталитических систем не высокая и всегда синтезируются смесь моно-и дивиниловых эфиров изученного диола.
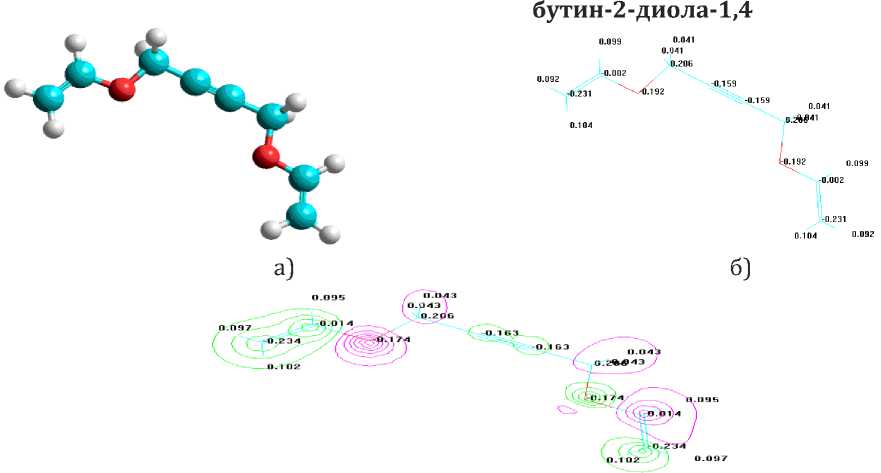
Исследовано молекулярнодинамическое характеристики дивинилового эфира бутин-2-диола-1,4 (Рис. 6.). Наблюдается что образованием дивинилового эфира заряд углеродов в цепи бутин-2-диола-1,4. В последнего атомы углерода С 1, С 2, С з и С 4, имеет заряд соответственно 0,223; -0,165; -0,165 и 0,223. Сообразованием дивинилового эфира эти значения меняется и соответственно составляет 0,206; -0,16з; -0,163 и 0,206. Можно предположить что характер тройной связи бутин-2-диола-1,4 и его дивинилового эфира почти одинаковой (не учитывая сферические факторы).
0.027
0.027
0.027 0.027
0.223 0.165 -0.165 0.223
0.101/0.297 UL297 0.184
Рис. 2. Распределение зарядов в молекуле бутин-2-диола-1,4
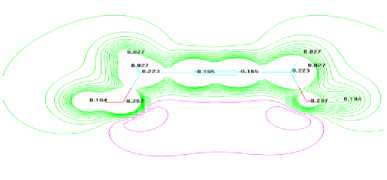
Рис. 3. Распределение электронной плотности по атомам в молекуле бутин-2-диола-1,4
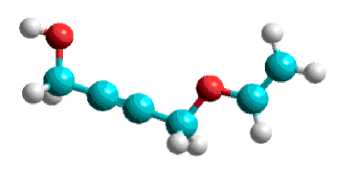
Рис. 4. Геометрическая структура моновинилового эфира бутин-2-диола -1,4 (винилокси-бутин-2-ол-1)
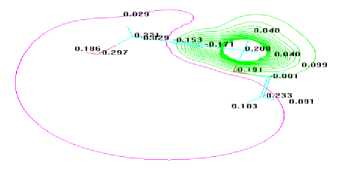
Рис. 5. Распределение электронной плотности по
атомам
в моновинилового молекуле эфира
в)
Рис. 6. Геометрическая структура (а), распределение за рядов (б) и электронной плотности (в) дивинилового эфира бутин-2-диола-1,4
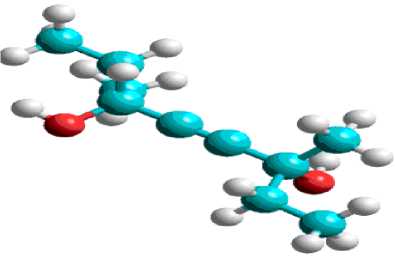
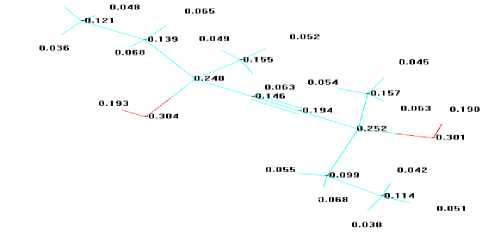
Исследования геометрическая структура, распределения зарядов и электронной плотности по атомам в молекуле 3,6-диметилоктин-4-диола-3,6 (рис. 7.) показало, что данная молекула имеет симметрию, наибольшее количество отрицательного заряда и электронной плотности сконцентрировано в атомах кислорода. Причем оба атома кислорода имеют одинаковую активность в реакции щелочного винилирования ацетиленом.
-
а) б)
дипольный момент, заряд атома кислорода).
Таким образом, на основании результатов исследования структуры, распределения зарядов, элве)ктронной плотности и
Рис. 7. Геометрическая структура (эан),ергетических характеристик распределение зарядов (б) выбранных молекул и электронной плотности (в) полуэмпирическим квантово- в молекуле 3,6-диметилоктин-4-ди<ммиЗеским методом выявлены
Нами также проведена квантово-химические расчеты (общая энергия, энергия образования, теплота образования, энергия электрона, энергия ядра, реакционные центры используемых молекул, которые в свою очередь использованы для предположения реакционной центры исследованных молекулы, а также для подтверждения экспериментальных данных.
Список литературы Квантово-химические расчеты бутин-2-диола-1,4 и их винилового эфира
- Hedberg K., Hedberg L., Bethune D.S., Brown C.A., Dorn H.C., Science - 1991. - Р. 254-410.
- Gioslowski J. Electronic structure calculations on Fullerenes and Their Derivatives. New York: Oxford Univ. Press 1995.
- Cтепанов Н.Ф. Квантовая механика и квантовая химия. - М. 2001. - С. 128-139.
- Haeser M., Almloet J., Scuseria G.E., Chem. Phys. Lett. 1991.181. - Р. 497.
- L. Yusupova1, S. Nurmanov2, A. Umrzoqov1, B. Yakubov1, F. Rakhmatov1. Quantum-chemical calculations and mathematical modelation of synthesis of acetylenical diols // Proceedings of the international conference on integrated innovative development of zarafshan region: achievements, challenges and prospects, Navoi, Uzbekistan 27-28 november, 2019, - pp. 331-337.
- Л.А. Юсупова, О.Б. Халимова Винилирование бутин-2-диола-1,4 с использованием трехкомпонентной системы CsF-КOH-ДМСО // "Инновации в нефтегазовое промышленности, современная энергетика и их актуальные проблемы" Международная онлайн конференция Ташкент, 26 мая, 2020, - С. 698-699.


