Квантово-химическое и статистическое исследование механизма действия органических соединений как ингибиторов коррозии
Автор: Сикачина А.А.
Журнал: Теория и практика современной науки @modern-j
Рубрика: Основной раздел
Статья в выпуске: 6 (6), 2015 года.
Бесплатный доступ
В публикуемой статье показана и проанализирована возможность взаимосвязи вычисленных посредством WinGAMESS квантово-химических дескрипторов молекулы и скоростью коррозии стали марки Ст3, выраженной как процент защитного эффекта при электрохимической коррозии в водно-солевой среде, имитирующей морскую воду с присадкой и без присадки н-октана), который зависит, в частности, от свойств молекулы, адсорбирующейся на поверхности металла. Квантово-химические дескрипторы электронной структуры молекулы вычислялись методом гибридного функционала плотности DFT/B3-LYP.
Электрохимическая коррозия, имитация морской воды, сталь ст3, индексы реакционной способности, коэффициенты корреляции, эффективные заряды, дипольный момент, энергии граничных орбиталей
Короткий адрес: https://sciup.org/140266773
IDR: 140266773
Текст научной статьи Квантово-химическое и статистическое исследование механизма действия органических соединений как ингибиторов коррозии
Список принятых авторских сокращений160: ОС - органическое соединение ; ККП- коэффициенты корреляции Пирсона ; Z - защитный эффект от коррозии, обратно пропорциональный скорости таковой ; Q О – заряд на гидроксильном атоме кислорода ; п.п.QС – заряд на пара -углероде бензольного кольца ; ф QС – заряд на атоме углерода, несущем гидроксильную группу ; Q S – заряд на атоме серы ; o.п. Q С - заряд на орто -углероде бензольного кольца, несущем R 2 ; ∑Q мет – суммарный заряд на метиленовых и метиновых группах ; ∑Q СН3 - суммарный заряд на метильных группах ; µ - дипольный момент
Цель исследования: В тему публикации выносятся 2 аспекта: квантовохимическое определение величин основных индексов реакционной способности молекулы и генерирование на их основе, и на основе ранее вычисленных скоростей коррозии (точнее их производных: защитных эффектов) коэффициентов корреляции, служащих в целях прогноза.
Методика проведения эксперимента: Расчетные параметры находились в программе WinGAMESS-2011 с применением уровня теории DFT/B3-LYP/3-21G* с предварительной оптимизацией геометрии ОС согласно уровня теории RHF/STO-3G*. Дальнейшее исследование было проведено путем анализа коэффициентов корреляции смешанных моментов, которые будут высчитаныв программном комплексе STATISTICA 7 таким образом, что ККПr jk , выражаемые в долях от единицы, дадут возможность судить о вкладе расчетного молекулярного параметра ингибитора в его защитный эффект модельного образца стали Ст3 определенного объема. В связи с необходимостью построения квадратной матрицы, исследованные 5 ОС были объединены в серию, исходя из общности химической структурной формулы, которая является необходимой информацией для численного эксперимента/3/.
Были построены коэффициенты корреляции между защитным эффектом серии ингибиторов в концентрации таковых 50 и 200 мг/л коррозионной среды, имитирующей морскую воду, и следующими дескрипторами: Q на атомах по анализу заселенностей Малликена, значения энергий граничных орбиталей Е (ВЗМО) и Е (НСМО), µ /4/.
ОС имели защитные эффекты при электрохимической коррозии в водносолевой среде, имитирующей морскую воду, вычисленные по известным методикам, и представленные в /1/. Исследованные соединения (класса фенолсульфидов) были следующие (рисунок 1)
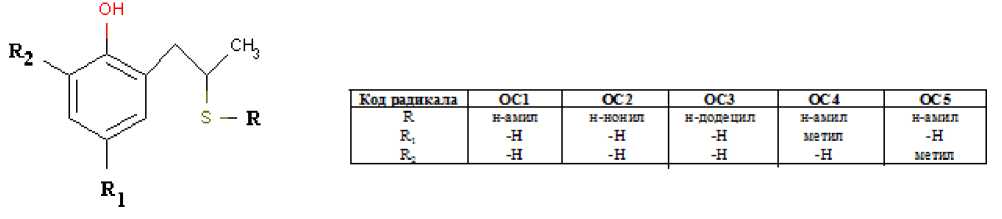
Рис. 1. Общая структура исследуемых молекул
Результаты и обсуждение: Сгенерированные GAMESS при указанном уровне теории результаты сведены в таблицу 1:
Табл. 1. Значения парциальных эффективных зарядов, энергии граничных орбиталей, жесткости молекул и дипольных моментов
|
и о |
ге К » Я ГЕ У о Я i Я Н > "О £ 3 я * и © S : у 2 ■ £ s ‘ " я |
Q О |
п.п. Q С |
ф Q С |
Q S |
o.п. Q С |
∑Q мет |
∑QСН 3 |
Е ВЗМО |
Е НСМО |
µ |
|
ОС1 |
-0,591 |
-0,189 |
0,273 |
0,166 |
-0,212 |
-2,459 |
-1,112 |
-0,201 |
0,005 |
2,903 |
|
|
ОС2 |
-0,590 |
-0,187 |
0,268 |
0,160 |
-0,213 |
-3,941 |
-1,105 |
-0,199 |
0,006 |
3,126 |
|
|
ОС3 |
-0,591 |
-0,189 |
0,274 |
0,166 |
-0,194 |
-5,032 |
-1,110 |
-0,200 |
0,005 |
2,896 |
|
|
ОС4 |
-0,593 |
0,013 |
0,268 |
0,166 |
-0,209 |
-2,460 |
-1,712 |
-0,200 |
0,007 |
2,861 |
|
|
ОС5 |
-0,591 |
-0,186 |
0,237 |
0,157 |
0,012 |
-1,688 |
-1,741 |
-0,198 |
0,011 |
3,554 |
При анализе сгенерированных GAMESS квантовохимических дескрипторов выявляется не слишком значительное изменение таковых от молекулы к молекуле. Длина R не оказывает влияния на величину Q S в ОС3. Наиболее слабо изменяются величины Q О и Е ВЗМО , первое связано с постоянным для всех молекул частичным переходом 2s-электронной плотности гидроксильного кислорода на бензольное кольцо. Поскольку он образует только связь О- ф С (помимо О-Н), то его донорные возможности оказываются исчерпанными. Величина Q О , по-видимому, не зависит от состава радикалов в остальной части молекулы, т.е. не зависит от ее структуры. ЕВЗМО каждой молекулы похожи в связи, во-первых, со схожестью молекул в целом, во-вторых, отличаются молекулы лишь длиной неполярного алифатического радикала; по-видимому, привнесение в ароматическое кольцо ОС4 и ОС5 метила оказывает влияние на п.п.QС , o.п.QС, т.е. только на состояние бензольного кольца, увеличивая в нем электронную плотность как ориентант 1 рода.
Анализ приведенных в таблице 2 величин ф Q С , Q S , o.п. Q С , п.п. Q С в сравнении с Е НСМО визуально дает прямую зависимость, истинная же ситуация показана на рисунке 2:
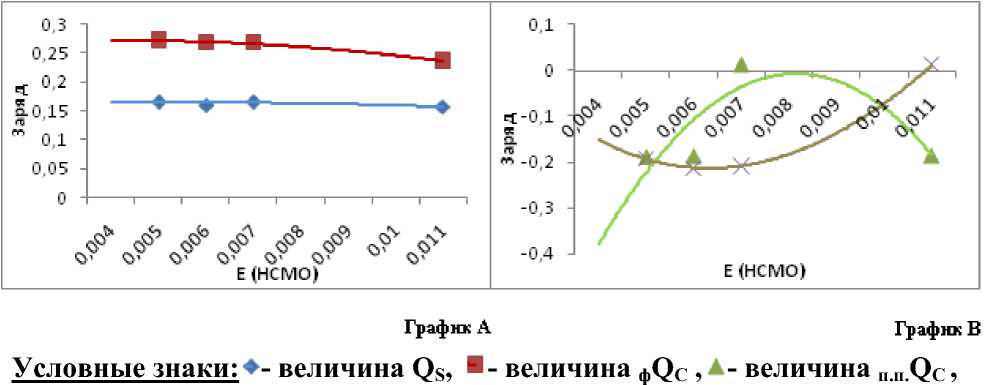
X -величина o.п.QС. Линии тренда имеют цвет соответствующих им точек
Рис. 2. Зависимость ЕНСМО от величины соответствующего заряда
Очевидно, что Е НСМО зависит только от величин зарядов на орто- (преимущественно, поскольку связь на графике В рисунка 2 почти прямая) и пара- положениях бензольного кольца (график В). Линии графика В имеют взаимно обратную зависимость. При уменьшении величины o.п.QС величина п.п. Q С возрастет и наоборот.
Были получены следующие КК (программный комплекс STATISTICA 7.0), связывающие Z со следующими квантовохимическими дескрипторами (таблица 2 и 3):
Табл. 2 .Величины ККП в системе «Ст3 / 3%-ый NaCI»
|
Защитны й эффект, % |
ККП «структура молекулы-антикоррозионные свойства»50 мг/л |
|||||||||
|
Z |
ф Q С |
п.п. Q С |
∑Q мет |
Q S |
o.п. Q С |
Q О |
∑Q СН 3 |
Е ВЗМО |
Е НСМ О |
µ |
|
0,41 |
0,27 |
0,76 |
-0,47 |
0,21 |
-0,08 |
-0,44 |
0,30 |
0,46 |
0,39 |
|
|
Защитны й эффект, % |
ККП «структура молекулы-антикоррозионные свойства» 200 мг/л |
|||||||||
|
Z |
-0,56 |
0,20 |
0,75 |
-0,63 |
0,36 |
-0,01 |
-0,51 |
0,48 |
0,59 |
0,55 |
Табл. 3 .Величины ККП в системе «Ст3 / 3%-ый NaCI+ н-С 8 Н 18 »
|
Защитны й эффект, % |
ККП «структура молекулы-антикоррозионные свойства» 50 мг/л |
|||||||||
|
Z |
ф Q С |
п.п. Q С |
∑Q мет |
Q S |
o.п. Q С |
Q О |
∑Q СН 3 |
Е ВЗМО |
Е НСМ О |
µ |
|
0,47 |
0,23 |
0.77 |
-0.53 |
0.27 |
-0,05 |
-0,46 |
0,35 |
0,51 |
0,45 |
|
|
Защитны й эффект, % |
ККП «структура молекулы-антикоррозионные свойства» 200 мг/л |
|||||||||
|
Z |
-0,68 |
0,12 |
0,80 |
-0.71 |
0.50 |
0,02 |
-0,55 |
0,56 |
0,70 |
0,66 |
Анализируя величины ККП в гетерогенных системах, имитирующих морскую воду, с присадкой и без нее «Ст3/3%-ый NaCI» и «Ст3 / 3%-ый NaCI + н-С8Н18», можно отметить, что при концентрации 50 мг/л и 200 мг/л ингибитора они равны по знакам, что говорит об идентичности механизма проявления ингибирующего действия.
Таким образом, Z будет увеличиваться при увеличении величин дескрипторов п.п.QC, о.п.QC, ∑Qмет, Е (ВЗМО), Е (НСМО), µ, а текущие величины соответствующих ККП лежат в диапазоне 0,20…0,76, давая достаточно высокий вклад в ингибирование коррозии. Соответственно, Z будет уменьшаться при увеличении остальных зарядов, а текущие величины соответствующих ККП лежат в диапазоне -0,71…-0,01.
Бензольное кольцо будет в целом обеднено электронной плотностью, которая донируется на поверхность стали, на что указывают положительные ККП вида «Z- п.п. Q C » и «Z- о.п. Q C ».
QО не имеет связи с проявлением действия ингибитора, поскольку атом кислорода не несет свободной электронной плотности, последняя внедряется в бензольное кольцо, и только оттуда частично переходит на металл.Атом кислорода вследствие высокой электроотрицательности является слабым донором электронной плотности. По вышеуказанной причине ККП вида « ф Q С - Z» отрицателен. ∑Q СН3 не вносит вклад в ингибирование коррозии, очевидно,донируя электронную плотность на алифатический радикал R /2/, группирующийся параллельно поверхности стали и вносящий электронную плотность на поверхностные атомы металла. По этой причине ККП вида «∑Qмет - Z» является самой крупной величиной.
Самая неоднозначная ситуация складывается в отношении атома серы. Благодаря высокой электроотрицательности и наличию свободных 3s, 3p -орбиталей, способен оттягивать электронную плотность от атомов металла, который ионизируется в связи с этим, и от атомов углерода алифатического R (растут основные свойства серы). В то же время атом серы характеризуется большей способностью, чем атом кислорода, быть донором электронов на металл благодаря нахождению в 3 периоде. Первое явление ведет к снижению величины заряда, второе же — к его росту. ККП вида «Z-Q S » ( как и вида «Z-Q О ») сопровождается сильным падением ККП при увеличении концентрации ингибитора, поскольку при увеличении числа адсорбирующихся на стали молекул с выраженными анионными центрами (каковым является согласно первому явлению атом серы) возникает φ-потенциал отрицательного знака, который ускоряет электрохимические реакции, причем стимулирующее действие тем сильнее, чем выше их концентрация, что и объясняет отрицательный знак. Весьма вероятно, что не последнее место занимает первое явление, поскольку атомы (группы атомов) с зарядами ф QС и ∑QСН3 , во-первых, также обуславливают отрицательную величина ККП соответствующего вида, во-вторых, модуль ККП соответствующего вида растет с повышением концентрации. Именно с зарядов ф Q С и ∑Q СН3 начинается обогащение электронной плотностью соответствующих углеводородных структур.
Анализируя ККП вида «Z-п.п.QC» и «Z-о.п.QC» можно предположить, откуда происходит отток электронной плотности на поверхность металлоатомов стали; аналогично последнее происходит с радикала (ККП вида «Z-∑Qмет» равен 0,76). Положительная величина Е (ВЗМО) говорит о низкой энергии ионизации, способствующей легкой отдаче электрона молекулой в целом /5/. Величина µ вносит вклад как мера растворимости вещества: чем молекула полярнее, тем лучше она растворима в воде, легче достигая поверхности стали.
ККП вида «Z-Е (ВЗМО)» и «Z-Е (НСМО)», «Z-µ» при повышении концентрации растут, поскольку это дескрипторы, описывающие состояние всей молекулы, которых чем больше, тем Z выше.
В случае присадки октана изменения ККП выражены сильнее. Неполярные группировки молекулы (бензольные кольца и алифатические радикалы) переходят в неполярную фазу, образуемую октановой присадкой; поскольку они занимают существенный процент массы ОС, полярные группировки молекулы (представленные как гетероатомами, так и богатыми электронной плотностью прочие участки ОС) проявляют донорные свойства в меньшей мере, с трудом адсорбируясь на металле: особенно явственно это влияет на ККП вида «Z- п.п. Q C » и вида «Z- ф Q C », Центры адсорбции (хемосорбции, т.к. не имеется явных положительных зарядов) – это о.п. Q C , п.п.QC и ∑Qмет , части неполярных структур исследуемых молекул, богатые электронной плотностью.
Список литературы Квантово-химическое и статистическое исследование механизма действия органических соединений как ингибиторов коррозии
- Магеррамов А.М., Байрамов М.Р., Джавадова О.Н., Агаева М.А., Алиева С.Г., Джавадов М.А. Получение фенолсульфидов на основе пропенилфенолов и исследование их в качестве ингибиторов коррозии стали//Вестник Бакинского Университета, -Баку: Изд-во "Бакинский Университет", 2009. С. 52-55
- Моррисон Р., Бойд Р. Органическая химия. -М.: Мир, 1974 -1132 с.
- Сикачина А.А. Комплексоны-полиаминополикарбоновые кислоты: квантовохимическое и статистическое исследование молекул и их серий//Естественные и технические науки. -2015 -№ 6 -C. 120-126
- Сикачина А.А. Построение статистической зависимости вида «структура-свойства» между биоцидной активностью комплексонов и строением их молекул//Перспективы науки-2015 -№ 5 -C. 137-142
- Терюшева С. А., Белоглазов Г. С., Белоглазов С. М., “Производные 1,4-гидрохинона в роли ингибиторов коррозии и наводороживания стали в присутствии СРБ”, Вестн. СамГУ. Естественнонаучн. сер., 2011, № 5(86), 136-143.


