Квантово-химическое исследование влияния дисперсионной среды на эмульгирующую способность молочных белков
Автор: Борисенко Александр Алексеевич
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 3 т.19, 2016 года.
Бесплатный доступ
В настоящее время в пищевой промышленности широко используются продукты, включающие молочные белки. Благодаря их применению стабилизируются белково-жировые эмульсии, улучшается консистенция, сочность и товарный вид готовой продукции. С целью исследования влияния электрохимически активированной воды на эмульгирующую способность молочных белков проведено молекулярное компьютерное моделирование и квантово-химические расчеты фрагмента молекулы αs1-казеина в питьевой воде и католите в присутствии триацилглицерина линолевой кислоты. Выявлено, что исследуемый белок в присутствии молекулы жира располагается в воде отрицательно заряженной областью к полярному компоненту системы, а неполярным участком - к гидрофобному компоненту. Установлено, что величина дипольного момента исследуемого фрагмента молекулы αs1-казеина в католите уменьшилась на 10,55 Дебай, количество водородных связей с молекулами католита возросло в 1,3 раза, а количество внутримолекулярных водородных связей белка увеличилось в 1,7 раза по сравнению с результатами моделирования системы на основе питьевой воды. На фрагменте молекулы αs1-казеина в католите зафиксирована концентрация мощного электростатического потенциала со смещением центра с высокой электронной плотностью в область фосфосеринового аминокислотного остатка, по сравнению с питьевой водой установлено увеличение эмульгирующей способности белка за счет усиления гидрофильных и гидрофобных свойств соответствующих участков пептидной цепи. На основании проведенных исследований установлено, что белковые молочные продукты, гидратированные электрохимически активированной водой (католитом), более эффективны в качестве эмульгаторов и водосвязывающих компонентов, чем при использовании питьевой воды, что позволяет рекомендовать их при производстве различных мясных изделий.
Молекулярное моделирование, квантово-химические расчеты, казеин, эмульгирующая способность, электрохимически активированная вода
Короткий адрес: https://sciup.org/14294927
IDR: 14294927 | УДК: 664.41+546.02+66.063.8 | DOI: 10.21443/1560-9278-2016-3-569-576
Текст научной статьи Квантово-химическое исследование влияния дисперсионной среды на эмульгирующую способность молочных белков
В настоящее время в пищевой промышленности при получении эмульсии на основе растительного или животного жира широко используются продукты, включающие молочные белки. На поверхности раздела фаз "жир – вода" белок адсорбируется, при этом вокруг капли жира формируется устойчивая и эластичная пленка, которая препятствует коалесценции – слиянию мелких жировых шариков в более крупные [1]. Эластические свойства и механическая прочность межфазной пленки определяют стабильность эмульсии и, как следствие, качество готовых изделий.
Результаты исследований эмульгирующей способности различных молочно-белковых концентратов, представленные во многих научных работах, позволяют считать, что молочные белки обладают более высокими эмульгирующими свойствами, чем растительные и другие виды немясных белков [2].
Целью работы являлось исследование влияния электрохимически активированной воды (католита) на эмульгирующую способность молочных белков (на примере α s1 -казеина) путем молекулярного моделирования и квантово-химического анализа механизма взаимодействий молекул белка, жира и дисперсионной водной среды.
Материалы и методы
Молекулярное моделирование и квантово-химические расчеты проводили с использованием инструментария программного продукта HyperChem (разработчик Hypercube, Inc.). Оптимизацию геометрии молекул проводили в соответствии с рекомендациями [3]. Для основной казеиновой фракции – α s1 -казеина – использовали метод молекулярной механики AMBER, разработанный специально для белков и нуклеиновых кислот. При моделировании триацилглицерина линолевой кислоты последовательно применяли основной метод молекулярной механики MM+, а затем полуэмпирический метод АМ1 (Austin Model 1), который позволяет получать достаточно точные результаты для органических молекул, содержащих в своем составе атомы кислорода [4].
Для установления распределения электростатического потенциала на поверхности молекулы αs1-казеина выполняли расчет частичных зарядов на атомах исследуемого фрагмента белка, используя полуэмпирический квантово-химический метод PM3 (modified neglect of diatomic overlap Parametric Method 3) [3]. Результаты расчета более простыми методами, такими как CNDO, оказались недостаточно точными, видимо, вследствие специфического распределения зарядов, связанного с выраженным чередованием гидрофильных и гидрофобных участков (блоков) молекулы αs1-казеина [5], что в целом характеризует казеины как линейные сополимеры блоков с разными физико-химическими свойствами.
Результаты и обсуждение
Для оценки эмульгирующей способности белковых концентратов проводят исследование стабильности эмульсий, приготовленных на основе 1 %-х по белку водных дисперсий и подсолнечного масла [6].
Основой растительных масел, как и всех жиров, являются сложные эфиры глицерина и высших алифатических (жирных) кислот. Каждая молекула глицерина в растительном масле связана с остатками трех жирных кислот с образованием триацилглицерина (триглицерида). Массовая доля триацилглицеринов в растительных жирах составляет 93–98 % [7]. Подсолнечное масло вне зависимости от сорта подсолнечника всегда имеет только четыре жирные кислоты (с относительным содержанием свыше 2,5 %) – пальмитиновую (5,0–7,6 %), стеариновую (2,7–6,5 %), олеиновую (14,0–39,4 %) и линолевую (48,3–77,0 %) 1 .
Учитывая, что в состав молекулы триацилглицерина могут входить одинаковые кислотные остатки [7], автором в программе HyperChem построена его молекулярная модель, в состав которой входят три остатка превалирующей для подсолнечного масла жирной кислоты – линолевой (рис. 1).
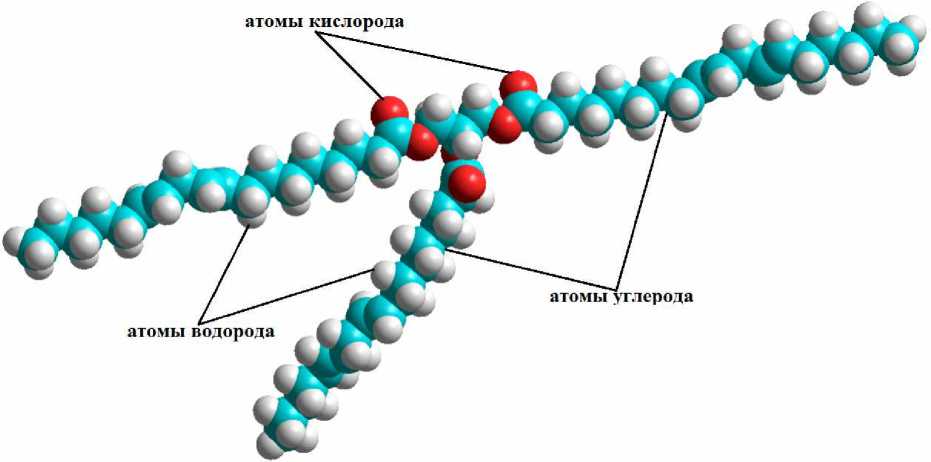
Рис. 1. Модель молекулы триацилглицерина линолевой кислоты
Величина дипольного момента (2,914 Дебай) и валентных углов связей С–С углеводородных цепей (110,57–112,02º) построенной модели молекулы триацилглицерина линолевой кислоты согласуется с расчетными и экспериментальными данными, полученными другими авторами [4; 8].
На основе проведенного анализа первичной структуры α s1 -казеина [9] для проведения исследований выбрана следующая последовательность из аминокислотных остатков, охватывающая переход от его гидрофобной части к гидрофильной с ярко выраженными для них свойствами: -Gly-Lys-Glu-Lys-Val-Asn-Glu-Leu-Ser-Lys-Asp-Ile-Gly-SerP-.
Для прогнозирования на молекулярном уровне эмульгирующей способности исследуемого белка фрагмент молекулы α s1 -казеина и триацилглицерин линолевой кислоты с помощью инструмента Periodic Box программы HyperChem помещали в центр водного бокса. После проведения релаксации молекул воды основным методом молекулярной механики MM+ осуществляли квантово-химические расчеты молекулы белка и триацилглицерина линолевой кислоты, оптимизировали их геометрию и выполняли расчет частичных зарядов на атомах исследуемого фрагмента молекулы α s1 -казеина (рис. 2).
На основе геометрической оптимизации молекулы белка в питьевой воде установлено значение минимальной потенциальной энергии системы минус 2285,380 кДж/моль при среднеквадратичном градиенте – 0,414 кДж/(Å · моль).
Полученная конформация фрагмента молекулы α s1 -казеина при контакте с гидрофобной поверхностью молекулы триацилглицерина линолевой кислоты подтверждает специфику блочной структуры данного белка и наличие у него эмульгирующих свойств: неполярный участок пептидной цепи прочно связывается с гидрофобной поверхностью, а гидрофильный – не контактирует с поверхностью триацилглицерина, при этом вытягивается в сторону жидкой фазы и взаимодействует только с растворителем (рис. 3).
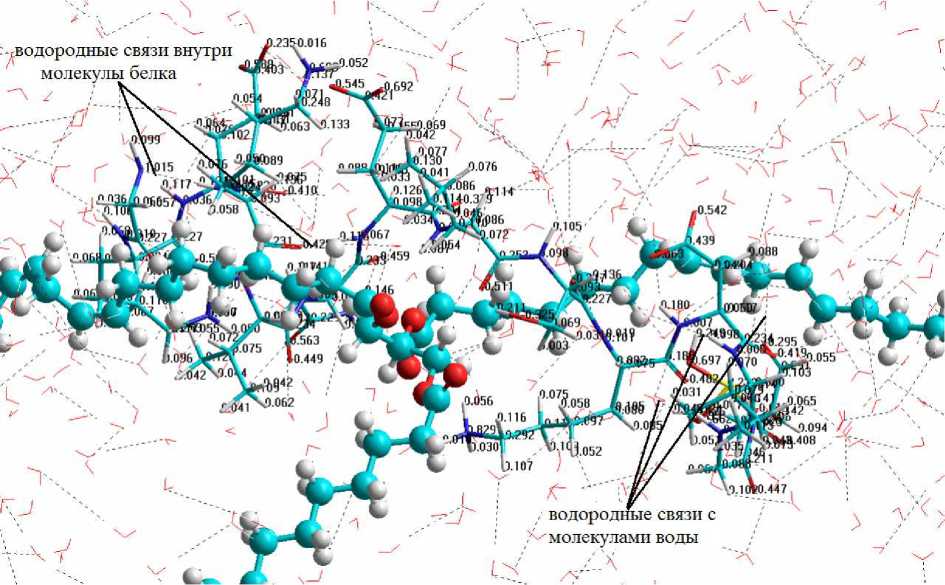
Рис. 2. Распределение зарядов на атомах фрагмента молекулы α s1 -казеина в системе "белок – вода – триацилглицерин"
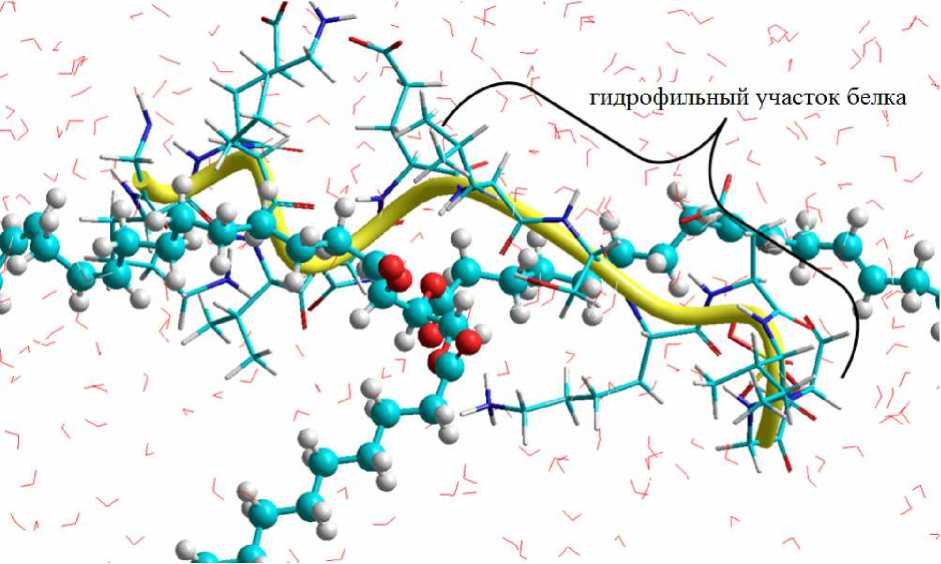
Рис. 3. Модель вторичной структуры фрагмента молекулы α s1 -казеина и триацилглицерина линолевой кислоты в питьевой воде
Известно, что эмульгаторами могут быть вещества, молекулы которых, кроме неполярных групп, содержат несимметричную поляризованную группу. Они легко адсорбируются на поверхности раздела фаз, создают адсорбционный слой гелеобразной структуры, который препятствует слиянию жировых шариков. Трехмерная карта распределения электростатического потенциала на поверхности фрагмента молекулы α s1 -казеина показывает (рис. 4), что белок в присутствии триацилглицерина линолевой кислоты в питьевой воде располагается отрицательно заряженной областью к полярному компоненту системы (вода), а неполярным участком – к гидрофобному компоненту (жир).
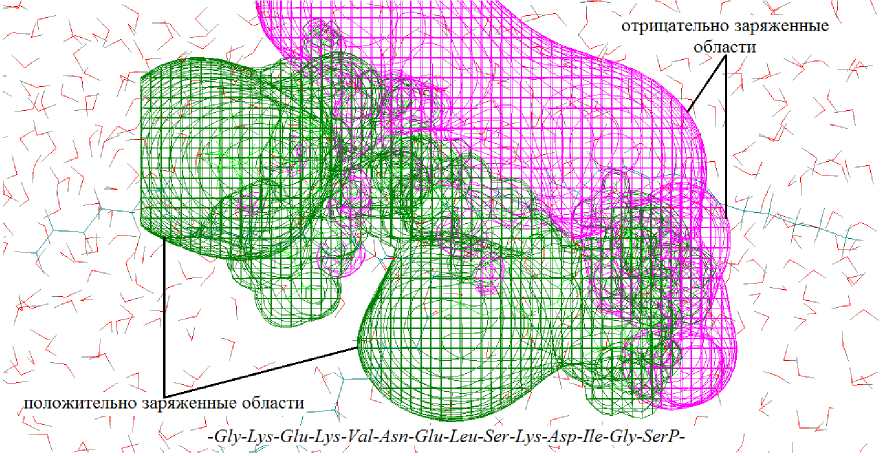
Рис. 4. Трехмерная карта распределения электростатического потенциала фрагмента молекулы α s1 -казеина в системе "белок – вода – триацилглицерин"
На основе собственных исследований и анализа результатов ранее проведенных научных работ [10–12] для подтверждения предположения автора о возможности повышения эмульгирующей способности казеинов в электрохимически активированной (ЭХА) воде по алгоритму, представленному выше, проведено моделирование взаимодействий белка с католитом (рН 11,2; окислительно-восстановительный потенциал (ОВП) – минус 500 мВ) в присутствии триацилглицерина линолевой кислоты (рис. 5).
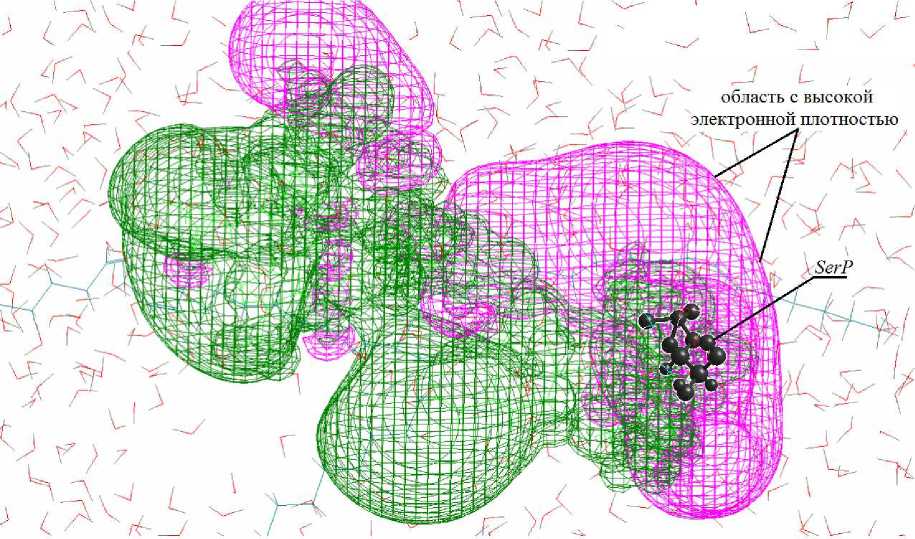
Рис. 5. Трехмерная карта распределения электростатического потенциала фрагмента молекулы α s1 -казеина в системе "белок – католит – триацилглицерин"
Геометрическая оптимизация молекулы белка в системе с католитом позволила установить минимальную потенциальную энергию системы минус 2311,359 кДж/моль при среднеквадратичном градиенте – 0,415 кДж/(Å ⋅ моль). Установленное изменение значения потенциальной энергии исследуемого фрагмента молекулы α s1 -казеина по сравнению с питьевой водой свидетельствует об увеличении его способности к структурообразованию в активированной водной среде.
Анализ распределения электростатического потенциала фрагмента молекулы α s1 -казеина в системе с католитом (рис. 5) по сравнению с питьевой водой указывает на концентрацию мощного электростатического потенциала со смещением центра с высокой электронной плотностью в область фосфосеринового аминокислотного остатка (SerP).
Известно, что эмульгирующие свойства белка зависят от его гидратационной способности [1], которую на молекулярном уровне можно оценить по величине дипольного момента, являющегося мерой полярности молекулы, и количеству образованных водородных связей [13], которые определяют практически все особенности участия воды в процессах органической, неорганической и биологической химии [14]. Установлено, что величина дипольного момента исследуемого фрагмента молекулы α s1 -казеина в католите (система "белок – католит – триацилглицерин") уменьшилась на 10,55 Дебай, а количество водородных связей между исследуемым фрагментом молекулы α s1 -казеина и молекулами католита возросло в 1,3 раза по сравнению с результатами моделирования системы на основе питьевой воды (рис. 6).
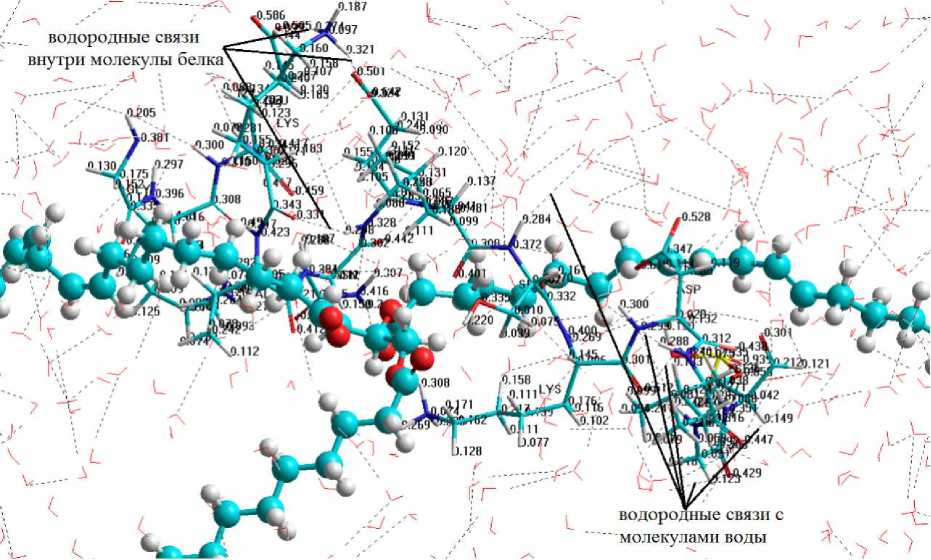
Рис. 6. Распределение зарядов на атомах фрагмента молекулы α s1 -казеина в системе "белок – католит – триацилглицерин"
Количество внутримолекулярных водородных связей белка увеличилось в 1,7 раза в сравнении с результатами моделирования системы "белок – вода – триацилглицерин" (табл.).
Таблица
Основные конформационные характеристики фрагмента молекулы α s1 -казеина в системе "белок – водная среда – триацилглицерин"
|
Наименование показателей |
Водная среда |
Отклонение по абсолютной величине (+, –) |
|
|
Питьевая вода |
Католит |
||
|
Количество водородных связей между фрагментом белка и молекулами воды, шт |
15 |
19 |
+4 |
|
Количество внутримолекулярных водородных связей, шт |
3 |
5 |
+2 |
|
Дипольный момент, Дебай |
78,56 |
68,01 |
–10,55 |
В соответствии с общепринятой классификацией форм связи влаги водная среда находится в физикохимической связи с молекулой белка, причем основной уровень соответствует водородной связи, значение энергии которой находится в пределах 18–25 кДж/моль [14]. Образование дополнительных водородных связей в исследуемой системе свидетельствует о повышении ее устойчивости при образовании эмульсии в католите.
На основании проведенных исследований (табл.) можно констатировать факт, что вступая в энергетический контакт с активными центрами сорбции биополимеров, католит в большей степени по сравнению с питьевой водой переходит в связанное состояние, что в свою очередь вызывает изменение их свойств на молекулярном уровне. Считается, что связанная таким образом влага претерпевает фазовый переход 1-го рода [14], это необходимо учитывать при организации и решении технологических задач.
Заключение
На молекулярном уровне установлено, что использование католита предоставляет новые возможности в технологии пищевых белоксодержащих продуктов, поскольку ЭХА вода в большей степени (до 30 % в сравнении с питьевой) переходит в связанное состояние, именно поэтому следует ожидать взаимосвязанные преобразования совокупных свойств гидрофильных компонентов пищевого сырья.
Результаты молекулярного моделирования и квантово-химических расчетов позволяют сделать вывод о том, что при использовании католита инициируется несколько иной механизм образования белковожировой эмульсии, чем при использовании питьевой воды. Это связано со спецификой распределения зарядов и электростатического потенциала молекулы белка в католите, что является причиной повышения степени его гидратации, адсорбции на поверхности частичек жира и, как следствие, увеличения эмульгирующей способности.
Данные проведенных исследований подтверждены результатами разработки и промышленной апробации новых технологий мясных продуктов, включающих использование ЭХА воды для гидратации молочного белкового концентрата и получения белково-жировых эмульсий.
Список литературы Квантово-химическое исследование влияния дисперсионной среды на эмульгирующую способность молочных белков
- Амирханов К. Ж. Технология получения многокомпонентных белковых комплексов//Вестник Алтайского государственного аграрного университета. 2009. № 1 (51). С. 59-61.
- Салаватуллина Р. М. Рациональное использование сырья в колбасном производстве. М.: Агропромиздат, 1995. 256 с.
- HyperChem Release 8.0 for Windows. Reference Manual. USA: Hypercube, Inc, 2013. 804 p.
- Лыков П. В., Дудкин В. И. Квантово-химический расчет дипольных моментов и потенциалов ионизации триглицеридов//Известия Алтайского государственного университета. 2014. № 1 (81). С. 215-216.
- Ельчанинов В. В. Структура казеинов и механизм сычужного свертывания. 1. Некоторые химические свойства и особенности структуры казеинов (Обзор литературы)//Актуальные проблемы техники и технологии переработки молока: сб. науч. трудов с междун. участием. Вып. 8. Барнаул: Азбука, 2011. С. 186-192.
- Inklaar P. A., Fortuin J. Determining the emulsifying and emulsion stabilizing capacity of protein meat additives//Food Technology, 1969. V. 23. Р. 103-107.
- Техника и технологии производства и переработки растительных масел: учеб. пособие/С. А. Нагорнов, Д. С. Дворецкий, С. В. Романцова, В. П. Таров. Тамбов: Изд-во ГОУ ВПО ТГТУ, 2010. 96 с.
- Овчинников Ю. А. Биоорганическая химия. М.: Просвещение, 1987. 816 с.
- Горбатова К. К. Химия и физика белков молока. М.: Колос, 1993. 192 с.
- Бахир В. М. Электрохимическая активация: изобретения, техника, технология. М.: ВИВА-СТАР, 2014. 510 с.
- Борисенко А. А. Теоретические основы аналитического определения параметров регулирования активной кислотности белоксодержащих систем//Хранение и переработка сельхозсырья. 2001. № 5. С. 13-17.
- Современные тенденции в области направленного регулирования свойств пищевого сырья и производства безопасных продуктов питания нового поколения/А. А. Брацихин, А. А. Борисенко, Л. А. Борисенко, В. И. Огнев//НаукаПарк. 2010. № 1 (1). С. 81-85.
- Химическая энциклопедия. Под ред. Н. С. Зефирова. Т. 4. М.: Большая Российская энциклопедия. 1995. 639 с.
- Теоретические основы пищевых технологий. В 2 кн. Отв. ред. В. А. Панфилов. М.: КолосС, 2009. 1408 с.


