Лабораторный способ оценки солеустойчивости ресурсных видов древесных растений
Автор: Алиева Зарина Магомедрасуловна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-1 т.18, 2016 года.
Бесплатный доступ
Нарастание напряженности стрессовых воздействий, в том числе почвенного засоления, требует разных подходов к изучению и оценке стрессоустойчивости растительных ресурсов. Основой для оценки устойчивости растений обычно служит учет амплитуды и скорости изменения разных физиологических параметров в стрессовых ситуациях. В лабораторных условиях в первую очередь оценивают всхожесть семян и рост проростков. В задачи данной работы входила оценка роли процессов регенерации изолированных структур в устойчивости к засолению и возможности использования этого показателя для ее диагностики. Отмечены различия в корнеобразовании при культивировании в растворах NaCl (10 - 100 мМ) у разных черенков ряда объектов: гипокотильных черенков гледичии и альбиции, листовых и стеблевых шелковицы, стеблевых айвы, алычи, алычево-персикового гибрида, винограда, граната, тополя, ивы. В работе установлены селективные и летальные дозы NaCl, выявлены более устойчивые (виноград, айва, ива) культуры и показано, что активность ризогенеза стеблевых черенков в условиях засоления является удобным показателем для диагностики солеустойчивости древесных растений. Анализ жизнеспособности черенков древесных культур в условиях стресса актуален, так как имеет значение для оценки их ресурсного потенциала и может существенно сократить время диагностики устойчивости.
Устойчивость, засоление, растительные ресурсы, регенерация, ризогенез, черенок
Короткий адрес: https://sciup.org/148204436
IDR: 148204436 | УДК: 581.14.051
Текст научной статьи Лабораторный способ оценки солеустойчивости ресурсных видов древесных растений
Опустынивание, нарастание почвенного засоления, засуха, тяжелые металлы, нефть и нефтепродукты, ксенобиотики подавляют продуктивность и развитие дикорастущих и культурных растений. Отсюда и необходимость фундаментального изучения стрессо-устойчивости биологических ресурсов (Шамсутдинов, 2006; Ковда, 2008; Prasad, 2003; Munns, Tester, 2008). Существующие методы оценки стрессоустойчивости растений делятся на прямые (включающие учет изменения урожайности, продуктивности и биометрических показателей роста и массы растений, определение всхожести семян растений в различных условиях) и косвенные (учет изменения физиолого-биохимических показателей); лабораторные, вегетационные и полевые. Лабораторная диагностика устойчивости растений к стрессам основывается на необходимости оценки спектра морфофизиологических параметров, связанных с напряженностью воздействий факторов. Качественной основой для оценки степени устойчивости растений служит учет амплитуды и скорости изменения разных физиологических параметров в стрессовых ситуациях (Удовенко, Гончарова, 1989). Для первичной оценки образцов более пригодны широко используемые лабораторные методы, например определение устойчивости по комплексу ростовых параметров ими всхожести семян в условиях стресса (Дроздов и др., 1988; Гончарова, 2011). В этом направлении уже накоплен разнообразный материал, однако пока недостаточно оценена роль реализации процессов регенерации изолированных структур в устойчивости к стрессам и возможность использования этого показателя для диагностики солеустойчивости.
Адаптивные возможности растения, определяющие устойчивость, могут определяться по многим параметрам: цитогенетическим, биохимическим, физиологическим, молекулярным маркеры
солеустойчивости (Удовенко, 1988; Munns, Tester, 2008; Кузнецов, Шевякова, 1999; Abdel-Hamid, 2014). Одним из интегральных показателей является рост, степень депрессии ростовых показателей, как правило, обнаруживает прямую корреляцию с солеустойчивостью (Удовенко, 1988, 1990; Дроздов и др., 1988; Munns, Tester, 2008).
Оценка жизнеспособности в условиях действия стрессоров у черенков древесных растений представляет особый интерес, поскольку имеет значение для оценки их ресурсного потенциала и может существенно сократить время диагностики стрессоустойчивости растения. Это важно при необходимости раннего мониторинга солевого стресса. На практике же его обнаруживают уже при его сильном и необратимом биологическом воздействии (Chanteele, Hoffman, 2003). В тоже время сравнительный анализ солеустойчивости древесных значительно реже обсуждается в литературе, чем травянистых. В классической работе А.А. Шахова (1956) предложена градация плодовых культур по группам по мере убывания солеустойчивости. В первую вошли груша, виноград, абрикос, шелковица, айва, гранат, во вторую – яблоня, слива, в третью (наименее солеустойчивые) – персик, вишня, черешня. Есть сведения о сравнительной солеустойчивости разных видов тополей (Дорохина и др., 2010). При этом практически отсутствует сравнительный анализ влияния засоления на процессы регенерации черенков. При этом данный показатель следует рассматривать как интегральный для оценки действия засоления на растения, что ранее было нами показано на примере черенков травянистых растений (Юсуфов, Алиева, 2001, Алиева и др., 2014). В связи с этим целью данной работы была оценка действия засоления на регенерационные процессы черенков древесных растений.
Методика. Объектами исследований являлись гипокотильные черенки альбиции ( Albizzia julibrissin Durazz.) и гледичии ( Gleditschia triacanthos L.), листовые и стеблевые черенки шелковицы ( Morus alba L.), полу-одревесневшие черенки граната ( Punica granatum L.) , айвы ( Cydonia oblonga Mill.), алычи ( Prunus cerasifera
Ehrh.) , алычево-персикового гибрида ( Persica vulgaris х Prunus divaricata ), винограда (Vitis vinifera L.), ивы (Salix alba L.), тополя Populus deltoidеs Marsh.
Полуодревесневшие черенки культивировали в химических стаканах объемом 500 мл с 200 мл раствора NaCl разных концентраций: 10,20, 40, 50, 75 мМ. Контролем служили варианты с культивированием черенков в воде. В каждом стакане – 4-5 черенков, каждый вариант опыта включал 20 черенков. Повторность опытов – 3-5 кратная. Показателями оценки жизнеспособности черенков в условиях засоления служили выживаемость черенков, активность каллусо- и корнеобразования (в % от общего числа черенков в варианте), сроки развития корней, их размеры и количество, активность распускания почек. В таблицах приведены средние арифметические значения и их стандартные ошибки (Лакин, 1990, Шмидт, 1980). Повторность опытов – 3-кратная. Результаты опытов обработаны с помощью программы Microsoft Excel 2007. В таблицах и на рисунках представлены средние значения и стандартные ошибки. Достоверность различий между контрольными и опытными вариантами оценивали по t-критерию Стьюдента при P<0.05. При оценке стрессоустойчивости проводили и дисперсионный анализ по общепринятым методам (Шмидт, 1984) и рассчитывали с помощью программы Microsoft Excel 2007. В таблицах приведены значения межгрупповой (факторной) дисперсии MS B , внутригрупповой (остаточной) дисперсии MS w , сумм квадратов отклонений SS, степеней свободы df, F-критерий Фишера.
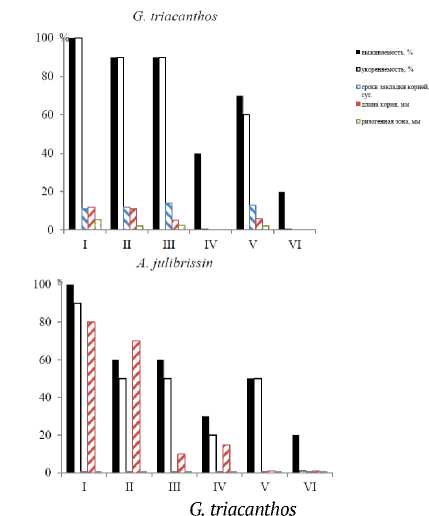
Рис. 1. Жизнеспособность гипокотильных черенков гледичии ( G. triacanthos) и альбиции ( A. julibrissin) при культивировании в течение 21 сут. в контроле (I) и растворах NaCl 10, 20, 40 мМ (II-IV) и Na 2 SO 4 10 и 20 мМ (V, VI).
Результаты и их обсуждение. Основной акцент в работе сделан на активность протекания регенерационных процессов в условиях засоления. При этом отмечены различия в корнеобразовании у разных изолированных структур, таких как гипокотильные черенки гледичии и альбиции с однотипной реакцией на засоление (рис. 1). Высокая чувствительность процессов корнеобразования у них наблюдается к хлориду натрия, как и у черенков травянистых форм (Алиева, Юсуфов, 2013). Токсичные и летальные дозы растворов солей для черенков гледичии и альбиции оказались более высокими, чем шелковицы. Так, в растворе 10 мМ NaCl укореняемость их черенков лишь снижалась, а у шелковицы – полностью подавлялась (рис. 2). У шелковицы листовые черенки укоренялись лучше, чем стеблевые, как в благоприятных условиях, так и при стрессе.
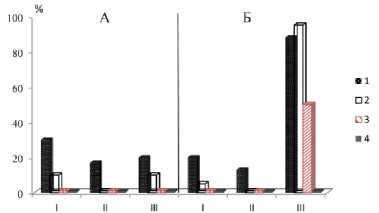
Рис. 2. Выживаемость (I), укореняемость (II) и каллусо-образование (III) стеблевых (А) и листовых (Б) черенков шелковицы ( M. alba) в контроле (1) растворах NaCl 10,20, 40 мМ (2-4)
У черенков тополя и ивы развитие корней в растворах NaCl подавлялось в меньшей степени, чем у черенков плодовых, при этом активно формировался каллус (табл. 1). При этом следует отметить, что в контроле и при слабом засолении (10-20 мМ NaCl) преимущественно формировались корни при слабом развитии каллуса, а в условиях более высокого засоления (40 мМ NaCl) развитие корней подавлялось, а каллус закладывался у большего числа черенков, чем в контроле. Снижение укореняемости черенков ивы с повышением концентрации соли происходило менее интенсивно, чем у тополя. Так, в растворе 20 мМ NaCl укоренилось 50% черенков тополя и 90% черенков ивы. В растворах с концентрацией, превышающей 20 мМ, наблюдалось быстрое отмирание распустившихся почек, хотя образование корней наблюдалось и в растворе 40 мМ. Засоление влияло и на сроки развития корней. В частности, у тополя в контроле и вариантах 1020 мМ NaCl корни формировались на 8-10 сутки опыта, а в варианте 50 мМ – на 13-е. У айвы, при более низкой общей укореняемости черенков (50%), развитие корней отмечено в 20 – 40 мМ растворах NaCl (44 и 25 % соответственно). Единичные же случаи формирования корней наблюдались даже в более концентрированных растворах. У 30-40 % черенков айвы в контроле формировались побеги, в 10 мМ растворе NaCl пробуждение почек наблюдалось у 15-20% черенков, но и они быстро завядали. Опыты показали, что более высокую степень устойчивости проявили черенки айвы, винограда, ивы. Только у этих культур наблюдалось укоренение черенков в растворах NaCl c концентрацией 40 мМ NaCl. При этом только у черенков винограда и ивы наблюдалось укоренение черенков в растворе 50 мМ, где у всех остальных объектов они отмирали без укоренения. Степень снижения активности корнеобразо-вания в условиях менее сильного засоления – 10 и 20 мМ – также варьировала у объектов (рис. 3). Так, у айвы укореняемость черенков, хотя в целом была невысокой, в растворах 10 и 20 мМ оставалась на уровне контрольного показателя. Относительно высокие показатели относительно контроля проявляли черенки винограда и ивы. Так, в растворе 10 мМ у винограда укоренялось 95% черенков, 20 мМ – 75%. Подобная картина наблюдалась и у черенков ивы, у которой показатели составили соответственно 100 и 85 %. В наиболее высокой концентрации, где еще наблюдали укоренение, у ивы укоренилось 45% черенков. При этом наблюдался дисбаланс между формированием корней и распусканием почек. Так, почки у некоторых объектов пробуждались даже в вариантах 50-100 мМ, однако быстро высыхали и черенки отмирали. Данные о степени влияния засоления на ризогенез черенков подтверждаются результатами однофакторного дисперсионного анализа, который проведен на основе данных по укореняемости черенков ивы в условиях засоления 10, 20, 40, 50 и 75 мМ (табл. 2).
Таблица 1. Состояние черенков древесных культур в условиях засоления
|
Объекты |
Варианты |
Выжива емость,% |
Каллусо-образо-вание,% |
Ризоге-нез, % |
Пробуждение почек % |
|
гранат |
Н 2 О |
90 |
60 |
60 |
60 |
|
NaCl,мМ 10 |
75 |
30 |
40 |
20 |
|
|
20 |
50 |
30 |
40 |
10 |
|
|
40 |
50 |
0 |
0 |
0 |
|
|
айва |
Айва К |
90 |
100 |
25 |
70 |
|
NaCl,мМ 10 |
80 |
100 |
25 |
70 |
|
|
20 |
70 |
75 |
25 |
50 |
|
|
40 |
50 |
50 |
10 |
35 |
|
|
алыча |
К |
100 |
90 |
75 |
100 |
|
NaCl,мМ 10 |
100 |
30 |
50 |
100 |
|
|
20 |
97 |
20 |
25 |
80 |
|
|
40 |
45 |
0 |
0 |
40 |
|
|
хурма |
К |
100 |
50 |
50 |
50 |
|
NaCl,мМ 10 |
90 |
50 |
0 |
30 |
|
|
20 |
70 |
20 |
0 |
0 |
|
|
40 |
0 |
0 |
0 |
0 |
|
|
виноград |
К |
100 |
- |
100 |
100 |
|
NaCl,мМ 10 |
100 |
- |
95 |
100 |
|
|
20 |
90 |
- |
75 |
90 |
|
|
50 |
45 |
- |
50 |
70 |
|
|
75 |
25 |
- |
25 |
50 |
|
|
100 |
0 |
- |
0 |
10 |
|
|
ива |
К |
100 |
12 |
100 |
100 |
|
NaCl,мМ 10 |
92 |
11 |
100 |
100 |
|
|
20 |
88 |
12 |
85 |
91 |
|
|
50 |
60 |
27 |
57 |
55 |
|
|
75 |
42 |
10 |
43 |
39 |
|
|
100 |
10 |
9 |
0 |
0 |
|
|
тополь |
Контроль |
90 |
95 |
80 |
90 |
|
NaCl, 10 |
90 |
900 |
70 |
85 |
|
|
20 |
75 |
100 |
50 |
90 |
|
|
50 |
30 |
855 |
305 |
60* |
|
|
100 |
0 |
50 |
0 |
10 |
Таблица 2. Результаты однофакторного дисперсионного анализа влияния хлорида натрия на черенки ивы
|
Дисперсионный анализ |
||||||
|
источник вариации |
SS |
df |
MS |
F |
P-Значение |
F критическое |
|
между группами |
13390 |
4 |
3347,5 |
51,10687 |
3,19E-10 |
2,866081 |
|
внутри групп |
1310 |
20 |
65,5 |
|||
|
Итого |
14700 |
24 |
||||
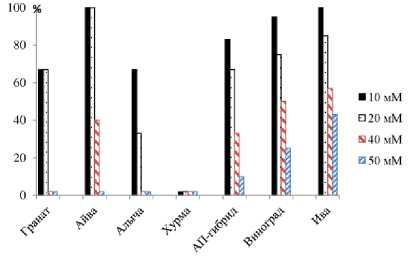
Рис. 3. Укореняемость (в % к контролю) черенков древесных культур в условиях засоления среды NaCl
Выводы: оценка стрессоустойчивости ресурсных видов в естественных условиях произрастания требует разных подходов и связана со сложностью ее проведения, поэтому ставится задача разработки лабораторных методов, чему и была посвящена наша работа. Предложенный в данном сообщении подход отличается от общепринятых. В частности, в продолжение наших исследований с травянистыми формами (Алиева, Юсуфов, 2013), удалось выявить видовые различия в регенерационной активности стеблевых черенков ряда древесных растений в условиях засоления (NaCl) с установлением его селективных (10-40 мМ) и летальных (50-100 мМ) концентраций для разных объектов. Предложенный способ диагностики солеустойчивости, основанный на анализе их регенерационных процессов в условиях засоления, имеет преимущество при оценке массового материала и может быть рекомендован для экспресс-оценки ресурсных видов древесных растений.
Список литературы Лабораторный способ оценки солеустойчивости ресурсных видов древесных растений
- Алиева, З.М. Индивидуальность и солеустойчивость растений и органов (Экологические аспекты): монография/З.М. Алиева, А.Г. Юсуфов. -Махачкала: Изд-во ДГУ, 2013. 198 с.
- Гончарова, Э.А. Изучение устойчивости и адаптации культурных растений к абиотическим стрессам на базе мировой коллекции генетических ресурсов: Научное наследие профессора Г.В. Удовенко/Под ред. А.А. Жученко -СПб: ГНУ ВИР, 2011. 336 с.
- Дроздов, С.Н. Диагностика чувствительности растений к стрессовым факторам (методическое руководство)/С.Н. Дроздов, Г.В. Еремин, Э.Л. Климашевский. -М., 1988. 228 с.
- Ковда, В.А. Проблемы опустынивания и засоления почв аридных регионов мира. -М.: Наука, 2008. 415 с.
- Кузнецов, Вл.В. Пролин при стрессе: биологическая роль, метаболизм, регуляция/Вл.В. Кузнецов, Н.И. Шевякова//Физиология растений. 1999. Т. 46, №2. С. 321-336.
- Удовенко, Г.В. Принципы и приемы диагностики устойчивости растений к экстремальным факторам среды/Г.В. Удовенко, Э.А. Гончарова//Сельскохозяйственная биология. 1989. №1. С. 18-24.
- Удовенко, В.Г. Диагностика устойчивости растений к стрессовым воздействиям. Методическое руководство. -М., 1988. 227 с.
- Шамсутдинов, Н.З. Генетические ресурсы галофитов и биологические основы введения их в культуру в аридных районах России: автореф. дис. … д.б.н. -СПб, 2006. 43 с.
- Шахов, А.А. Солеустойчивость растений. -М.: Изд. АН СССР, 1956. 552 с.
- Abdel-Hamid, A.M.E. Physiological and Molecular Markers for salt Tolerance in Four Barley Cultivars//European Scientific Journal. 2014. Vol. 10. № 3. P. 252-272.
- Chanteele, S. Monitoring salt stress in grapevines: Are measurs of plant trait variability useful/S. Chanteele, A.A. Hoffman//J. Appl. Ecol. 2003. V.40. №5. Р. 928-937.
- Munns, R. Mechanisms of Salinity Tolerance/R. Munns, M. Tester//Annu. Rev. Plant Biol. 2008. V.59. P. 651-681.
- Prasad, M.N. Heavy metal stress in plants. From Biomolekules to Ecosystems. -Springer-Verlag, 2003. 462 p.


