Лапароскопическая радикальная простатэктомия с максимальным сохранением перипростатической анатомии… возможно ли?
Автор: Новиков А.Б., Галлямов Э.А., Кочкин А.Д., Биктимиров Р.Г., Сергеев В.П., Попов С.В., Орлов И.Н., Преснов К.С., Мещанкин И.В., Санжаров А.Е., Комаров М.И., Болгов Е.Н., Вольных И.Ю., Агапов М.А., Биктимиров Т.Р., Володин Д.И., Галлямов Э.Э.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 2 (42), 2020 года.
Бесплатный доступ
Основным принципом всех методик радикальной простатэктомии, направленных на улучшение функциональных результатов вмешательства является атравматичность выполнения операции, сохранение возможно большего объема анатомических, фасциальных и мышечных структур, а также максимальное сохранение перипростатической нервной сети. Однако, подавляющее количество данных разработок описано именно в робот-ассистированной хирургии, т.к. нестабильное оптическое поле и ригидные инструменты ограничивают применение традиционной лапароскопии в такой технически сложной операции. Что и послужило поводом к нашему исследованию.Проведён мультицентровый ретроспективный анализ результатов лечения 4025 больных, подвергнутых ЛРПЭ в период с 2010 по 2020 годы. Оценивали: объем кровопотери, интра- и послеоперационные осложнения, особенности хирургической техники, продолжительность операции и стационарного лечения больных, функциональные результаты в виде удержания мочи. Критериям включения соответствовали 714 пациентов в возрасте 62 лет (54-77) со средним объемом предстательной железы 42 см3 (19-163), средним уровнем исходного ПСА 9,3±7 нг/мл и ИМТ 32,7 кг/м2 (26-54). Описанная хирургическая техника, при приемлемых периоперационных показателях, позволила добиться полного контроля над удержанием мочи непосредственно после удаления катетера более чем у трети пациентов.На наш взгляд, по мере совершенствования хирургической техники и набора опыта, ЛРПЭ с сохранением перипростатической анатомии может стать методом выбора в лечении рака предстательной железы у тщательно отобранной категории пациентов.
Радикальная простатэктомия, лапароскопия, раннее удержание мочи, сохранение шейки, "фартук" детрузора, пубовезикальный комплекс
Короткий адрес: https://sciup.org/142226485
IDR: 142226485 | УДК: 616.65-002-089.87 | DOI: 10.38181/2223-2427-2020-2-23-35
Текст научной статьи Лапароскопическая радикальная простатэктомия с максимальным сохранением перипростатической анатомии… возможно ли?
Введение. Рак предстательной железы (РПЖ) является часто встречающимся злокачественными новообразованием, занимая в России 4-е место в контингенте онкологических больных, составляя 6,3% от общего числа злокачественных опухолей. В России в период с 2008 по 2018 годы заболеваемость РПЖ возросла на 100 человек на сто тысяч населения (с 60 до 162) [1,2]. В силу активного внедрения скрининговых методик, увеличивается частота ранней диагностики заболевания у пациентов молодого возраста [3,4]. В связи с этим качество жизни и функциональные послеоперационные показатели (удержание мочи и эректильная функция) приобретают ничуть не меньшее значение чем онкологическая адекватность вмешательства [5].
«Золотым стандартом» лечения локализованного РПЖ является простатэктомия. Оптимальными ее результатами является достижение «пентафекты»: радикальность операции с отрицательным хирургическим краем, отсутствие послеоперационных осложнений, полное удержание мочи и сохранение потенции [6, 8].
Достижения технического прогресса, в частности совершенствование оптических систем позволило хирургу более точно следовать анатомическим ориентирам, не являющимся очевидными во время открытой хирургии. Это и стало предпосылкой для выяснения аспектов перипростатической анатомии, в том числе фасциальных слоев, окружающих простату (Rassweiler и др., 2006), структуры нейроваскулярных пучков (Martınez, Pineiro, 2007), добавочной срамной артерии (Secin и др., 2007), строения уретрального сфинктера (Stolzenburg и др., 2007) [7].
Преимущества роботизированного метода, такие как 3D – визуализация с увеличением и инструменты с семью степенями свободы, позволили хирургу прецизионно манипулировать в анатомических пространствах, что и привело к разработке инновационных подходов в радикальной простатэктомии (РПЭ), улучшающих ее функциональные результаты. В последние годы описаны такие методики как: сохранение пубовезикального комплекса (Asimakopoulos и др., 2010, 2012), определение уровня нервосберегающей диссекции по анатомическим ориентирам (артерии или вене) за пределами капсулы простаты (Patel и др 2012; Pisipati и др, 2014), минимизация тракционной нейропатии и нейропраксии (Alemozaffar и др., 2012), расширенное нервосбережение «вуаль Афродиты» (Menon и др. 2002, Savera и др., 2006), доступ через Дугласово пространство, позволяющий выполнить РПЭ, без диссекции Ретциева пространства (Galfano и др. 2010) [8,9]. Каждый из этих приемов имеет свою точку приложения в достижении конечного результата (Таблица 1).
Вместе с тем, ряд авторов сообщает о средней частоте удержания мочи после удаления катетера около 70% [10]; однако, при детальном анализе раннего удержания (немедленно после удаления катетера), эта цифра оказывается значительно меньше и составляет 25.7% [11]. Что и служит мотивом для дальнейших исследований.
Сохранение пубовезикального комплекса (ПВК: «фартук» детрузора с пубовезикальными связками и дорзальным венозным комплексом) в сочетании с достаточной длиной уретры расценивается многими авторами как залог успеха в обеспечении раннего удержания мочи [12].
Кроме того, экономная диссекция шейки мочевого пузыря (ШМП), сохранение сопоставимых диаметров шейки и уретральной культи, уменьшают риск развития стриктуры [13], повреждения мочеточников [14], сокращают время формирования анастомоза, снижают вероятность его негерметичности из-за меньшей длины линии шва [15].
Таблица 1
Улучшение функциональных результатов: развитие хирургических приемов (Jacobs EF и др, 2013)
|
Результат |
Метод |
Год |
Авторы |
|
Удержание мочи |
Sling construсtion Bladder neck preservation Intraoperative cooling Pubovesical complex sparing |
1997 2002 2009 2011 |
Jorion Delivetios et al., Selli et al. Finley et al. Asimakopulos et al. |
|
Уретровезикальный анастомоз |
Posterior reconstruction Anterior reconstruction Double layer anastomosis Barbed suture |
2008 2009 2009 2011 |
Rocco et al. Patel et al. Menon et al., Sammon et.al., Sammon et.al., Kaushik et al. |
|
Сохранение сосудисто-нерных пучков |
NVB sparing Veil of Afphrodite Athermal dissection Tension free |
1991 2002 2007 2007 |
Quinlan et al. Catalona et al. Menon et al. Tewari et al., Ahlering et al. Kowalczyk et al. |
В идеальном представлении, РПЭ с полным сохранением перипростатической анатомии показана пациентам с клинически локализованным РПЖ (сT1c – сТ2а, Глисон <7, и уровнем простатспецифического антигена (ПСА) <10 нг/мл), заинтересованным в сохранении ЭФ. Эта операция обычно не предлагается пациентам с предоперационным дефицитом эректильной функции или не заинтересованым в сохранении потенции.
Основным принципом всех этих методик является атрав-матичность выполнения операции, сохранение возможно большего объема фасциальных и мышечных структур для достижения ранней континенции мочи и максимального сохранения перипростатической нервной сети для обеспечения ЭФ. Однако, подавляющее количество данных разработок описано именно в робот-ассистированной хирургии, т.к. нестабильное оптическое поле и ригидные инструменты ограничивают применение традиционной лапароскопии в такой технически сложной операции [10].
Ведущие зарубежные эксперты в роботической урологии подвергают сомнению техническую возможность реализации вышеуказанных приемов традиционным лапароскопическим доступом. Оценка справедливости этого суждения и явилась целью нашего исследования. Первоначальные данные были опубликованы ранее [16]. В настоящей работе приводятся и отработанный алгоритм техники операции и результаты уже десятилетнего опыта подобных вмешательств.
Материалы и методы. Проведён мультицентровый ретроспективный анализ результатов лечения 4025 больных, подвергнутых ЛРПЭ в период 2010 – 2020 годов. Критерии включения: больные РПЖ низкого или промежуточного риска, без признаков местной распространенности опухоли по данным предоперационного обследования, перенесшие ЛРПЭ с максимально возможным сохранением перипро- статической анатомии. Критерии исключения: предшествующие гормонотерапия, лучевая терапия, hi-fu, перенесенные операции на ПЖ (ТУР, аденомэктомия). Ограничений по возрасту, массе тела, объему ПЖ не было.
Предоперационное обследование включало стандартный лабораторный комплекс, УЗИ, мультипараметрическую МРТ малого таза. Всем пациентам проведена оценка соматического статуса, ИМТ, коррекция сопутствующей патологии (сосудистые заболевания, сахарный диабет, неврологические заболевания), рентгенография органов грудной клетки. Период ожидания после биопсии простаты составлял 2 месяца (для регресса перипростатического воспаления и геморрагической реакции).
Оценивали: объем кровопотери, интра- и послеоперационные осложнения, особенности хирургической техники, продолжительность операции и стационарного лечения больных, функциональные результаты в виде удержания мочи. Последнее - при помощи pad-test.
Хирургическая техника
Укладка пациента - положение Тренделенбурга с уклоном 10 - 15 градусов. Выполняем стандартный экстрапери-тонеальный доступ с использованием баллона – спейсмей-кера. Обычно применяется 1 оптический (10 мм) и 4 рабочих троакара. Порт для камеры располагается по средней линии, ниже пупка. 2 порта 5 мм – параректально на уровне или чуть ниже оптического порта справа и слева (в зависимости от конституции пациента), латеральные порты (5 и 12 мм) – справа и слева на уровне и на 2 поперечных пальца медиальнее передней верхней ости подвздошных костей [17].
Выполняется окончательная диссекция Ретциева пространства до внутритазовой фасции. Удаляется жировая клетчатка с передней поверхности простаты. Внутрита-зовая фасция не вскрывается. Лоцируется шейка мочевого пузыря (ШМП). Низкоамплитудная дробная тракция за уретральный катетер с баллоном, наполненным на 20 мл, позволяет более четко контурировать ШМП, что упрощает этот этап. Мы выполняем диссекцию попеременно справа и слева, ориентируясь на слой между детрузором и основанием предстательной железы, медиальнее пубо-везикальных связок (Рис. 1).
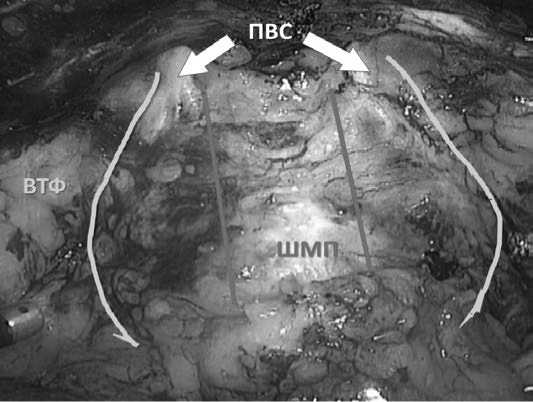
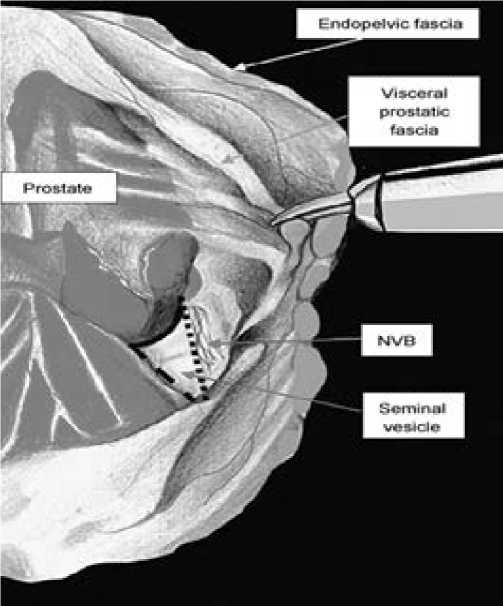
Рис. 2. Треугольное пространство справа, образованное основанием простаты, шейкой МП, правым сосудисто-нервным пучком, ограниченное снизу правым семенным пузырьком. Схема Asimakopoulos et al. 2010
Рис. 1. Треугольное пространство слева
ШМП – шейка мочевого пузыря П – предстательная железа СНП – сосудисто-нервный пучок
Далее разрабатываем эту плоскость в глубину, достигая листка фасции Денонвилье, покрывающей переднюю поверхность семенных пузырьков. В данном слое встречаются единичные крупные артериальные ветви к основанию простаты, которые клипируются (Hem-o-loc), а при отсутствии необходимости нервосбережения – коагулируются (Harmonic, Ligasure) и пересекаются. По завершению данного этапа билатерально создаются треугольные пространства, образованные основанием предстательной железы, боковыми полуокружностями шейки мочевого пузыря, сосудистонервными пучками, ограниченные снизу семенными пузырьками (Рис. 2, 3).
Таким образом, данный прием является не только мобилизацией латеральных границ шейки мочевого пузыря, но и отправной точкой для продолжения нервосбережения, облегчая последующие шаги.
Следующим этапом, в отличие от роботической методики, простата отсекается от сохраненной шейки мочевого пузыря. Мы прибегаем к этому для расширения пространства и возможности хирургического маневра, а также для уменьшения тракционного воздействия на сохраняемые структуры (Рис. 4).
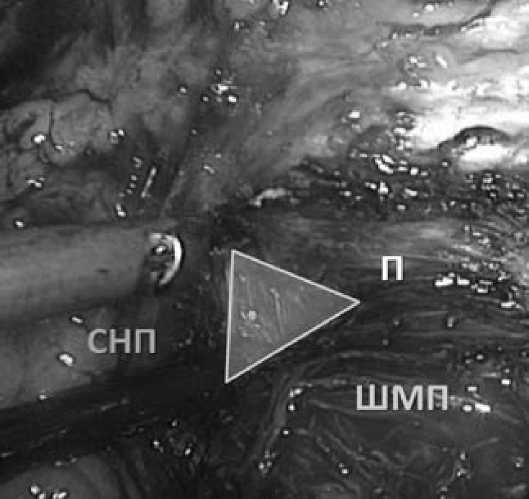
Рис. 3. Треугольное пространство слева ШМП – шейка мочевого пузыря П – предстательная железа
СНП – сосудисто-нервный пучок
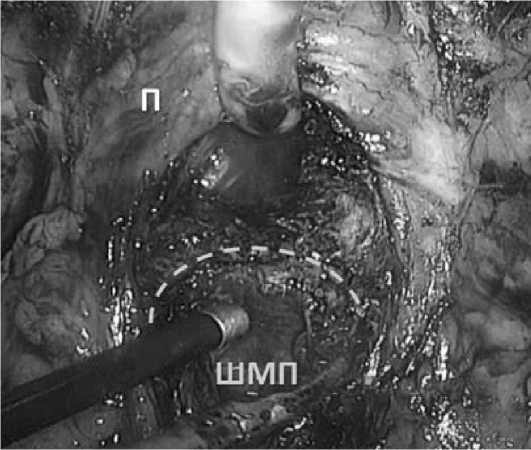
Рис. 4. Диссекция шейки мочевого пузыря. Пунктиром указана отсеченная задняя полуокружность.
ШМП – шейка мочевого пузыря П – предстательная железа
Важно, что латеральная диссекция дает возможность идентификации боковых и нижней границ шейки МП до ее вскрытия, что помогает избежать неправильных слоев рассечения (например, между узлом гиперплазии и капсулой ПЖ, как это часто происходит при переднем доступе). Кроме того, латеральный подход, очень хорош в случаях с большой средней долей. В этой ситуации боковой разрез от задней губы ШМП осуществляется без риска отсечения части ткани ПЖ или травмы устьев мочеточников.
Учитывая низкий риск распространенности заболевания на дистальную часть семенных пузырьков у исследуемой группы, в ряде случаев мы используем технику с их резекцией, не удаляя полностью. Артерии семенных пузырьков, семявыносящие протоки клипируем и пересекаем (Рис. 5).
Данный этап операции производится атермально с минимальным тракционным воздействием на сохраняемые структуры.
Следом выполняется диссекция по задней поверхности ПЖ. Это производится смещением фасции Денонвилье книзу (Рис. 6).
По окончанию этого этапа мы видим трапецевидное пространство, ограниченное сверху нижней поверхностью ПЖ, с боков – СНП, cнизу – фасцией Денонвилье, покрывающей параректальную клетчатку.
Далее выполняется тупая диссекция в слое между висцеральной простатической фасцией и капсулой простаты. Кровотечение из мелких сосудов в данной зоне останавливаем клипированием или точечной биполярной коагуляцией. Сосудисто-нервные пучки аккуратно отслаиваются с боковых поверхностей простаты (Рис. 7).
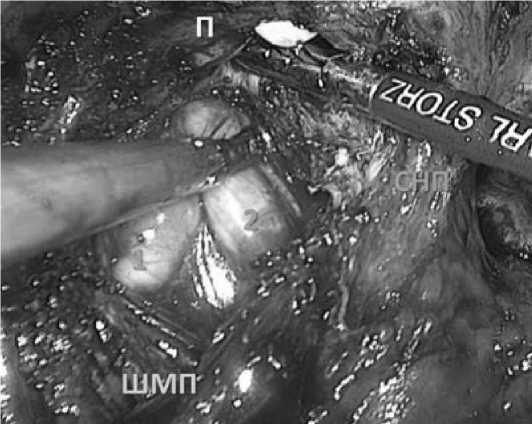
Рис. 5. Выделение семявыносящих протоков (1 и 2).
ШМП – шейка мочевого пузыря П – предстательная железа СНП – сосудисто-нервный пучок
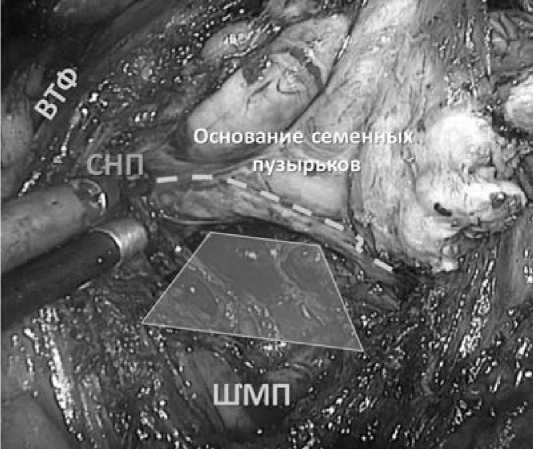
Рис. 6. Диссекция по задней поверхности ПЖ. Пунктиром указан слой смещения фасции Денонвилье.
ВТФ - внутритазовая фасция
ШМП – шейка мочевого пузыря СНП – сосудисто-нервный пучок
Этот «латеральный доступ» позволяет достичь широкого обзора плана диссекции и учесть изгиб, а также изменение направления СНП, зависящие от объема ПЖ [18]. После первоначального выделения средней части СНП, продолжаем его диссекцию в 2-х направлениях: краниально, к основанию ПЖ до достижения основания семенных пузырьков, а затем каудально к апикальной части. Большое внимание уделяем дозированной трак- ции, избегая повреждения капсулы ПЖ и травматиза-ции СНП. Сосуды «ножек» простаты пересекаются после клипирования / коагуляции (Рис. 8).
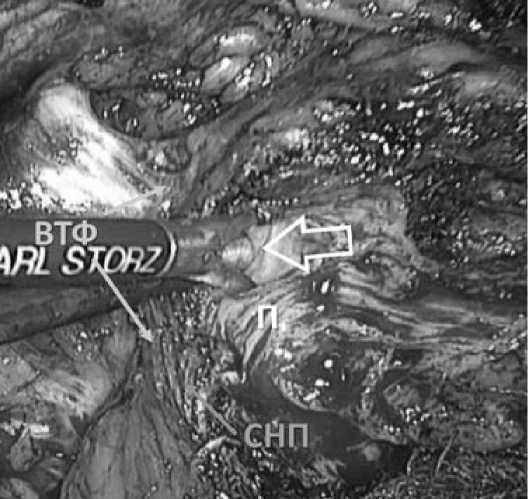
Рис. 7. Диссекция СНП слева. Стрелкой указан слой между висцеральной простатической фасцией и капсулой простаты.
ВТФ - внутритазовая фасция П – предстательная железа СНП – сосудисто-нервный пучок
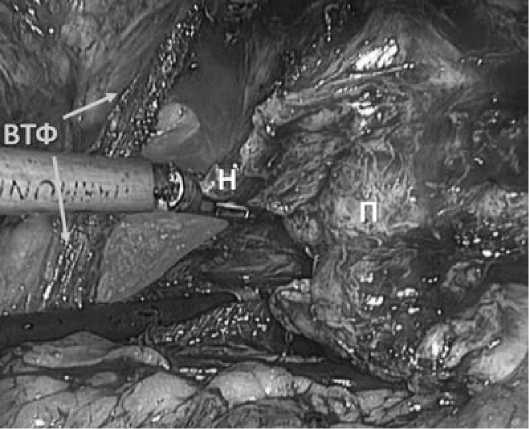
Рис. 8. Коагуляция и пересечение левой «ножки» простаты ультразвуковым диссектором. Цветным полем выделена основная её часть.
П – предстательная железа
Н – часть «ножки»
ВТФ – внутритазовая фасция
Дальнейший этап - апикальная диссекция с сохранением части «фартука» детрузора и пубовезикального комплекса
(ПВК). Ткань, покрывающая ПЖ по передней поверхности, представляет собой продолжение передней стенки мочевого пузыря - «фартук» детрузора (ФД) [19,20]. Возможна тракция атравматичным зажимом за эту ткань. ФД поперечно рассекается на протяжении 1 см между передней полуокружностью шейки мочевого пузыря и передней поверхностью ПЖ. Это дает возможность открыть аваскулярный слой, следуя которому можно отсепаровывать ФД с пубовезикаль-ными связками и крупными венами дорзального комплекса от передней поверхности ПЖ (Рис. 9).
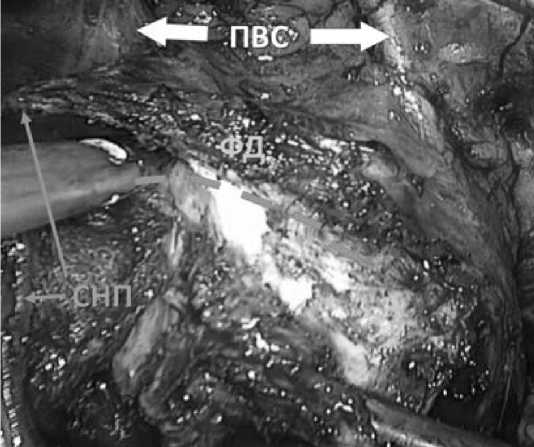
Рис. 9. Апикальная диссекция. Пунктиром указан аваскулярный слой. П – предстательная железа
СНП – сосудисто-нервный пучок ПВС – пубовезикальные связки ФД – часть «фартука» детрузора
Затем пересекаем уретру «холодными» ножницами (Рис. 10).
Уретровезикальный анастомоз выполняется непрерывным швом, начиная с 4-х часов условного циферблата. Мы используем Вилок 3.0, кривизна иглы 5/8, длина нити 15 или 23 см. На данном этапе, сохраненный ПВК создает неудобства для формирования анастомоза, поэтому мы прибегаем к бережной тракции за него. Техника шва в этой ситуации требует экспертных навыков, умения бимануального шитья разнообразными хватами иглы. Учитывая не нарушенную целостность парапростатической анатомии, в частности фасциально – связочного аппарата, задняя реконструкция при формировании анастомоза не требуется. Передняя реконструкция представляет собой восстановление целостности переcеченной части ФД. (Рис. 11).
Завершающим этапом вмешательства являются проверка герметичности анастомоза (наполнением мочевого пузыря до 150 мл) и дренирование зоны операции (Рис. 12).
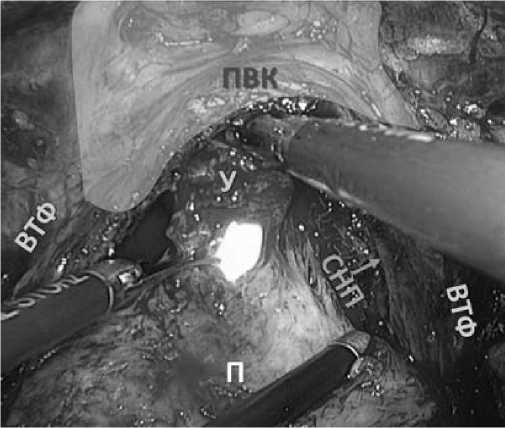
Рис. 10. Пересечение уретры. Цветным полем выделена часть пубовезикального комплекса (ПВК). П – предстательная железа. СНП – правый сосудисто - нервный пучок. ВТФ – внутритазовая фасция. У – уретра
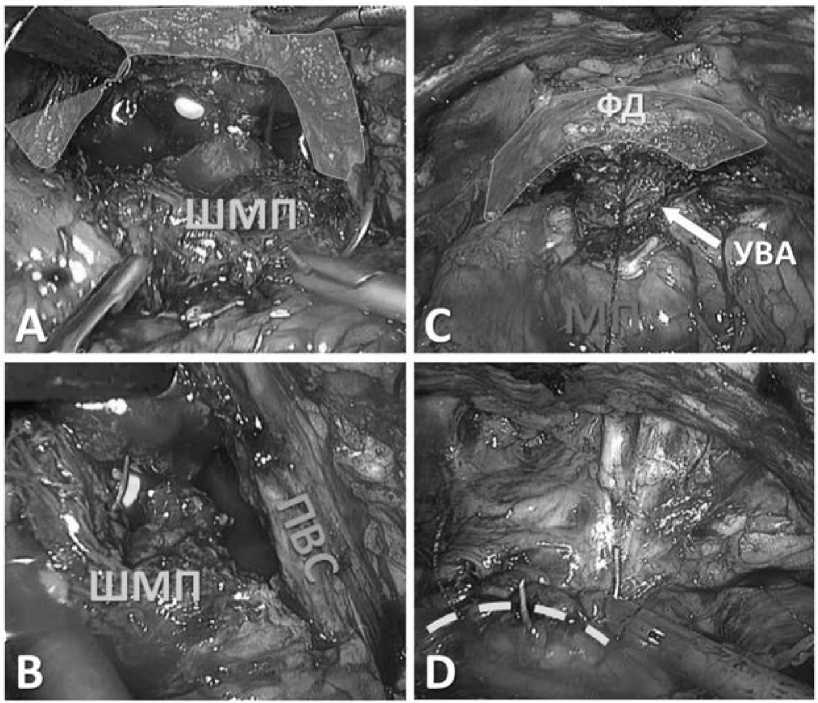
Рис. 11. Уретровезикальный анастомоз (УВА). А – формирование задней полуокружности. В – формирование передней полуокружности. С – финальный вид УВА. D – ушивание ПВК
Цветным полем выделена часть пубовезикального комплекса (ПВК). У – уретра. ШМП – шейка мочевого пузыря. ПВС – правая пубовезикальная связка. ФД – «фартук» детрузора.МП – мочевой пузырь
Пунктиром обозначена линия шва ПВК
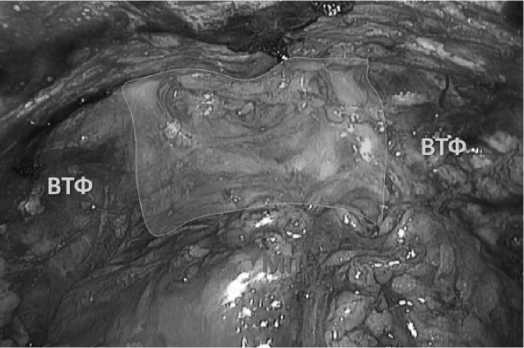
Рис. 12. Финальный вид. Цветным полем выделен пубовезикальный комплекс (ПВК).
МП – мочевой пузырь
ВТФ – внутритазовая фасция
В послеоперационном периоде все пациенты активизированы в первые сутки, наркотические анальгетики не применялись. Дренаж удаляли по мере уменьшения количества отделяемого менее 50 мл.
Удаление уретрального катетера производилось на 5-7 сутки послеоперационного периода. Всем пациентам перед удалением катетера выполнялась цистография с наполнением мочевого пузыря до 150 мл. При выявлении экстравазации контрастного вещества срок катетеризации увеличивался на 5 дней с повтором цистографии.
Результаты
Критериям включения соответствовали 714 пациентов в возрасте 62 лет (54-77) со средним объемом предстательной железы 42 см3 (19-163), средним уровнем исходного ПСА 9,3±7 нг/мл и ИМТ 32,7 кг/м2 (26-54). Распределение больных по клинической стадии заболевания: Т1 – 224 пациента, Т2 – 490. Из них только 308 (43,1%) выполнена операция с атермальным сохранением сосудисто-нервных пучков, т.к. остальные больные не были заинтересованы в сохранении эректильной функции. Летальности и конверсий не было. Основные показатели представлены в Таблице 2.
Учитывая неоднородность группы исследования по характеристикам ЭФ, детальный анализ её восстановления не проводился.
Полное удержание мочи в первые часы после удаления уретрального катетера отмечено у 273 больных (38,2%). Еще 302 (42,3%) пациента отмечали капельное подтекание мочи при кашле, переходе в ортостатическое положение, используя 1 прокладку в сутки. 64 (8,9%) больных - 2 прокладки. 75 (10,5%) пациентов использовали 3 и более прокладок.
Несмотря на тщательную и многостороннюю предоперационную диагностику по результатам послеоперационного патоморфологического исследования в 16,9% случаев
(121 пациент) стадия заболевания возросла до местнораспространенной (Т3а – Т3b). У этих пациентов также чаще диагностирован ПХК.
Таблица 2
Основные показатели пери- и послеоперационного периода
|
Время операции, мин |
155,3 (58-250) |
|
Кровопотеря, мл |
187,2 (100 – 1250) |
|
Срок дренирования зоны операции более 48 часов, n (%) |
25 (3,5) |
|
Длительность катетеризации мочевого пузыря, cут |
7,4 (5-28) |
|
Удержание мочи в первые 24 часа после удаления катетера, n (%) |
273 (38,2) |
|
Стадия «p» |
Т1-2 – 593 (83%) Т3а-b – 121 (17%) |
|
Позитивный хирургический край, n (%) |
69 (9,7) |
|
Послеоперационный койко-день |
8,1 (6 - 12) |
Величины, представленные в таблице – среднеарифметические, данные в скобках – минимальное и максимальное значения.
Послеоперационных осложнений Clavien ≥ III в нашей серии зафиксировано не было. 9 (1,3%) пациентов потребовали антибактериальной терапии по поводу обострения пиелонефрита. У 6 (0,84%) больных возникла необходимость длительной катетеризации мочевого пузыря по поводу негерметичности уретровезикального анастомоза (максимальный срок катетеризации – 28 дней).
Обсуждение. Современные представления об анатомии простаты и окружающих её тканей находят отражение в хирургической технике. Основываясь на понимании анатомических деталей и возможных индивидуальных вариаций, хирург получает возможность избрать тот план диссекции, который позволит добиться оптимальных как онкологических, так и функциональных результатов [21]. Сегодня РП уже не является трафаретным вмешательством, а должна стать индивидуализированной операцией, проводимой с учётом множества нюансов и деталей.
Роботизированная платформа в силу лучшего обзора и технических возможностей манипуляторов позволяет хирургу следовать фасциальным слоям, что очень трудно достижимо в процессе классической открытой операции и, следовательно, увеличивает возможность полного соблюдения перипростатической анатомии, что обеспечивает, согласно последним данным авторов, наличие меньшего количества осложнений и улучшение функциональных исходов [9]. Тем не менее, ряд авторов указывает о технической возможности выполнения подобных вмешательств и с применением традиционной лапароскопической техники [22, 23].
Ставшие стандартными операции с сохранением пубо-простатических связок – методика, не учитывающая их структурную связь с мочевым пузырем [19, 20]. Как следствие, происходит прерывание этой целостности с целью выделения уретропростатического сегмента. Когда хирурги заявляют, что они не пересекают эти связки, имеется в виду, их сохранение на стыке с лоном [12, 19, 20], а не сохранение ПВК.
Цель переднего рассечения в описанной выше методике – сохранение анатомической структуры, которая поддерживает наружный сфинктер уретры и сохраняет ее в физиологическом положении в малом тазу.
Традиционным доступом в открытой хирургии, позволяющим «вылущить» простату из-под вышележащего ФД и ДВК является промежностный [24]. В исследованиях европейских авторов показано, что ПВК может быть сохранен и при РАРПЭ [12, 15, 19]. При этом не нужны дополнительные маневры необходимые для фронтальной стабилизации сфинктера уретры [25, 26]. Кроме того, сохраняя ДВК, удается избежать недостатков, свойственных как селективным, так и стандартным техникам лигирования [12].
Передне - латеральный подход к шейке мочевого пузыря является ключевым моментом правильного начала диссекции, требует опыта для безопасного выполнения.
Тщательный отбор пациентов и детальное обследование необходимы для выявления группы с низким риском и как следствие для благоприятного онкологического исхода. Мультипараметрическая МРТ обеспечивает полную визуализацию всей ПЖ, включая сложные для визуализации передние отделы [4, 27]. Тем не менее, в нашей группе в 16,9% случаев отмечено повышение стадии с сТ1-2 до рТ3. Авторами, проведшими анализ РАРПЭ, получены схожие морфологические результаты и данные ПХК при более строгих критериях отбора [12, 15]. Одним из факторов, ограничивающих использование описанной методики является локализации опухоли в передних и апикальных отделах простаты.
Сохранение шейки мочевого пузыря благоприятно влияет на удержание мочи в послеоперационном периоде, однако увеличивает риск ПХК в основании предстательной железы [28]. В нашей серии общий показатель ПХК соответствует данным литературы [12, 23].
Большое значение имеет правильная идентификация и разработка аваскулярного слоя между ФД и передней поверхностью простатоуретрального сегмента под ДВК. При малых размерах ПЖ этот слой короче, и, следовательно, ДВК, сфинктер уретры и СНП могут быть легко повреждены. При большом объеме ПЖ, ФД оказывается тоньше и более распластанным по простате, а значит, его мобилизация - более сложный маневр и может потребовать большей протяженности поперечного рассечения и увеличивает время вмешательства.
В следствие ограниченности пространства, формирование уретровезикального анастомоза под сохраненным ПВК представляет собой сложную задачу по сравнению с анастомозом при методике «широкого иссечения». Применение дозированной тракции за ФД облегчает наложение швов.
В нашем исследовании низкий эректильный статус и/или нежелание пациентов сберечь потенцию не являлись критерием исключения. Им выполнялось вмешательство по той же описанной схеме, но с применением хирургических энергий (ультразвук, биполяр). Подобная техника, при приемлемых периоперационных показателях, позволила добиться полного контроля над удержанием мочи непосредственно после удаления катетера более чем у трети пациентов вне зависимости от способа обработки СНП.
Выводы. Выполнение радикальной простатэктомии с сохранением перипростатической анатомии лапароскопическим доступом технически возможно и безопасно. Однако, требует от хирургической бригады командной работы с высоким уровнем содружественности в манипуляциях, опыта ЛРПЭ в «более простых» модификациях, детального знания и видения анатомии ПЖ и малого таза, а также экспертных мануальных навыков.
Сбережение не только сосудисто-нервных пучков, но и пубовезикального комплекса, внутритазовой фасции, а также шейки мочевого пузыря и является целевым полным сохранением перипростатической анатомии.
Объём проведённого исследования пока не позволяет сделать однозначные выводы. Кроме того, использование приёмов с возможным синергическим влиянием на функциональные результаты (сохранение шейки мочевого пузыря, фасциально - связочного аппарата, резекция семенных пузырьков, расширенное нервосбережение) затрудняет объективную оценку влияния каждого из них. Последнее требует дополнительного исследования. Тем не менее, на наш взгляд, по мере совершенствования хирургической техники и набора опыта, описанный способ ЛРПЭ может стать методом выбора в лечении РПЖ у тщательно отобранной категории пациентов.
Список литературы Лапароскопическая радикальная простатэктомия с максимальным сохранением перипростатической анатомии… возможно ли?
- Состояние онкологический помощи населению России в 2018 году / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. - М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2019 г. - 236 с.
- Аполихин, О. И. и др. Состояние и прогнозы заболеваемостивзрослого населения Нижегородской области болезнями мочеполовой системы //Экспериментальная и клиническая урология. - 2012. - №. 4. - С. 4-7.
- Попов С.В. и др. Прогностическое значение простатоспецифического антигена при определении показаний к первичной биопсии предстательной железы. Урология. 2018;3:92-97. DOI: 10.18565/urology.2018.3.92-97
- Попов С.В. и др. Место магнитно-резонансной трактографии в диагностике рака предстательной железы. Первый российский опыт. Экспериментальная и клиническая урология 2019;(3):54-58. DOI: 10.29188/2222-8543-2019-11-3-54-58
- Кочкин А. Д. и др. Эндоскопическая экстраперитонеальная радикальная простатэктомия после различных биполярных трансуретральных вмешательств у больных с ожирением // Эндоскопическая хирургия. - 2013. - Т. 19. - №. 6. - С. 23-26.
- Раснер П.И., Котенко Д.В., Колонтарев К.Б., Пушкарь Д.Ю. Сравнительный анализ функциональных результатов радикальной позадилонной и робот-ассистированной простатэктомии у больных локализованным раком предстательной железы. Экспериментальная и клиническая урология. 2014. №4.
- Хирургическая анатомия простаты: учебное пособие / под ред. А.Д. Кочкина. - Н. Новгород: издательство Нижегородской государственной медицинской академии, 2017. -72с., ил. 978-57032-1205-9.
- ISBN: 9785703212059
- Patel VR., Sivaraman A., Coelho RF., Chauhan S., Palmer KJ., Orvieto MA., Camacho I., Coughlin G., Rocco B. Pentafecta: A new concept for reporting outcomes of robot-assisted laparoscopic radical prostatectomy. Eur Urol. 2011. 59:5; 702-707.
- Asimakopoulos A., Miano R., Galfano A., Bocciardi M., Vespasiani G., Spera E., Gaston R. Retzius-Sparing Robot-Assisted Laparoscopic Radical Prostatectomy: Critical Appraisal of the Anatomic Landmarks for a Complete Intrafascial Approach. Clinical Anatomy. 2015. 28:896 - 902.
- Ficarra V., Novara G., Fracalanza S., et al. Aprospective, nonrandomized trial comparing robot-assisted laparoscopic and retropubic radical prostatectomy in one European institution. BJU Int. 2009. 104: 534 - 9.
- Coelho RF., Chauhan H., Palmer KJ., Rocco B., Patel MB., Patel VR. Robotic-assisted radical рrostatectomy: a review of current outcomes. BJU Int. 2009. 104:1428 - 35.
- Asimakopoulos A., Annino F., D'Orazio A., Fraga C., Pereira T., Mugnier C., Hoepffner J-L., Piechaud T., Gaston R. Complete Periprostatic Anatomy Preservation During Robot-Assisted Laparoscopic Radical Prostatectomy (RALP): The New Pubovesical Complex-Sparing Technique. European Urology. 2010. 58: 407 - 417.
- Licht MR., Klein EA., Tuason L., Levin H. Impact of bladder neck preservation during radical prostatectomy on continence and cancer control. Urology. 1994. 44: 883 - 7.
- Jenkins LC., Nogueira M., Wilding GE et al. Median lobe in robotassisted radical prostatectomy: evaluation and management. Urology. 2008. 71:810 - 3.
- AsimakopoulosA., Mugnier C., Hoepffner J-L., Piechaud T., Gaston R. Bladder neck preservation during minimally invasive radical prostatectomy: a standardised technique using a lateral approach. BJU Int. 2012. 110: 1566 - 1571.
- Кочкин А.Д. и др. Лапароскопическая радикальная простатэктомия и максимальное сохранение перипростатической анатомии. Вопросы урологии и андрологии. 2017; 5(1): 34-38.
- DOI: 10.20953/2307-6631-2017-1-34-38
- Луцевич О.Э., Галлямов Э.А., Забродина Н.Б., Преснов К.С., Новиков А.Б. Использование лапароскопического и внебрюшинного доступа при эндовидеохирургической радикальной простатэктомии: анализ 300 случаев // Эндохирургия сегодня. - 2012 - № 2 - С. 33-41.
- Kessler TM., Burkhard FC., Studer UE. Nerve-sparing open radical retropubic prostatectomy. Eur Urol. 2007. 51:90 - 7.
- Myers RP. Detrusor apron, associated vascular plexus, and avascular plane: relevance to radical retropubic prostatectomy-anatomic and surgical commentary. Urology. 2002. 59:472 - 9.
- Watz J., Burnett AL., Costello AJ et al. A critical analysis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection in candidates for radical prostatectomy. Eur Urol. 2010. 57:179 - 92.
- Walz J., Epstein J., Ganzer R., Graefen M., Guazzoni G., Kaouk J., Menon M., Mottrie A., Myers R., Patel V., Tewari A., Villers A., Artibani W. A Critical Analysis of the Current Knowledge of Surgical Anatomy of the Prostate Related to Optimisation of Cancer Control and Preservation of Continence and Erection in Candidates for Radical Prostatectomy: An Update. Eur Urol. 2016. 6626;1- 11
- Stolzenburg JU., Liatsikos EN., Rabenalt R. et al. Nerve sparing endoscopic extraperitoneal radical prostatectomy - effect of puboprostatic ligament preservation on early continence and positive margins. Eur Urol. 2006. 49:103 - 12.
- Stolzenburg JU., Kallidonis P., Do M., et al. A comparison of outcomes for interfascial and intrafascial nerve-sparing radical prostatectomy. Urology. 2010. 76:743 - 8.
- Wimpissinger TF., Tschabitscher M., Feichtinger H., Stackl W. Surgical anatomy of the puboprostatic complex with special reference to radical perineal prostatectomy. BJU Int. 2003. 92:681 - 4.
- Patel VR., Coelho RF., Palmer KJ., Rocco B. Periurethral suspension stitch during robot-assisted laparoscopic radical prostatectomy: description of the technique and continence outcomes. Eur Urol. 2009. 56: 472 - 8.
- Papatsoris A., Mandron E. Anterior suspension of the dorsal vein complex and fixation of the anterior fibromuscular stroma during laparoscopic prostatectomy for facilitating early continence. BJU Int. 2009. 104:1542 - 6.
- Villers A., Lemaitre L., Haffner J., Puech P. Current status of MRI for the diagnosis, staging and prognosis of prostate cancer: implications for focal therapy and active surveillance. Curr Opin Urol. 2009. 19:274 - 82.
- Katz R., Salomon L., Hoznek A., de la Taille A., Antiphon P., Abbou CC. Positive surgical margins in laparoscopic radical prostatectomy: the impact of apical dissection, bladder neck remodeling and nerve preservation. J Urol. 2003. 169:2049 - 52.


