Лапароскопическая резекция почки в условиях холодовой ишемии при сложной опухоли (Renal Score-11): клинический случай в условиях одного института
Автор: Гаас М.Я., Каприн А.Д., Воробьев Н.В., Иноземцев Р.О., Рерберг А.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Актуальность. Золотым стандартом лечения почечно-клеточного рака (ПКР) являются резекция почки или нефрэктомия в зависимости от стадии или локализации образования. Сохранение функции органа имеет большое значение для пациентов с локализованными опухолями, особенно при наличии единственной почки, предшествующей хронической болезни почек (ХБП), протеинурии или множественных/билате-ральных образований. Важной целью резекции почки является сохранение функциональной активности органа, однако данная операция в любом случае приводит к ее снижению вследствие потери массы васкуляризированных нефронов и необратимого ишемического повреждения. Описание клинического случая. Представлен клинический случай пациентки 24 лет с диагнозом: Рак правой почки cT1bN0M0, I стадия. По данным МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием выявлено опухолевое образование правой почки, вдающееся в синус почки и вызывающее пиелокаликоэктазию. В связи со сложным анатомическим расположением опухоли, предполагающим длительное время ишемии почки, была выполнена лапароскопическая резекция правой почки в условиях селективной «внутриартериальной» холодовой ишемии по методике, разработанной в МНИОИ им. П.А. Герцена, которая была запатентована. Заключение. Холодовая артериальная перфузия имеет ряд преимуществ. Во-первых, она позволяет добиться быстрого снижения температуры почечной паренхимы до 25 °С, что обеспечивает более комфортную и быструю резекцию почки и ушивание дефекта. Во-вторых, она исключает обратный венозный ток крови благодаря положительному перфузионному давлению в собирательной системе. В-третьих, она не влияет на экспозицию интраоперационной картины, т. к. не предполагает наличие в рабочей зоне дополнительных объектов (например, лед или зажимы). Согласно данным литературы, в наиболее сложных случаях (резекция единственной почки, опухоль большого диаметра, высокий показатель по шкале R.E.N.A.L.) гипотермия является методом выбора.
Почечно-клеточный рак, селективная
Короткий адрес: https://sciup.org/140302024
IDR: 140302024 | УДК: 616.61-006.6-089 | DOI: 10.21294/1814-4861-2023-22-4-84-93
Текст научной статьи Лапароскопическая резекция почки в условиях холодовой ишемии при сложной опухоли (Renal Score-11): клинический случай в условиях одного института
Золотым стандартом лечения ПКР являются резекция почки (РП) или нефрэктомия в зависимости от стадии или локализации образования. Выполнение резекции почки, в отличие от нефрэктомии, не оказывает резко негативного влияния на функциональное состояние почек в послеоперационном периоде, однако стоит отметить, что существенной разницы в показателях общей выживаемости или частоте сердечно-сосудистых осложнений у пациентов, перенесших резекцию почки и нефрэктомию, не выявлено [1].
Сохранение функции почек после РП имеет большое значение для пациентов с локализованными опухолями, особенно при наличии единственной почки, предшествующей ХБП, протеинурии [2] или множественных/билатеральных образований. Хотя важной целью РП является сохранение функционального состояния почек, данная операция в любом случае приводит к его ухудшению вследствие потери массы васкуляризи- рованных нефронов и необратимого ишемического повреждения. В настоящее время в большинстве исследований сообщается о 10 % снижении СКФ при РП в условиях тепловой ишемии у пациентов со здоровой контралатеральной почкой [3–5].
Клинический случай
Пациентка А., 24 лет, обратилась в поликлинику по месту жительства по поводу панических атак, приступов тахикардии и головокружения. Семейный анамнез отягощен: рак яичников у тети по материнской линии. При обследовании кардиологической и неврологической патологий не обнаружено. При МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием в средней трети правой почки выявлено опухолевое двухузловое образование (верхний узел – 27×29 мм, нижний – 29×25 мм), активно накапливающее контраст, вдающееся в синус почки, раздвигающее чашечки средней и верхней групп; ЧЛС правой почки расширена, де- формирована (лоханка до 22 мм, чашечки до 11 мм) (рис. 1). По данным МРТ органов забрюшинного пространства с внутривенным контрастированием в соответствии с сигнальными характеристиками, типом контрастирования – высокая вероятность лимфомы почки (дифференциальный диагноз с онкоцитомой) (рис. 2).
С результатами обследования пациентка обратилась за консультацией в МНИОИ им. П.А. Герцена. На момент обращения предъявляла жалобы на периодически возникающую одышку, тахикардию, слабость при физической нагрузке. При комплексном обследовании установлен клинический диагноз: рак правой почки cT1bN0M0, стадия I (шкала R.E.N.A.L.: 2+3+3+3=11 баллов). По данным динамической нефросцинтиграфии – умеренное снижение накопления и неравномерное распределение радиофармпрепарата в паренхиме правой почки, замедление его оттока из ЧЛС. Т максимального накопления – 3 мин 40 сек, Т полувыведения – 18 мин 39 сек. Перфузионный индекс – 49 %. Уровень креатинина – 67 мкмоль/л, СКФ по формуле CKD-EPI – 111 мл/мин/1,73 м2.
С учетом неоднозначности данных инструментального обследования относительно злокачественности опухолевого процесса предпринята попытка биопсии образования правой почки, которая оказалась невозможной из-за интраси-нусного расположения опухоли и ее интимного прилежания к анатомически важным структурам (ЧЛС, сосуды почки). С учетом молодого возраста пациентки, отсутствия убедительных данных о злокачественности опухолевого процесса, отсутствия в анамнезе ранее перенесенных хирургических вмешательств и прочих противопоказаний было предложено хирургическое лечение в объеме лапароскопической резекции правой почки. В целях предоперационного планирования на основании данных МСКТ выполнено 3D-моделирование (рис. 3). В связи со сложным анатомическим расположением опухоли, предполагающим длительную ише-
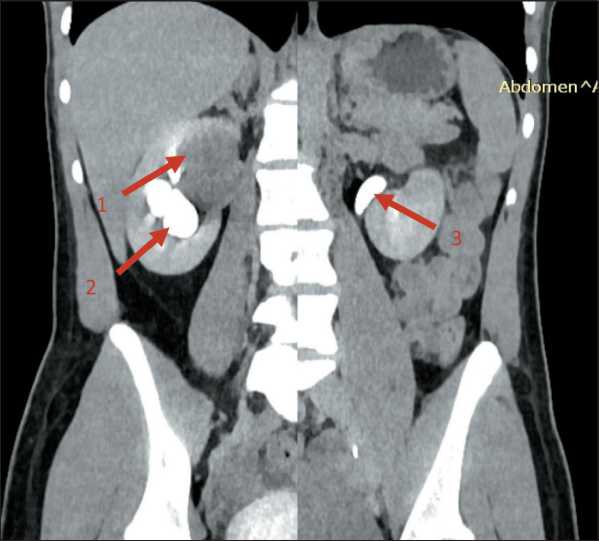
Рис. 1. Предоперационная МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием: 1 – опухоль правой почки; 2 – нарушение оттока контрастного препарата; 3 – нормальный пассаж контрастного препарата
Fig. 1. Preoperative abdominal and retroperitoneal MSCT with intravenous contrast: 1 – tumor of the right kidney; 2 – violation of the outflow of contrast; 3 – normal passage of contrast мию почки, решено выполнить пособие в условиях селективной «внутриартериальной» холодовой ишемии по методике, разработанной в МНИОИ им. П.А. Герцена, которая была запатентована (Патент РФ № 2793505 от 04.04.23) [6].
В условиях эндотрахеального наркоза в положении лежа на спине с отведенной левой рукой на 90°, на уровне верхней трети плеча под ультразвуковым контролем больной выполнена пункция левой плечевой артерии по Сельдингеру, в левую плечевую артерию установлен гидрофильный интродьюсер диаметром 7 Fr (2,3 мм), длиной 11 см. Через ин-тродьюсер проведен диагностический катетер Cobra диаметром 7 Fr, длиной 110 см, внутренний
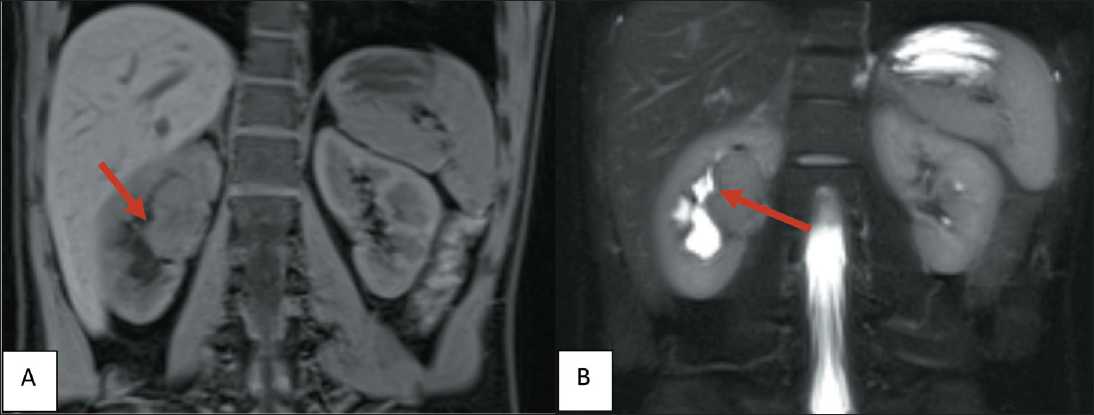
Рис. 2. МРТ органов забрюшинного пространства с внутривенным контрастированием: А – Т1-взвешенное изображение;
В – Т2 – взвешенное изображение
Fig. 2. MRI of retroperitoneal organs with intravenous contrast: A – T1-weighted image; B – T2-weighted image
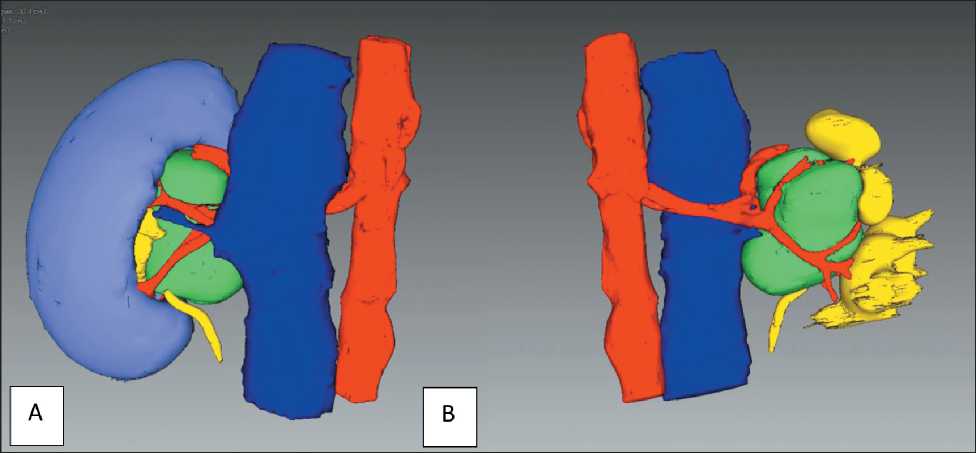
Рис. 3. 3D-модель правой почки с опухолью. Зеленым обозначена опухоль почки; голубым – паренхима почки; желтым – чашечнолоханочная система почки.
А – вид спереди; В – вид сзади Fig. 3. 3D model of the right kidney with a tumor. The kidney tumor is green, the kidney parenchyma is blue, and the pelvicalyceal system of the kidney is yellow. A – front view;
B – posterior view
просвет которого – 1,5 мм (0,038 дюймов). Через катетер установлен проводник с J-образным изгибом на дистальном конце радиусом 0,97 мм (0,038 дюймов). Под рентгенконтролем с введением рентгенконтрастного не ионного йодсодержащего вещества в левую почечную артерию заведен дистальный конец диагностического катетера. После чего интродьюсер и катетер фиксированы к руке пациентки.
Для основного этапа операции проведена репозиция пациентки на левый бок с фиксацией левой руки на держателе операционного стола. Установка портов проведена в соответствии с локализацией опухоли, она не отличалась от стандартной методики при тепловой или zero-ишемии (рис. 4). Визуализация опухолевого узла затруднена в связи с его интрасинусной локализацией и интимным прилежанием к правым почечным сосудам и мочеточнику. Осуществлен доступ к правым почечным артерии и вене и гонадной вене (рис. 5).
Симультанно в просвет ранее установленного в правой почечной артерии диагностического катетера заведен двухпросветный баллонный катетер диаметром 6Fr. Выбор диаметра баллона основывался на предоперационной оценке диаметра почечной артерии по данным артериальной фазы
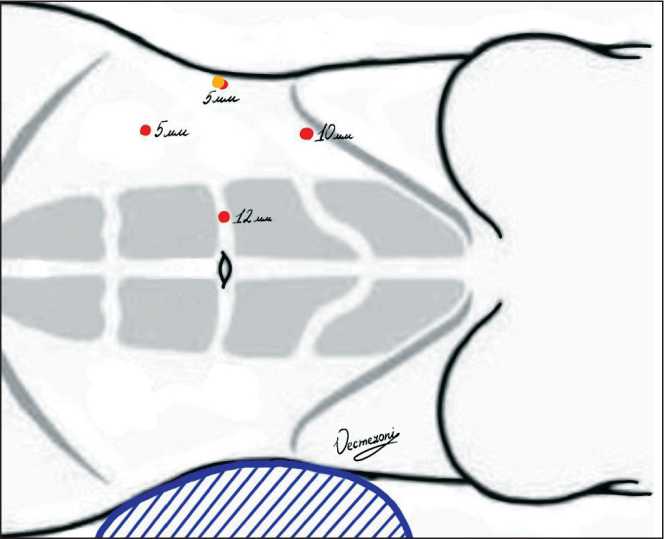
Рис. 4. Схема установки троакаров: 12 мм – видеотроакар; 10 мм – основной манипуляционный троакар;
5 мм (красный) – дополнительный манипуляционнный троакар; 5 мм (желтый) – вспомогательный троакар Fig. 4. Scheme of trocars insertion. 12 mm – video trocar; 10 mm – main manipulation trocar; 5 mm (red) – additional manipulative trocar; 5 mm (yellow) – auxiliary trocar
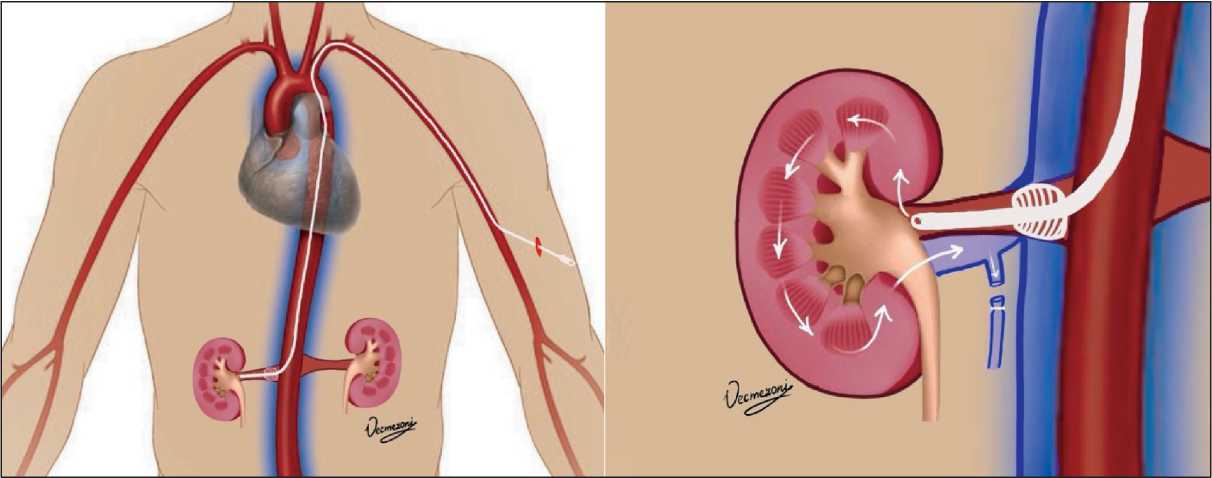
Рис. 5. Схема селективного доступа к правой почечной артерии Fig. 5. Scheme of selective access to the right renal artery
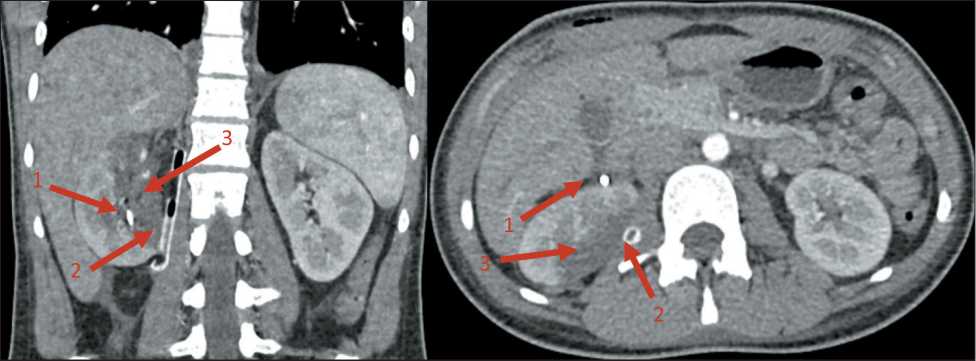
Рис. 6. МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием в раннем послеоперационном периоде (7 сут): 1 – мочеточниковый стент верхних мочевыводящих путей справа; 2 – страховой дренаж в области правой почечной ножки; 3 – аваскулярная зона по заднемедиальной поверхности правой почки
Fig. 6. The abdominal and retroperitoneal MSCT with intravenous contrast in the early postoperative period (day 7): 1 – ureteral stent of the upper urinary tract on the right; 2 – safety drainage in the right renal pedicle; 3 – avascular zone on the posteromedial surface of the right kidney
риска значимой потери функции почки и паренхиматозного кровотечения. С техническими трудностями (опухолевый узел вовлекал группу нижних чашечек ЧЛС) произведена резекция правой почки в пределах здоровых тканей при помощи аппарата Harmonic Ace и холодных ножниц. Однако в связи с интимным прилежанием задней сегментарной артерии к опухолевому узлу и невозможностью ее диссекции выполнена электрокоагуляция артерии. При энуклеации опухоли почки выявлен дефект нижней группы чашечек, через который в верхние мочевые пути справа установлен мочеточниковый стент Rusch 17Ch. Дефект в ЧЛС ушит однорядным непрерывным атравматическим швом нитью PDS II 4.0. Рана почки ушита непрерывным однорядным атравматическим швом VICRYL 1.0 с фиксацией при помощи рассасывающихся клипс ETHICON ABSOLOK. После окончания данного этапа просвет правой гонадной вены ушит атравматическим непрерывным швом нитью PROLENE 5.0, далее снят зажим с правой почечной вены, после чего баллонный катетер удален из правой почечной артерии, время холодовой ишемии составило 60 мин. К зоне почечной ножки справа установлены гемостатическая сетка SURGICEL и страховой дренаж. Суммарное время операции составило 260 мин, объем кровопотери – 150 мл.
В раннем послеоперационном периоде (первые трое суток) отмечалось повышение температуры тела до субфебрильной (37,7–38,2 °С), однако на фоне антибактериальной (Кларуктам 1000 мг + 500 мг, внутривенно, 2 раза в сут), нестероидной противовоспалительной (Кетодексал 50 мг, внутримышечно, 2 раза в сут) и инфузионной терапии удалось добиться стабилизации состояния. Данных об остром почечном повреждении не получено. Креатинин крови на 1-е сут после операции – 118 мкмоль/л. СКФ по формуле CKD-EPI – 56 мл/мин/1,73 м2. При МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием на 7-е сут после операции отмечаются постоперационные изменения правой почки в виде аваскулярной зоны по задней медиальной поверхности жидкостной структуры, не накапливающей контрастный препарат (рис. 6). Дренаж удален на 8-е сут. Пациентка выписана на 9-е сут после операции в удовлетворительном состоянии. Мочеточниковый стент удален через 1 мес в амбулаторных условиях.
При морфологическом исследовании операционного материала: светлоклеточный почечноклеточный рак почки, сукцинат-дегидрогиназный тип, G1 с участками эозинофильной метаплазии, пикноморфными одноморфными ядрами. Митозы и некрозы отсутствуют (рис. 7). Опухоль, по большей части, имеет солидное строение, частью формируя гнезда из относительно крупных клеток с четкими, сглаженными границами. Наряду с клетками с оптически пустой цитоплазмой имеются клетки с «нежной», эозинофильной цитоплазмой, содержащие едва заметные гранулы, которые отдаленно напоминают собой гепатоциты. Ядра правильной округлой формы, содержащие в себе заметный зернистый хроматин, ядрышки не определяются. Митотические фигуры и очаги некроза отсутствуют. При меньшем увеличении видно, что опухолевые кластеры разделены между собой большим количеством лимфатических сосудов, однако какие-либо признаки пери- и интра-лимфоваскулярной инвазии отсутствуют.
Для исключения генетической предрасположенности к онкологическим заболеваниям, а также для определения дальнейшей тактики лечения, с учетом семейного анамнеза и гистологического подтипа ПКР, проведено молекулярногенетическое исследование образцов крови пациентки на следующие маркеры: BRCA1, BRCA2, VHL, CHEK2. Методы исследования мутаций:
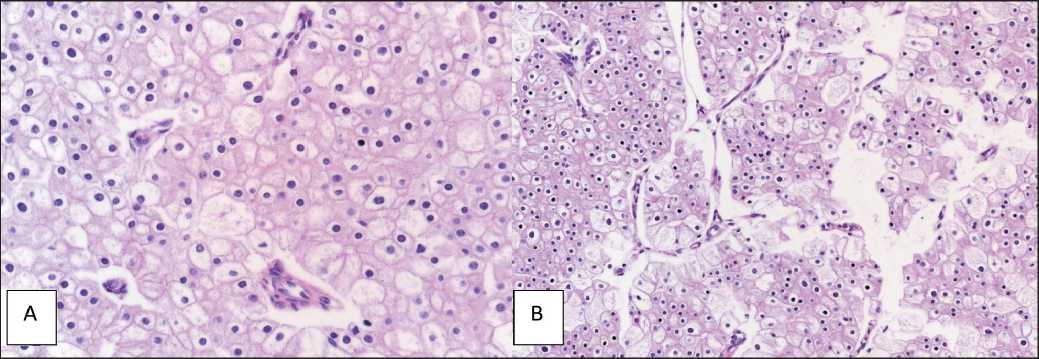
Рис. 7. Микрофото. Опухоль почки. Окраска гематоксилином и эозином: А – ×40; В – ×20 Fig. 7. Microphotj. Kidney tumor. H&E staining. A – ×40; B – ×20
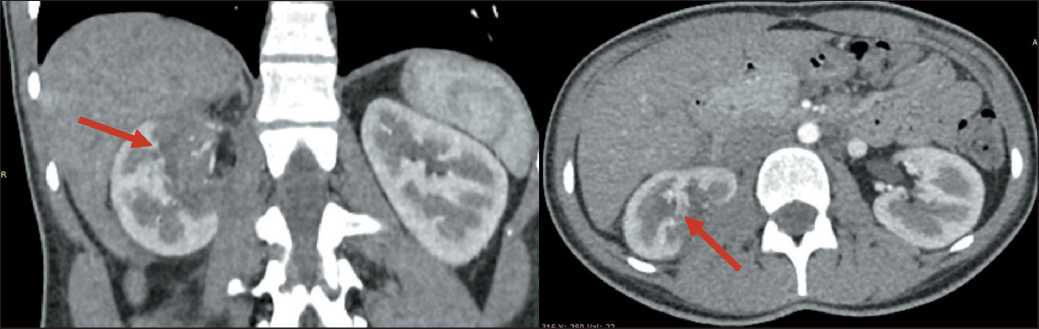
Рис. 8. Контрольная МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием через 3 мес после операции. Стрелкой обозначена аваскулярная зона по заднемедиальной поверхности правой почки (положительная динамика)
Fig. 8. Control abdominal and retroperitoneal MSCT with intravenous contrast 3 months after surgery. Arrow shows the right kidney’s non-vascular area along the posteromedial surface (positive dynamics)
ПЦР и секвенирование на платформе ABI 3500xL Genetic Аnalyzer, Applied Biosystems для определения первичной структуры кодирующей части гена VHL; Real-time ПЦР c использованием набора реагентов «ОнкоГенетика CHEK2» на платформе ДТ-прайм 5 (ООО «ДНК-технология ») и набора «ОнкоГенетика» РУ № ФСР 2010/08415 на платформе ДТ-прайм 5 (ООО «ДНК-технология») для определения первичной структуры кодирующей части гена CHEK2 и BRCA1, BRCA2. При исследовании ДНК, выделенной из лимфоцитов периферической крови, герминальных мутаций в генах BRCA1, BRCA2, VHL, CHEK2 не выявлено.
В связи с отсутствием данных о молекулярногенетической предрасположенности пациентки к системным заболеваниям принято решение продолжать динамическое наблюдение согласно следующей тактике: контрольная МСКТ органов брюшной полости, забрюшинного пространства c контрастированием через 3, 6 и 12 мес после операции, далее каждый год в течение 3 лет; МСКТ, либо рентгенологическое исследование органов грудной клетки каждый год в течение 5 лет после операции. С учетом исходного нарушения паренхиматозновыделительной функции правой почки рекомендовано выполнение контрольной нефросцинтиграфии через 3 и 12 мес после операции.
По данным контрольной МСКТ органов брюшной полости и забрюшинного пространства с контрастированием через 3 мес в правой почке выявлены послеоперационные изменения в виде аваскулярной зоны по задней губе верхней, средней и частично нижней трети правой почки, без убедительных данных за наличие объемного процесса, контуры правой почки деформированы – динамика в виде уменьшения размеров аваскулярной зоны (рис. 8). При контрольной динамической нефрос-цинтиграфии через 3 мес: накопление РФП в правой почке значительно снижено, распределение в паренхиме неравномерное, контуры волнистые, отток не задержан. Т максимального накопления – 4 мин 10 сек, Т полувыведения – 20 мин 34 сек. Перфузионный индекс – 23 %. Уровень креатинина – 66 мкмоль/л.
При МСКТ-контроле органов брюшной полости и забрюшинного пространства с контрастированием через 6 мес: в правой почке постоперационные изменения в виде аваскулярной зоны без существенной динамики. Данных о наличии рецидива не получено (рис. 9).
При МСКТ-контроле органов брюшной полости и забрюшинного пространства с контрастированием через 12 мес: в правой почке по медиальным отделам – постоперационные изменения в виде
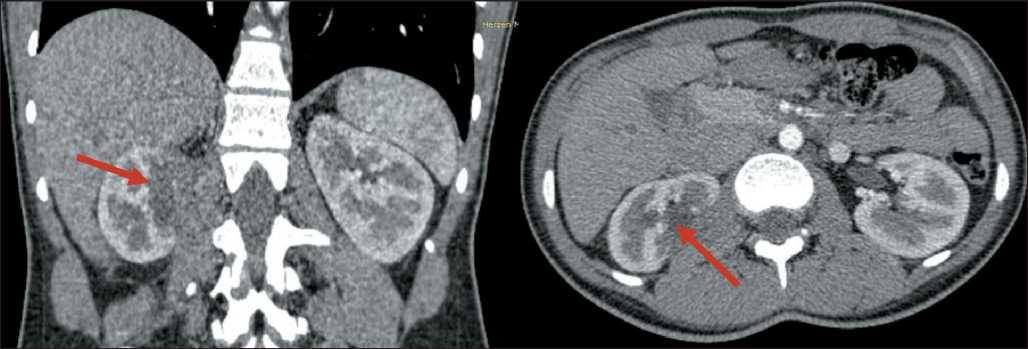
Рис. 9. Контрольная МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием через 6 мес после операции. Стрелкой обозначена аваскулярная зона по заднемедиальной поверхности правой почки (без существенной динамики)
Fig. 9. Control abdominal and retroperitoneal MSCT with intravenous contrast 6 months after surgery. Arrow shows the right kidney’s non-vascular area along the posteromedial surface (without significant dynamics)
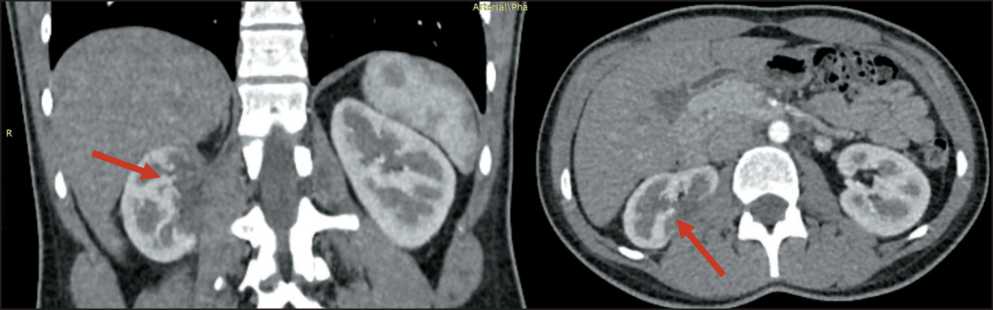
Рис. 10. Контрольная МСКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием через 12 мес после операции. Стрелкой обозначена аваскулярная зона по заднемедиальной поверхности правой почки (без существенной динамики)
Fig. 10. Control abdominal and retroperitoneal MSCT with intravenous contrast 12 months after surgery. Arrow shows the right kidney’s non-vascular area along the posteromedial surface (without significant dynamics)
зоны пониженной плотности, без признаков рецидива (рис. 10). По данным контрольной динамической нефросцинтиграфии через 12 мес: накопление радиофармпрепарата в правой почке умеренно снижено, распределение в паренхиме неравномерное, контуры волнистые, к 20-й мин исследования отмечена задержка РФП в собирательной системе, отток значительно замедлен. Т максимального накопления (Tmax) – 16 мин 10 сек, Т полувыведения – 23 мин 18 сек, функциональный вклад 28 %. Креатинин крови – 66 ммоль/л. СКФ по формуле CKD-EPI – 113 мл/мин/1,73 м2.
Необходимо подчеркнуть, что пациентка отметила исчезновение панических атак, приступов тахикардии и головокружения на протяжении всего периода наблюдения (18 мес) в послеоперационном периоде.
Обсуждение
Главным преимуществом резекции почки является сохранение ее функционального состояния, несмотря на частичное снижение объема функционирующих нефронов и необратимое ишемическое повреждение доли сохраненной паренхимы [7]. По данным литературы, функциональное восстановление после РП, в первую очередь, зависит от предоперационного значения СКФ, т.е. качества нефронов и доли сохраненной васкуляризованной паренхимы, или количества сохранившихся нефронов [8–11]. В исследованиях, направленных на оценку послеоперационного функционального состояния почек, отмечено восстановление функции прооперированной почки после резекции на 80 % по данным СКФ [9–12].
Неоднократно обсуждался вопрос относительно влияния времени ишемии и ее характера на функциональное состояние почки после резекции. Считается, что ишемия может потенцировать повреждение нефронов через следующие патофизиологические механизмы: вазоконстрикцию с аномальной компенсаторной реакцией эндотелиальных клеток, канальцевую обструкцию с обратным током мочи и реперфузионное повреждение клеток [13]. При этом временной порог, при котором начинается развитие необратимого ишемического повреждения, на данный момент не определен и может быть связан с соматическим статусом пациента [3, 14, 15]. В исследовании американских ученых при многомерном анализе данных 362 пациентов с единственной почкой, которым проведена резекция почки, обнаружено, что тепловая ишемия продолжительностью >25 мин связана с высоким риском развития ХБП IV стадии (HR=2,27, p<0,05) [8]. Однако последующие исследования, основанные на анализе сывороточных биомаркеров и образцов биопсии почки, взятых во время пережатия почечных артерий, показали большую устойчивость органа к ишемии, чем считалось ранее [16]. Таким образом, пришли к выводу, что степень необратимого ишемического повреждения почки после резекции остается предметом дискуссий [17–19].
Выделяют 2 основных типа ишемии: тепловую и холодовую, которые, в свою очередь, могут быть осуществлены разными способами. Так как основной целью РП является сохранение функционального состояния почки, особого внимания заслуживают исследования, направленные на определение потенциальной роли типа и продолжительности ишемии, являющихся наиболее легко модифицируемыми факторами, влияющими на функциональное восстановление [20].
Гипотермия давно используется в трансплантационной хирургии для обеспечения защиты почек в течение нескольких часов, что позволяет сохранить их функциональное состояние. Гипотермия традиционно применяется при открытой резекции почки, особенно когда предполагается длительное время ишемии. Она может быть достигнута двумя способами: охлаждением поверхности почки при помощи льда и артериальной перфузии органа охлажденным раствором. Оба этих метода доказали свою эквивалентную эффективность [21, 22].
Холодовая артериальная перфузия имеет ряд преимуществ: 1) она позволяет добиться быстрого снижения температуры почечной паренхимы до 25 °С, что обеспечивает более комфортную и быструю резекцию почки; 2) исключает обратный венозный ток крови благодаря положительному перфузионному давлению в собирательной системе; 3) не влияет на экспозицию интраоперационной картины, т.к. не предполагает наличие в рабочей
Список литературы Лапароскопическая резекция почки в условиях холодовой ишемии при сложной опухоли (Renal Score-11): клинический случай в условиях одного института
- Van Poppel H., Da Pozzo L., Albrecht W., Matveev V., Bono A., Borkowski A., Colombel M., Klotz L., Skinner E., Keane T., Marreaud S., Collette S., Sylvester R. A prospective, randomised EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephronsparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol. 2011; 59(4): 543–52. doi: 10.1016/j.eururo.2010.12.013.
- Zhang Z., Zhao J., Zabell J., Remer E., Li J., Campbell J., Dong W., Palacios D.A., Patel T., Demirjian S., Campbell S.C. Proteinuria in Patients Undergoing Renal Cancer Surgery: Impact on Overall Survival and Stability of Renal Function. Eur Urol Focus. 2016; 2(6): 616–22. doi: 10.1016/j.euf.2016.01.003.
- Mir M.C., Ercole C., Takagi T., Zhang Z., Velet L., Remer E.M., Demirjian S., Campbell S.C. Decline in renal function after partial nephrectomy: etiology and prevention. J Urol. 2015; 193(6): 1889–98. doi: 10.1016/j.juro.2015.01.093.
- Mir M.C., Campbell R.A., Sharma N., Remer E.M., Simmons M.N., Li J., Demirjian S., Kaouk J., Campbell S.C. Parenchymal volume preservation and ischemia during partial nephrectomy: functional and volumetric analysis. Urology. 2013; 82(2): 263–8. doi: 10.1016/j.urology.2013.03.068. Erratum in: Urology. 2013; 82(5): 1195.
- Simmons M.N., Hillyer S.P., Lee B.H., Fergany A.F., Kaouk J., Campbell S.C. Functional recovery after partial nephrectomy: effects of volume loss and ischemic injury. J Urol. 2012; 187(5): 1667–73. doi: 10.1016/j.juro.2011.12.068.
- Воробьев Н.В., Рерберг А.Г., Рябов А.Б., Мурадян А.Г, Болотова Р.С., Каприн А.Д., Тараки Х. Способ антиишемической защиты паренхимы почки при лапароскопической резекции. Патент РФ № 2793505. Заявл. 10.06.2022; Опубл. 04.04.2023. [Vorobyov N.V., Rerberg A.G., Ryabov A.B., Muradyan A.G., Bolotova R.S., Kaprin A.D., Taraki Kh. A method for anti-ischemic protection of the kidney parenchyma during laparoscopic resection. The patent of the Russian Federation No 2793505. 04.04.2023. (in Russian)].
- Zabell J.R., Wu J., Suk-Ouichai C., Campbell S.C. Renal Ischemia and Functional Outcomes Following Partial Nephrectomy. Urol Clin North Am. 2017; 44(2): 243–55. doi: 10.1016/j.ucl.2016.12.010.
- Thompson R.H., Lane B.R., Lohse C.M., Leibovich B.C., Fergany A., Frank I., Gill I.S., Blute M.L., Campbell S.C. Renal function after partial nephrectomy: effect of warm ischemia relative to quantity and quality of preserved kidney. Urology. 2012; 79(2): 356–60. doi: 10.1016/j.urology.2011.10.031.
- Lane B.R., Russo P., Uzzo R.G., Hernandez A.V., Boorjian S.A., Thompson R.H., Fergany A.F., Love T.E., Campbell S.C. Comparison of cold and warm ischemia during partial nephrectomy in 660 solitary kidneys reveals predominant role of nonmodifiable factors in determining ultimate renal function. J Urol. 2011; 185(2): 421–7. doi: 10.1016/j.juro.2010.09.131.
- Mir M.C., Takagi T., Campbell R.A., Sharma N., Remer E.M., Li J., Demirjian S., Stein R., Kaouk J., Campbell S.C. Poorly functioning kidneys recover from ischemia after partial nephrectomy as well as strongly functioning kidneys. J Urol. 2014; 192(3): 665–70. doi: 10.1016/j.juro.2014.03.036.
- Yossepowitch O., Eggener S.E., Serio A., Huang W.C., Snyder M.E., Vickers A.J., Russo P. Temporary renal ischemia during nephron sparing surgery is associated with short-term but not long-term impairment in renal function. J Urol. 2006; 176(4 Pt 1): 1339–43. doi: 10.1016/j.juro.2006.06.046.
- Takagi T., Mir M.C., Campbell R.A., Sharma N., Remer E.M., Li J., Demirjian S., Kaouk J.H., Campbell S.C. Predictors of precision of excision and reconstruction in partial nephrectomy. J Urol. 2014; 192(1): 30–5. doi: 10.1016/j.juro.2013.12.035.
- Secin F.P. Importance and limits of ischemia in renal partial surgery: experimental and clinical research. Adv Urol. 2008. doi: 10.1155/2008/102461.
- Zhang Z., Zhao J., Velet L., Ercole C.E., Remer E.M., Mir C.M., Li J., Takagi T., Demirjian S., Campbell S.C. Functional Recovery From Extended Warm Ischemia Associated With Partial Nephrectomy. Urology. 2016; 87: 106–13. doi: 10.1016/j.urology.2015.08.034.
- Volpe A., Blute M.L., Ficarra V., Gill I.S., Kutikov A., Porpiglia F., Rogers C., Touijer K.A., Van Poppel H., Thompson R.H. Renal Ischemia and Function After Partial Nephrectomy: A Collaborative Review of the Literature. Eur Urol. 2015; 68(1): 61–74. doi: 10.1016/j.eururo.2015.01.025.
- Parekh D.J., Weinberg J.M., Ercole B., Torkko K.C., Hilton W., Bennett M., Devarajan P., Venkatachalam M.A. Tolerance of the human kidney to isolated controlled ischemia. J Am Soc Nephrol. 2013; 24(3): 506–17. doi: 10.1681/ASN.2012080786.
- Simmons M.N., Lieser G.C., Fergany A.F., Kaouk J., Campbell S.C. Association between warm ischemia time and renal parenchymal atrophy after partial nephrectomy. J Urol. 2013; 189(5): 1638–42. doi: 10.1016/j.juro.2012.11.042.
- Zhang Z., Ercole C.E., Remer E.M., Mir M.C., Takagi T., Velet L., Li J., Zhao J., Demirjian S., Campbell S.C. Analysis of Atrophy After Clamped Partial Nephrectomy and Potential Impact of Ischemia. Urology. 2015; 85(6): 1417–22. doi: 10.1016/j.urology.2015.02.040.
- Choi K.H., Yoon Y.E., Kim K.H., Han W.K. Contralateral kidney volume change as a consequence of ipsilateral parenchymal atrophy promotes overall renal function recovery after partial nephrectomy. Int Urol Nephrol. 2015; 47(1): 25–32. doi: 10.1007/s11255-014-0847-2.
- Ackermann D., Lenzin A., Tscholl R. Renale Hypothermie in situ. Vergleich zwischen Oberflächen- und Perfusionskühlung hinsichtlich der Nierenfunktion im späteren postoperativen Verlauf beim Schwein [Renal hypothermia in situ. Comparison between surface and perfusion coolingconcerning renal function in pigs (author’s transl)]. Urologe A. 1979; 18(1): 38–43. German.
- Wagenknecht L.V., Hupe W., Bücheler E., Klosterhalfen H. Selective hypothermic perfusion of the kidney for intrarenal surgery. Eur Urol. 1977; 3(2): 62–8. doi: 10.1159/000472060.
- Morishita K., Yokoyama H., Inoue S., Koshino T., Tamiya Y., Abe T. Selective visceral and renal perfusion in thoracoabdominal aneurysm repair. Eur J Cardiothorac Surg. 1999; 15(4): 502–7. doi: 10.1016/s1010-7940(99)00075-5.
- Janetschek G., Abdelmaksoud A., Bagheri F., Al-Zahrani H., Leeb K., Gschwendtner M. Laparoscopic partial nephrectomy in cold ischemia: renal artery perfusion. J Urol. 2004; 171(1): 68–71. doi: 10.1097/01.ju.0000101040.13244.c4.


