Лапароскопические тазовые эвисцерации у мужчин и женщин
Автор: Галлямов Э.А., Агапов М.А., Биктимиров Р.Г., Сергеев В.П., Санжаров А.Е., Кочкин А.Д., Володин Д.И., Малахов П.С., Гололобов Г.Ю., Какоткин В.В.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 1 (41), 2020 года.
Бесплатный доступ
Лечение больных с первичными и рецидивными местно-распространенными опухолями малого таза представляет крайне сложную проблему современной хирургической онкологии.Цель: оценить периоперационные и отдаленные послеоперационные результаты лапароскопической методики эвисцерации малого таза.Материал и методы: в период с 2011 по 2018 год, было выполнено 21 эвисцераций малого таза лапароскопическим доступом, (средний возраст 59,79±8,5), распределение по полу: 17 женщин и 4 мужчины. Распределение по нозологиям: у 6 пациентов верифицирован рак шейки матки, 7 пациентов - рак мочевого пузыря, 4 пациента рак прямой кишки, 1 пациент рак влагалища, 2 пациента - рецидив рака культи влагалища после ранее перенесенной экстирпации матки и 1 пациент с новообразованием яичника.Результаты: объем эвисцерации был следующий: 9 тотальных, 7 передних и 5 задних. Во всех случаях удалось достичь негативного края резекции (R0). Оценивались длительность операции, объем кровопотери, частота и характер периоперационных осложнений.Заключение: использование лапароскопического доступа сопровождается меньшим объемом кровопотери, снижением частоты ранних послеоперационных осложнений, способствует более комфортному послеоперационному периоду с ранней активизацией, менее выраженным болевым синдромом, и приводит к снижению сроков стационарного лечения.
Лапароскопическая эвисцерация (экзентерация) малого таза, местно-распространённый рак малого таза, рецидивирующий рак т вых органов
Короткий адрес: https://sciup.org/142226475
IDR: 142226475 | УДК: 617-089.87 | DOI: 10.38181/2223-2427-2020-1-15-23
Текст научной статьи Лапароскопические тазовые эвисцерации у мужчин и женщин
За последнею декаду значительно выросла заболеваемость онкологической патологией органов малого таза. По последним данным Американского сообщества онкологов рак шейки матки составляет 7% от всех онкологических заболеваний, колоректальный рак - 9%, рак мочевого пузыря - 7%, рак простаты – 19% [1].
Несмотря на современные высокотехнологичные методы ранней диагностики и своевременного адекватного лечения онкологических заболеваний, рецидив данных заболеваний является важной клинической проблемой для современных онкологов. Риск развития местного рецидива рака прямой кишки (РПК) после тотальной мезоректумэктомии (ТМЭ) составляет 5-10% [2,3], риск развития рецидива рака шейки матки (РШМ) по различным данным достигает 25% [4,5,6]. На ранних этапах местный рецидив протекает бессимптомно, жалобы возникают на более поздних стадиях при вовлечении в опухолевый процесс соседних органов и тканей. Лечение больных с первичными и рецидивными местно-распространенными опухолями органов малого таза представляет крайне сложную проблему современной хирургической онкологии. Серьезным осложнением лучевой терапии при лечении РШМ является формирование комбинированных свищей, что значительно снижает качество жизни пациента и приводит к полной социальной дезадаптации [5-8].
Операция выбора для данных групп пациентов, которая приведёт к повышению качества жизни, а при отсутствии отдалённых метастазов даст шанс на излечение - эвисцерация малого таза (ЭМТ). Существует разделение ЭМТ на тотальную и частичную (заднюю и переднюю) [9-13].
Традиционная лапаротомия при ЭМТ, несмотря на высокий уровень послеоперационных осложнений, является общепринятой. Однако внедрение лапароскопических методик в хирургию малого таза позволяет совсем по-другому по- смотреть на тактику лечения данных пациентов. Лапароскопическая методика зарекомендовала себя в качестве золотого стандарта в оперативном лечении заболеваний органов малого таза (прямая кишка, матка, мочевой пузырь, простата) [2,14-17]. Первые результаты лапароскопических ЭМТ показывают значительное снижение интра- и послеоперационных осложнений, при этом онкологическая эффективность при достижении R0 краёв резекции и отсутствии отдалённых метастазов остаётся на высоком уровне [9,10,12,18-21].
Цель исследования
Оценить периоперационные и отдаленные послеоперационные результаты лапароскопической методики эвисце-рации малого таза.
Материалы и методы
В период 2011 по 2018 год, было выполнено 21 эвисце-рация малого таза лапароскопическим доступом, (средний возраст 59,79±8,5), распределение по полу: 17 женщин и 4 мужчины. Распределение по нозологиям: у 6 пациентов верифицирован рак шейки матки, 7 пациентов - рак мочевого пузыря, 4 пациента - рак прямой кишки, 1 пациент - рак влагалища, 2 пациента - рецидив рака культи влагалища после ранее перенесенной экстирпации матки и 1 пациент с новообразованием яичника.
Наиболее распространенными жалобами были: кровь во время дефекации, кровянистые выделения из влагалища, запоры, боли в малом тазу, слабость, резкое снижение веса. У большинства пациентов наблюдалась анемия, агранулоцитоз, лимфоцитоз. У пациентов с вовлечением в опухолевый процесс нижних мочевыводящих путей наблюдалось повышение мочевины, креатина.
Всем пациентам проведён стандартный перечень обследований. Для более точной топической диагностики использовали данные компьютерной томография (КТ) (Рис.1-2), магнитно-резонансной томографии (МРТ), ультразвукового исследования (УЗИ) органов малого таза и брюшной полости, колоноскопии, цистоскопии, экскреторной урографии, сцинтиграфии, позитронно-эмиссионной томографии (ПЭТ КТ).
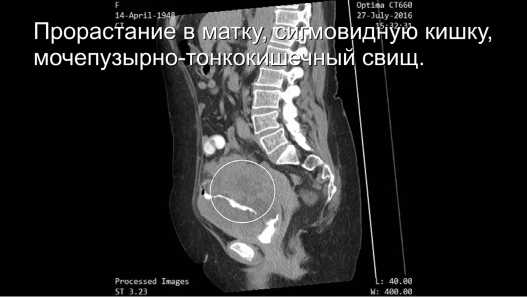
Рис.1. Данные мультиспиральной компьютерной томографии. Сагиттальный срез.
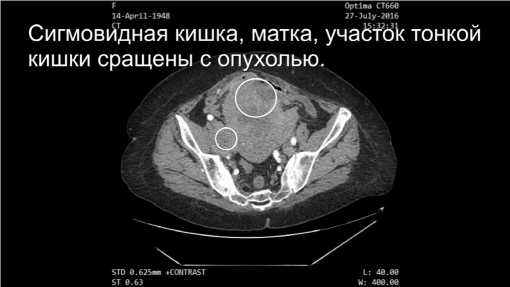
Рис.2. Данные мультиспиральной компьютерной томографии. Аксиальный срез.
Показатель общей и безрецидивной выживаемости после указанного оперативного вмешательства оценивался по статистическому методу «Каплана–Майера»
Этапы операции
Доступ, расстановка рабочих троакаров, адгезиолизис.
Определение распространенности опухолевого процесса, резектабельности.
-
3) Мобилизация и удаление органокомплекса, вовлеченного в опухолевый процесс, с лимфодиссекцией.
-
4) Реконструктивный этап.
-
5) Извлечение препарата.
Первый ассистент находится с противоположной стороны от хирурга, ассистент с камерой стоит за головой пациента. Вход в брюшную полость осуществляется оптическим троакаром 10 мм. на 3-4 см. выше пупка. Уровень карбокси-перитонеума на уровне 10-12 мм. рт. ст., пациент находится в умеренном положении Тренделенбурга. Классическое расположение троакаров: рабочие троакары по параректальным линиям на уровне оптического троакара - два 5 мм порта, по левой передней аксиллярной 12 мм порт, по правой – 5 мм порт. Однако при выраженном спаечном процессе вход в брюшную полость осуществляется через «оптическое окно», которое перед операцией определяется с помощью УЗИ (Рис.3).
Рис.3. Расположение троакаров с учетом «акустического окна».
При определении резектабельности оценивается вовлеченность сосудистых структур (общие и наружные подвздошные артерии) в опухолевый процесс. Тотальная ЭМТ подразумевает удаление всех тазовых органов: у мужчин резекционный объем операции включает брюшно-промежностную экстирпацию или ТМЭ, цист-простатвезикулэктомию. У женщин — цистэктомию, экстирпацию матки с придатками и субтотальную резекцию (или экстирпацию) влагалища, брюшно-промежностную экстирпацию или ТМЭ. Частичная ЭМТ применима только в отношении пациентов женского пола. При передней ЭМТ выполняется цистэктомия, экстирпация матки с придатками и субтотальная резекция (или экстирпация) влагалища; при задней ЭМТ выполняется брюшно-промежностная экстирпация или ТМЭ, экстирпация матки с придатками и субтотальная резекция (или экстирпация) влагалища (Рис.4-6). В дальнейшем, при ЭМТ выполняется необходимый объем лимфаденэктомии (Рис.7).
Рис.4. Общий вид малого таза после передней эвисцерации.
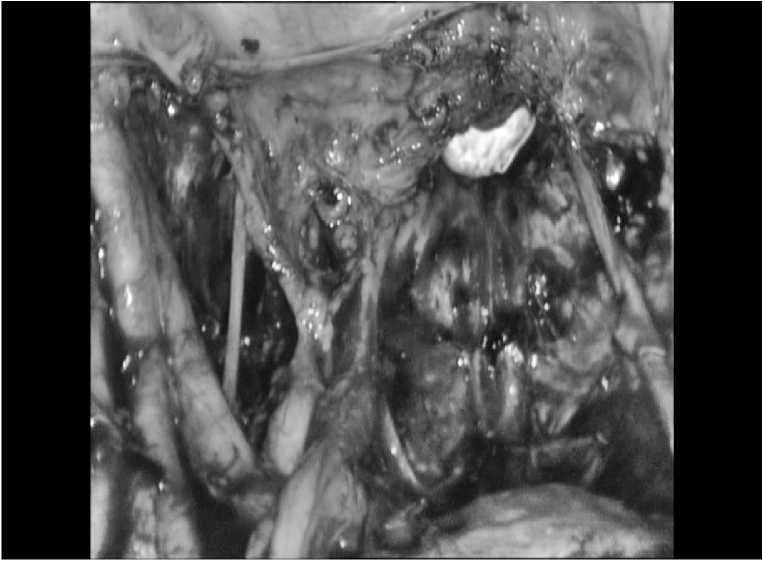
Рис.5. Общий вид малого таза после задней эвисцерации
После мобилизации и удаления органокомплекса, вовлечённого в опухолевый конгломерат выполняется реконструктивный этап. Для восстановления пассажа мочи выполняется операция Bricker, последняя заключается в формировании уретероилеостомы. (Рис.8). Для деривации кала выполняется колоректальный анастомоз «конец в конец» с первичным анастомозом (с или без илеостомы), при невозможности формирования анастомоза выводим концевую колостому.
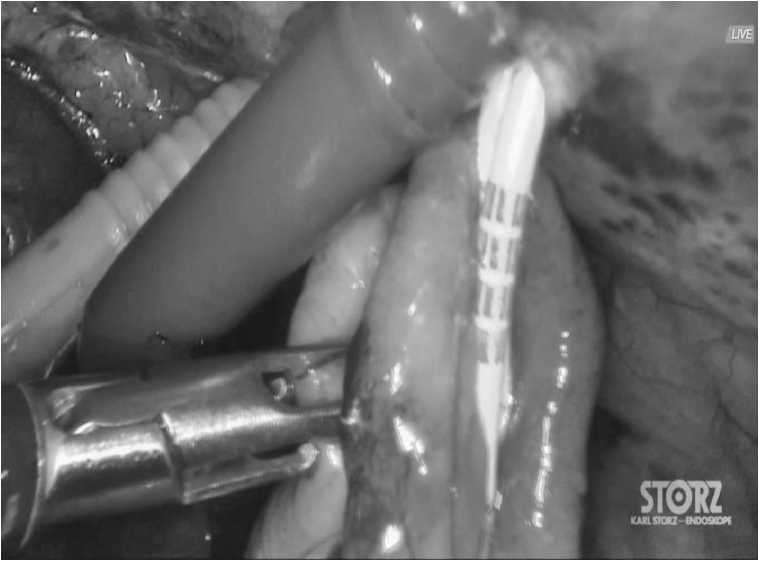
Рис.8. Формирование уретероилеостомы.
Извлечение органокомплекса осуществляется через доступ по Пфанненштилю (Рис.9).
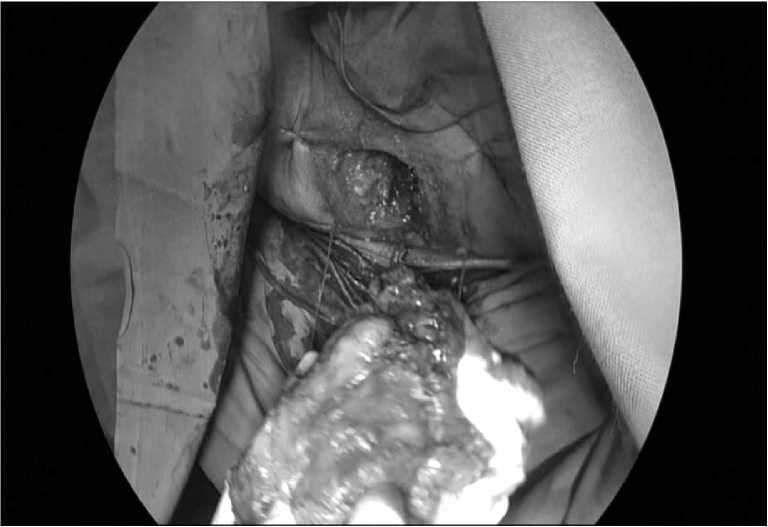
Рис.6. Общий вид промежности после выполнения брюшно-промежностной экстирпации.

Рис.9. Общий вид извлеченного органокомплекса в контейнере.
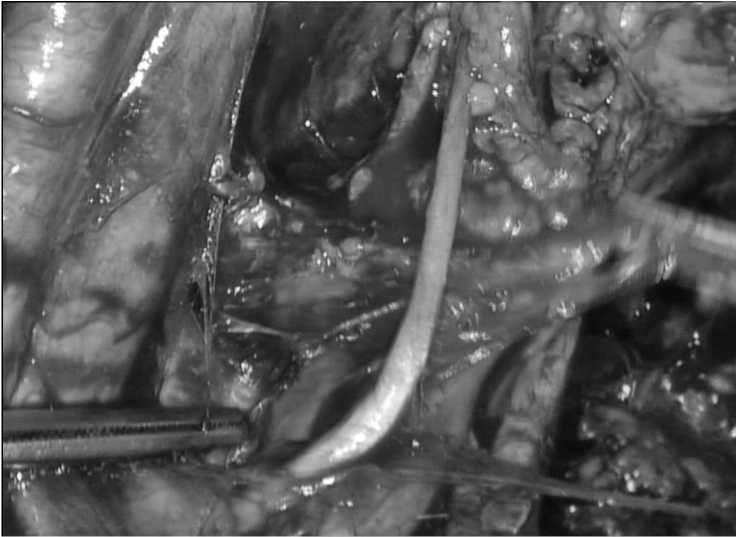
Рис.7. Этап стандартной лимаденэктомии вдоль левой полуокружности малого таза.
Результаты
У всех пациентов была проведена лапороскопическая эвисцерация органов малого таза. Количество, виды и показания к оперативному вмешательству представлены в Таблице 1.
Таблица 1
Клинические данные о пациентах, перенесших тазовую эвисцерацию
|
Вид эвисцерации |
■ * R « 5 ^ c |
Показания к тазовой эвисцерации |
|
9 тотальных эвисцераций: |
2 |
Рецидив рака культи влагалища, с прорастанием в прямую кишку и мочевой пузырь, после экстирпации матки 3, 6 лет назад. |
|
1 |
Рак влагалища с прорастанием в мочевой пузырь и прямую кишку, осложнённый мочепузырно-влагалищным свищем. |
|
|
2 |
Рак прямой кишки с прорастанием в матку у женщин и мочевой пузырь у мужчин. |
|
|
4 |
Рак мочевого пузыря, с прорастанием в матку и в прямую кишку, осложнённый мочепузырно-тонкокишечным свищем. |
|
|
7 передних эвисцераций |
3 |
Рак мочевого пузыря с совлечением влагалища и шейки матки. |
|
3 |
Рак шейки матки с прорастанием в мочевой пузырь. |
|
|
1 |
Состояние после лучевой терапии после рака шейки матки (блок мочеточников, микроцеле, мочепузырно-прямокишечный свищ). |
|
|
5 задних эвисцераций: |
2 |
Рак шейки матки с прорастанием в прямую кишку. |
|
2 |
Рак прямой кишки с инвазией в матку |
|
|
1 |
Рак яичника, с инвазией матки и прямой кишки |
У всех пациентов удалось достичь патоморфологически-негативного края резекции опухоли. В целях деривации мочи у всех пациентов, которым выполнялась тотальная и передняя эвисцерация, выполнена операция Bricker. Для восстановления толстокишечного сегмента пищеварительного тракта у пациентов, перенесших тотальную и заднюю эвис-церацию, был наложен колоанальный анастомоз «конец в конец» у 4 (28,57%) пациентов, у 10 (71,43%) была сформирована концевая колостома.
Периоперационные результаты эвисцерации органов малого таза у данной группы пациентов приведены в Таблице 2.
Таблица 2
Периоперационные результаты эвисцерации органов малого таза
|
Показатель |
Результат |
|
Продолжительность операции, мин |
227.4 [160;420] |
|
Объём интраоперационной кровопотери, мл |
363.8 [100;1200] |
|
Послеоперационный койко-день |
10 [7;15] |
Одним из самых вероятных интраоперационных осложнений в данной группе пациентов является кровотечение. Чаще всего кровотечение является результатом неосторожной попытки мобилизации опухолевого конгломерата вблизи наружных или внутренних подвздошных вен. Повреждение стенки подвздошных артерий происходит гораздо реже. По нашему опыту при диссекции вблизи сосудистых структур удобнее и безопаснее использовать «холодные» ножницы, дабы исключить вероятность термического повреждения стенки сосуда. В нашем исследовании у одного пациента в результате повреждения наружной подвздошной вены развилось интраоперационное кровотечение. Кровопотеря составила 1200 мл. кровотечение удалось остановить прошиванием стенки вены.
Послеоперационные осложнения зафиксированы у 6 (28,6%) пациентов. Структура ранних и поздних послеоперационных осложнений в соответствии с классификацией Clavien–Dindo [22] представлена в Таблице 3. К ранним послеоперационным осложнениям отнесены нежелательные эффекты, возникшие в течение первых трёх месяцев после перенесённого оперативного вмешательства.
Таблица 3
Ранние и поздние послеоперационных осложнения в соответствии с классификацией Clavien-Dindo
|
Показатель |
n |
% |
|
I степень |
||
|
Инфекция мочеполовых путей |
2 |
9.5 |
|
Тромбоз глубоких вен нижних конечностей |
1 |
4.76 |
|
IIIb степень |
||
|
Вентральная грыжа |
2 |
9.5 |
|
V степень |
||
|
Смерть в течение 90 дней после операции |
1 |
4.76 |
|
Всего |
6 |
28,6 |
Сроки наблюдения за пациентами составили от 1 до 84 месяца (медиана – 36 месяцев). Все пациенты (100%) в послеоперационном периоде в различные сроки получали адъювантную химиотерапию или химиолучевую терапию. Двум пациенткам через 12 месяцев после операции, по отсутствующим КТ-признаков рецидива рака, была выполнена реконструктивная операция, по закрытию колостомы, лапароскопическим доступом. Умерли 3 (14.3%) пациента: из них двое на сроке 9, 14 месяцев после операции, от прогрессирования заболевания (отдалённые метастазы в печень и лёгкие), один пациент - через 3 месяца после операции в связи с декомпенсацией соматической патологии.
Трёхлетняя общая и безрецидивная выживаемость в группе пациентов после эвисцерации тазовых органов составила 85.71% (Рис.10).
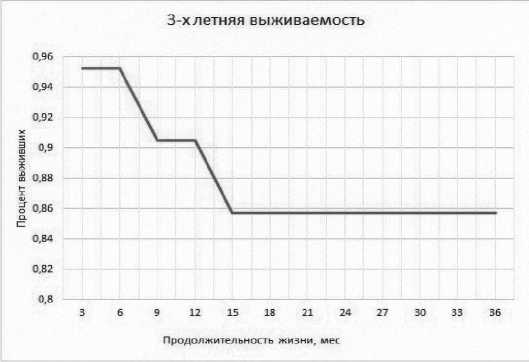
Рис.10. Показатель общей и безрецидивной выживаемости по Каплану–Майеру.
Учитывая отсутствие собственной базы пациентов после традиционной эвисцерации, мы сравнили наши результаты с работами, где эвисцерация малого таза была выполнена открытым способом [8,23,24]. При этом лапароскопический доступ сопровождался снижением среднего времени оперативного вмешательства (227.4 vs 266, 403, 351 мин.), меньшим объемом кровопотери (363.3 vs 700, 5169, 750 мл.), снижением длительности стационарного лечения (10 vs 15, n/a, 17 дней), меньшей частотой ранних и поздних послеоперационных осложнений (28.6 vs 29.3, 42, 40 %). Кроме того, в нашей группе отсутствовали пациенты с осложнениями, требующими хирургической коррекции. Сравнивания наши данные с другими работами по лапароскопическим эвисцерациям малого таза [6, 10], нужно отметить схожесть полученных результатов в величине средней кровопотери (363.3 vs 450, 250 мл.) и частоте послеоперационных осложнений (28.6 vs 23.3, 0 %).
Uehara K. и Ogura A. в своих работах по оценке безопасности лапароскопической методики в сравнении с открытой методикой эвисцерации малого таза пришли к выводу, что лапароскопический доступ приводит к снижению кровопотери, более низкой степени осложнений и более короткому послеоперационному пребыванию в стационаре [10,12].
Что касается онкологических результатов, то по данным литературы [11,23,25] открытая методика не всегда позволяет достичь R0 резекции, возможно, это объясняется менее качественной визуализацией области малого таза. Лапароскопическая методика позволяет достигнуть лучшей визуализации и обеспечить более прецизионную работу с тканями, что позволяет добиться лучшего онкологического результата [9,10,12,20,21].
Заключение
Полученные результаты лапароскопической эвисцерации малого таза, свидетельствуют о безопасности методики и позволяют рекомендовать её в специализированных стационарах, имеющих большой опыт проведения лапароскопических вмешательств.
Лапароскопический доступ сопровождается снижением объема интраоперционной кровопотери, снижением вероятности развития интра- и послеоперационных осложнений и способствует более ранней активизации пациентов.
Лапароскопическая визуализация с высокой вероятностью позволяет достигнуть негативного патоморфологиче-ского края резекции, что подтверждает онкологическую эффективность методики.
Долгосрочные онкологические результаты требуют более детальной оценки на основании большего количества клинического материала.
Список литературы Лапароскопические тазовые эвисцерации у мужчин и женщин
- American Cancer Society. Cancer Fact & Figures 2017. Atlanta: American Cancer Society; 2017.76 p.
- Jayne DG, Thorpe HC, Copeland J, Quirke P, Brown JM, Guillou PJ. Five-year follow-up of the Medical Research Council CLASSIC trial of laparoscopically assisted versus open surgery for colorectal cancer. Br J Surg. 2010, 97, pp. 1638-1645. DOI: 10.1002/bjs.7160
- PelvEx Collaborative. Factors affecting outcomes following pelvic exenteration for locally recurrent rectal cancer. Br J Surg. 2018 May, 105(6), pp. 650-657. DOI: 10.1002/bjs.10734
- Shindo M, Leitao MM, Gardner GJ, Jewell E, Chi DC, Abu-Rustum NR et al. Local cervical recurrence after radical trachelectomy for earlystage cervical cancer: Is completion hysterectomy necessary? Gynecologic Oncology. 2017, 145, p. 193. DOI: 10.1016/j.ygyno.2017.03.440
- Результаты тазовой экзентерации у женщин, выполненной по поводу опухолевых поражени и осложнений лучевой терапии. Диагностика и лечения опухолей мочеполовой системы / В.Р. Латыпов// Онкоурология. 2015. 1. C. 55-63.
- Костюк И.П., Шестаев А.Ю. Эвисцерация органов малого таза, как метод выбора в лечении рецидива рака шейки матки // Вестник российской военно-медицинской академии. 2012. 1(37). C. 280-285.
- Костюк И.П., Васильев Л.А., Крестьянинов С.С. Классификация местно-распространенных новообразований малого таза и вторичного опухолевого поражение мочевого пузыря // Онкоурология. 2014. 1. C. 39-43.
- Лоран О.Б., Серегин А.В., Довлатов З.А. Поздние результаты лечения и качество жизни после экзентерации органов таза у женщин // Онкоурология. 2016. 1. C. 36-41.
- DOI: 10.17650/1726-97762016-12-1-36-41
- Hayashi K, Kotake M, Kakiuchi D, Yamada S, Hada M, Kato Y et al. Laparoscopic total pelvic exenteration using transanal minimal invasive surgery technique with en bloc bilateral lymph node dissection for advanced rectal cancer. Surg Case Rep. 2016. 2(1). C. 74.
- DOI: 10.1186/s40792-016-0198-6
- Ogura A, Akiyoshi T, Konishi T, Fujimoto Y, Nagayama S, Fukunaga Y et al. Safety of laparoscopic pelvic exenteration with urinary diversion for colorectal malignancies. World J Surg. 2016 May, 40(5), pp. 1236-43.
- DOI: 10.1007/s00268-015-3364-2
- Quyn AJ, Austin KK, Young JM, Badgery-Parker T, Masya LM, Roberts R et al. Outcomes of pelvic exenteration for locally advanced primary rectal cancer: Overall survival and quality of life. Eur J Surg Oncol. 2016 Jun, 42(6), pp. 823-8.
- DOI: 10.1016/j.ygyno.2017.01.014
- Uehara K, Nakamura H, Yoshino Y, Arimoto A, Kato T, Yokoyama Y et al. Initial experience of laparoscopic pelvic exenteration and comparison with conventional open surgery. Surg Endosc. 2016, 30(1), pp. 132-8.
- DOI: 10.1007/s00464-015-4172-3
- Rausa E, Kelly ME, Bonavina L, O'Connell PR, Winter DC. A systematic review examining quality of life following pelvic exenteration for locally advanced and recurrent rectal cancer. Colorectal Dis. 2017, 19(5), pp. 430-436.
- DOI: 10.1111/codi.13647
- Van der Pas MH, Haglind E, Cuesta MA, Furst A, Lacy AM, Hop WC et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol. 2013, 14, pp. 210-218.
- DOI: 10.1016/S1470-2045(13)70016-0
- Jeong SY, Park JW, Nam BH, Kim S, Kang SB, Lim SB et al. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an openlabel, non-inferiority, randomised controlled trial. Lancet Oncol. 2014, 15, pp. 767-774.
- DOI: 10.1016/S1470-2045(14)70205-0
- Porpiglia F, Renard J, Billia M, Scoffone C, Cracco C, Terrone C et al. Open versus laparoscopy-assisted radical cystectomy: results of a prospective study. J Endourol. 2007, 21, pp. 325-329.
- DOI: 10.1089/end.2006.0224
- Vizza E, Pellegrino A, Milani R, Fruscio R, Baiocco E, Cognetti F et al. Total laparoscopic radical hysterectomy and pelvic lymphadenectomy in locally advanced stage IB2-IIB cervical cancer patients after neoadjuvant chemotherapy. Eur J Surg Oncol. 2011, 37, pp. 364-369.
- DOI: 10.1016/j.ejso.2010.12.001
- Martinez-Gomez C, Angeles MA, Martinez A, Ferron G. Laparoscopic anterior pelvic exenteration in 10 steps. Gynecol Oncol. 2018 Jul, 150(1), pp. 201-202.
- DOI: 10.1016/j.ygyno.2018.04.561
- Kanao H, Aoki Y, Hisa T, Takeshima N. Total laparoscopic pelvic exenteration for a laterally recurrent cervical carcinoma with a vesicovaginal fistula that developed after concurrent chemoradiotherapy. Gynecol Oncol. 2017 Aug, 146(2), pp. 438-439.
- DOI: 10.1016/j.ygyno.2017.05.030
- Isla-Ortiz D, Montalvo-Esquivel G, Herrera-Goepfert RE, Herrera-Gomez A, Salcedo-Hernandez RA. Laparoscopic anterior pelvic exenteration in a patient with locally advanced melanoma. Cir Cir. 2017 Dec, 85 Suppl 1, pp. 93-98.
- DOI: 10.1016/j.circir.2016.10.012
- Aiba T, Uehara K, Tsukushi S, Yoshino Y, Ebata T, Yokoyama Y et al. Perineal alveolar soft part sarcoma treated by laparoscopy-assisted total pelvic exenteration combined with pubic resection. Asian J Endosc Surg. 2017 May, 10(2), pp. 198-201. 10(2):198-201.
- DOI: 10.1111/ases.12342
- Dindo D., Demartines N., Clavien P.A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004, 240(2), pp. 205-13.
- DOI: 10.1097/01.sla.0000133083.54934.ae
- Сто экзентераций малого таза при местно-распространенных первичных и рецидивных опухолях прямой кишки / Д.В. Сидоров// Онкология. Журнал им. ПА Герцена. 2017. 6(2). C. 5-11.
- DOI: 10.17116/onkolog2017625-11
- Cibula D, Zikan M, Fischerova D, Kocian R, Germanova A, Burgetova A et al. Pelvic floor reconstruction by modified rectus abdominis myoperitoneal (MRAM) flap after pelvic exenterations. Gynecol Oncol. 2017 Mar, 144(3), pp. 558-563.
- DOI: 10.1016/j.ygyno.2017.01.014
- Dessole M, Petrillo M, Lucidi A, Naldini A, Rossi M, De Iaco P et al. Quality of life in women after pelvic exenteration for gynecological malignancies: a multicentric study. Int J Gynecol Cancer. 2018 Feb, 28(2), pp. 267-273.
- DOI: 10.1097/IGC.0000000000000612


