Лапароскопическое лечение рецидивной промежностной грыжи. Клинический случай
Автор: Галлямов Э.А., Агапов М.А., Маркарьян Д.Р., Какоткин В.В., Казаченко Е.А., Кубышкин В.А.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 3 (43), 2020 года.
Бесплатный доступ
Введение: Рецидивные послеоперационные грыжи промежности представляют собой редкое осложнение таких операций, как задняя эвисцерация таза, выполняемых по поводу онкологических заболеваний. Данное состояние может снижать качество жизни в послеоперационном периоде и требует хирургического восстановления нарушенной анатомии малого таза.Клинический случай: Пациентка Л. 54 лет в июле 2020 г. обратилась с жалобами на наличие выпячивания в области промежности, был установлен диагноз «рецидивная промежностная послеоперационная грыжа». Из анамнеза известно, что в 2017 г. были установлены рак прямой кишки сT4N1M0 и дисплазия шейки матки тяжелой степени, проведено 6 курсов неоадъювантной полихимиотерапии, лучевая терапия. В 2018 г. выполнена экстралеваторная брюшно-промежностная экстирпация прямой кишки с экстирпацией матки и формированием постоянной концевой колостомы. В марте 2020 г. была диагностирована промежностная послеоперационная грыжа, проведена пластика промежности сетчатым имплантом трансабдоминальным доступом. В апреле 2020 г. вновь появились жалобы на наличие выпячивания в области промежности. В августе 2020 г. выполнены лапароскопическое устранение промежностной грыжи, пластика промежности с использованием композитного сетчатого импланта. Пациентка выписана в удовлетворительном состоянии на девятые сутки после операции.Вывод: Послеоперационные промежностные грыжи представляют собой довольно редкое осложнение в хирургической практике, которое сопровождается высокой частотой рецидивов. Недостаточное количество пациентов, небольшой срок послеоперационного наблюдения и наличие достаточно большого выбора хирургических методик лечения затрудняют проведение крупных рандомизированных клинических исследований, которые могли бы как более достоверно оценить эффективность хирургических вмешательств, так и определить показания к тем или иным методикам.
Брюшно-промежностная экстирпация, рак прямой кишки, лапароскопия, осложнения, промежностная грыжа, рецидивная грыжа
Короткий адрес: https://sciup.org/142230045
IDR: 142230045 | УДК: 616-089.844 | DOI: 10.38181/2223-2427-2020-3-59-64
Текст научной статьи Лапароскопическое лечение рецидивной промежностной грыжи. Клинический случай
Послеоперационныегрыжи промежности представляют собой выпячивание содержимого брюшной полости через образовавшийся дефект тазового дна. Они относятся к вторичным грыжам и являются в целом достаточно редким осложнением вхирургии (менее 1% случаев), возникающим в среднем через 10–19 месяцев после таких хирургических вмешательств, как задняя эвисцерация таза, включающая в себя брюшно-промежностную экстирпацию (БПЭ) и экстирпацию органов мочеполовой системы [1, 2–6]. Как правило в ходе данного вмешательства образуется достаточно большой дефект мягких тканей промежности, что может приводить к более длительному заживлению раны (более 30 дней после хирургического вмешательства) и увеличению послеоперационного периода восстановления [7]. В совокупности с другими факторами, такими как сахарный диабет, ожирение, гипоальбуминемия, высокий риск по шкале ASA, длительный стаж курения, повышается риск послеоперационных осложнений, в том числе и грыж [8–10]. Местно распространенныйрак нижне- и среднеампулярного отдела прямой кишки, как правило, требует назначения неоадъювантной химиолучевой терапии (ХЛТ), что может значительно повлиять на период реабилитации [1]. После неоадъювантного лечения частота послеоперационных осложнений выше в 2 раза, чем у пациентов без курса ХЛТ и составляет примерно 40–66% случаев, среди которых наиболее часто встречаются отсроченное заживление раны (24%) и инфекционные осложнения (10%) [1, 7].
По данным литературы, около 50% пациентов через 3 года после БПЭ испытывают такие симптомы со стороны промежности, как постоянный болевой синдром, нарушения функций мочеполовой системы, изменения со стороны кожи,дискомфорт, что можетявляться следствием промежностной грыжи и ведет кзначительному снижению качества жизни и ежедневной активности [5, 11, 13, 16]. По некоторым данным, промежностные грыжи после БПЭ встречаются в 7–24%, но их реальную распространенность оценить достаточно сложно, так как большая часть из них остается бессимптомными [11, 14, 15]. Своевременные диагностика и выявлениетакой патологии крайне необходимы не только для повышения качества жизни в целом, но также потому, что, как и другие виды грыж, промежностные грыжи могут стать причиной неотложных состояний [2, 5].
На данный момент нет общепринятого стандарта лечения послеоперационных перинеальных грыж. Радикальное хирургическое лечениеможет проводиться с перианальным абдоминальным или комбинированным доступом с простым ушиванием дефекта с использованием сетчатого импланта и пластикой дна промежности тканевым лоскутом [5]. Случаи рецидивов таких грыж наблюдаются у 22–47% пациентов [5, 15, 22]. Лечение рецидивных грыж является еще более сложной проблемой и заключается в устранении образовавшегося дефекта тазового дна, что может быть выполнено с помощью вышеупомянутых методик.
В современной литературе описываются единичные случаи рецидивных послеоперационных грыж промежности что не дает в полной мере оценить эффективность того или иного метода лечения. Более того, имеющиеся результаты тех или иных методик могут быть не вполне достоверными ввиду небольшого опыта хирургов в лечении такого вида грыж. В данной статье мы представляем один клинический случайуспешного лечения рецидивной послеоперационной промежностной грыжи.
Описание клинического случая
Пациентка Л. 54 лет в июле 2020 года обратилась в МНОЦ МГУ им. М.В. Ломоносова с жалобами на наличие выпячивания в области промежности, дискомфорт и болезненность в промежности при длительном сидении. При физикальном обследовании в области послеоперационного рубца промежности определяется грыжевое выпячивание размерами 10 × 12 ×7 см, частично вправимое,урчащее, безболезненное при пальпации. Грыжевые ворота ограничены анатомическими структурами: спереди — влагалищем (истонченным corpus perineale), справа и слева — внутренними поверхностями седалищных костей, сзади — верхушкой крестца. Копчик отсутствует.
Из анамнеза пациентки известно, что в ноябре 2017 года она впервые отметила появление дискомфортав нижних отделах живота. Пациентка была проконсультирована гинекологом, установлен диагноз дисплазии шейки матки 2–3 степени.
В рамках предоперационного обследования проведена колоноскопия (22.03.2018), обнаружено новообразование нижнеампулярного отделапрямой кишки,гистологически — аденокарцинома G2. По даннымМРТ малого таза, клиническая стадия сT4N1M0. Проведено неоадъювантное лечение: с 15.03.18 — 4 курса ПХТ по схеме XELOX, с 07.06.18 — ЛТ СОД 50 Гр + капецитабин 1650 мг/м2 в сут, 26.09–19.10.2018 — 2 курса ПХТ по схеме XELOX.
07.11.2018 выполнена расширенная комбинированная экстралеваторная брюшно-промежностная экстирпация прямой кишки с расширенной лимфодиссекцией, экстирпацией матки с придатками и формированием постоянной концевой колостомы. По данным гистологического исследования, опухольпредставляет собойумеренно-дифференци-рованную аденокарциному с инвазией в мышечный слой и слабовыраженными признаками регресса после ПХТ. В июне 2019 года при проведении МРТ обнаружены метастазы в печени, выполнена атипичная резекция левой доли печени. Далее были проведены еще 6 курсов ПХТ в режиме XELIRI 07–11.2019.
В марте 2020 года появились жалобы на наличие грыжевого выпячивания в области промежности, диагностирована послеоперационная промежностная грыжа, проведена пластика промежности сетчатым полипропиленовым им-плантомтрансабдоминальным доступом. В апреле 2020 года вновь появились вышеуказанные жалобы, а также дискомфорт в области промежности при длительном сидении. По данным МРТ органов брюшной полости и малого таза от 22.06.2020 (рис. 1):в области промежности определяется отграниченное скопление серозной жидкости однородного сигнала без признаков перифокальной реакции размером 64 × 77 × 40 мм и объемом приблизительно 100 мл. Пролабирование тонкой кишки в полость грыжевого мешка, расположенного ниже уровня тазового дна.
В МНОЦ МГУ было проведенохирургическое лечение в объеме лапароскопического устранения промежностной грыжи, пластика промежности с использованием композитного сетчатого импланта (11.08.2020). При проведении ревизии малого таза во время операции выявлено, что содержимым грыжи являются петли тонкой кишки, плотно спаянные со стенками грыжевого мешка, также визуализируется сгофрированный сетчатый имплант, фиксированный к мысу крестца плотными сращениями и шовным материалом. Передний край импланта свободно спускается в полость малого таза, где визуализированы грыжевые ворота размерами 6 × 8 см на уровне диафрагмы таза (рис. 2). Выполнено иссечение свободного переднего края сетчатого импланта. Композитный сетчатый имплант 10 × 15 см установлен впроекции грыжевыхворот и фиксирован узловыми
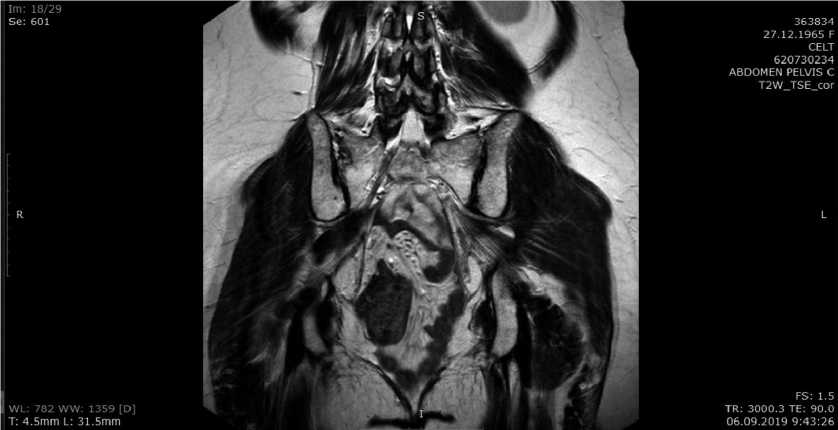
Рис. 1. МРТ брюшной полости и малого таза от 22.06.2020 г. Фронтальная плоскость. В области промежности определяется отграниченное скопление серозной жидкости однородного сигнала размером 64 × 77 × 40мм. Пролабирование тонкой кишки в полость малого таза.
Fig. 1. MRI of the abdomen and pelvis from 22.06.2020. Frontal plane. There is a limited accumulation of serous fluid 64 × 77 × 40mm in the perianal area. Prolapse of the small intestine is visualized into the pelvic cavity.
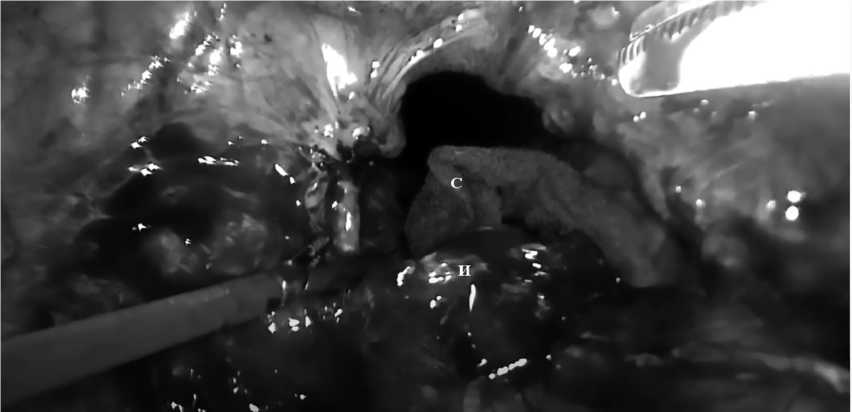
Рис. 2. Общий вид малого таза. И — свободный край сетчатого импланта. С — салфетка в полости грыжевого мешка. Интраоперационная эндофотография Fig. 2. General view of the pelvis. И — the free edge of the mesh implant. С — gauze in the cavity of the hernial sac. Intraoperative endophoto
швами к мысу крестца, культе влагалища, внутренней поверхности грушевидных мышц, области шейки мочевого пузыря (рис. 3).
Ранний послеоперационный период характеризовался нарушением мочеиспускания — острой задержкой мочи в первые сутки, в связи с чем потребовались назначение си-лодозина 8 мг в сутки и проведение интермиттирующей катетеризации мочевого пузыря. Через 3 суток функция мочевого пузыря восстановлена.
Во время ультразвукового исследования органов брюшной полости и малого таза на 1 сутки после вмешательства выявлено незначительное количество свободной жидкости в брюшной полости (32 × 15 × 36 мм, объем 9 мл).
На 2 послеоперационный день, по данным УЗИ, в области промежности (проекция грыжевого мешка) визуализируется ограниченное жидкостное образование (объем до 120 мл), в связи с чем проведена пункция, эвакуировано 120 мл сукровичного отделяемого. Данное образование представляло собой остаточную полость грыжевого мешка расположенную под сетчатым имплантом. При проведении УЗИ области промежности на 7 сутки после операции жидкостного скопления не определялось.
Через 1 месяц после хирургического лечения пациентка повторно осмотрена,выполнено УЗИ промежности. По данным ультразвукового исследования эхо-признаков свободной жидкости в брюшной полости и полости малого таза не выявлено.Жалоб пациентка не предъявляет. При влагалищном осмотре по задней полуокружности культи влагалища пальпируется передний край сетчатого импланта.
Обсуждение
У данной пациентки была проведена одномоментная брюшно-промежностная экстирпация прямой кишки с экстирпацией матки спридатками после неоадъювантной ХЛТ
Это может свидетельствовать не только о наличии большого дефекта мягких тканей в дне малого таза, но и о снижении способности организма к репарации после облучения. Данные особенности пациентки должны рассматриваться как факторы риска образования послеоперационной грыжи промежности. В литературе описываются методики с одномоментной пластикой промежности для пациентов стакими факторамириска. Использование лоскута изместных тканей теоретически позволит снизить риск развития инфекции и снизить напряжение тканей для лучшего заживления раны [7]. Так как показания к проведению таких вмешательств определяются индивидуально в зависимости от возможно-стейхирургического центра и опытаврача,результаты представляются достаточно спорными. У данной пациентки согласно представленной документации, при проведении первичного хирургического лечения попыток восстановления тазового дна не проводилось.
Выбор того или иного метода лечения послеоперационных грыж промежности представляется довольно сложным ввиду того,что многие источники сообщают о различной эффективности хирургических техник. Так, по результатам одного исследования (n = 78) у пациентов с закрытием раны без использования лоскута скорость заживления раны была значительно выше (p = 0.002), но при пластике с лоскутом частота послеоперационных раневых осложнений была значительно ниже (р= 0,03) [7]. По данным другого исследования, пластика с тканевымлоскутом ассоциирована с более частыми инфекционными осложнениями раны и длительным сроком заживления.6 В отношении использования сетчатых имплантов большинство авторов сообщает об их большей эффективности и меньшей частоте рецидивов по сравнению с простымуши-ванием [12, 17–22].

Рис. 3. Вход в малый таз после фиксации композитного сетчатого импланта. Интраоперационная эндофотография Fig. 3. The pelvis inlet after composite mesh implant fixation. Intraoperative endophoto
Выводы
Послеоперационные промежностные грыжи представляют собой довольно редкое осложнение в хирургической практике, которое сопровождается высокой частотой рецидивов. Недостаточное количество пациентов, небольшой срок послеоперационного наблюдения и наличие достаточно большого выбора хирургических методик лечения затрудняет проведение крупныхрандомизированных клинических исследований, которые могли бы как более достоверно оценить эффективность хирургических вмешательств, так и определить показания ктем или инымметодикам. Представленный клинический случай может свидетельствовать о возможности эффективного и безопасного использования лапароскопических технологий влеченииданной нозологии.
Список литературы Лапароскопическое лечение рецидивной промежностной грыжи. Клинический случай
- Bullard KM, Trudel JL, Baxter NN, Rothenberger DA. Primary perineal wound closure after preoperative radiotherapy and abdominoperineal resection has a high incidence of wound failure. Dis Colon Rectum 2005;48:438-443.
- Brotschi E, Noe JM, Silen W (1985) Perineal hernia after proctectomy. Am J Surg 149: 301-305
- Bech DE, Fazio VW, Jagelman DG, Lavery IC, McGonagle BA (1986) Post-operative perineal hernia. Dis Colon Rectum 29: 21-24
- Pearl RK (1989) Perineal hernia. In: Nyhus LM, Condon RE, (eds) Hernia. Philadelphia: JB Lippincott: pp 441-446
- Levic K, Rosen KV, Bulut O, Bisgaard T. Low incidence of perineal hernia repair after abdominoperineal resection for rectal cancer. Dan Med J. 2017 Jul;64(7):A5383. PMID:28673377.
- Billig JI, Hsu JJ, Zhong L, Wang L, Chung KC, Kung TA. Comparison of Effective Cost and Complications after Abdominoperineal Resection: Primary Closure versus Flap Reconstruction. Plast Reconstr Surg. 2019;144(5):866e-875e. https://doi.org/10.1097/PRS.0000000000006158
- Chessin DB, Hartley J, Cohen AM, et al. Rectus flap reconstruction decreases perineal wound complications after pelvic chemoradiation and surgery: A cohort study. Ann Surg Oncol. 2005;12:104-110.
- Althumairi AA, Canner JK, Gearhart SL, et al. Risk factors for wound complications after abdominoperineal excision: Analysis of the ACS NSQIP database. Colorectal Dis. 2016;18:O260-O266.
- Chang CC, Lan YT, Jiang JK, Chang SC, Yang SH, Lin CC, Lin HH, Wang HS, Chen WS, Lin TC, Lin JK. Risk factors for delayed perineal wound healing and its impact on prolonged hospital stay after abdominoperineal resection. World J Surg Oncol. 2019 Dec 21;17(1):226. https://doi.org/10.1186/s12957-019-1768-4. PMID:31864365;PMCID: PMC6925835.
- Kamrava A, Mahmoud NN. Prevention and management of nonhealing perineal wounds. Clin Colon Rectal Surg. 2013;26:106-111.
- Musters GD, Sloothaak DA, Roodbeen S, van Geloven AA, Bemelman WA, Tanis PJ (2014) Perineal wound healing after abdominoperineal resection for rectal cancer: a two-centre experience in the era of intensified oncological treatment. Int J Colorectal Dis 29(9):1151-1157. https://doi.org/10.1007/s00384-014-1967-y
- Han JG, Wang ZJ, Gao ZG, Wei GH, Yang Y, Zhai ZW, Zhao BC, Yi BQ. Perineal Wound Complications After Extralevator Abdominoperineal Excision for Low Rectal Cancer. Dis Colon Rectum. 2019 Dec;62(12):1477-1484. https://doi.org/10.1097/DCR.0000000000001495. PMID:31567926.
- Asplund D, Prytz M, Bock D, Haglind E, Angenete E (2015) Persistent perineal morbidity is common following abdominoperineal excision for rectal cancer. Int J Colorectal Dis 30(11):1563-1570. https://doi.org/10.1007/s0038 4-015-2328-1
- Hullsiek HE (1956) Perineal Hernia after abdominoperineal resection. Am J Surg 92: 735-738
- Balla A, Batista Rodríguez G, Buonomo N, Martinez C, Hernández P, Bollo J, Targarona EM. Perineal hernia repair after abdominoperineal excision or extralevator abdominoperineal excision: a systematic review of the literature. Tech Coloproctol. 2017 May;21(5):329-336. https://doi.org/10.1007/s10151-017-1634-8. Epub 2017 May 15. PMID:28508281.
- Blok RD, Musters GD, Borstlap WAA, Buskens CJ, Bemelman WA, Tanis PJ, Collaborative Dutch Snapshot Research G (2018) Snapshot study on the value of omentoplasty in abdominoperineal resection with primary perineal closure for rectal cancer. Ann Surg Oncol 25(3):729-736. https https://doi.org/://doi.org/10.1245/ s10434-017-6273-9
- De Campos FGCM, Habr-Gama A, Araújo SE et al. Incidence and management of perineal hernia after laparoscopic proctectomy. Surg LaparoscEndosc Percutan Tech 2005;15:366-70.
- Mjoli M, Sloothaak DAM, Buskens CJ et al. Perineal hernia repair after abdominoperineal resection: a pooled analysis. Colorectal Dis 2012;14:e400-e406.
- Martijnse IS, Holman F, Nieuwenhuijzen GAP et al. Perineal hernia repair after abdominoperineal rectal excision. Dis Colon Rectum 2012;55:90-5.
- Svane M, Bulut O, Svane M et al. Perineal hernia after laparoscopic abdominoperineal resection - reconstruction of the pelvic floor with a biological mesh (PermacolTM). Int J Colorectal Dis 2012;27:543-4.
- Dulucq J-L, Wintringer P, Mahajna A. Laparoscopic repair of postoperative perineal hernia. Surg Endosc 2006;20:414-8.
- Musters GD, Lapid O, Stoker J et al. Is there a place for a biological mesh in perineal hernia repair? Hernia 2016;20:747-54.


